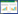文章信息
- 匡子禹, 刘可心, 李杰.
- KUANG Ziyu, LIU Kexin, LI Jie.
- 消癌平注射液联合一线化疗治疗晚期胃癌疗效的系统评价及Meta分析
- A systematic review and Meta-analysis of the efficacy of Xiaoaiping injection combined with first-line chemotherapy in the treatment of advanced gastric cancer
- 天津中医药, 2024, 41(7): 857-864
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 857-864
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.10
-
文章历史
- 收稿日期: 2024-04-08
2. 中国中医科学院广安门医院, 北京 100053
胃癌是全球第5大常见恶性肿瘤和第3大癌症相关死亡原因[1],具有发病率高、隐匿性强的特点,是中国常见的消化道恶性肿瘤之一,同时也是恶性肿瘤相关死亡的主要原因[2-3]。约90%的患者在初诊时已为中晚期胃癌,且合并远处转移患者的5年生存率不足10%[4];研究显示,针对胃癌晚期不可切除带瘤生存的患者,采用姑息性化疗仍能增加晚期胃癌患者的总生存期(OS)、无进展生存期(PFS)、客观缓解率(ORR)[5],然而部分患者对常规化疗方案的耐受性较差,同时化疗相关不良反应等是目前颇为棘手的临床问题。
增效减毒是中医药治疗恶性肿瘤的核心优势,其通过多靶点、多通路等特性增加抗肿瘤治疗疗效、减轻抗肿瘤治疗所引起的不良反应。消癌平注射液作为临床中常用中成药,其主要成分为通关藤提取物,含有生物碱、甾体苦味酯苷等,具有软坚散结、化痰、清热解毒等功效,可有效抑制胃癌细胞增殖、调节免疫微环境,并增强胃癌细胞对化疗药物的敏感性[6-8],在晚期胃癌的治疗当中广泛应用;为进一步评价其疗效及安全性,本文遵循PRISMA声明[9],通过检索消癌平注射液联合一线化疗方案治疗晚期胃癌的随机对照试验(RCT)并进行系统评价及Meta分析,为临床合理地联合应用化疗药物,发挥最大疗效并尽可能减少其不良反应提供依据。
1 资料与方法 1.1 纳入标准 1.1.1 研究类型前瞻性RCT,语种限定为中文和英文。
1.1.2 研究对象1)经细胞学/组织病理学/经影像学[如计算机断层扫描(CT)、磁共振成像(MRI)、正电子发射计算机断层显像(PET)-CT等]证实为原发性胃癌的患者;2)TNM分期为Ⅳ期的胃癌患者,TNM分期则依据AJCC第8版胃癌分期[10];3)预计生存期>3个月;4)年龄为18~75岁,性别不限。
1.1.3 干预措施对照组为胃癌一线化疗方案,方案的选择为2023年中国临床肿瘤学会(CSCO)、2023美国国立综合癌症网络(NCCN)以及2023年欧洲肿瘤内科学会(ESMO)胃癌诊疗指南所推荐的晚期胃癌一线化疗方案,即奥沙利铂+替吉奥(SOX方案)、奥沙利铂+卡培他滨(XELOX/CapeOX方案)、奥沙利铂+氟尿嘧啶+亚叶酸钙(FOLFOX方案)或替吉奥单药[11];试验组在对照组的基础上加用消癌平注射液,且两组患者至少完成2个化疗周期以进行疗效评价。
1.1.4 结局指标1)ORR:依据实体瘤疗效评价标准(RECIST)1.1版[12]进行判定,ORR=完全缓解+部分缓解;2)PFS:从随机化开始到肿瘤发生(任何方面)进展或(因任何原因)死亡之间的时间;3)OS:从随机化开始至(因任何原因)死亡的时间;4)KPS:改善:治疗后增加≥10分,明显改善:治疗后增加≥20分,降低:治疗后减少≥10分,稳定:治疗后增加或减少<10分,改善+明显改善例数表示为KPS有效改善例数;5)≥3级不良反应数量(SAE):根据美国国立癌症协会所制定的CTCAE 4.0版手册中所规定的3-4级不良事件,对患者治疗过程中发生的毒副反应进行评估。
1.2 排除标准1)多重癌患者;2)所检索数据库重复收录的研究;3)结局指标数据不完整或无法提取的研究;4)数据存在明显误差/数据存疑的研究。
1.3 检索策略本文检索方式以计算机检索为主,所检索的数据库分别是:中国知网(CNKI)、万方数据库(WanFang)、维普数据库(VIP),英文数据库包括PubMed和Web of science;使用“胃癌”“消癌平”等进行中文数据库的检索;使用“Xiaoaiping”“Gastric cancer”等检索词检索英文数据库。检索时间设定为各数据库建库至2023年10月27日;中文数据库检索式:SU=(“胃癌”)AND SU=(“消癌平”);英文数据库检索式:(gastric cancer[Title/Abstract])AND(Xiaoaiping[Title/Abstract])。
1.4 资料提取由两位作者按照中英文检索式分别进行检索,并按照纳排标准对检索结果进行筛选,同时两位作者分别对纳入研究进行数据的提取(包括第一作者、发表年份、样本量、平均年龄、男女比例、化疗方案、结局指标等信息);完成数据的提取后两人交叉核对,若存在分歧则由第3名研究者介入并进行商讨。
1.5 纳入研究质量评估使用Cochrane Handbook(6.4版)对纳入研究的7个方面进行评估,即:入组患者随机方法是否合理,分配隐藏是否合理,是否对患者、试验人员以及结局评价者实施盲法,研究结果的数据是否完整,是否存在选择性报告。两名作者分别对以上7项内容进行评价,并做出“Low risk”“High risk”“Unclear risk”3种判断,若存在分歧,则由第3名研究者介入并进行商讨;质量评价结果以“纳入文献质量评价图”呈现。
1.6 统计学分析由于本文所纳入的研究均为前瞻性研究,因此二分类变量使用相对危险度(RR)及其95%置信区间(CI)表示合并的结果;对于生存资料则使用风险比(HR)及其95%CI表示,对于没有提供HR值以及95%CI,但是提供了生存曲线的文章,按照Tierney等[13]的方法,使用Engauge Digitizer软件通过生存曲线提取HR值及95%置信区间;通过Review Manager 5.4软件对结局指标进行合并分析,同时使用卡方检验对数据进行异质性分析,若P>0.05,I2≤50%,则说明合并结果异质性不显著,使用固定效应模型进行结局指标数据的合并;若P<0.05,I2>50%,则说明合并结果之间存在明显异质性,在排除明显临床异质性的影响后,则使用随机效应模型对数据进行合并。若纳入研究的数量为10项及以上,则绘制漏斗图对发表偏倚进行评估。在证据等级分级方面,参照GRADE证据质量分级系统对结局指标进行证据分级,将结局指标的证据质量分为高、中、低、极低共4个级别。
2 结果 2.1 文献检索检索5个数据库共检索研究213项(中文199项,英文14项),对213项进行去重并根据纳入排除标准进行进一步筛选,共排除203项研究;重复收录的研究97项,动物/细胞基础研究30项,综述、会议报告、荟萃分析等共20项,非RCT的临床研究(横断面、队列、观察性研究)36项,不符合纳排标准的RCT共30项,最终纳入研究共10项[14-23],均为中文文献。检索流程见图 1。
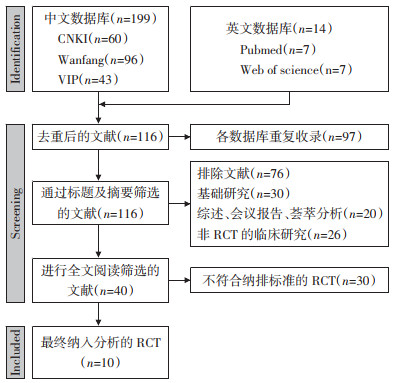
|
| 图 1 文献筛选流程图 Fig. 1 Flow chart of literature screening |
所纳入的10项研究均为RCT,包括814例患者,其中试验组410例,对照组404例,最小研究样本量为48例,最大研究样本量为183例,研究发表时间为2009~2023年。试验组与对照组在基线资料方面差异均无统计学意义;干预措施方面,试验组均为消癌平联合一线化疗方案,对照组均为一线化疗。见表 1。
所纳入的10项研究中,有3项使用了随机数字表对患者进行了随机化,评价为“Low risk”,有3项研究的随机方法存在明显的错误,因此评价为“High risk”,其余研究未交代如何进行随机化,全文中仅提及“随机”等字样,评价为“Unclear risk”;由于3项随机方法存在明显错误,因此“否对随机方案进行了隐藏”该项评价为High risk,剩余7项研究均未报告是否对随机方案进行了隐藏,并且均未报告盲法的实施情况,均评价为“Unclear risk”;所有的数据均完整且可提取,均评价为“Low risk”;所有纳入研究均未进行注册,因此尚不清楚是否选择性报告的情况,所有研究均评价为“Unclear risk”;同时由于纳入研究大部分质量不高,因此不清楚是否有其他方面的偏倚来源,所有研究均评价为“Unclear risk”。纳入研究的风险评价见图 2。
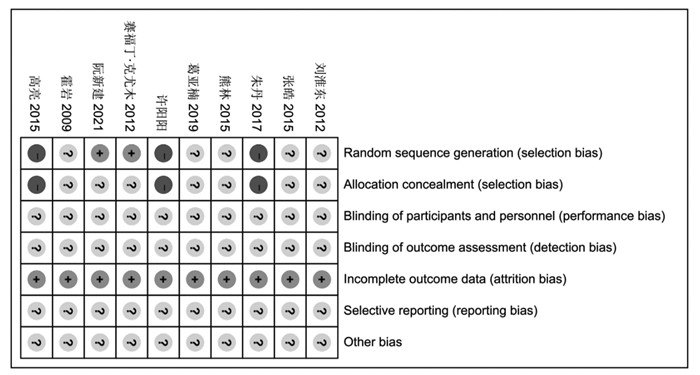
|
| 图 2 纳入文献质量评价图 |
共10项研究报道了试验组与对照组治疗前后的ORR情况,异质性检验结果显示无明显异质性(I2=0%,P=0.90);固定效应模型下合并结果显示,试验组与对照组经治疗后的ORR差异有统计学意义[RR:1.35,95%CI(1.15,1.58),P=0.0002],对ORR进行敏感性分析显示逐一剔除数据后异质性未发生明显改变,显示结果相对稳定可靠。显示消癌平联合一线化疗方案相较于单纯一线化疗可有效提升Ⅳ期胃癌患者的ORR。见图 3。
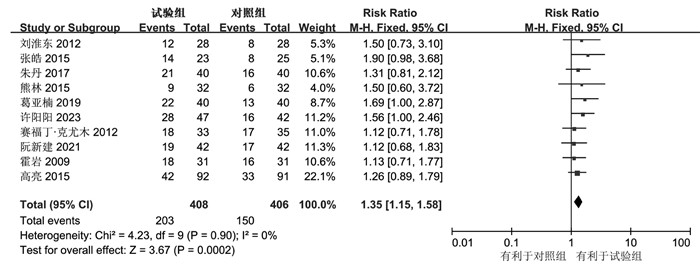
|
| 图 3 ORR的森林图 Fig. 3 Forest diagram of ORR |
共2项研究报告了试验组与对照组治疗前后PFS相关数据,对数据进行了提取并计算logHR及selogHR后进行数据合并,显示无显著异质性(I2=0%,P=0.36);固定效应模型下合并结果显示消癌平联合一线化疗方案在PFS方面优于单纯化疗[HR:0.32,95%CI(0.17,0.62),P=0.0007]。见图 4。
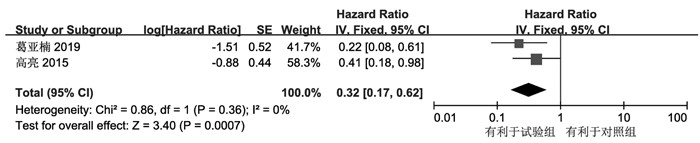
|
| 图 4 PFS的森林图 Fig. 4 Forest diagram of PFS |
共2项研究报道了试验组与对照组治疗前后OS相关数据,对数据进行了提取并计算logHR及selogHR后进行数据合并;合并结果显示无显著异质性(I2=6%,P=0.30);固定效应模型下合并结果显示消癌平联合一线化疗方案在OS方面优于单纯化疗[HR:0.33,95%CI(0.16,0.65),P=0.002]。见图 5。
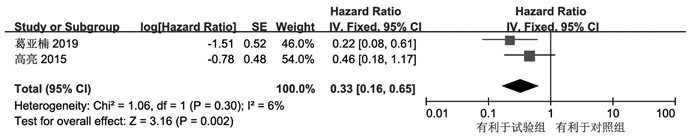
|
| 图 5 OS的森林图 Fig. 5 Forest diagram of OS |
有3项研究报道了试验组与对照组治疗前后KPS评分,异质性检验显示无明显异质性(I2=0%,P=0.81);固定效应模型下合并结果显示试验组与对照组差异有统计学意义[RR:1.62,95%CI(1.16,2.26),P=0.005],因此说明在治疗前后KPS评分方面消癌平联合一线化疗方案优于单纯使用一线化疗方案。见图 6。

|
| 图 6 KPS评分的森林图 Fig. 6 Forest diagram of KPS |
共5项研究报道了试验组与对照组治疗后的所发生的837个不良事件,在SAE方面,试验组报道了19个,对照组报道了66个;异质性检验显示存在显著异质性(I2=69%,P=0.01),因此使用随机效应模型进行效应量合并;结果显示消癌平联合一线化疗方案在SAE时间发生数量方面明显少于单纯使用一线化疗方案[RR:0.23,95%CI(0.06,0.90),P=0.04]。见图 7。
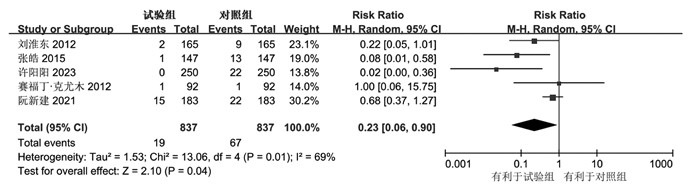
|
| 图 7 SAE的森林图 Fig. 7 Forest diagram of SAE |
由于仅有“ORR”纳入10项研究,因此使用该结局指标对10项纳入研究进行漏斗图的绘制;结果显示多数研究分布于漏斗图的上部,漏斗图基底部分布较少,且漏斗图左右不对称,提示存在发表偏倚的可能较大。见图 8。
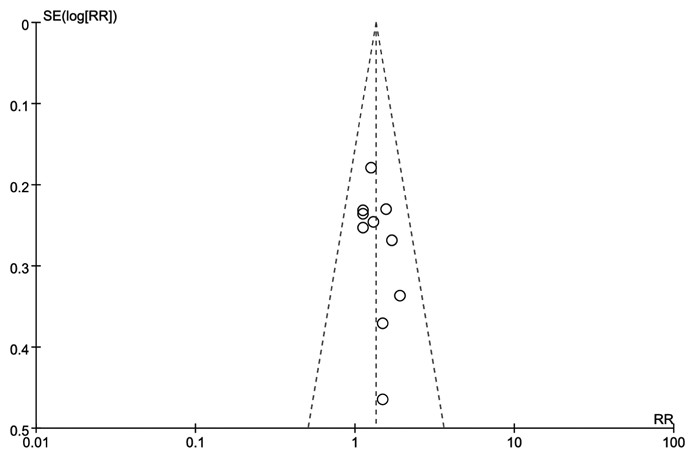
|
| 图 8 发表偏倚风险漏斗图 Fig. 8 Publication risk of bias funnel plot |
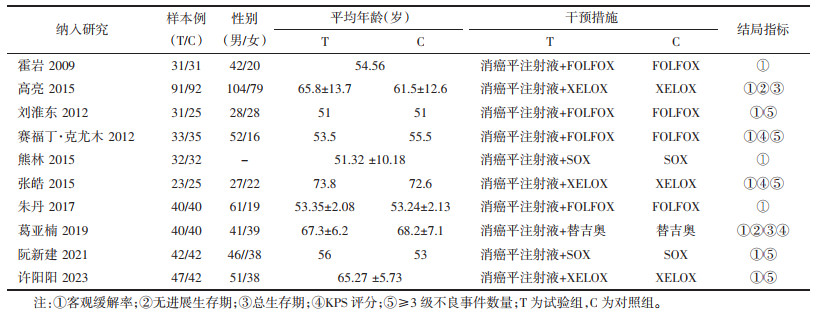
GRADE分级结果显示,ORR、PFS、OS、KPS评分为低质量证据,SAE为极低质量证据,由于纳入研究盲法的缺失、分配隐藏不充分,所有指标在偏倚风险方面均需降级;由于漏斗图不对称,因此在发表偏倚部分需降级;另外“SAE”该结局指标存在较大异质性,在不一致性方面需降级;以上均为降级原因,无升级原因,见表 2。
晚期胃癌目前仍然缺乏令人满意的治疗手段;对于初治晚期胃癌患者目前仍主要推荐以化疗为主的系统治疗,同时结合患者免疫分型等联合靶向或免疫治疗。关于化疗方案的选择,CSCO与NCCN推荐基于奥沙利铂的双药方案(SOX、XELOX)以及替吉奥单药等作为晚期胃癌的一线化疗方案ESMO则推荐基于奥沙利铂的三药方案(FOLFOX)作为晚期胃癌一线化疗方案。然而胃癌的临床试验表明标准化疗的疗效已经达到极限[24],同时化疗耐药性以及化疗带来的不良反应也是目前晚期胃癌治疗方面颇为棘手的问题。随着靶向治疗及免疫治疗的兴起,从一定程度上弥补了传统放化疗的不足,然而靶向、免疫治疗相比于传统化疗更易出现耐药,同时在传统化疗+靶向/免疫治疗的模式下,其不良事件的发生率升高[25],降低了患者的生活质量及依从性;另外靶向/免疫治疗有着严格的适用人群以及高昂的治疗费用,使其难以在成本-效益比显现优势[26-27]。增效减毒是中医药的传统优势,中医药以其个体化、整体性、多效应的治疗优势,通过纠正机体的阴阳失调,去除肿瘤复发转移因素,能够达到抗肿瘤、减毒增效的作用,在病灶缓解率、改善率、生存质量、减轻化疗副作用以及3~5年生存率方面具有明显优势[28]。
消癌平注射液的主要成分为通关藤提取物,具有软坚散结、化痰、清热解毒等功效,在恶性肿瘤治疗中应用广泛。机制方面,消癌平注射液有效成分通关藤苷H(TSH)可通过下调肿瘤细胞GOLPH3及ATF3蛋白表达抑制肿瘤细胞迁移、促进肿瘤细胞凋亡[29];同时TSH可抑制恶性肿瘤细胞中金属蛋白酶及细胞周期蛋白,从而抑制细胞增殖[30]。临床研究显示,消癌平联合一线化疗方案可有效降低白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)浓度及外周血髓源性抑制性细胞(MDSC)、调节性T细胞(Treg)水平,调节免疫细胞水平的同时改善炎症状态[31],并且消癌平联合其他抗肿瘤药可以降低消化道反应、肝肾功能异常等不良反应的发生率,从而实现减毒增效[32]。故本文基于系统评价及荟萃分析的方法,对消癌平注射液联合一线化疗的疗效及安全性进行评估,以进一步指导晚期胃癌的中西医结合治疗。
本文通过检索5个数据库,共纳入10项关于消癌平注射液联合一线化疗方案治疗晚期胃癌的RCT,分别从ORR、PFS、OS、KPS以及安全性5个方面对其进行评估。分析显示,无论是ORR、PFS还是OS,消癌平注射液联合一线化疗方案相较于单纯化疗均具有优势;同时消癌平注射液可有效改善临床症状,在一线化疗的基础上加用消癌平注射液可有效提升KPS,改善机体功能状态;在安全性方面,消癌平注射液联合一线化疗发生的SAE数量少于单纯化疗,差异有统计学意义,显示其具有较好的安全性;在证据等级方面,ORR、PFS、OS、KPS均为低等级质量证据,由于存在不一致性,SAE降级为极低等级质量证据。
本研究尚存在以下局限性:1)10项纳入研究中,仅有3项研究报道了如何随机分组,其余研究仅提及了“随机”二字,未说明随机方案是否隐藏,同时所有纳入研究均未提及盲法的使用,因此存在选择性偏倚的可能性较大;2)本文纳入的研究数量有限,同时纳入的10项研究仅观察了化疗前后瘤体大小变化情况,仅有2项研究进行长期随访并报道了生存获益情况,因此对于评估消癌平注射液联合一线化疗的远期疗效方面有一定的局限性;3)纳入研究的样本量普遍较小,部分研究样本量不足50例,可能存在小样本量效应,对结果的准确性可能有一定影响;4)所有纳入研究试验方案均未经注册,无法追溯研究方案与预期结局指标,难以排除报告偏倚;5)GRADE分级评估显示,ORR、PFS、OS、KPS为低质量证据,SAE为极低质量证据,影响结果的外推性,因此对于消癌平注射液联合一线化疗的疗效及安全性仍然需要进一步评估。
虽然消癌平注射液在晚期胃癌治疗中广泛应用,但目前仍存在诸多不足之处,笔者认为今后的研究应当从以下方面进行开展:1)消癌平注射液作为临床中常用的抗肿瘤中药制剂,其疗效及安全性备受关注,然而通过本研究可看出目前尚缺乏消癌平注射液等中药制剂治疗晚期胃癌的大规模、多中心的前瞻性RCT,循证证据等级不高,今后应当立足于临床,做好临床研究顶层设计,开展大规模、多中心、方法学严谨的RCT进行进一步验证;2)消癌平注射液的临床应用存在不辨证使用等问题,今后应当结合患者的具体病情与证型进行使用,对提高姑息化疗的疗效和提高晚期胃癌患者的生存质量以及预后具有重要的意义;3)有关消癌平注射液机制方面研究相对不足,在一定程度上限制了其临床应用及推广,因此加强基础研究,深层次、多方位揭示消癌平注射液干预晚期胃癌的机制;4)由于晚期胃癌具有很强的异质性,个体差异较大,有必要充分考虑胃癌的分子分型特征,同时结合靶向/免疫治疗,制定出更精准的、中西医结合治疗Ⅳ期胃癌的方案。
4 结论综上所述,结合现有研究的结果分析得出,在晚期胃癌的治疗方面,消癌平注射液联合一线化疗方案在近期疗效及远期生存获益方面均具有一定的优势,同时有效提升KPS、改善功能状态,且发生SAE的数量更低,具有一定的临床参考意义及推广价值。但由于本次纳入的研究质量不高且数量较少,今后仍需要大样本、多中心、设计严谨的高质量RCT进一步验证,提升循证证据等级的同时,进一步明确消癌平注射液的临床定位,以期为晚期胃癌的治疗提供低成本、高收益的中西医联合方案。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
ZHAO J K, WU M, KIM C H, et al. Jiangsu Four Cancers Study: a large case-control study of lung, liver, stomach, and esophageal cancers in Jiangsu Province, China[J]. European Journal of Cancer Prevention, 2017, 26(4): 357-364. DOI:10.1097/CEJ.0000000000000262 |
| [3] |
GBD STOMACH CANCER COLLABORATOR. The global, regional, and national burden of stomach cancer in 195 countries, 1990-2017:a systematic analysis for the Global Burden of Disease study 2017[J]. The Lancet Gastroenterology & Hepatology, 2020, 5(1): 42-54. |
| [4] |
WANG Q W, ZHANG X T, LU M, et al. Impact of duration of adjuvant chemotherapy in radically resected patients with T4bN1-3M0/TxN3bM0 gastric cancer[J]. World Journal of Gastrointestinal Oncology, 2018, 10(1): 31-39. DOI:10.4251/wjgo.v10.i1.31 |
| [5] |
ARAI H, NAKAJIMA T E. Recent developments of systemic chemotherapy for gastric cancer[J]. Cancers, 2020, 12(5): 1100. DOI:10.3390/cancers12051100 |
| [6] |
李茂全, 沈建华, 胥彬, 等. 消癌平对SGC-7901胃癌细胞的作用及机制的实验研究[J]. 介入放射学杂志, 2001, 10(4): 228-231. DOI:10.3969/j.issn.1008-794X.2001.04.013 |
| [7] |
韩丽, 冷彩云, 李文华, 等. 通关藤提取物体内外抗肿瘤作用研究[J]. 中药新药与临床药理, 2017, 28(1): 51-55. |
| [8] |
HU Y J, SHEN X L, LU H L, et al. Tenacigenin B derivatives reverse P-glycoprotein-mediated multidrug resistance inHepG2/Dox cells[J]. Journal of Natural Products, 2008, 71(6): 1049-1051. DOI:10.1021/np070458f |
| [9] |
PAGE M J, MCKENZIE J E, BOSSUYT P M, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews[J]. Journal of Clinical Epidemiology, 2021, 134: 178-189. DOI:10.1016/j.jclinepi.2021.03.001 |
| [10] |
SANO T, COIT D G, KIM H H, et al. Proposal of a new stage grouping of gastric cancer for TNM classification: International Gastric Cancer Association staging project[J]. Gastric Cancer, 2017, 20(2): 217-225. DOI:10.1007/s10120-016-0601-9 |
| [11] |
中国临床肿瘤学会指南工作委员会组织. 中国临床肿瘤学会(CSCO)胃癌诊疗指南-2023[M]. 北京: 人民卫生出版社, 2023.
|
| [12] |
EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1)[J]. European Journal of Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [13] |
TIERNEY J F, STEWART L A, GHERSI D, et al. Practical methods for incorporating summary time-to-event data into meta-analysis[J]. Trials, 2007, 8: 16. DOI:10.1186/1745-6215-8-16 |
| [14] |
许阳阳, 贺春娇, 李红霞. Ⅳ期胃癌伴肝转移的临床病理特点及消癌平联合CapeOX方案的疗效分析[J]. 实用癌症杂志, 2023, 38(5): 807-810. DOI:10.3969/j.issn.1001-5930.2023.05.029 |
| [15] |
阮新建, 贾佳, 刘慧龙, 等. 消癌平注射液联合SOX化疗方案一线治疗晚期胃癌的临床观察[J]. 临床合理用药杂志, 2021, 14(22): 13-16. |
| [16] |
葛亚楠, 张冠中, 刘兆喆, 等. 消癌平注射液联合替吉奥胶囊治疗老年晚期胃癌的临床疗效及不良反应观察[J]. 肿瘤药学, 2019, 9(6): 892-896. DOI:10.3969/j.issn.2095-1264.2019.06.12 |
| [17] |
高亮, 卢丽琴, 洪朝金, 等. 消癌平注射液联合XELOX方案治疗晚期胃癌的效果分析[J]. 中华中医药学刊, 2015, 33(5): 1259-1261. |
| [18] |
熊林, 孟以秀, 李丹. 消癌平注射液用于晚期胃癌化疗患者效果观察[J]. 山东医药, 2015, 55(14): 71-72. DOI:10.3969/j.issn.1002-266X.2015.14.027 |
| [19] |
霍岩, 程刚. 消癌平联合化疗治疗晚期胃癌的临床观察[J]. 中国社区医师(医学专业半月刊), 2009, 11(18): 138. |
| [20] |
赛福丁·克尤木, 马兰英, 唐勇. 消癌平注射液联合FOLFOX6方案化疗治疗晚期胃癌的疗效观察[J]. 肿瘤基础与临床, 2012, 25(5): 397-399. DOI:10.3969/j.issn.1673-5412.2012.05.010 |
| [21] |
朱丹, 梁敏娇, 杨美娟. 消癌平注射液联合FOLFOX6方案化疗在晚期胃癌治疗与干预效果分析[J]. 中国生化药物杂志, 2017, 3(8): 287-288, 290. DOI:10.3969/j.issn.1005-1678.2017.08.121 |
| [22] |
张皓, 李晓林. 消癌平注射液联合XELOX方案治疗老年晚期胃癌的疗效[J]. 江苏医药, 2015, 41(6): 642-644. |
| [23] |
刘淮东, 朱子元. 消癌平注射液联合化疗治疗晚期胃癌的临床研究[J]. 河北医学, 2012, 18(12): 1704-1707. DOI:10.3969/j.issn.1006-6233.2012.12.013 |
| [24] |
JOSHI S S, BADGWELL B D. Current treatment and recent progress in gastric cancer[J]. CA: a Cancer Journal for Clinicians, 2021, 71(3): 264-279. DOI:10.3322/caac.21657 |
| [25] |
LACOUTURE M, SIBAUD V. Toxic side effects of targeted therapies and immunotherapies affecting the skin, oral mucosa, hair, and nails[J]. American Journal of Clinical Dermatology, 2018, 19(Suppl 1): 31-39. |
| [26] |
ZHU Y X, ZHU X D, WEI X W, et al. HER2-targeted therapies in gastric cancer[J]. Biochimica et Biophysica Acta Reviews on Cancer, 2021, 1876(1): 188549. DOI:10.1016/j.bbcan.2021.188549 |
| [27] |
TOPALIAN S L, TAUBE J M, PARDOLL D M. Neoadjuvant checkpoint blockade for cancer immunotherapy[J]. Science, 2020, 367(6477): eaax0182. DOI:10.1126/science.aax0182 |
| [28] |
侯文沛, 杨燕. 中医药治疗中晚期胃癌的优势与疗效机制[J]. 现代中西医结合杂志, 2019, 28(6): 677-680. DOI:10.3969/j.issn.1008-8849.2019.06.031 |
| [29] |
陈志川, 邱成志, 庄海滨, 等. 通关藤苷H抗结肠癌作用的研究[J]. 中国临床药理学杂志, 2022, 38(10): 1069-1073. |
| [30] |
陈丽佳, 张岩. 通关藤苷H抑制低分化鼻咽癌细胞增殖及转移的作用机制研究[J]. 天津中医药, 2021, 38(9): 1209-1214. DOI:10.11656/j.issn.1672-1519.2021.09.24 |
| [31] |
王军艳, 陈建婷. 消癌平注射液辅助治疗进展期胃癌的临床研究[J]. 中华普外科手术学杂志(电子版), 2018, 12(6): 503-506. DOI:10.3877/cma.j.issn.1674-3946.2018.06.017 |
| [32] |
李佳佳, 邱家学. 基于文献计量方法的消癌平注射液临床安全性评估[J]. 上海医药, 2016, 37(7): 32-34. |
2. Guang'anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China
 2024, Vol. 41
2024, Vol. 41