1. 北京中医药大学, 北京 100029;
2. 北京中医药大学东方医院呼吸科, 北京 100078;
3. 北京中医药大学东方医院风湿科, 北京 100078;
4. 中国中医科学院中药研究所, 北京 100029;
5. 北京市昌平区中西医结合医院, 北京 100096;
6. 首都医科大学附属北京中医医院风湿科, 北京 100010;
7. 北京市房山区燕山社区卫生服务中心, 北京 102500;
8. 北京市通州区永乐店卫生服务中心, 北京 101105
收稿日期:2024-01-22
基金项目:国家自然科学基金项目(51972034)
作者简介:张正菊(1991-),女,博士,医师,主要从事中医内科相关工作.
结缔组织病(CTD)是一大类以免疫介导的器官功能障碍为特征的系统性自身免疫性疾病,以结缔组织和血管的慢性炎症为主要特征。肺脏因含有丰富的胶原和血管而成为最易受累的器官之一,间质性肺病(ILD)是其最常见的临床表现,常合并ILD的CTD主要有类风湿性关节炎(RA)、系统性硬化(SSc)、混合性结缔组织病(MCTD)、干燥综合征(SS)以及系统性红斑狼疮(SLE)等[1]。CTD-ILD的特征主要涉及肺间质及肺泡壁的不同程度的炎症和纤维化。糖皮质激素(GC)是临床治疗CTD-ILD首选药物之一,其作用机制是通过诱导合成抗炎细胞因子、抑制免疫炎性细胞因子高表达,从而发挥抗炎和免疫抑制作用[2],是CTD-ILD模型中的阳性对照研究常选药物[3]。中药在改善CTD-ILD患者症状、提高患者生活质量等方面发挥着不可或缺的作用。姜虎汤由中药姜黄、虎杖组成,课题组在大量临床经验基础上,进行了相关实验研究证明姜虎汤能够抑制免疫炎性损伤,改善脏器纤维化[4-5]。在CTD-ILD相关动物模型中,博来霉素(BLM)诱导的CTD-ILD模型是常用模型,相关文献报道采用此法成功构建CTD-ILD模型,且取得一定的研究成果[6-8]。因此,本实验采用BLM构建CTD-ILD小鼠模型,进一步探讨姜虎汤对CTD-ILD的干预作用及相关分子机制。
1 材料与方法
1.1 实验动物及饲料
SPF级雄性C57/BL6小鼠36只,4周,体质量(20±2)g。购买于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006;普通清洁级小鼠专用维持饲料,购于北京科澳协力饲料有限公司。将上述受试动物置于SPF级环境中,环境参数为:温度(22±2)℃,相对湿度(55±5)%,12 h明暗周期光线,自由进食和饮水,适应性喂养1周。
1.2 药物
姜虎汤由虎杖40 g、姜黄40 g组成,由北京中医药大学东方医院颗粒药房提供颗粒剂;醋酸泼尼松片,5 mg×100片/瓶,批号:1709109,购于天津力生制药股份有限公司;注射用盐酸博莱霉素,15 mg/支,批号:Y00720,由日本化药株式会社生产。
1.3 主要试剂及仪器
核因子-κB p65(NF-κB p65)抗体(ab16502)、高迁移率族蛋白B1(HMGB1)抗体(ab18256)、转化生长因子β1(TGF-β1)抗体(ab92486),单磷酸腺苷(AMP)活化蛋白激酶α1(AMPKα1)抗体(ab32047)、磷酸化AMPKα1(pAMPKα1)抗体(ab131357)均由美国Abcam公司生产;电热恒温培养箱DH4000A天津泰斯特;高速冷冻离心机Beckman Allgre 21R,Beckman公司;凝胶成像仪BioSens SC 810B,上海山富科学仪器有限公司;分光光度计UV-2000,上海菁华科技有限公司。
1.4 造模及动物分组
参考国内外相关文献[5-7],采用气管内滴注博来霉素制备CTD-ILD小鼠模型。实验前所有小鼠适应性喂养1周后,随机分为30只和6只两组,其中前者为模型组,后者为正常组。两组小鼠禁食12 h后,异氟烷联合丙二醇按3∶2比例制备麻醉剂,用1 000 μL移液枪,吸取1 mL麻药滴入小动物麻醉瓶中,将小鼠放入其中1 min进行麻醉,达到深而慢的呼吸状态为麻醉成功。麻醉后将小鼠上牙齿迅速悬吊在悬吊装置上,身体呈竖直状态,用镊子将小鼠舌头向外牵拉,暴露气管,200 μL移液枪向气管内快速滴入1 mg/mL浓度的盐酸博来霉素50 μL,旋转动物,使造模药物弥漫至全肺,制备CTD-ILD小鼠模型;正常组用生理盐水,方法同上。待小鼠自然苏醒,随即放回,常规SPF级环境中分笼饲养。CTD-ILD模型小鼠按随机数表法分为模型组6只、阳性药组6只,姜虎汤高、中、低剂量组各6只。
1.5 干预方法
造模7 d后给药,根据人与小鼠之间公斤体质量等效剂量换算,小鼠用药量为人公斤体质量用药量的10倍,则阳性药组小鼠予醋酸泼尼松7.5 mg/(kg·d),姜虎汤倍量、等量、半量设为高、中、低剂量组,即26.66、13.33、6.67 g/(kg·d)。正常组与模型组予蒸馏水10 mL/(kg·d),干预时中药治疗组根据小鼠体质量称取每日所需量,去离子水溶解,用电磁炉浓煎后灌胃给药。其中姜虎汤高剂量组为避免给药量造成的影响,每日分2次灌胃,连续干预4周。
1.6 标本采集
给药干预4周后,吸入异氟烷联合丙二醇按3∶2比例制备的麻醉剂麻醉后处死小鼠,沿腹中线向上剪开胸壁,将胸腔打开,暴露整个肺部,迅速摘取右侧肺脏组织,液氮冻存,用于蛋白免疫印迹法(Western Blot)指标检测;左侧肺脏组织10%甲醛溶液中固定,以备光镜观察。
1.7 检测指标及方法
1.7.1 各组小鼠肺组织病理学观察
取小鼠左肺组织包埋、切片,进行苏木精-伊红(HE)染色法,光镜下观察各组小鼠肺实质及肺间质炎性浸润及纤维化等病理学改变。
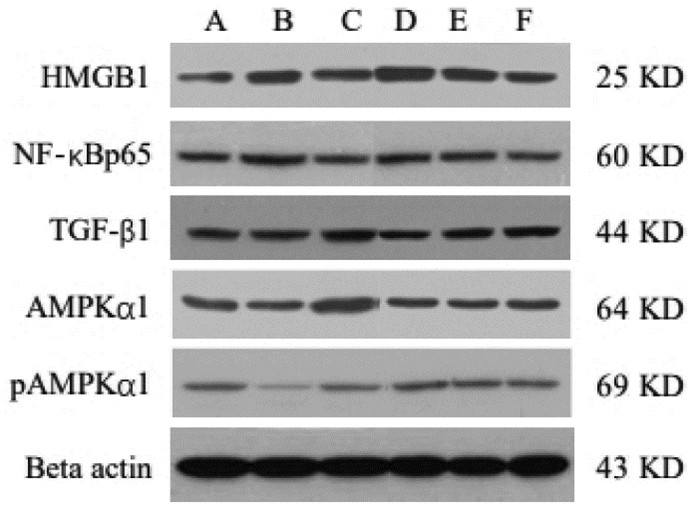
1.7.2 采用Western Blot技术检测小鼠肺组织
HMGB1、NF-κB p65、TGF-β1、AMPKα1、pAMPKα1的蛋白表达水平取出适量右肺组织置于冰上,迅速使用4 ℃预冷的生理盐水进行冲洗,随后加入适量裂解液超声匀浆裂解,提取蛋白,通过二奎啉甲酸(BCA)法检测蛋白浓度,并计算蛋白上样量。经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离后转移至聚偏氟乙烯(PVDF)膜上。转膜结束后,丽春红染色观察条带分布,将膜洗净后用5%脱脂奶粉室温封闭2 h,洗膜后放入一抗、二抗孵育,滴加ECL发光试剂,通过化学发光凝胶成像系统显影。采用凝胶图像分析系统对Western Blot蛋白杂交条带进行扫描;用Alpha View SA软件对图像进行灰度分析;计算各样本目标蛋白表达的相对含量。相对含量=目的蛋白灰度/Actin灰度。
1.8 统计学方法
应用SPSS 25.0统计软件,计量资料采用均数±标准差(x ± s)表示,多组间比较采用单因素方差分析,方差齐时,各组间两两比较采用LSD检验,方差不齐时,则采用Tamhance’s T2检验。等级资料统计用非参数检验法,独立多组间比较用Kruskal-Wallis Test法比较,独立两组间比较用Mann-Whitney Test法比较。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠一般情况
干预过程中正常组小鼠皮毛柔顺光亮,活动正常,反应灵敏,精神状态好,呼吸平稳。模型组小鼠皮毛逐渐枯槁无光泽,活动减少,反应迟钝,精神差,呼吸急促,咳喘较明显。阳性药组及姜虎汤各组皮毛光泽度差,活动有所减少,后期恢复正常,初有咳喘,后有所缓解,一般状态较模型组有改善。
2.2 各组小鼠肺组织肉眼观察结果
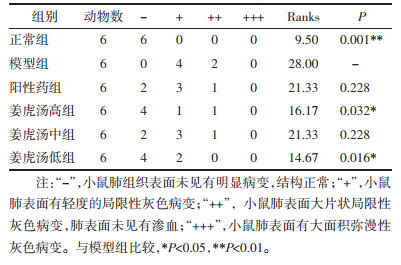
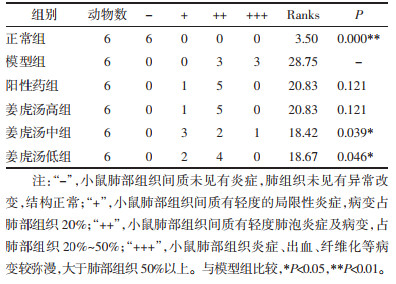
正常组小鼠肺组织结构正常,肺叶轮廓清晰,表面光滑,呈粉红色,质地均匀,弹性好,无出血点及结节。模型组小鼠肺组织表面有不同程度弥漫性灰色病变,表面未见有渗出,与正常组比较,模型组病理改变有显著差异(P < 0.01)。阳性药组小鼠肺组织表面有局限性轻度灰色病变。姜虎汤高、中、低剂量组小鼠肺组织表面有不同程度局限性灰色病变,与模型组比较,姜虎汤高、低剂量组小鼠肺组织病变明显改善(P < 0.05)。见表 1。
表 1 各组小鼠肉眼肺组织病理变化半定量化统计
Tab. 1
Semi-quantitative statistics of pathological changes in lung tissue of mice in each group by naked eyes
2.3 各组小鼠肺组织HE病理变化
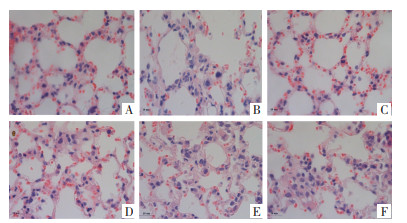
如图 1所示,正常组小鼠肺组织结构正常,间质未见有炎症、水肿,肺间隔未见有纤维化改变(图 1A)。模型组小鼠肺部组织有轻度水肿,蛋白渗出,被染成粉色。有弥漫性肺间质及肺泡炎症细胞浸润。大、小血管周围有异常纤维细胞增殖、增宽,大量肺泡炎症、肺纤维化特征大量粗细不等,肺纤维化病变较弥漫,肺间质有出血、瘀血,部分肺泡失去正常结构(图 1B)。阳性药组小鼠肺组织间质炎症增生、小鼠肺泡粗细不等的纤维化等病变(图 1C)。姜虎汤高、中、低剂量组小鼠肺部组织间质炎症增生,肺泡纤维化,与模型组相比,肺部病变有不同程度改善姜虎汤高剂量组小鼠肺组织间质炎症增生、肺泡大小不等、水肿及粗细不等的纤维化(图 1D)。姜虎汤中剂量组小鼠肺组织间质炎症增生、肺泡炎症及粗细不等的纤维化(图 1E)。姜虎汤低剂量组小鼠肺组织间质炎症、出血、水肿及肺泡纤维化(图 1F)。
2.4 各组小鼠肺组织HE病理改变统计学变化
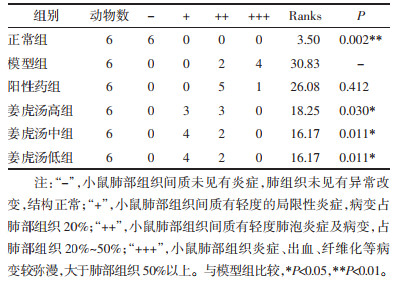
正常组小鼠肺组织间质未见有炎症,未见有水肿,肺间隔未见有纤维化。与正常组比较,模型组小鼠肺组织显著病理改变(P < 0.01),主要表现在肺组织水肿,蛋白渗出,弥漫性肺间质及肺泡炎症细胞浸润,炎症细胞增生;大、小血管周围有异常纤维细胞增殖、增宽,大量肺泡炎症、肺纤维化特征,肺纤维化病变较弥漫,肺间质有出血、瘀血,有部分肺泡失去正常结构。与模型组比较,阳性药组小鼠肺组织间质炎症、纤维化等病变有不同程度改善;姜虎汤中、低剂量组肺组织炎症病变明显改善(P < 0.05),姜虎汤各组小鼠肺组织纤维化病变明显改善(P < 0.05)。见表 2、表 3。
表 2 各组小鼠镜下肺组织炎症病变半定量化统计
Tab. 2
Semi-quantitative statistics of inflammatory lesions in lung tissue of mice in each group under light microscope
表 3 各组小鼠镜下肺组织纤维化病变半定量化统计
Tab. 3
Semi-quantitative statistics of pulmonary fibrosis in mice of each group under light microscope
2.5 姜虎汤对CTD-ILD小鼠肺组织免疫炎性因子HMGB1蛋白表达水平的影响
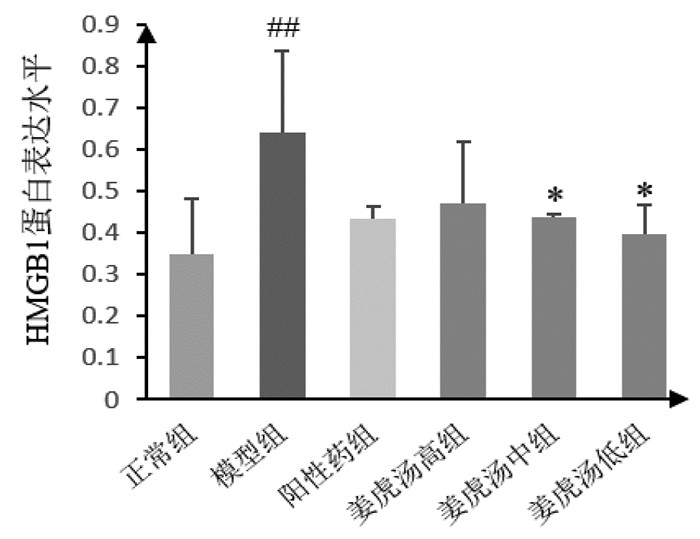
与正常组比较,模型组小鼠肺组织中HMGB1蛋白表达水平显著上调(P < 0.01);与模型组比较,姜虎汤中、低剂量组小鼠肺组织中HMGB1蛋白表达水平明显下调(P < 0.05);姜虎汤各剂量与阳性药组比较无明显差异;姜虎汤各剂量组间比较无明显差异。说明姜虎汤能够抑制小鼠肺组织中免疫炎性因子HMGB1蛋白表达,且中、低剂量的姜虎汤效果更佳。见图 2、图 6。
2.6 姜虎汤对CTD-ILD小鼠肺组织免疫炎性因子NF-κB p65蛋白表达水平的影响
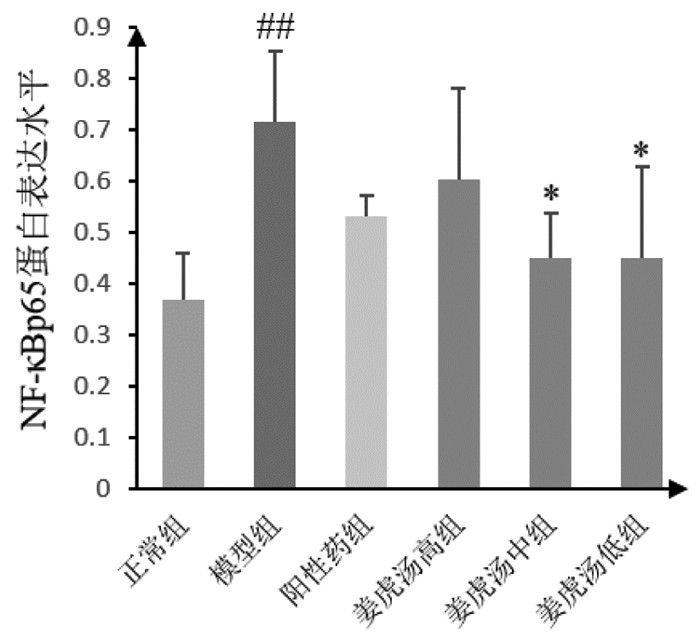
与正常组比较,模型组小鼠肺组织中NF-κB p65蛋白表达水平显著上调(P < 0.01);与模型组比较,姜虎汤中、低剂量组小鼠肺组织中NF-κB p65蛋白表达水平明显下调(P < 0.05)。与阳性药组比较,姜虎汤各剂量组无明显差异;姜虎汤各剂量组间比较无明显差异。说明姜虎汤能够抑制小鼠肺组织中免疫炎性因子NF-κB p65蛋白表达,且中、低剂量的姜虎汤效果更佳。见图 3、图 6。
2.7 姜虎汤对CTD-ILD小鼠肺组织纤维化因子TGF-β1蛋白表达水平的影响
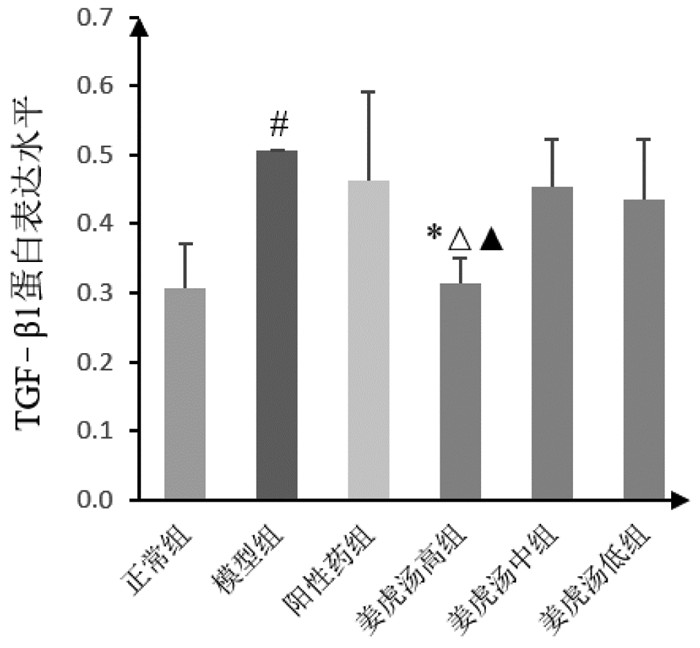
与正常组比较,模型组小鼠肺组织中TGF-β1蛋白表达水平明显上调(P < 0.05);与模型组比较,姜虎汤高剂量组小鼠肺组织中TGF-β1蛋白表达水平明显下调(P < 0.05),阳性药组、姜虎汤中、低剂量组小鼠肺组织中TGF-β1蛋白表达水平均有下调趋势,但差异均无统计学意义;与阳性药组比较,姜虎汤高剂量组小鼠肺组织中TGF-β1蛋白表达水平明显下调(P < 0.05);姜虎汤各剂量组间比较,姜虎汤高剂量组与姜虎汤中剂量组差异明显(P < 0.05)。说明姜虎汤能够抑制小鼠肺组织纤维化因子TGF-β1的蛋白表达,且高剂量的姜虎汤更有优势。见图 4、图 6。
2.8 姜虎汤对CTD-ILD小鼠肺组织免疫炎性抑制因子AMPKα1、pAMPKα1蛋白表达水平的影响
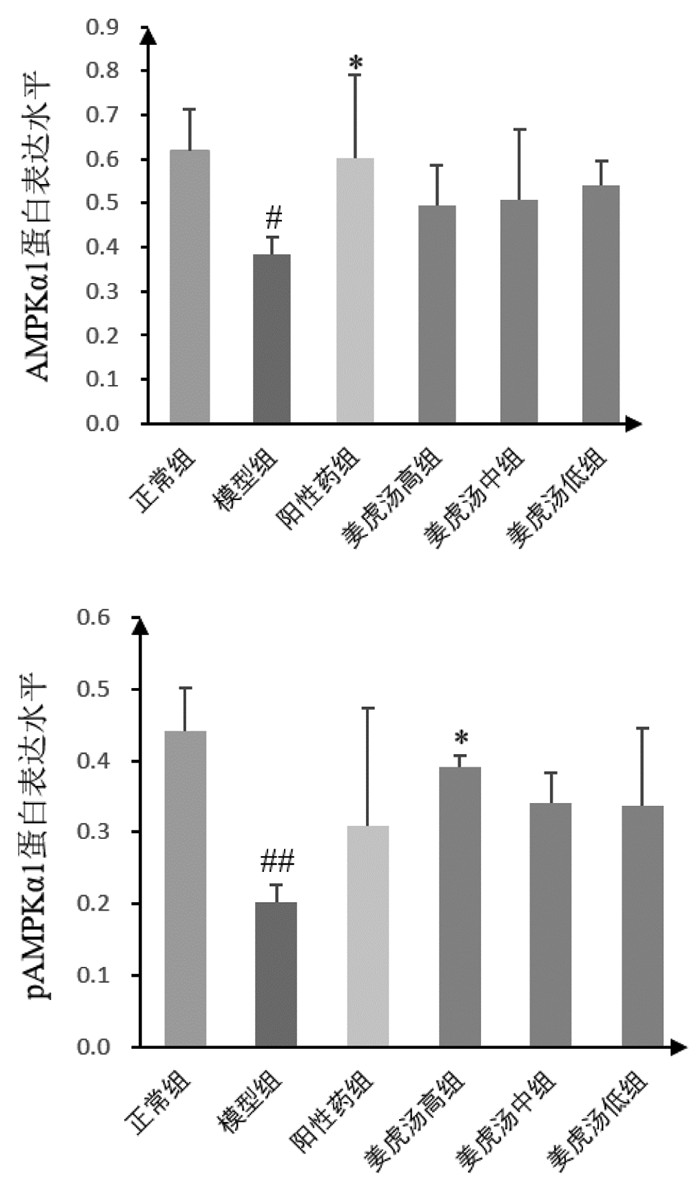
与正常组比较,模型组小鼠肺组织中AMPKα1、pAMPKα1蛋白表达水平明显下调(P < 0.05或P < 0.01);与模型组比较,阳性药组小鼠肺组织中AMPKα1蛋白表达水平明显上调(P < 0.05),姜虎汤各剂量组小鼠肺组织中AMPKα1蛋白表达水平均有上调趋势,但差异无统计学意义;与模型组比较,姜虎汤高剂量组小鼠肺组织中pAMPKα1蛋白表达水平明显上调(P < 0.05),阳性药组及姜虎汤中、低剂量组小鼠肺组织中pAMPKα1蛋白表达水平有上调趋势,但差异无统计学意义;与阳性药组比较,姜虎汤各剂量组小鼠肺组织AMPKα1、pAMPKα1蛋白表达差异无统计学意义;姜虎汤各剂量组间比较差异无统计学意义。说明姜虎汤能够激活小鼠肺组织免疫炎性抑制因子AMPKα1及其磷酸化水平pAMPKα1的蛋白表达,且高剂量的姜虎汤更有优势。见图 5、图 6。
3 讨论
CTD-ILD临床以进行性呼吸困难、咳嗽、咳痰等为主要表现,肺功能检查主要表现为限制性通气功能障碍、弥散功能降低,低氧血症,肺电子计算机断层扫描(CT)显示双肺弥漫性病变等,其特征是免疫介导的组织损伤,累及肺部,从而出现肺间质弥漫性炎性渗出、浸润及间质纤维化。先天免疫系统和适应性免疫系统均可诱导纤维化的发展[9]。目前研究认为,CTD-ILD的发病机制与遗传易感性、免疫失调和/或宿主修复过程异常等有关[10]。经过多项研究证实了某些细胞亚群及细胞因子在肺间质病变的过程中起关键作用 [11]。
HMGB1是一种多功能细胞因子,被认为是各种组织的主要免疫炎症因子之一,且与肺部炎症反应性疾病的发生、发展密切相关,它可与其他炎症因子相互作用,放大和加重炎症性反应,引起组织损伤[12]。通过与其受体晚期糖基化终末产物受体(RAGE)结合,激活NF-κB信号通路,释放白细胞介素-1β(IL-1β)、肿瘤坏死因子α(TNF-α)等多种炎症性介质[13]。NF-κB作为一种经典的炎症信号通路,通过多种促炎细胞因子和趋化因子的产生和分泌,在炎症和免疫的复杂调控网络中起着至关重要的作用。而NF-κB通路参与HMGB1释放[12]。Wang等[14]发现HMGB-1可通过激活巨噬细胞中的M2型巨噬细胞,以及通过RAGE/NF-κB信号通路诱导M1巨噬细胞极化参与急性肺损伤的发病机制。
TGF-β1是诱导纤维化所必需的多功能细胞因子。当被激活时,TGF-β1会诱导成纤维细胞到肌成纤维细胞的反式分化和上皮到间充质的转化(EMT),导致胶原过度沉积,从而诱导组织纤维化[15]。研究发现,HMGB1可以促进TGF-β1释放,诱导肺成纤维细胞分化为肌成纤维细胞,从而参与肺纤维化的发生发展[16]。HMGB1促进TGF-β1的产生,参与肺血管重塑[17]。此外,HMGB1的过表达刺激TGF-β1的释放,引起肺间质纤维化和通过该途径的一系列免疫炎性反应,导致CTD-ILD发生发展。
AMPK是公认的细胞生物能量传感器和代谢调节剂,也是重要的免疫炎性抑制因子,在抑制肺组织免疫炎性损伤及纤维化的发展中发挥重要作用。而AMPK的生物学功能是通过其磷酸化形式即pAMPK实现的。AMPK是一种异源三聚体复合物,由催化亚基α和两个调节亚基β和γ结构域组成[18]。AMPKα亚基N末端的激酶结构域(KD)内是活化环中保守的苏氨酸残基(Thr172),上游激酶对Thr172进行磷酸化是AMPK激活的主要事件[19]。研究表明,AMPK活化与HMGB1释放的抑制之间存在密切关系,使用AMPK激活剂激活AMPK,可减少HMGB1、NF-κB的释放,进而减轻组织免疫炎症反应[20]。此外,AMPK激活能够逆转TGF-β1对纤维化反应的影响,而抑制AMPK则增强了TGF-β1的作用。此外,TGF-β1能够减少Thr172的磷酸化,同时增加纤维化[21]。由此可见AMPK能够抑制HMGB1,降低NF-κB的表达,减轻免疫炎性反应;AMPK抑制TGF-β1的表达,阻碍肺组织间质纤维化进程,提示AMPK作为重要的调控因子,在免疫炎性反应及纤维化的分子调控网络中发挥重要作用。
与文献报道一致,本研究中,BLM诱导的CTD-ILD模型小鼠肺组织镜下可见大量组织水肿,蛋白渗出,弥漫性肺间质及肺泡炎症细胞浸润,炎症细胞增生,异常纤维细胞增殖、增宽,肺间质弥漫性纤维化样改变,且肺组织中免疫炎性因子HMGB1、NF-κB p65及纤维化细胞因子TGF-β1蛋白表达水平显著升高,免疫炎性抑制因子AMPKα1及pAMPKα1蛋白表达显著降低;药物干预4周后,姜虎汤中、低剂量组的肺组织炎症病理损伤明显改善,免疫炎性因子HMGB1、NF-κB p65蛋白表达水显著降低;姜虎汤高、中、低各组肺纤维化病理特征均显著改善,姜虎汤高剂量组小鼠肺组织中纤维化细胞因子TGF-β1蛋白表达水平显著降低,免疫炎性抑制因子pAMPKα1蛋白表达水平显著增加。提示姜虎汤在CTD-ILD免疫调节中的作用可能是通过以下通路实现的:首先,姜虎汤中、低剂量组通过抑制HMGB1/NF-κB信号通路,改善免疫炎性损伤,同时通过抑制HMGB1 /TGF-β1信号通路改善免疫炎性损伤及间质纤维化;其次,姜虎汤高剂量组通过激活AMPKα1,增加其磷酸化pAMPKα1的表达,抑制HMGB1、NF-κB蛋白表达,减轻免疫炎性损伤;同时抑制TGF-β1的释放,减轻肺间质纤维化。
中医认为CTD-ILD属于“肺痹”“肺痿”的范畴,在CTD-ILD整个病变过程中痰、瘀、毒等病理产物与脏腑虚损、外邪侵袭互为因果,共同影响疾病进展。姜虎汤由虎杖、姜黄组成,是临床用于治疗CTD-ILD的有效验方,在改善患者临床症状如呼吸困难、咳嗽、咳痰、胸闷等方面发挥潜在优势。现代药理证明,虎杖具有抗感染、抗炎、抗氧化应激、抑制纤维化以及免疫调节等作用[22]。研究表明,虎杖可通过调控脂质代谢,减轻肺纤维化小鼠的肺组织炎症反应和胶原沉积,改善小鼠肺组织纤维化进程[23]。姜黄为姜科姜黄属多年生草本植物姜黄的干燥根茎,现代药理学研究发现姜黄具有抗氧化、抗炎等作用[24]。研究发现,姜黄能够降低肺纤维化细胞外基质的含量,抑制成纤维细胞的增殖和细胞外基质的合成,促进炎症区域细胞凋亡,促进肺泡结构修复[25]。此外,姜黄素能够从蛋白水平调控TGF-β1的表达,下调肺组织中TGF-β1蛋白的表达,延缓肺纤维化的发展进程[26]。
研究提示姜虎汤中、低剂量组在改善小鼠肺组织炎症病理损伤、抑制免疫炎性因子高表达的作用更具优势;姜虎汤高剂量组在改善小鼠肺组织间质纤维化、抑制纤维化生成因子高表达及上调免疫炎性抑制因子的作用更强。说明中药相同药物组成,剂量不同可能出现不同的干预结果或不同的作用靶点。姜虎汤在改善CTD-ILD免疫炎性病理损伤和延缓肺间质纤维化方面发挥重要作用,其分子机制可能与激活AMPK,从而抑制HMGB1/NF-κB/TGF-β1免疫炎性信号通路相关,深入研究在继续进行。
Effect of Jianghu Decoction on immune inflammatory injury in connective tissue disease associated interstitial lung disease model mice
1. Beijing University of Chinese Medicine, Beijing 100029, China;
2. Department of Respiration, Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100078, China;
3. Department of Rheumatology, Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100078, China;
4. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100029, China;
5. Beijing Changping District Hospital of Integrated Traditional Chinese and Western Medicine, Beijing 100096, China;
6. Department of Rheumatology, Beijing Hospital of Traditional Chinese Medicine of Capital Medical University, Beijing 100010, China;
7. Yanshan Community Health Service Center, Beijing 102500, China;
8. Yongledian Health Service Center of Tongzhou District, Beijing 101105, China
 2024, Vol. 41
2024, Vol. 41