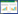文章信息
- 孙越臣, 张琪, 刘薇薇, 等.
- SUN Yuechen, ZHANG Qi, LIU Weiwei, et al.
- 宣肺清络方对肺炎支原体肺炎痉挛性咳嗽大鼠肺组织病理学及炎性因子的影响
- Effect of Xuanfei Qingluo Formula on lung histopathology and inflammatory factors in rats with MPP spasmodic cough
- 天津中医药, 2024, 41(7): 893-897
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 893-897
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.16
-
文章历史
- 收稿日期: 2024-01-22
肺炎支原体肺炎(MPP)是儿童常见的社区获得性肺炎[1],早期可出现痉挛性咳嗽,后期可伴有黄痰,咳嗽是贯穿MPP整个病程的主要症状。西医方面,大环内酯类药物作为首选药物,但在大量应用中却又会出现耐药性[2]。大量研究显示[3-5],中医药治疗MPP在有效性方面优势显著。
MPP在中医学归属于“肺炎喘嗽”范畴,其基本病机在于“肺络阻滞”,认为邪灼伤肺络,壅阻络脉,肺失宣降致气逆上冲,而发为痉挛性咳嗽。宣肺清络方是天津中医药大学第二附属医院经验方,秉承“络以通为用”“凡病宜通”的治疗思想[6-7],结合临床实践组方而成。该方在清肺化痰(麻黄、石膏、桑白皮)的基础上,配合祛除络瘀(桃仁)、温肺化痰(莱菔子、冬瓜子)、行气宽胸通络(瓜蒌)、清热通络解毒(金银花、鱼腥草、黄芩)、搜风刮络(地龙、僵蚕)并行的理念,以利肺络通畅,恢复气血流畅,调整肺络病理状态,达到通之目的,改善MPP所致的肺络痹阻。
目前有关文献表明[8],感染后咳嗽动物模型的建立多采用病毒滴鼻联合辣椒素雾化的造模方法,并从行为学、支气管肺泡灌洗液(BALF)白细胞分类计数等进行观察评价,但鲜有肺炎支原体(MP)感染后咳嗽的动物模型可供参考,本课题组基于前期课题经验,拟结合该法尝试建立MPP痉挛性咳嗽大鼠的动物模型。同时以血清中IL-6、IL-8、TNF-α含量及肺组织病理为观察目标,验证大鼠血清中炎症因子水平的上调,以及宣肺清络方对其下调的作用,为中医药治疗MPP痉挛性咳嗽提供新思路。本研究通过天津中医药大学实验动物伦理委员会批准(批号:TCM-LAEC2022130)。
1 材料 1.1 动物Wistar大鼠,雄性,体质量150~160 g,由北京维通利华实验动物技术有限公司提供[9],生产许可证编号:SCXK(京)2021-0011,普通喂养,湿度在50%左右,温度25~26 ℃,充足光照、水和食物,自由活动。
1.2 药物宣肺清络复方颗粒剂:药物组成如下[6]:炙麻黄6 g,金银花10 g,黄芩10 g,鱼腥草20 g,炒冬瓜子10 g,桃仁6 g,炒莱菔子10 g,瓜蒌20 g,地龙10 g,炒僵蚕10 g,炙桑白皮10 g,甘草6 g,生石膏20 g。宣肺清络复方颗粒剂由天江药业有限公司提供。阿奇霉素干混悬剂[10](希舒美,辉瑞公司生产,国药准字H10960112);规格:0.1 g,密封,在干燥处保存。
1.3 MP培养肺炎支原体国际标准株(ATCC,15531),购自American Type Culture Collection官网。在易生源检测技术服务天津有限公司保存。将冻存的MP菌株接种至液体培养基中,温度设置37 ℃,5%二氧化碳(CO2)条件下培养。
1.4 主要试剂及仪器二甲苯、无水乙醇(国药集团化学试剂有限公司,货号10023418、100092683);伊红染液、苏木素染液(北京中杉金桥生物科技有限公司,货号ZLI-9613、ZLI-9610);甲酸脱钙液、酸性乙醇分化液(源叶生物,货号R20408、R20777);IL-6、IL-8、TNF-α试剂盒、中性树胶(北京索莱宝科技有限公司,货号分别为SEKR-0005、SEKR-0071、SEKR-0009、G8590)。
DNM-9602酶标检测仪,北京普朗科技有限公司;LEiCA TP-1020脱水机、LEiCA HistoCore MULTICUT病理切片机,徕卡仪器有限公司;BPG-9106A恒温箱,上海一恒仪器有限公司[11];ES500-1包埋机、ES500-3H组织摊片机,金华市华速科技有限公司;OLYMPUS CKX43-LP显微镜,OLYMPUS;10212432C盖玻片、80302-2101载玻片,江苏世泰实验器材有限公司。
2 方法 2.1 分组及模型建立60只大鼠随机分为空白组、肺炎支原体肺炎组、模型组、阿奇霉素组、宣肺清络组、宣肺清络+阿奇霉素组,共计6组,每组10只。模型组采用肺炎支原体培养液滴鼻+烟熏法+辣椒素溶液雾化激发法建立肺炎支原体肺炎感染后痉挛性咳嗽大鼠模型。参考文献[12]方法,肺炎支原体肺炎组在第1、4、7天用10%水合氯醛溶液按300 mg/kg,腹腔注射进行麻醉,用1 mL注射器将107 CCU/mL的肺炎支原体培养液缓慢地滴入动物鼻中,诱导大鼠气道炎症,按每日1次,每次0.1 mL[12]。模型组和各药物组将大鼠置放于自制的熏箱内(长4 cm,宽30 cm,高40 cm),每日用13支香烟进行烟熏,每日烟熏15 min,每日1次,连续7 d。烟熏结束后第1、4、7天,同肺炎支原体肺炎组进行MP感染。辣椒素雾化激发实验从烟熏结束后的第2、3、5、6天,将模型组和各药物组大鼠置于透明密闭容器中,以10-4 mol/L的辣椒素溶液雾化吸入激发,每次3 min,每日1次[8]。每日观察各组大鼠状态及行为学改变,记录间断或持续性咳嗽等表现,结合支气管肺泡灌洗液中白细胞分类计数结果,提示造模成功。
2.2 给药方法肺炎支原体肺炎组及模型组造模成功后开始治疗,空白组、肺炎支原体肺炎组、模型组按生理盐水8 mL灌胃,每日2次。阿奇霉素组63 mg溶于4 mL生理盐水中,每日1次。宣肺清络组14 g,溶于8 mL生理盐水中,每日2次。宣肺清络+阿奇霉素组将阿奇霉素63 mg溶于4 mL生理盐水中,每日1次,将宣肺清络方14 g,溶于8 mL生理盐水中,每日2次。所有组别连续灌胃7 d。
2.3 一般外观行为学在造模过程中观察大鼠是否出现精神不振、纳差、消瘦、间断咳嗽等表现[13]。
2.4 大鼠咳嗽次数测定烟熏结束后的第2、3、5、6天,将大鼠置放于自制的熏箱内(长4 cm,宽30 cm,高40 cm),进行辣椒素溶液雾化吸入激发后到停止吸入后2 min时,由专门人员计数5min内咳嗽次数[14],大鼠咳嗽时,有伸出前脚、颈部伸向前、张口等特征性体位出现,即可记录1次[15]。
2.5 大鼠肺泡灌洗液中白细胞总数的测定将灌洗液混匀,在全自动模式血液体液分析仪上测定白细胞总数。
2.6 MPP定量检测取肺脏样本25 mg进行研磨,用核酸提取试剂盒进行提取40 μL,使用MP荧光定量PCR检测试剂盒进行鉴定。
2.7 ELISA法检测大鼠血清中白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)等含量取尾静脉血3 mL,离心后收集血清-70 ℃冻存,统一待测[16-17]。严格操作方法,按照ELISA定量检测试剂盒。
2.8 苏木精-伊红(HE)染色法观察大鼠肺组织病理形态新鲜肺组织以10倍体积的10%甲醛溶液固定24 h以上,常规石蜡包埋切片,HE染色,光学显微镜下观察肺组织病理形态学变化[18]。
2.9 统计学方法采用SPSS22.0软件进行数据分析与处理,数据以均数±标准差(x ± s)表示,差异性分析采用单因素方差分析。若不同组间的指标存在统计学差异,采用Bonferroni两两比较法进行检验[19]。以P < 0.05为差异具有统计学意义。
3 结果 3.1 一般情况观察结果实验过程中,空白组大鼠行为表现正常。随着烟熏天数的增加,肺炎支原体肺炎组及模型组大鼠表现为精神萎靡不振,呼吸声嘶哑。辣椒素溶液雾化吸入激发后,模型组出现较明显咳嗽症状,表现为颈部向前,口张开,耳朵颤栗等[20]。
3.2 大鼠咳嗽测定与空白组比较,模型组大鼠咳嗽次数明显增多,差异具有统计学意义(P < 0.05)。见表 1。
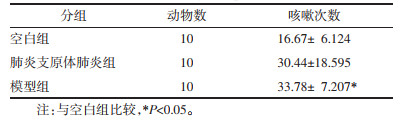
与空白组比较,肺炎支原体肺炎组、模型组大鼠中BALF中白细胞分类计数均有升高的趋势,差异具有统计学意义(P < 0.05),显示造模成功。见表 2。
MP DNA定量结果显示肺炎支原体肺炎组、模型组感染大鼠肺组织中均有MP DNA表达,显示造模成功。见表 3。
空白组肺泡血管充血,伴少量炎症细胞浸润,肺内支气管上皮脱落,少量炎细胞,间质内少量炎细胞浸润。肺炎支原体肺炎组肺泡血管充血,伴少量炎症细胞浸润,支气管内上皮组织增生,周围淋巴组织增生,部分组织炎症细胞浸润,间质组织血管周围大量嗜酸性粒细胞聚集。模型组肺泡组织坏死,大量炎症细胞浸润,局部组织实变,支气管内皮细胞脱落坏死,周围淋巴组织增生,间质内炎症细胞浸润。见图 1。
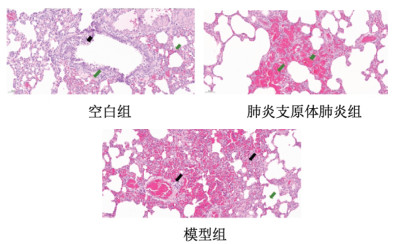
|
| 图 1 各组大鼠病理结果比较(HE染色,×200,刻度尺:50 μm) Fig. 1 Comparison of pathological results in each group of rats(HE staining, ×200, scale: 50 μm) |
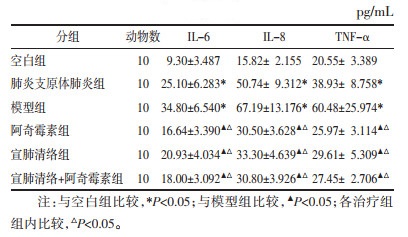
与空白组比较,肺炎支原体肺炎组、模型组血清中IL-6、IL-8、TNF-α含量表达增高,差异有统计学意义(P < 0.05);与模型组比较,各治疗组血清中IL-6、IL-8、TNF-α含量表达明显降低,差异有统计学意义(P < 0.05);在治疗干预后,各治疗组血清中IL-6、IL-8、TNF-α含量比较差异无统计学意义(P < 0.05)。见表 4。
HE染色显示,空白组可见肺组织结构基本正常,视野可见肺泡壁厚度均匀,肺泡壁上可见丰富的毛细血管,肺泡结构清晰,未见萎缩[21]。支气管上皮细胞排列规则,未见脱落。组织未见水肿和炎症细胞浸润[22]。模型组肺组织结构重度异常,视野可见肺泡上皮细胞增生,肺泡萎缩伴随肺泡壁增厚;肺泡间质出血;支气管管腔可见出血;组织可见大量炎症细胞浸润,炎症细胞以中性粒细胞为主。肺炎支原体肺炎组肺组织结构中度异常,视野可见肺泡上皮细胞增生,肺泡萎缩伴随肺泡壁增厚;支气管上皮细胞排列较规则,未见明显脱落;组织可见少量炎症细胞浸润,炎症细胞以中性粒细胞为主[23]。阿奇霉素组、宣肺清络组、宣肺清络组+阿奇霉素组也有不同程度的肺组织损伤,视野可见部分肺泡上皮细胞轻度增生,肺泡萎缩伴随肺泡壁增厚,组织可见少量炎症细胞浸润[24],程度均介于空白组与模型组之间。见图 2。
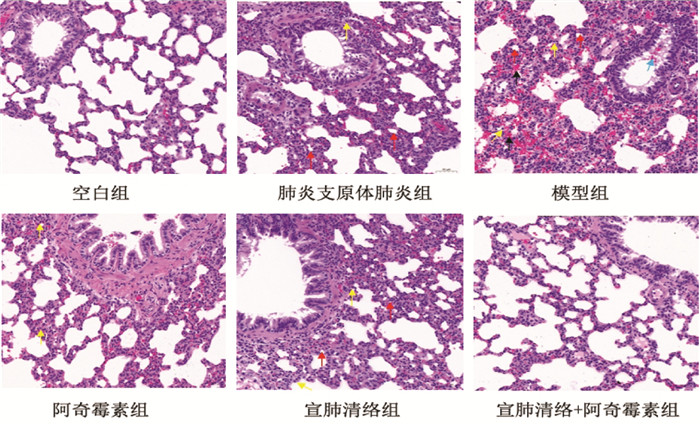
|
| 图 2 各组大鼠肺组织形态病理结果比较(HE染色,×200,刻度尺:50 μm) Fig. 2 Comparison of morphological and pathological results of lung tissue of rats in each group(HE staining, ×200, scale: 50 μm) |
MPP引起的咳嗽呈痉挛性、刺激性,这与肺炎支原体感染后引起的气道高反应密不可分[25]。MP本身是一种特异性的抗原,能够通过速发或者迟发的变态反应诱导机体产生相应的抗体和细胞因子参与气道的慢性炎性反应,也是引发气道高反应的根本原因之一。目前MPP的发病机制研究中,免疫学致病机制是其中的靶点,而MP诱导的炎症损伤在免疫损伤中占重要地位[26]。IL-6是一种多功能细胞因子,是炎症反应中的重要细胞因子,在机体的炎症反应、抗感染、自身免疫方面起着重要作用。IL-8对中性粒细胞、T淋巴细胞具有强烈的趋化作用[27],研究表明,这些炎症细胞释放活性物质,引起广泛的炎症反应。MP感染可诱发巨噬细胞产生TNF-α,既增加了炎症反应,又能产生IL-6、IL-8等细胞因子,致使血清IL-6、IL-8、TNF-α含量显著升高。
MPP痉挛性咳嗽在病程过程中是最为突出的症状,以起病急、症状重、持续时间长为特点。中医将MPP归属于“肺炎喘嗽”范畴,病因病机以肺络阻滞为基础,若气滞血瘀、痰浊阻滞肺络可导致肺络气机紊乱,气逆上冲而为痉挛性咳嗽。随着中医和西医的交流与渗透,中医在MPP急性期治疗以及早期干预等方面的独特作用正逐步显现。然而,缺乏MPP痉挛性咳嗽模型,也是制约其研究深度的一大原因。本课题组通过肺炎支原体培养液滴鼻+烟熏法+辣椒素溶液雾化方法,探索建立MPP痉挛性咳嗽大鼠模型的可行性。本次实验观察到,该法诱导的模型组大鼠可出现精神不振、间断咳嗽等表现[13],随着造模时间延长,症状逐渐加重,且具有颈部向前伸等表现,同时观察到模型组BALF中白细胞分类计数均有升高的趋势,符合感染后咳嗽动物模型的判断,这为后续的实验研究建立模型提供基础。
随着对MP感染研究的不断深入,有研究表明[28],中药对肺炎支原体具有一定的抑制作用,且可调节免疫,改善循环。前期临床及实验研究已证实宣肺清络方在减轻MPP患儿夜间咳嗽症状、咳嗽程度、气道修复、减轻气道高反应方面疗效明显。本课题实验在前期研究基础上,进一步探讨其作用机制。本实验结果显示宣肺清络方能够改善肺组织结构损害,周围淋巴组织增生,间质内炎症细胞浸润。血清IL-6、IL-8、TNF-α含量较模型组明显降低,统计学处理差异具有统计学意义(P < 0.05),在治疗干预后,各治疗组血清中IL-6、IL-8、TNF-α含量相互比较差异无统计学意义(P > 0.05),联合用药组未优于宣肺清络组以及阿奇霉素组,说明不除外存在干预因素,作为中药复方,其作用机制可能更为复杂,需要更深入的研究证实。本实验已证明宣肺清络方对IL-6、IL-8、TNF-α的释放具有下调作用,可达到增效、减毒、降低气道高反应作用,能够改善微循环障碍,为今后临床减少阿奇霉素的使用提供依据。
综上所述,通过检测模型大鼠肺组织形态病理学及血清中IL-6、IL-8、TNF-α含量变化,探讨宣肺清络方治疗MPP的药理机制,期望能够为抗MPP痉挛性咳嗽的中医药研发提供更多的数据支持。
| [1] |
卞金玲. 异丙托溴铵联合吸入糖皮质激素对喘息性支气管炎患儿影响[J]. 实用中西医结合临床, 2020, 20(6): 92-94. |
| [2] |
付晓燕, 秦选光, 辛德莉. 小儿肺炎支原体感染耐药情况回顾分析[J]. 中国儿童保健杂志, 2017, 25(9): 951-954. |
| [3] |
周媛媛. 阿奇霉素结合中药治疗小儿支原体肺炎39例[J]. 中医临床研究, 2018, 10(34): 114-116. DOI:10.3969/j.issn.1674-7860.2018.34.047 |
| [4] |
姜之炎, 阚倩娜. 清肺通络方对肺炎支原体肺炎TGF-β、IL-1β表达的影响[J]. 中华中医药杂志, 2021, 36(11): 6731-6734. |
| [5] |
刘秀秀, 阚倩娜, 肖臻, 等. 基于Nrf2/ARE信号通路探讨清肺通络方对肺炎支原体感染小鼠肺氧化损伤的影响[J]. 中华中医药杂志, 2022, 37(1): 441-445. |
| [6] |
屈永. 宣肺清络方治疗儿童肺炎支原体肺炎痰热闭肺证痉咳疗效观察与机制初探[D]. 天津: 天津中医药大学, 2021.
|
| [7] |
刘薇薇, 张同园, 师长丽, 等. 通络四法于小儿支原体肺炎咳嗽的辨治要点[J]. 中国中医基础医学杂志, 2019, 25(8): 1153-1154. |
| [8] |
李飞侠, 朱佳, 王文, 等. 一种感染后咳嗽动物模型制作方法的建立及评价[J]. 中华中医药学刊, 2013, 31(10): 2315-2317, 2342. |
| [9] |
CHENG Y L, XIE S Y, WANG X X, et al. Effects of Shenfu Yixin Granules on myocardial fibrosis in rats with post-infarction heart failure[J]. Journal of Traditional Chinese Medicine, 2020, 61(1): 68-73. |
| [10] |
熊燕. 中医辨证分型穴位贴敷辅助治疗小儿肺炎支原体肺炎疗效观察[J]. 内蒙古中医药, 2017, 36(10): 77-78. DOI:10.3969/j.issn.1006-0979.2017.10.079 |
| [11] |
安雪晶. 基于酸敏感离子通道研究针刺预防性治疗偏头痛CSD模型鼠的机制[D]. 天津: 天津中医药大学, 2021.
|
| [12] |
程燕, 李晓丹, 陈慧. 肺炎支原体感染大鼠气道反应性的实验研究[J]. 吉林医学, 2012, 33(9): 1796-1797. DOI:10.3969/j.issn.1004-0412.2012.09.002 |
| [13] |
王文丽, 李冬梅, 施雷. 咳嗽变异性哮喘病证结合动物模型的建立和评价[J]. 中医药导报, 2016, 22(7): 24-27, 35. |
| [14] |
吕寒静, 邱忠民, 杨忠民, 等. 气道速激肽在卵蛋白致敏豚鼠模型咳嗽反应中的作用[J]. 中国病理生理杂志, 2005, 21(9): 1744-1747. DOI:10.3321/j.issn:1000-4718.2005.09.019 |
| [15] |
王谦, 史利卿, 马建岭, 等. 咳嗽敏感性增高豚鼠模型两种造模方法比较研究[J]. 辽宁中医药大学学报, 2017, 19(5): 92-95. |
| [16] |
张峰, 汪洋, 孙军伟, 等. 缺血预处理对肝脏缺血-再灌注IL-6-STAT3信号通路活性的影响[J]. 华中科技大学学报(医学版), 2019, 48(6): 667-670. |
| [17] |
曾祥富, 梁土金, 李明海, 等. 血浆脂蛋白磷脂酶A2水平在急性动脉硬化性脑梗死患者中的变化[J]. 辽宁医学院学报, 2016, 37(6): 47-49. |
| [18] |
夏金婵, 从人愿, 袁静, 等. 黄芩苷通过p38 MAPK/NLRP3通路对脂多糖诱导大鼠急性肺损伤的影响[J]. 中国实验方剂学杂志, 2022, 28(2): 79-86. |
| [19] |
邹博. IL-6/STAT3信号通路在湿热内蕴证UC大鼠肠黏膜免疫屏障中的作用及芍药汤的干预机制[D]. 长沙: 湖南中医药大学, 2021.
|
| [20] |
仲坤, 齐越, 李昭, 等. 感染后咳嗽大鼠模型建立研究[J]. 辽宁中医药大学学报, 2019, 21(2): 23-26. |
| [21] |
刘卫东. FTY-720通过TGF-β1/TAK1/P38 MAPK信号通路对小鼠肺纤维化的影响[D]. 延吉: 延边大学, 2020.
|
| [22] |
贾敏, 樊文花, 秦巧红, 等. 香烟尘雾颗粒经鼻腔滴入建立小鼠COPD肺功能损伤模型[J]. 中国病理生理杂志, 2019, 35(10): 1915-1920. |
| [23] |
宋璟, 孙志佳. 培土生金法对慢性阻塞性肺疾病大鼠膈肌细胞增殖与凋亡的影响[J]. 广州中医药大学学报, 2016, 33(3): 342-346. |
| [24] |
谢晗, 陈琼, 王懿春. 内皮抑素通过Notch1/血小板源生长因子信号通路对小鼠肺纤维化的抑制作用[J]. 中华危重症医学杂志(电子版), 2019, 12(6): 361-366. |
| [25] |
朱炜春. 支原体肺炎的治疗对气道高反应发生的影响[J]. 中国医药科学, 2012, 2(10): 203-204. |
| [26] |
许钰翎. 血清IL-6、TNF-α、D-dimer在儿童肺炎支原体肺炎病情轻重中的预测价值[D]. 延安: 延安大学, 2020.
|
| [27] |
支学军, 刘建华, 苏菁, 等. COPD患者急性期吸入布地奈德-福莫特罗对炎性介质IL-8、TNF-α的影响[J]. 河北北方学院学报(自然科学版), 2014, 30(1): 74-76. |
| [28] |
赵晓阳, 姜永红. 中药治疗肺炎支原体感染的实验研究进展[J]. 辽宁中医杂志, 2019, 46(4): 874-877. |
 2024, Vol. 41
2024, Vol. 41