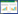文章信息
- 阎皓, 于小惠, 冯丹丹, 等.
- YAN Hao, YU Xiaohui, FENG Dandan, et al.
- 生脉胶囊逆转小鼠结肠癌细胞5-氟尿嘧啶耐药研究
- Reversal effect of Shengmai capsule on 5-fluorouracil resistance in mouse colon cancer cells
- 天津中医药, 2024, 41(7): 898-903
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 898-903
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.17
-
文章历史
- 收稿日期: 2024-01-31
2. 天津中医药大学中西医结合学院, 天津 301617;
3. 天津中医药大学医学技术学院, 天津 301617
世界范围内结直肠癌(CRC)的发病率位列恶性肿瘤第3位,病死率仅次于肺癌排名第2[1]。近年来,中国CRC的发病率和病死率也明显升高[2]。
化疗是临床治疗CRC尤其是晚期CRC的常用手段,其中5-氟尿嘧啶(5-FU)单独或联合用药是临床治疗CRC的一线方案,但在治疗过程中,患者易对药物产生耐药性而使得总体有效率较低(晚期CRC对5-FU单药治疗的有效率仅为10%~15%)[3]。逆转化疗耐药对于提高临床治疗CRC的效果,改善患者生存率具有重要意义,成为研究的热点之一[4-6]。
生脉方类制剂是根据经典古方生脉散(人参、麦冬、五味子)制作而成的现代中药制剂,常见的有生脉注射液、参麦注射液、生脉饮和生脉胶囊等,能够养阴生津、益气复脉,广泛应用于心血管类疾病的治疗和作为肿瘤放化疗辅助用药[7]。生脉方类制剂可能逆转某些癌细胞的化疗耐药,增强治疗的效果。
文献报道,参麦注射液能够诱导肺腺癌细胞A549的凋亡,并分别通过下调P-糖蛋白(P-gp)的表达和调节线粒体动态,逆转A549细胞的多西他赛和顺铂耐药[8-9]。此外,参麦注射液还能增强成骨肉瘤细胞R-OS-732对阿霉素的敏感性,以及通过下调P-gp表达逆转乳腺癌细胞MCF-7的阿霉素耐药[10-11]。生脉注射液的含药血清能够下调P-gp的表达,逆转胃癌细胞SGC7901/VCR的化疗耐药[12]。临床研究也表明,生脉注射液能够逆转晚期结肠癌患者的多药耐药[13]。但生脉方类制剂在逆转结肠癌5-FU耐药中的作用和机制并不明确。
本研究选择生脉胶囊为研究对象,一方面通过网络药理学分析考察生脉胶囊在逆转结肠癌5-FU耐药中的可能作用及机制;另一方面,使用小鼠结肠癌细胞CT26的5-FU耐药株(CT26/FU)构建移植瘤模型,对生脉胶囊的作用和机制加以探讨。
1 材料和方法 1.1 动物和细胞无特定病原体(SPF)级6~8周龄雄性Balb/c小鼠18只,购自北京华阜康生物科技股份有限公司,动物生产许可证号SCXK(京)2019-0008,饲养于天津中医药大学实验动物中心,实验前适应性饲养3 d,饲养环境: 普通饲料,动物自由进食、饮水,温度22~26℃,湿度40%~70%,光照12 h。本研究经天津中医药大学动物伦理委员会审查批准,批准号: TCM-LAEC2022131。小鼠结肠癌细胞CT26购买自中国科学院生物化学与细胞生物学研究所。
1.2 试剂和仪器5-FU购买自上海生工生物工程股份有限公司,货号H202BA0024。生脉胶囊成份为红参、麦冬、五味子,购买自正大青春宝药业有限公司(国药准字Z33021036)。RPMI1640培养液(美国Sigma公司,#R8758);胎牛血清(乌拉圭Lonsera公司,#S711-001);CCK8试剂盒(苏州宇恒公司,#C6005);TRIzol试剂(北京康为世纪,#CW0580S);反转录试剂盒HiFiScript cDNA synthesis kit(康为世纪,#CW2569M);实时定量PCR试剂盒FastSYBR Mixture(康为世纪,#CW0955);TYMS、DPYD、TOP2A、NNMT和NR3C1的扩增引物以及内参基因β-肌动蛋白(β-actin,ACTB)的引物均购自上海生工公司,序列见表 1。所用主要仪器有酶标仪(ThermoFisher公司,型号Varioskan Flash)和定量PCR仪(BioRad公司,型号iQ5)。
获取生脉胶囊可能调节的与结直肠癌5-FU耐药有关的基因。使用中医药整合药理学研究平台(http://www.tcmip.cn/TCMIP/index.php/Home/)中的中药方剂数据库,搜索“生脉胶囊”,在Candidate Target Genes栏中获得生脉胶囊的靶基因集;使用Gene Cards数据库,以“colorectal carcinoma chemoresistance”为关键词获取结直肠癌化疗抵抗相关基因集,以“fluorouracil resistance”为关键词获取5-FU抗性相关基因集。对3个基因集取交集,找出共有基因,作为生脉胶囊调节的与结直肠癌5-FU耐药相关的靶基因。使用在线可视化分析平台(www.xiantaozi.com)对筛选出的靶基因进行GO和KEGG的富集分析,以Q-value<0.05作为具有统计学意义的标准,并根据Q-value值升序排序,选取排名靠前的通路绘制气泡图。
1.4 耐药细胞筛选CT26细胞培养在含有10%胎牛血清的RPMI1640培养液中。细胞传代后,在培养液中加入5-FU使其终浓度为5 μmol/L,处理24 h后更换正常培养液继续培养,待存活的细胞恢复生长并达到80%融合度时,再用含有5 μmol/L 5-FU的培养液处理细胞24 h,重复上述操作直到细胞在该浓度5-FU处理下没有显著死亡,再逐步提高5-FU处理的浓度(10,15和20 μmol/L),分别进行多轮筛选,得到具有5-FU耐药的细胞株CT26/FU。培养CT26细胞和CT26/FU细胞,分别给予不同浓度(0,6.25,12.5,25和50 μmol/L的5-FU处理24 h),通过CCK8实验检测CT26和CT26/FU在不同浓度5-FU处理下的存活率以及根据5-FU处理24 h后细胞的存活情况计算半数抑制浓度(IC50)。
1.5 移植瘤模型的构建与给药处理在18只小鼠的右侧腋下,皮下注射1×106个CT26/FU细胞,观察成瘤情况,8 d后能够触及皮下移植瘤的形成,将荷瘤小鼠分为3组开始给药处理: 模型组(Model组),6只,正常喂养;5-FU处理组(FU组),5只,每只小鼠按照25 mg/kg体质量腹腔注射5-FU溶液,连续注射3 d+中断2 d为1个给药周期,共执行2个给药周期;生脉胶囊组(FU+SM组),7只,该组在FU组处理方式的基础上每天灌胃生脉胶囊(350 mg/kg体质量),连续10 d。
1.6 肿瘤生长曲线的绘制与肿瘤称质量从给药第1天起,使用游标卡尺测量肿瘤的长径和短径,利用公式V=1/2×长径×短径2,计算移植瘤的体积,并绘制移植瘤生长曲线;实验结束后处死小鼠,分离移植瘤,称质量并拍照留存。
1.7 检测移植瘤中5-FU耐药相关基因的表达使用TRIzol法提取各组移植瘤中的总RNA,按照说明书的要求使用反转录试剂盒HiFiScript cDNA synthesis kit对所得RNA进行反转录,而后使用实时定量PCR试剂盒Fast SYBR Mixture对所得cDNA进行扩增,以ACTB作为内参,使用比较CT法检测基因的相对表达。
1.8 统计学分析使用SPSS 23.0软件统计数据,使用GraphPad Prism 8.0软件作图。计量资料采用均数±标准差(x±s)表示。多组间采用单因素方差分析进行比较,组间多重比较采用LSD法,两组间比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果 2.1 筛选生脉胶囊逆转结直肠癌细胞5-FU耐药可能调节的靶基因在中医药整合药理学研究平台获取生脉胶囊调节的靶基因872个,从Gene Cards上获得CRC化疗抵抗相关基因968个,获得5-FU抗性相关基因228个。有38个基因为3个基因集所共有,其中包括TOP2A、TYMS和DPYD等已报道与5-FU耐药有关的基因(图 1A)[14-16]。
|
| 图 1 生脉胶囊靶基因的筛选(A)的GO(B)和KEGG(C)富集分析 Fig. 1 Screening(A) and GO(B) and KEGG(C) enrichment analysis of target genes of Shengmai capsule |
使用在线分析工具仙桃学术平台对筛选出的38个靶基因进行GO和KEGG富集分析。
GO分析中,按照Q-value从小到大排序,富集在生物过程(BP)部分的前5个条目依次是: 类固醇激素应答(response to steroid hormone),化学压力细胞应答(cellular response to chemical stress),腺体发育(gland development),皮质类固醇应答(response to corticosteroid),外源性刺激应答(response to xenobiotic stimulus)。
富集在细胞组分(CC)部分的前5个条目是: 小窝(caveola),磷脂酰肌醇-3-激酶复合物(phosphatidylinositol 3-kinase complex),神经元胞体(neuronal cell body),膜筏(membrane raft),膜微结构域(membrane microdomain)。
富集在分子功能(MF)部分的前5个条目是: 胰岛素受体底物结合(insulin receptor substrate binding),核受体活性(nuclear receptor activity),配体激活的转录因子活性(ligand-activated transcription factor activity),激素结合(hormone binding),转录辅激活子结合(transcription coactivator binding),见图 1B。
KEGG富集分析展示了排名前20的通路,发现与肿瘤耐药有关的通路如叶酸抗代谢物抵抗(antifolate resistance),Q-value从小到大排序,排名第1,表皮生长因子酪氨酸激酶抑制剂抵抗(EGFR tyrosine kinase inhibitor resistance)排名第9和铂类药物抵抗(platinum drug resistance)排名第12,图 1C。这些结果提示生脉胶囊可能具有逆转CRC化疗耐药的作用。
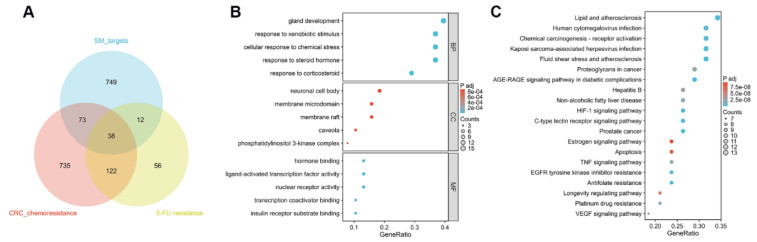
2.3 筛选5-FU耐药株CT26/FU并在移植瘤模型中评价生脉胶囊逆转CT26/FU耐药的作用使用5-FU长期处理体外培养的小鼠结肠癌细胞CT26,筛选得到具有5-FU耐药性的细胞株CT26/FU,为验证筛选的结果,通过CCK8实验检测不同浓度5-FU对CT26和CT26/FU的毒性作用(图 2A),并计算5-FU处理24 h对两种细胞的IC50值,结果表明5-FU对CT26的IC50为(19.44±2.70)μmol/L,显著低于对CT26/FU的IC50值(67.10±7.22)μmol/L,提示CT26/FU细胞株构建成功(图 2B)。
|
| 注:A,细胞生存率,****P<0.000 1;B,IC50计算,***P<0.001;C,移植瘤生长曲线,与Model组比较,*P<0.05;与FU组比较,#P<0.05。 图 2 CT26/FU细胞株的鉴定及移植瘤的生长曲线 Fig. 2 Identification of CT26/FU cells and growth curve of xenografts |
将CT26/FU细胞种植在小鼠皮下,待成瘤后,将带有移植瘤的小鼠分为模型组、FU组和FU+SM组。模型组正常饲养,FU组给予5-FU处理,FU+SM组给予5-FU联合生脉胶囊处理,从给药开始测量各组小鼠移植瘤体积,给药8 d时,FU组与模型组比,肿瘤体积没有明显改变,而FU+SM组与模型组比,肿瘤体积明显减小;给药10 d时,FU组和模型组相比,肿瘤体积依然没有明显的变化,但FU+SM组与模型组相比以及与FU组相比,都明显减小(图 2C)。
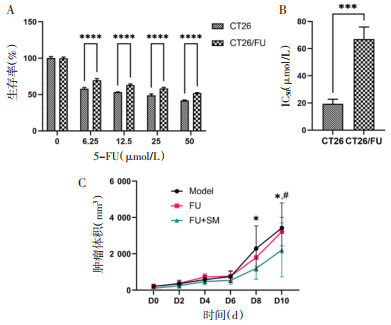
给药结束后,处死小鼠,分离各组移植瘤,发现与模型组相比,FU+SM组移植瘤的质量明显降低(图 3)。这些结果表明,生脉胶囊能够逆转CT26/FU对5-FU的耐药性。
|
| 注:与Model组比较,*P<0.05。 图 3 肿瘤的大小与质量 Fig. 3 Volume and weight of xenografts |
在CT26/FU构建的小鼠移植瘤模型中通过Real time RT-PCR比较了模型组、FU组和FU+SM组移植瘤中耐药相关基因TYMS、DYPD、TOP2A、NNMT和NR3C1的表达,发现与FU组相比,FU+SM组TOP2A的表达降低(图 4)。表明生脉胶囊逆转CT26/FU细胞化疗耐药的机制可能跟下调TOP2A表达有关。
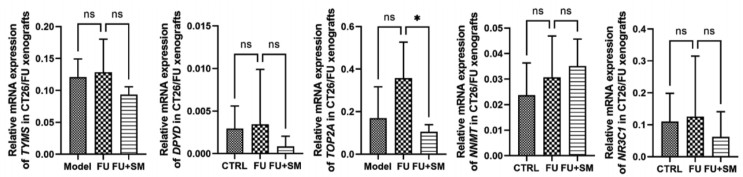
|
| 注:与FU组比较,*P<0.05。 图 4 化疗抗性相关基因的mRNA表达 Fig. 4 Relative mRNA expression of chemotherapy resistance related genes |
5-FU是临床治疗结直肠癌和乳腺癌等恶性肿瘤的常用化疗药物,一方面可以抑制TYMS的活性干扰胸苷酸的合成,影响DNA合成和修复,另一方面其代谢产物可以掺入到细胞RNA中,导致蛋白质合成的阻断[17]。然而,在5-FU作为单药或联合用药的治疗过程中,患者易产生对5-FU的耐药性而使得总体有效率较低[18]。因此,提高化疗敏感性,降低肿瘤耐药,是临床治疗的迫切需求。
TYMS蛋白是5-FU抑制的靶标,其表达水平与肿瘤5-FU耐药密切相关,高表达TYMS的患者其生存率和对氟尿嘧啶类药物的化疗有效率均低于低表达TYMS的患者,此外,该基因的多态性也能影响5-FU治疗的预后[14]。DPYD是嘧啶分解的限速酶,体内超过80%的5-FU经DPYD代谢而失活,临床研究表明,在100例接受FOLFOX6方案化疗的结直肠癌患者中,TYMS和DPYD在病理标本中检测为阴性的患者治疗的总体有效率(完全缓解+部分缓解)显著高于检测为阳性的患者,提示TYMS和DPYD的高表达可以使得肿瘤获得对5-FU的耐药性[15]。TOP2A基因编码DNA拓扑异构酶,在DNA的复制和转录中起到重要作用,之前的研究比较了野生型结肠癌细胞和5-FU耐药的结肠癌细胞的基因表达,发现TOP2A在5-FU耐药的细胞中表达增加,使用小干扰RNA(siRNA)敲低TOP2A的表达能够增强5-FU对耐药结肠癌细胞的毒性作用[16]。此外,Zhu等[19]也报道了上调TOP2A蛋白的磷酸化可以维持结直肠癌细胞的干性,促进癌细胞对奥沙利铂的抵抗[19]。近期文献表明,NNMT可以通过重塑细胞代谢和增强炎性反应介导癌细胞的化疗抵抗,且姜黄素能够在结直肠癌细胞中通过上调活性氧(ROS)水平以及诱导细胞周期阻滞逆转NNMT介导的5-FU抗性[20-21]。此外,NR3C1的表达降低与结肠癌预后不良相关,microRNA-19b能够通过下调NR3C1的表达增强结肠癌细胞对奥沙利铂的抗性[22]。比较模型组、FU组和FU+SM组小鼠CT26/FU移植瘤中上述基因的表达差异,发现TOP2A可能是生脉胶囊逆转CT26/FU细胞耐药的关键靶标。
尽管文献报道了生脉方类制剂对一些肿瘤细胞化疗耐药的逆转作用,但大多数实验使用生脉方类制剂的注射剂型和体外培养的细胞系作为研究模型,体内研究和临床研究尚有所欠缺。本研究使用了口服生脉方类制剂—生脉胶囊,从网络药理学分析和动物移植瘤实验两个层面证明生脉胶囊逆转小鼠结直肠癌细胞5-FU耐药的作用,对于生脉方类制剂药理作用的研究具有一定的参考价值。但同时也存在着不足,一方面,本研究使用的CT26/FU移植瘤模型不能模拟临床上患者的真实情况,还需要大量的临床样本和数据证实生脉胶囊的确切作用,另一方面,本研究通过网络药理学分析获得了与化疗抵抗相关的生脉胶囊的靶基因,并结合文献报道,检测了其中TYMS、DPYD、TOP2A、NNMT和NR3C1的表达,但这并不能很全面地揭示生脉胶囊调节的分子机制,还需要高通量的多组学检测进行深入研究。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
王露尧, 张鹭鹭. 中国结直肠癌发病和死亡情况及防控策略[J]. 解放军医院管理杂志, 2021, 28(12): 1195-1197. |
| [3] |
YANG C, SONG J, HWANG S, et al. Apigenin enhances apoptosis induction by 5-fluorouracil through regulation of thymidylate synthase in colorectal cancer cells[J]. Redox Biology, 2021, 47: 102144. DOI:10.1016/j.redox.2021.102144 |
| [4] |
ALZAHRANI S M, AL DOGHAITHER H A, AL-GHAFARI A B, et al. 5-Fluorouracil and capecitabine therapies for the treatment of colorectal cancer[J]. Oncology Reports, 2023, 50(4): 175. DOI:10.3892/or.2023.8612 |
| [5] |
熊刚, 邹华, 胡承莲, 等. 绿原酸通过影响自噬及耐药蛋白表达逆转5-氟尿嘧啶结肠癌细胞的耐药性[J]. 天津中医药, 2020, 37(11): 1304-1308. DOI:10.11656/j.issn.1672-1519.2020.11.22 |
| [6] |
崔勇和, 沈先敏. 白藜芦醇通过PI3K/Akt信号通路协同5-氟尿嘧啶对结肠癌细胞的抑制作用[J]. 天津中医药, 2021, 38(10): 1345-1349. DOI:10.11656/j.issn.1672-1519.2021.10.24 |
| [7] |
鞠爱春, 崔子悦, 王蕴华, 等. 生脉方类注射剂抗肿瘤药理及临床研究进展[J]. 药物评价研究, 2021, 44(11): 2289-2299. |
| [8] |
张磊, 常青, 李艳, 等. 参麦注射液对肺腺癌耐药细胞株的逆转作用[J]. 基因组学与应用生物学, 2016, 35(12): 3268-3272. |
| [9] |
CHEN Y S, SUN Y, ZHAO Q Y, et al. Shenmai injection enhances cisplatin-induced apoptosis through regulation of Mfn2-dependent mitochondrial dynamics in lung adenocarcinoma A549/DDP cells[J]. Cancer Drug Resistance, 2021, 4(4): 1047-1060. |
| [10] |
石宇雄, 黄永明, 许少健, 等. 参麦注射液对人成骨肉瘤多药耐药细胞株R-OS-732逆转作用[J]. 广东医学, 2006, 27(8): 1200-1201. DOI:10.3969/j.issn.1001-9448.2006.08.044 |
| [11] |
YANG L, ZHANG C D, CHEN J T, et al. Shenmai injection suppresses multidrug resistance in MCF-7/ADR cells through the MAPK/NF-κB signalling pathway[J]. Pharmaceutical Biology, 2020, 58(1): 276-285. DOI:10.1080/13880209.2020.1742167 |
| [12] |
刘丽坤, 宋微, 郝淑兰, 等. 生脉注射液含药鼠血清对人胃癌细胞多药耐药性的逆转作用及可能机制[J]. 中华中医药杂志, 2018, 33(9): 4204-4208. |
| [13] |
陈新超. 生脉注射液结合姑息化疗治疗耐药性晚期结肠癌临床分析[J]. 中国现代药物应用, 2020, 14(10): 93-95. |
| [14] |
李雪花, 刘铎, 董梅. TYMS基因多态性与氟尿嘧啶类药物临床应用的研究进展[J]. 实用肿瘤杂志, 2020, 35(4): 377-381. |
| [15] |
聂启鸿, 彭卫卫, 王于理, 等. DPD、TS基因多态性与晚期结直肠癌氟尿嘧啶敏感性关系的研究[J]. 医学理论与实践, 2021, 34(19): 3441-3443. |
| [16] |
FANG Y, YANG C, ZHANG L, et al. Spica prunellae extract enhances fluorouracil sensitivity of 5-fluorouracil-resistant human colon carcinoma HCT-8/5-FU cells via TOP2α and miR-494[J]. BioMed Research International, 2019, 2019: 5953619. |
| [17] |
LONGLEY D B, HARKIN D P, JOHNSTON P G. 5-fluorouracil: Mechanisms of action and clinical strategies[J]. Nature Reviews Cancer, 2003, 3(5): 330-338. DOI:10.1038/nrc1074 |
| [18] |
丁欣, 陈国江. 5-氟尿嘧啶化疗耐药的研究进展[J]. 国际药学研究杂志, 2017, 44(6): 491-494. |
| [19] |
ZHU C C, ZHANG L, ZHAO S L, et al. UPF1 promotes chemoresistance to oxaliplatin through regulation of TOP2A activity and maintenance of stemness in colorectal cancer[J]. Cell Death&Disease, 2021, 12(6): 519. |
| [20] |
YANG C M, WANG T X, ZHU S B, et al. Nicotinamide N-methyltransferase remodeled cell metabolism and aggravated proinflammatory responses by activating STAT3/IL1β/PGE2 pathway[J]. ACS Omega, 2022, 7(42): 37509-37519. DOI:10.1021/acsomega.2c04286 |
| [21] |
LI G L, FANG S N, SHAO X, et al. Curcumin reverses NNMT-induced 5-fluorouracil resistance via increasing ROS and cell cycle arrest in colorectal cancer cells[J]. Biomolecules, 2021, 11(9): 1295. DOI:10.3390/biom11091295 |
| [22] |
HAN Z B, ZHANG C, WANG Q F, et al. MicroRNA-19b downregulates NR3C1 and enhances oxaliplatin chemoresistance in colon cancer via the PI3K/AKT/mTOR pathway[J]. Clinical Medicine Insights Oncology, 2021, 15: 11795549211012666. |
2. School of Integrative Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. School of Medical Technology, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2024, Vol. 41
2024, Vol. 41