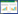文章信息
- 史俊祖, 王雪峰, 崔振泽, 等.
- SHI Junzu, WANG Xuefeng, CUI Zhenze, et al.
- 基于网络药理学的小儿定喘颗粒抗呼吸道合胞病毒肺炎的作用机制研究
- Study on the mechanism of Xiaoer Dingchuan Cranules against respiratory syncytial virus pneumonia based on network pharmacology
- 天津中医药, 2024, 41(7): 904-913
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 904-913
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.18
-
文章历史
- 收稿日期: 2024-01-30
2. 辽宁中医药大学附属医院, 沈阳 110032;
3. 大连医科大学附属大连市儿童医院, 大连 116012
社区获得性肺炎(CAP)是5岁以下儿童住院的主要原因。呼吸道合胞病毒(RSV)是导致婴幼儿急性和严重下呼吸道疾病最常见的病毒病原体,其感染具有明显的季节性,在发展中国家的病死率较高[1]。抗病毒药物利巴韦林及免疫预防药物帕利珠单抗是已获批用于治疗RSV感染所致呼吸道系统疾病的有效药物,然而其疗效、不良反应及价格较高等因素限制了其在临床中的应用[2-3]。因此,找到安全有效的替代疗法至关重要。
中医以治本为主,强调调畅患者整体的生理功能,且毒副作用较小,在临床中被广泛应用。小儿定喘颗粒源于明代医家张时彻所著《摄生众妙方》中的定喘汤,由麻黄、苦杏仁、紫苏子、葶苈子、炙甘草、茯苓、黄芩、浙贝母、桑白皮和牡丹皮10味中药组成,为经过规范化制备工艺而制作成的颗粒剂,具有润肺化痰、止咳平喘等功效。研究发现,小儿定喘颗粒可有效改善儿童病毒性肺炎的临床症状,原方定喘汤可以显著改善RSV感染大鼠肺部组织的病理变化、降低病毒载量,调节细胞免疫功能,在治疗RSV感染方面安全有效[4-6]。然而,其演变方小儿定喘颗粒发挥治疗作用的药效机制目前尚不清楚。
网络药理学是基于系统生物学和计算机技术的广泛学科,可以从系统水平探究药物的作用机制,有助于揭示“药物-基因-靶点-疾病”的相互作用关系,符合中药复方治疗疾病的多成分、多靶点、多通路的特点[7]。为较全面了解小儿定喘颗粒治疗RSV的作用机制,本研究通过采用病毒滴度TCID50检测法、细胞毒性检测法、抗病毒效果测定法验证了小儿定喘颗粒体外抗呼吸道合胞病毒的药理作用,并运用网络药理学及分子对接技术探求了小儿定喘颗粒有效成分抗RSV的作用靶点,为揭示其药效作用机制和拓宽其临床应用奠定理论基础。
1 实验方法 1.1 体外细胞实验 1.1.1 试剂、药物与仪器不完全RPMI-1640细胞培养液(批号:FG211014E)购于亿奥邦(北京)生物科技研究有限公司;特级胎牛血清(批号:2375386CP)购于美国GIBCO公司;无菌PBS(批号:21040071)购于美国CORNING公司;增强型CCK-8(批号:MA0218)购于美仑云细胞生物科技有限公司;TNF-α、IL-6、IL-1β ELISA试剂盒(批号:202304)购于上海源桔生物科技中心;小儿定喘颗粒(江阴天江药业有限公司,批号:2203319);Infinite F50酶标仪购于帝肯奥地利有限责任公司;Sorwall ST16R离心机购于赛默飞世尔科技(中国)有限公司。
1.1.2 病毒滴度测定接种病毒前将生长状态良好的A549细胞以每孔1×105个的密度接种于96孔板中,放入37 ℃、5% CO2培养箱中培养过夜,待细胞贴壁后,弃去上清,用细胞维持培养基(含2% FBS的RPMI 1640)将病毒液以10倍比依次稀释(1×10-1~1×10-10),依次横向接种于96孔板中,每个浓度设置6个重复孔,在37 ℃、5% CO2条件下培养,每天观察细胞病变效应并记录,采用Reed-Muench法检测病毒半数组织培养感染剂量TCID50。
1.1.3 小儿定喘颗粒的配制使用含2% FBS的RPMI 1640培养液溶解小儿定喘颗粒至质量浓度160 mg/mL,经0.22 μmol/L滤膜过滤除菌作为储备液,正式实验前使用RPMI 1640培养液逐步稀释至所需浓度。
1.1.4 小儿定喘颗粒的药物毒性测定将小儿定喘颗粒储备液按2倍比稀释为80、40、20、10、5、2.5、1.25、0.625、0.3125 mg/mL 9个浓度,然后以每孔1×105个的密度将A549细胞接种于96孔细胞培养板中,每孔100 μL,每一浓度设置6个复孔,同时设立正常细胞对照组,将培养板放置于37 ℃、5%CO2培养箱中培养,观察48 h。弃去培养基,将CCK8按10%的浓度用培养基稀释,每孔加入100 μL,避光培养4 h,采用酶标仪(波长450 nm)测定各孔光吸收值OD450。
1.1.5 小儿定喘颗粒抗病毒效果测定将生长状态良好的A549细胞接种于96孔板中,在37 ℃、5 % CO2条件下培养至贴壁,弃去上清液,从TC0开始依次加入2倍比系列稀释的小儿定喘颗粒与等体积100 TCID50病毒液的混合液100 μL,每个稀释度设置6个复孔,并同时设置细胞对照组与病毒对照组,细胞对照组加入100 μL细胞维持液,病毒对照组加入50 μL病毒和50 μL维持液,将96孔板放置于37 ℃、5% CO2的培养箱中培养,每天观察细胞病变效应,待病毒对照组细胞病变效应达到75%以上时,用Reed-Muench法计算小儿定喘颗粒的半数有效浓度(EC50),得治疗指数(TI),TI=TC50/EC50。
1.2 网络药理学研究 1.2.1 小儿定喘颗粒相关靶点的筛选通过中药系统药理学数据库(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)寻找麻黄、苦杏仁、紫苏子、葶苈子、炙甘草、茯苓、黄芩、浙贝母、桑白皮和牡丹皮10味中药的化学成分,根据口服生物利用度(OB)≥ 30%以及类药性(DL)≥0.18两个药动学参数进行初步筛选,与此同时,本研究还结合了文献检索及整理,对TCMSP的筛选结果进行了补充,以获得小儿定喘颗粒的主要化学成分及其作用的蛋白靶点。筛选结束后,为标准化蛋白质靶点信息,统一在Uniprot蛋白质数据库(https://www.uniprot.org)将化学成分作用的蛋白靶点进行规范处理。
1.2.2 RSV相关靶点的筛选分别以“respiratory syncytial virus pneumonia”“RSV pneumonia”和“RSV-induced lung inflammation”为关键词,检索GeneCards数据库(https://www.genecards.org)、OMIM数据库(http://www.omim.org)中RSV的潜在靶点,合并两个疾病数据库靶点后,删除重复值得到RSV的相关靶点。
1.2.3 “中药-成分-疾病靶点”网络的构建为明确小儿定喘颗粒活性成分作用靶点与RSV靶点之间的相互作用,利用Venny 2.1.0绘图网站(https://bioinfogp.cnb.csic.es/tools/venny/index.html)将两者靶点取交集并绘制Venn图。进而将交集靶点基因导入CytoScape 3.9.0软件绘制“中药-成分-疾病靶点”网络图,并根据网络图各个节点的度值筛选小儿定喘颗粒治疗RSV的主要活性成分。
1.2.4 蛋白质-蛋白质相互作用(PPI)网络的构建及核心基因的筛选将上述交集靶点提交至STRING 11.5数据库(https://string-db.org) 构建PPI网络图,将生物种类设定为“Homo sapiens”,其余设置均为默认设置,得到PPI网络。将导出的数据通过Cytoscape 3.9.0软件的CytoNCA插件,根据中间中心性(BC)、紧密中心性(CC)、度中心性(DC)、特征向量中心性(EC)、局部平均连通性(LAC)和网络中心性(NC)6个参数值筛选核心靶点,核心靶点经两次筛选后获得(阈值≥各参数平均值),并对最终数据进行可视化处理。
1.2.5 基因本体论(GO)及京都基因与基因组百科全书(KEGG)通路富集分析将上述得到的交集靶点录入David平台(https://david.ncifcrf.gov),物种设置为“ Homo sapiens”,分析其主要的生物学过程与代谢通路并进行富集分析,选取P值小于0.01的前20条数据,利用微生信网站(https://www.bioinformatics.com.cn)对其进行可视化处理。
1.2.6 小儿定喘颗粒“关键活性成分-核心靶点-信号通路”网络构建利用Excel软件整理汇总小儿定喘颗粒治疗RSV肺炎核心靶点所对应的主要活性成分及核心靶点对应的KEGG信号通路的预测结果,将结果导入CytoScape 3.9.0软件进行可视化分析。
1.3 分子对接实验以1.3项下获得的活性成分为配体,1.4项下获得的核心作用靶点为受体进行分子对接,以进一步验证上述的筛选结果。利用PDB数据库(https://www1.rcsb.org/)寻找并下载靶蛋白的分子结构文件。使用PyMOL 2.3.0软件对下载的靶点蛋白进行删除水分子和删除原配体等操作。使用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载活性成分的2D结构,使用Chem3D 2020软件对活性成分分子结构进行分子力场优化。采用Auto Dock Vina1.2.0软件分别对受体和配体进行对接,以最低结合能作为评判分子对接结果的标准。两者结合能越低,表明结合力越强,最后使用PyMOL 2.3.0软件进行部分对接结果可视化展示。
1.4 核心靶点验证实验将处于生长对数期的A549细胞按2×105的密度接种于6孔板中,在37 ℃、5% CO2培养箱中培养12 h,弃去上清液,将2.5 mg/mL的小儿定喘颗粒与等体积100 TCID50病毒液的混合液2 mL接种于板中,并同时设置细胞对照组与病毒对照组,细胞对照组加入2 mL细胞维持液,病毒对照组加入1 mL病毒和1 mL维持液,每组设置3个复孔。将6孔板放置于37 ℃、5% CO2的培养箱中继续培养,待病毒对照组细胞病变效应达到75% 以上时,收集各组细胞上清液,3 000 r/min离心15 min(离心半径6.75 cm),取上清液,参照TNF-α、IL-6、IL-1β ELISA试剂盒说明书,检测各组细胞上清液中TNF-α、IL-6、IL-1β水平。
1.5 统计学方法采用SPSS 26.0统计软件对实验数据进行处理,实验指标用均数±标准差(x±s)表示,数据服从正态分布且满足方差齐性,采用单因素方差分析和LSD方法进行多组间比较分析,以P<0.05表示差异有统计学意义。
2 实验结果 2.1 体外细胞实验结果 2.1.1 病毒TCID50检测经计算RSV的TCID50为1×10-3.67/0.1 mL。
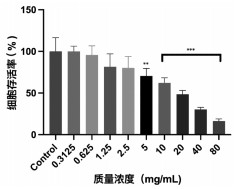
2.1.2 小儿定喘颗粒对A549细胞的毒性实验随着小儿定喘颗粒质量浓度的降低,细胞破碎、坏死等细胞病变效应特征逐步减弱。结果观察到当小儿定喘颗粒质量浓度≥20 mg/mL时,细胞存活率低于50 %;当小儿定喘颗粒质量浓度≤2.5 mg/mL时,细胞病变较少,与对照组无显著性差异,见图 1。经计算小儿定喘颗粒的TC50值为18.55 mg/ mL。
|
| 注:与对照组比较,**P<0.01,***P<0.001。 图 1 小儿定喘颗粒对A549细胞的毒性作用(n=6) Fig. 1 Toxic effect of Xiaoer Dingchuan Granules on A549 cells(n=6) |
接毒后每日观察细胞状态,观察到病毒感染12 h后病毒组与药物组细胞均开始出现病变,并且随着质量浓度的降低,药物保护作用减弱,细胞变圆、破碎、脱落等细胞病变表现明显。当病毒对照组观察到出现75%病变时,观察到药物组几个浓度梯度孔的细胞被保护,细胞状态良好,见图 2,经计算小儿定喘颗粒的EC50=0.706 2 mg/mL,TI=26.27。

|
| 图 2 小儿定喘颗粒抑制RSV A549细胞病变(×100) Fig. 2 Inhibition of RSV A549 cytopathy by Xiaoer Dingchuan Granules(×100) |
利用TCMSP数据库以OB≥30%和DL≥0.18为筛选条件,分别检索麻黄、苦杏仁、紫苏子、葶苈子、炙甘草、茯苓、黄芩、浙贝母、桑白皮和牡丹皮10味中药,并结合文献查阅结果,补充纳入有较好治疗RSV病理的活性成分麻黄碱、伪麻黄碱、苦杏仁苷[8-10]。删除无法检索出与之相对应靶点的化学成分后,得到小儿定喘颗粒化学成分194个,靶点2 981个,删除靶点重复项,利用Uniprot数据库将靶点转化成相对应基因名,并进行规范化处理,得到靶点基因282个。
2.2.2 RSV的靶点分别以“respiratory syncytial virus pneumonia” “RSV pneumonia”和“RSV-induced lung inflammation”为关键词,收集RSV相关靶点,其中在GeneCards数据库收集到靶点974个,OMIM数据库403个,删除重复基因,得到1 337个RSV疾病基因。
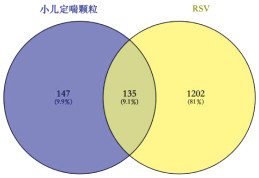
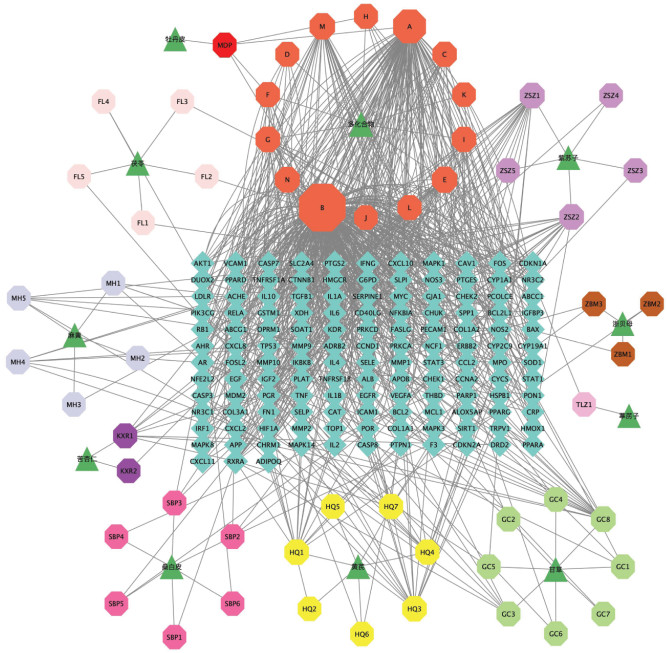
2.2.3 “中药-成分-疾病靶点”网络的构建利用Venny 2.1.0网站将小儿定喘颗粒化学成分靶点与疾病靶点取交集,得到交集靶点135个,并绘制Venn图,见图 3。为更加清晰阐明化学成分与靶点之间的关系,以中药名称拼音首字母对中药进行简化后对各类中药进行编码,如麻黄(MH),以英文字母A、B、C、D、E、F、G等对小儿定喘颗粒中交集靶点对应的14种化学成分进行编码,如kaempferol编码为A,小儿定喘颗粒的化学成分见OSID开放科学标识码。利用CytoScape 3.9.0软件对135个交集靶点进行“中药化学成分-疾病靶点”网络图的绘制,使用CytoScape 3.9.0软件中Network Analysis功能计算分析得到203个节点,802条边,见图 4。使用CytoNCA软件进行拓扑分析,其中Degree值较大的活性成分为槲皮素、山柰酚、异鼠李素等,这些关键成分主要来源于麻黄、苦杏仁、葶苈子、甘草、桑白皮、牡丹皮等中药,见表 1。
|
| 图 3 小儿定喘颗粒与RSV交集靶点Venn图 Fig. 3 Venn plot of the intersection target of Xiaoer Dingchuan Granules and RSV |
|
| 注:正八边形表示小儿定喘颗粒中筛选的化学成分;菱形表示小儿定喘颗粒治疗RSV的作用靶点;三角形表示小儿定喘颗粒中的10味中药;节点越大代表其在网络中越重要。 图 4 “中药-成分-疾病靶点”网络图 Fig. 4 Network diagram of"traditional Chinese medicine-ingredient-disease target" |
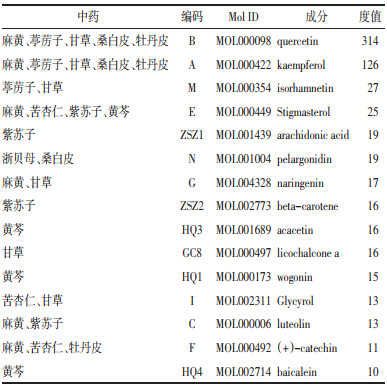
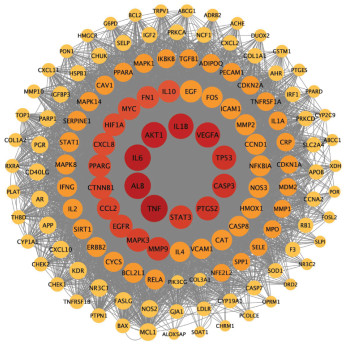
将135个交集靶点导入String数据库,获得PPI网络数据,见图 5。将数据导入Cytoscape 3.9.0软件中的CytoCNA插件进行拓扑分析,得到135个节点,6 584条边。再以阈值BC>89.33、CC>0.61、DC>97.54、EC>0.08、LAC>64.41、NC>81.54为条件进行筛选,得到37个节点,1 260条边,获得37个基因,进一步以阈值BC>252.35、CC>0.73、DC>169.57、EC>0.12、LAC>96.22、NC>145.89为条件进行二次筛选,得到10个节点,90条边,获得10个基因,见图 6。笔者推测这10个基因为小儿定喘颗粒治疗RSV的核心靶点,分别为肿瘤坏死因子(TNF)、白蛋白(ALB)、白细胞介素-6(IL-6)、RAC-α-丝氨酸/苏氨酸蛋白激酶(AKT1)、白细胞介素-1β(IL-1β)、前列腺素G/H合酶2(PTGS2)、血管内皮生长因子A(VEGFA)、肿瘤蛋白P53(TP53)、表皮生长因子受体(EGFR)、半胱氨酸天冬氨酸蛋白酶-3(CASP3),见表 2。
|
| 注:圆形代表小儿定喘颗粒治疗RSV的靶点;颜色越深代表其在网络中越重要。 图 5 PPI网络 Fig. 5 PPI Network |

|
| 图 6 核心靶点的筛选 Fig. 6 Screening of core targets |
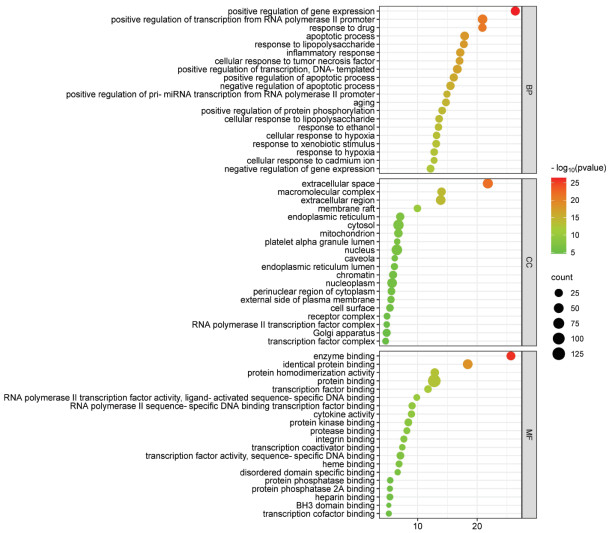
将得到的135个交集靶点导入David数据库进行GO分析,包括生物过程(BP)分析、分子功能(MF)分析和细胞成分(CC)分析。选取P值小于0.01的前20条数据,利用微生信网站绘制气泡图。GO-BP分析可得到822个条目,发现小儿定喘颗粒治疗RSV主要富集在基因表达的正调控、RNA聚合酶Ⅱ启动子转录的正调控、对药物的反应、细胞凋亡的正向调控等BP。GO-MF分析得到138个条目,发现其主要富集在酶的结合、相同的蛋白质结合、蛋白质的同源二聚作用和蛋白质结合等MF。GO-CC分析得到89个条目,发现其主要富集在细胞外隙、细胞外区、膜筏、内质网、细胞质等CC,见图 7。GO功能分析结果表明小儿定喘颗粒可能通过影响DNA复制、转录,细胞凋亡等BP,通过与酶、转录因子等靶点蛋白的结合影响靶点蛋白的MF,通过干预细胞外间隙、细胞质等CC的合成,发挥治疗RSV的作用。
|
| 图 7 GO功能富集分析气泡图(BP、CC、MF) Fig. 7 GO functional enrichment analysis bubble diagram(BP, CC, MF) |
使用David数据库对135个交集靶点进行KEGG通路富集分析,得到159个富集通路条目。选取P值小于0.01的前20条数据,结果显示,基因主要富集于脂质和动脉粥样硬化(lipid and atherosclerosis)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、Toll样受体信号通路(Toll-like receptor signaling pathway)、乙型肝炎(hepatitis B)、甲型流感(influenza A)、人类巨细胞病毒感染(human cytomegalovirus infection)等通路,KEGG通路富集分析气泡图见OSID开放科学标识码。
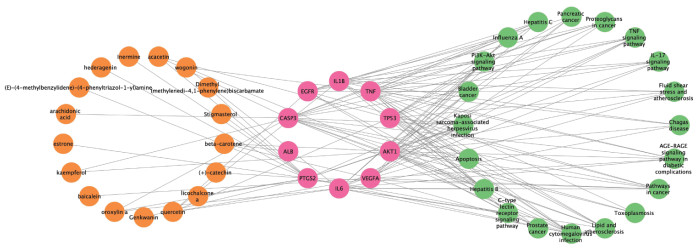
2.2.7 小儿定喘颗粒“关键活性成分-核心靶点-信号通路”网络构建根据上述筛选的10个核心靶点对应出小儿定喘颗粒具体治疗RSV肺炎的关键活性成分,将结果导入CytoScape 3.9.0软件得到“关键活性成分-核心靶点-信号通路”网络,见图 8。运用“Network Analyze”进行拓扑分析,得到47个节点,133个边的网络。分析网络发现其存在一个活性成分与多个核心靶点相互作用、多个活性成分作用于一个靶点及一个靶点对应多条信号通路的现象。说明小儿定喘颗粒治疗RSV肺炎具有多成分、多靶点、多途径的特点。
|
| 注:橙色代表小儿定喘颗粒中的主要活性成分;粉色代表小儿定喘颗粒作用于RSV的核心靶点;绿色代表核心靶点富集到的信号通路。 图 8 “关键活性成分-核心靶点-信号通路”网络 Fig. 8 "Key active ingredient-core target-signaling pathway" network |
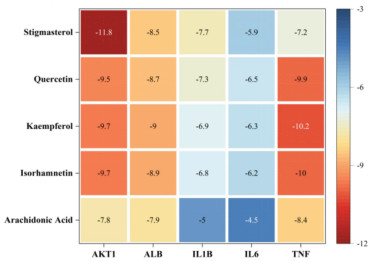
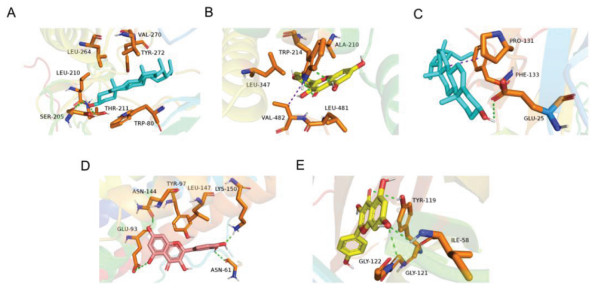
根据2.3项下的结果,分别选取排名前5的活性成分与核心靶点进行分子对接实验,结果表明小儿定喘颗粒中的核心成分槲皮素、山柰酚、异鼠李素、豆甾醇、花生四烯酸与关键靶蛋白TNF、ALB、IL6、AKT1、IL-1β均可以相互结合,结合能热图见图 9。其中豆甾醇与AKT1,山奈酚与ALB,豆甾醇与IL-1β,槲皮素与IL-6,山柰酚与TNF的结合能最低,分别为-11.8、-9、-7.7、-6.5、-10.2 kcal/mol,表明两者之间结合最为紧密。分子对接可视化结果见图 10。
|
| 图 9 结合能的热图分析 Fig. 9 Heat map analysis of binding energy |
|
| 注:A,AKT1与豆甾醇;B,ALB与山柰酚;C,IL-1β与豆甾醇;D,IL-6与槲皮素;E,TNF与山柰酚。 图 10 小儿定喘颗粒活性分子与关键靶点分子对接可视化 Fig. 10 Visualization of the docking of active molecules of Xiaoer Dingchuan Granules with key target molecules |
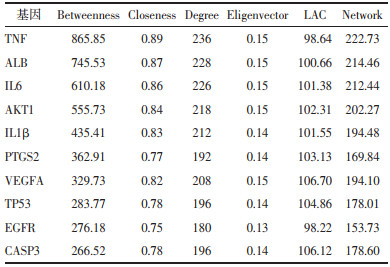
研究发现与空白组相比,模型组中的TNF-α、IL-6、IL-1β含量显著升高(P<0.05),给予小儿定喘颗粒治疗后,TNF-α、IL-6、IL-1β含量较模型组相比显著下降(P<0.05),结果见表 3。
目前,能够有效治疗小儿RSV感染的药物较少,给医生和患者带来了诸多不便[11]。近年来,许多单味中药及中药复方已被证实具有抗炎、抗病毒等药理作用。小儿定喘颗粒是在中医药基础理论的指导下,结合患儿的临床特点,由经典名方《定喘汤》衍化而成,具有较好的临床疗效。本研究首先通过体外细胞实验对小儿定喘颗粒抗RSV的效果进行考察,并基于网络药理学、分子对接及酶联免疫吸附技术探究了小儿定喘颗粒中活性成分与RSV靶点之间的相互作用关系,以期揭示小儿定喘颗粒的药物作用机制。
本研究在A549细胞上对小儿定喘颗粒抑制RSV的作用强度进行探究,旨在考察小儿定喘颗粒对RSV病毒的抑制作用,以评价其药效。实验结果显示小儿定喘颗粒在一定程度上能够保护细胞不受RSV病毒侵害,具有一定的抗病毒作用,为后续网络药理学机制研究打下坚实基础。
通过分析“中药-成分-疾病靶点”网络图发现小儿定喘颗粒治疗RSV的主要活性成分大多为黄酮类、甾醇类等化合物。研究发现,槲皮素可以显著抑制RSV感染引起的支气管上皮细胞凋亡、改善病毒性呼吸道感染小鼠的免疫功能,抑制炎症反应[12-13]。山柰酚具有抗炎、抗菌、抗病毒的药理作用,可以保护脂多糖诱导的急性肺损伤[14]。异鼠李素也具有抗炎、抗病毒的作用,可以有效减轻肺部炎症反应[15-16]。利用CY to CNA插件筛选小儿定喘颗粒治疗RSV的核心靶点,排名前10的分别为TNF、ALB、IL-6、AKT1、IL-1β、PTGS2、VEGFA、TP53、EGFR和CASP3,其多为炎症、免疫调节相关的靶点基因。炎症反应是RSV形成的病理机制,白蛋白含量及炎性因子水平通常作为评估肺损伤的指标[17-18]。通常情况下,肺泡灌洗液中白蛋白水平明显低于血液中,当病毒感染致肺损伤后,血管通透性增加可能会提高肺泡灌洗液中的白蛋白水平[19]。肿瘤坏死因子TNF,可分为TNF-α和TNF-β 2种亚型,研究表明TNF具有激活成纤维细胞,促进炎症反应的作用[20]。IL-6、IL-1β具有诱导免疫细胞分化,调节机体免疫反应的作用[21]。临床发现,RSV患儿的血液中TNF、IL-6及IL-1β的水平均显著升高。并且RSV感染后可能破坏了气道上皮细胞的紧密连接性,影响了气道的屏蔽功能,故可观察到血管内皮生长因子VEGFA、表皮生长因子受体EGFR表达升高的现象[22-23]。
对筛选出来的135个交集靶点进行GO、KEGG通路富集分析,发现小儿定喘颗粒可以调节免疫通路和病毒防御的进程。GO (BP) 项表明小儿定喘颗粒可以抑制RSV肺炎治疗过程中的病原微生物刺激和氧化应激过程。KEGG通路富集结果显示潜在通路主要与炎症、免疫相关,大多数靶基因富集在病毒相关信号通路、TNF信号通路、IL-17信号通路及磷脂酰肌醇3激酶(PI3K)-蛋白激酶B(Akt)信号通路中。几项研究表明,TNF信号通路、IL-17信号通路及PI3K-Akt信号通路与RSV感染密切相关。TNF信号通路可以通过激活Caspase蛋白酶、JNK信号通路以及NF-κB信号通路,从而发挥抗病毒、免疫调节、细胞凋亡等生物学功能[24-25]。实验证据表明,TNF受体阻断剂可以降低与RSV感染密切相关的细胞因子和趋化因子的表达。IL-17可以募集中性粒细胞,促进T细胞活化及刺激上皮细胞、内皮细胞等释放炎症因子,从而介导组织炎症反应,促进新血管生成[26]。感染RSV后IL-17水平升高可能与机体感染后黏液大量分泌,增加了气道高反应性有关[27]。PI3K-Akt通路在调节炎症反应中发挥着重要的作用。有研究表明,PI3K-AKt信号通路与抑制炎症反应、抗病毒等作用有关,与肺部炎症反应具有负向调控关系。机体感染RSV后,PI3K-Akt通路会被激活,活化的Akt通过促进NF-κB抑制蛋白的磷酸化,激活NF-κB信号通路,进而趋化大量炎性细胞聚集到炎症部位,诱导炎症反应[28-29]。
分子对接实验预测了5种活性成分与主要蛋白质靶标之间的相互作用,结合能量有助于进一步验证对接结果的可靠性。研究发现小儿定喘颗粒中核心成分与关键靶点的结合能均<-4.5 kcal/mol,结合能均较低,表明具有良好的结合性能。接着,本研究以A549细胞为模型,对核心靶点进行酶联免疫吸附实验以考察小儿定喘颗粒对上述靶点含量的影响,结果发现小儿定喘颗粒干预后可明显下调模型组中TNF-α、IL-6、IL-1β 3个核心靶点的含量,进一步验证了上述网络药理学及分子对接实验结果。同时,KEGG通路富集所得到的与RSV相关通路大多与以上基因有关,证明其可能在治疗RSV肺炎中发挥重要作用。
综上所述,本研究结果显示小儿定喘颗粒可以有效改善RSV感染的细胞状态,具有明显的抗RSV作用;网络药理学研究发现小儿定喘颗粒可能通过槲皮素、山柰酚、异鼠李素等主要活性成分,与TNF、ALB、IL-6、AKT1和IL-1β等靶蛋白结合,进而调节TNF等信号通路,通过抑制炎症反应和调节免疫机制来抑制RSV形成。分子对接及酶联免疫吸附实验验证了上述实验结果。研究结果进一步证明中药复方通过多成分、多靶点、多通路协调治疗疾病的特点,为小儿定喘颗粒临床用途提供基础,但确切的分子机制仍需要更深入的实验研究和验证。
| [1] |
房亚菲, 刘丽娟, 霍晨. 儿童社区获得性肺炎的流行特征和临床表现及病原菌调查[J]. 中华医院感染学杂志, 2020, 30(5): 752-756. |
| [2] |
赵瑞玲, 毛秀娣, 张丽锋. 利巴韦林在儿科临床应用的安全性评价[J]. 国际药学研究杂志, 2016, 43(4): 615-620. |
| [3] |
LI Y, WANG X, BLAU D M, et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019:a systematic analysis[J]. Lancet, 2022, 399(10340): 2047-2064. DOI:10.1016/S0140-6736(22)00478-0 |
| [4] |
高媛媛, 王雪峰, 张秀英, 等. 小儿定喘颗粒治疗儿童病毒性肺炎(痰热闭肺证)的临床研究[J]. 中国中西医结合儿科学, 2023, 15(4): 351-355. DOI:10.3969/j.issn.1674-3865.2023.04.017 |
| [5] |
冷玲, 崔振泽, 黄燕. 定喘汤对呼吸道合胞病毒感染大鼠细胞免疫的影响[J]. 中医杂志, 2018, 59(14): 1223-1227. |
| [6] |
崔振泽, 黄燕, 徐超, 等. 定喘汤对呼吸道合胞病毒感染大鼠细胞免疫调节作用的量效关系研究[J]. 中华中医药学刊, 2016, 34(9): 2067-2070. |
| [7] |
庄延双, 蔡宝昌, 张自力. 网络药理学在中药研究中的应用进展[J]. 南京中医药大学学报, 2021, 37(1): 156-160. |
| [8] |
姜丽, 高萌, 屈飞, 等. 基于HPLC-MS/MS研究麻杏石甘汤在正常及RSV肺炎感染模型大鼠体内的药动学[J]. 中国中药杂志, 2015, 40(13): 2649-2655. |
| [9] |
李会竹, 宋丹丹, 常辰琦, 等. 麻杏石甘汤胶体相态的拆分、表征及抗病毒研究[J]. 中国中药杂志, 2023, 48(16): 4394-4401. |
| [10] |
朱欣, 李闻文. 麻黄水提液抑制呼吸道合胞病毒作用实验研究[J]. 实用预防医学, 2012, 19(10): 1555-1557. DOI:10.3969/j.issn.1006-3110.2012.10.044 |
| [11] |
MAYOR A, CHESNAY A, DESOUBEAUX G, et al. Therapeutic antibodies for the treatment of respiratory tract infections-current overview and perspectives[J]. Vaccines, 2021, 9(2): 151. DOI:10.3390/vaccines9020151 |
| [12] |
许玲芬, 李英兰, 王佳斌, 等. 基于TLR4-NF-κB通路的槲皮素对病毒性呼吸道感染小鼠免疫功能的影响及抑炎作用研究[J]. 中药药理与临床, 2023, 9(6): 53-57. |
| [13] |
章秋霞, 陈炯科, 吴伶莉. 槲皮素通过上调miR-140-5p抑制呼吸道合胞病毒感染的支气管上皮细胞凋亡和炎症反应的实验研究[J]. 免疫学杂志, 2022, 38(10): 883-889. |
| [14] |
赵妍. 山奈酚对脂多糖诱导小鼠急性肺损伤的保护作用[D]. 哈尔滨: 东北农业大学, 2013.
|
| [15] |
滕丹, 栾新尧. 异鼠李素的药效学研究进展[J]. 中医药临床杂志, 2016, 28(4): 593-596. |
| [16] |
朱敏, 赵丽敏, 王培, 等. 异鼠李素抑制卵清蛋白诱导的哮喘小鼠肺部炎症[J]. 中国病理生理杂志, 2021, 37(1): 106-111. DOI:10.3969/j.issn.1000-4718.2021.01.016 |
| [17] |
尚莹, 可秋萍, 娄莹, 等. 呼吸道合胞病毒感染患儿临床及细胞因子特点[J]. 中华医院感染学杂志, 2020, 30(18): 2839-2842. |
| [18] |
陈娇, 柏振江, 谢敏慧, 等. 2007-2010年苏州儿童重症呼吸道合胞病毒肺炎临床特点分析[J]. 儿科药学杂志, 2013, 19(5): 14-17. DOI:10.3969/j.issn.1672-108X.2013.05.006 |
| [19] |
杨筱萌, 罗语思, 郭名扬, 等. 人呼吸道合胞病毒感染致小鼠急性肺损伤动物模型的建立[J]. 中国病原生物学杂志, 2022, 17(9): 993-998, 1004. |
| [20] |
POREDOŠ P, SPIRKOSKA A, JEŽOVNIK M K. In patients with superficial vein thrombosis the inflammatory response is increased and related to the recanalization rate[J]. Archives of Medical Science, 2019, 15(2): 393-401. DOI:10.5114/aoms.2019.83292 |
| [21] |
李俏琦, 杨茜, 高玲, 等. 细胞因子风暴与病毒性肺炎[J]. 中国呼吸与危重监护杂志, 2021, 20(1): 70-75. |
| [22] |
高元妹, 张平, 蔡绍曦. 呼吸道合胞病毒对人支气管上皮细胞通透性的影响[J]. 热带医学杂志, 2012, 12(1): 37-39, 44. |
| [23] |
刘娟娟, 张婷, 米芋枚. 呼吸道合胞病毒感染对气道上皮细胞表皮生长因子受体、紧密连接相关蛋白及黏蛋白表达的影响[J]. 中国当代儿科杂志, 2019, 21(3): 294-299. |
| [24] |
KIST M, K?M?VES L G, GONCHAROV T, et al. Impaired RIPK1 ubiquitination sensitizes mice to TNF toxicity and inflammatory cell death[J]. Cell Death and Differentiation, 2021, 28(3): 985-1000. DOI:10.1038/s41418-020-00629-3 |
| [25] |
VARFOLOMEEV E, GONCHAROV T, MAECKER H, et al. Cellular inhibitors of apoptosis are global regulators of NF-κB and MAPK activation by members of the TNF family of receptors[J]. Science Signaling, 2012, 5(216): ra22. |
| [26] |
DU J W, XU K Y, FANG L Y, et al. Interleukin-17, produced by lymphocytes, promotes tumor growth and angiogenesis in a mouse model of breast cancer[J]. Molecular Medicine Reports, 2012, 6(5): 1099-1102. DOI:10.3892/mmr.2012.1036 |
| [27] |
姚圣连, 徐美玉, 钱金强, 等. 辅助性T细胞17及白介素-17在呼吸道合胞病毒毛细支气管炎的表达及作用[J]. 临床儿科杂志, 2013, 31(9): 850-853. DOI:10.3969/j.issn.1000-3606.2013.09.013 |
| [28] |
刘小雪, 王雪峰, 张秀英, 等. 清肺通络膏对呼吸道合胞病毒感染大鼠肺组织PI3K-AKT-NFκB信号通路的影响[J]. 中国中西医结合儿科学, 2016, 8(2): 136-138, 249. |
| [29] |
李明, 李天苏, 杨倩文. 基于PI3K/Akt信号通路观察白藜芦醇对呼吸道合胞病毒致肺炎小鼠的保护作用机制[J]. 中药材, 2020, 43(4): 986-990. |
2. Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110032, China;
3. Dalian Children's Hospital of Dalian Medical University, Dalian 116012, China
 2024, Vol. 41
2024, Vol. 41