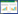文章信息
- 任亮, 王丽斌, 张敏.
- REN Liang, WANG Libin, ZHANG Min.
- 丹参酮ⅡA通过抑制JAK2/STAT3通路减轻慢性萎缩性胃炎大鼠胃黏膜损伤的机制研究
- Study on the mechanism of Tanshinone ⅡA alleviates gastric mucosal injury in rats with chronic atrophic gastritis by inhibiting JAK2/STAT3 pathway
- 天津中医药, 2024, 41(7): 914-921
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 914-921
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.19
-
文章历史
- 收稿日期: 2024-01-20
2. 邯郸市涉县医院, 邯郸 056400
慢性萎缩性胃炎(CAG)是指胃黏膜变薄、固有腺体萎缩或消失、肌层增厚、伴有肠上皮化生等病理学改变,临床表现为上腹部疼痛、胃胀、恶心、食欲不振等,具有反复发作、迁延难愈的特点,被认为是胃癌病理发展的关键阶段[1]。因此,有效抑制或逆转CAG进展对胃癌预防具有重要意义。CAG病理机制复杂,其中炎症反应和细胞凋亡在其发生发展过程中扮演着重要角色[2-3]。Janus激酶2(JAK2)/信号转导与转录激活子3(STAT3)是炎症反应及细胞凋亡等病理机制中关键的信号传导通路,有文献报道通过抑制JAK2/STAT3通路可有效抑制CAG大鼠炎症反应和细胞凋亡,进而减轻胃黏膜损伤[4-5]。因此,JAK2/STAT3通路可作为CAG防治药物研究的切入点。
中医药在CAG等慢性胃病防治方面具有独到的理论体系和治疗思路。在中医CAG可归属“胃脘痛”“痞满”“胃痞”等范畴,其病机在于脾虚气滞、痰湿血瘀、浊毒内蕴。中药丹参以唇形科植物丹参干燥根茎入药,味苦性寒,具有活血化瘀、行气止痛、凉血消痈等功效。有文献报道丹参单药或组方对CAG具有一定的临床疗效[6-7]。丹参酮ⅡA(Tan ⅡA)为中药丹参的主要活性成分之一,化学结构属于共轭醌酮类化合物,具有抗炎、抗氧化、抑凋亡等多种生物学活性[8]。研究证实,Tan ⅡA可减轻幽门螺杆菌所致胃部炎症和细胞凋亡[9];此外,Tan ⅡA对JAK2/STAT3通路及其介导的炎症反应和细胞凋亡具有抑制作用[10-11]。本实验通过构建CAG大鼠模型,研究Tan ⅡA对CAG大鼠胃黏膜的影响,并基于JAK2/STAT3通路探讨其机制。以期为临床治疗CAG提供新的思路。
1 材料与方法 1.1 实验动物清洁级健康Wistar大鼠(雄性、7周龄、体质量180~220 g)购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2021-0011。在室温23~25 ℃、相对湿度45%~65%、明暗各12 h循环的安静环境中饲养,饮水进食不限。本实验获得邯郸市中心医院伦理委员会批准[伦理号:HDZXLL(K)2022-017]。
1.2 主要药物、试剂与仪器Tan ⅡA购自四川维克奇生物科技有限公司(纯度≥98%,货号WKQ-0000161);JAK2抑制剂AG490、JAK2激动剂Coumermycin A1(C-A1)购自英国Abcam公司(货号ab69072、ab55681);N-甲基-N'-硝基-N-亚硝基胍溶液(MNNG)购自大连美仑生物科技公司(货号MB0455);雷尼替丁胶囊购自辽宁亿邦制药有限公司(规格0.15 g/粒,批号2204A013);酶联免疫吸附(ELISA)法胃泌素(GAS)、胃动素(MTL)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)试剂盒购自江苏晶美生物科技公司(货号JM-10448R1、JM-01898R2、JM-01587R1、JM-01454R1、JM-01597R2);苏木精-伊红(HE)、TUNEL染色试剂盒和TRizol法总RNA抽提试剂、增强化学发光液(ECL)购自上海碧云天生物技术公司(货号C0105S、C1098、R0016、P0018S);一步法逆转录试剂盒、RIPA裂解液、核蛋白提取试剂盒、2喹啉甲酸(BCA)法蛋白浓度测定试剂盒购自北京索莱宝生物科技公司(货号T2240、R0010、R0050、PC0020);JAK2、p-JAK2、STAT3、p-STAT3、核因子-κB p65(NF-κB p65)、B淋巴细胞瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)、激活型半胱氨酸蛋白酶3(C-Cas-3)、激活型半胱氨酸蛋白酶9(C-Cas-9)、内参GAPDH、内参H3抗体购自北京博奥森生物技术公司(货号bs-23003R、bs-2485R、bs-55208R、bsm-52210R、bs-20355R、bs-4563R、bs-28034R、bs-0081R、bs-0050R、bs-41373R、bsm-60350R)。RM2235型石蜡切片机(德国Leica公司);ELx800型多功能酶标仪、MINI-4型电泳仪、Turbo型转膜仪(美国Bio-Rad公司);9600型PCR仪(美国PE公司);ST16R型高速低温离心机(美国Thermo公司)。
1.3 方法 1.3.1 动物分组与模型制备按照随机数字表法,将80只实验用Wistar大鼠随机分为5组(n=16):正常(Normal)组、模型(Model)组、Tan ⅡA组、Tan ⅡA+AG490组和Tan ⅡA+C-A1组。除Normal组外,其他4组均采用连续20周MNNG(浓度0.04 g/mL)自由饮用联合雷尼替丁0.03 g/kg灌胃(每日1次)、饥饱失常饮食(饱2 d、饥1 d,循环)的综合法制备CAG大鼠模型[12]。病理学检查胃黏膜呈现腺体数量减少、炎性细胞浸润,则认定CAG模型制备成功[13]。
1.3.2 给药造模完成后,Tan ⅡA组通过腹腔注射(ip)给予Tan ⅡA 5 mg/kg(根据人与大鼠剂量换算公式计算所得),Tan ⅡA+AG490组ip给予Tan ⅡA 5 mg/kg和AG490 5 mg/kg[4],Tan ⅡA+C-A1组ip给予Tan ⅡA 5 mg/kg和C-A1 50 mg/kg[14],Normal组和Model组ip给予等体积生理盐水,各组均每日1次给药,连续12周。
1.3.3 中性红清除法测定胃黏膜血流量末次给药12 h后,分别随机取各组8只大鼠,采用中性红清除法测定大鼠胃黏膜血流量[15]。
1.3.4 ELISA法检测血清GAS、血浆MTL、胃黏膜炎症因子水平末次给药12 h后,分别取各组剩余的8只大鼠,40 mg/kg ip戊巴比妥钠实施麻醉,通过腹主动脉采血,3 000 r/min离心(离心半径10 cm)5 min取血清;通过抗凝采血管采血,3 000 r/min离心(离心半径10 cm)5 min取血浆;颈椎脱臼处死大鼠后,取胃组织并沿胃大弯方向切开,取部分胃黏膜组织,冰上研磨匀浆后3 500 r/min离心(离心半径10 cm)10 min后取上清液。然后按照ELISA试剂盒操作说明,通过酶标仪检测血清GAS、血浆MTL及胃黏膜炎症因子TNF-α、IL-1β、IL-6水平。
1.3.5 胃黏膜病理学变化和细胞凋亡观察取部分胃黏膜组织置于4%多聚甲醛溶液固定5 d,经梯度乙醇脱水、石蜡包埋后4 μm厚度连续切片、梯度乙醇脱蜡处理后,取部分切片行HE染色,光学显微镜下观察胃黏膜病理学改变,参照文献[16]报道行黏膜萎缩病变评分:未见病变计0分、轻度病变计1分、中度病变计2分、重度病变计3分。另外取部分切片行TUNEL染色,光学显微镜下观察胃黏膜细胞凋亡状况(胞核黄褐色为阳性着色),分别取5个不重叠视野计数细胞总数和凋亡细胞数,凋亡指数=(凋亡细胞数/细胞总数)×100%。
1.3.6 逆转录聚合酶链反应(RT-PCR)法检测胃黏膜JAK2/STAT3通路相关mRNA表达取部分胃黏膜组织,TRizol法提取总RNA,按照试剂盒说明,将RNA逆转录成cNDA后行PCR扩增,条件设置为:95 ℃预变性10 min,95 ℃变性15 s、60 ℃退火40 s,共40个循环。PCR引物由上海生工生物公司设计与合成,序列见表 1。
取部分胃黏膜组织,RIPA法提取总蛋白,通过核蛋白提取试剂盒提取核蛋白,BCA法测定蛋白浓度,每孔40 μg蛋白量上样,10%聚丙烯酰胺凝胶电泳分离蛋白、转膜、5%脱脂奶粉室温封闭1.5 h,TBST溶液洗膜5 min×3次后加一抗JAK2(1∶1 000)、p-JAK2(1∶1 000)、STAT3(1∶1 000)、p-STAT3(1∶1 000)、NF-κB p65(1∶800)、Bcl-2(1∶800)、Bax(1∶800)、C-Cas-3(1∶800)、C-Cas-9(1∶800)、GAPDH(1∶2 000)稀释液4 ℃孵育过夜,TBST溶液洗膜5 min×3次后加二抗IgG(1∶2 000)稀释液室温孵育1 h,TBST溶液洗膜5 min×3次后ECL显色,通过Image J软件分析蛋白条带灰度值,目标蛋白表达量以其与内参GAPDH条带灰度值的比值表示。
1.4 统计学方法实验数据运用SPSS 20.0软件进行统计学处理。计量资料符合正态分布以均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
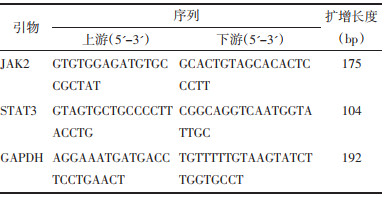
2 结果 2.1 Tan ⅡA对CAG大鼠胃黏膜血流量的影响与Normal组相比,Model组胃黏膜血流量明显降低(P<0.05)。与Model组相比,Tan ⅡA组、Tan ⅡA+AG490组和Tan ⅡA+C-A1组胃黏膜血流量明显升高(P<0.05)。与Tan ⅡA组相比,Tan ⅡA+AG490组胃黏膜血流量明显升高,Tan ⅡA+C-A1组胃黏膜血流量明显降低(P<0.05)。见图 1。
|
| 注:与Normal组比较,*P<0.05;与Model组比较,#P<0.05;与Tan ⅡA组比较,△P<0.05。 图 1 Tan ⅡA对CAG大鼠胃黏膜血流量的影响 Fig. 1 Effect of Tan ⅡA on gastric mucosal blood flow in CAG rats |
与Normal组相比,Model组血清GAS、血浆MTL水平明显降低(P<0.05)。与Model组相比,Tan ⅡA组、Tan ⅡA+AG490组和Tan ⅡA+C-A1组血清GAS、血浆MTL水平明显升高(P<0.05)。与Tan ⅡA组相比,Tan ⅡA+AG490组血清GAS、血浆MTL水平明显升高,Tan ⅡA+C-A1组血清GAS、血浆MTL水平明显降低(P<0.05)。见图 2。

|
| 注:与Normal组比较,*P<0.05;与Model组比较,#P<0.05;与Tan ⅡA组比较,△P<0.05。 图 2 Tan ⅡA对CAG大鼠血清GAS、血浆MTL水平的影响 Fig. 2 Effects of Tan ⅡA on the level of GAS in serum, MTL in plasma of CAG rats |
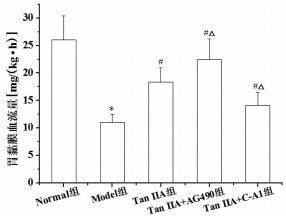
与Normal组相比,Model组胃黏膜TNF-α、IL-1β、IL-6水平明显升高(P<0.05)。与Model组相比,Tan ⅡA组、Tan ⅡA+AG490组和Tan ⅡA+C-A1组胃黏膜TNF-α、IL-1β、IL-6水平明显降低(P<0.05)。与Tan ⅡA组相比,Tan ⅡA+AG490组胃黏膜TNF-α、IL-1β、IL-6水平明显降低,Tan ⅡA+C-A1组胃黏膜TNF-α、IL-1β、IL-6水平明显升高(P<0.05)。见图 3。
|
| 注:与Normal组比较,*P<0.05;与Model组比较,#P<0.05;与Tan ⅡA组比较,△P<0.05。 图 3 Tan ⅡA对CAG大鼠胃黏膜TNF-α、IL-1β、IL-6水平的影响 Fig. 3 Effects of Tan ⅡA on the level of TNF-α, IL-1β, IL-6 in gastric mucosa of CAG rats |
HE染色结果显示:Normal组大鼠胃黏膜形态结构未见异常,腺体丰富、排列有序;与Normal组相比,Model组胃黏膜厚度降低,腺体萎缩、数量减少、排列无序,固有层可见炎性细胞浸润,上皮细胞增生并伴有杯状细胞、潘氏细胞出现,部分肠上皮化生等病理学改变;与Model组相比,Tan ⅡA组、Tan ⅡA+AG490组和Tan ⅡA+C-A1组胃黏膜病理学改变状况呈不同程度改善,其中Tan ⅡA+AG490组效果优于Tan ⅡA组,Tan ⅡA组效果优于Tan ⅡA+C-A1组。TUNEL染色结果显示:与Normal组相比,Model组胃黏膜细胞凋亡指数明显升高(P<0.05);与Model组相比,Tan ⅡA组、Tan ⅡA+AG490组和Tan ⅡA+C-A1组凋亡指数明显降低(P<0.05);与Tan ⅡA组相比,Tan ⅡA+AG490组凋亡指数明显降低,Tan ⅡA+C-A1组凋亡指数明显升高(P<0.05)。见图 4、图 5。
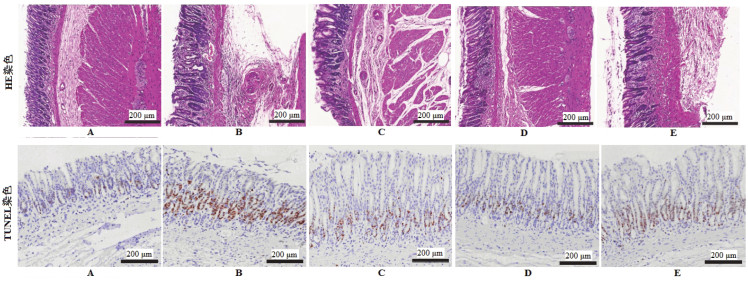
|
| 注:A,Normal组;B,Model组;C,Tan ⅡA组;D,Tan ⅡA+AG490组;E,Tan ⅡA+C-A1组。 图 4 Tan ⅡA对CAG大鼠胃黏膜病理学改变及细胞凋亡的影响 Fig. 4 Effect of Tan ⅡA on pathological changes and apoptosis of gastric mucosa in CAG rats |
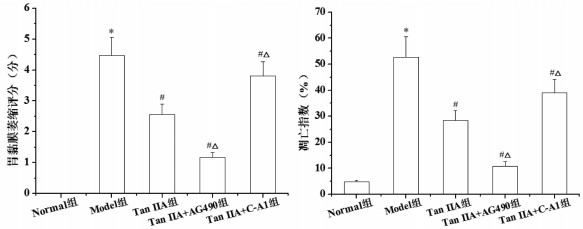
|
| 注:与Normal组比较,*P<0.05;与Model组比较,#P<0.05;与Tan ⅡA组比较,△P<0.05。 图 5 Tan ⅡA对CAG大鼠胃黏膜萎缩评分和细胞凋亡指数的影响 Fig. 5 Effects of ⅡA on gastric mucosa atrophy score and apoptosis index in CAG rats |
与Normal组相比,Model组胃黏膜JAK2、STAT3 mRNA相对表达量明显升高(P<0.05)。与Model组相比,Tan ⅡA组、Tan ⅡA+AG490组和Tan ⅡA+C-A1组胃黏膜JAK2 mRNA相对表达量明显降低(P<0.05);Tan ⅡA组、Tan ⅡA+AG490组胃黏膜STAT3 mRNA相对表达量明显降低(P<0.05)。与Tan ⅡA组相比,Tan ⅡA+AG490组胃黏膜JAK2、STAT3 mRNA相对表达量明显降低,Tan ⅡA+C-A1组胃黏膜JAK2、STAT3 mRNA相对表达量明显升高(P<0.05)。见图 6。
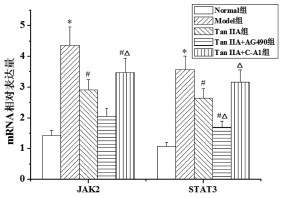
|
| 注:与Normal组比较,*P<0.05;与Model组比较,#P<0.05;与Tan ⅡA组比较,△P<0.05。 图 6 Tan ⅡA对CAG大鼠胃黏膜JAK2/STAT3通路相关mRNA相对表达量的影响 Fig. 6 Effects of ⅡA on the relative expression of JAK2/ STAT3 pathway related mRNAs in gastric mucosa of CAG rats |
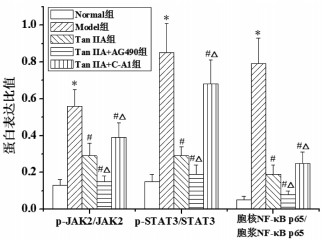
与Normal组相比,Model组胃黏膜Bcl-2蛋白相对表达量明显降低,p-JAK2、p-STAT3、胞核NF-κB p65、Bax、C-Cas-3、C-Cas-9蛋白相对表达量及p-JAK2/JAK2、p-STAT3/STAT3、胞核NF-κB p65/胞浆NF-κB p65表达比值明显升高(P<0.05)。与Normal组相比,Model组胃黏膜Bcl-2蛋白相对表达量明显升高,p-JAK2、p-STAT3、胞核NF-κB p65、Bax、C-Cas-3、C-Cas-9蛋白相对表达量及p-JAK2/JAK2、p-STAT3/STAT3、胞核NF-κB p65/胞浆NF-κB p65表达比值明显降低(P<0.05)。与Tan ⅡA组相比,Tan ⅡA+AG490组胃黏膜Bcl-2蛋白相对表达量明显升高,p-JAK2、p-STAT3、胞核NF-κB p65、Bax、C-Cas-3、C-Cas-9蛋白相对表达量及p-JAK2/JAK2、p-STAT3/STAT3、胞核NF-κB p65/胞浆NF-κB p65表达比值明显降低(P<0.05);Tan ⅡA+C-A1组胃黏膜Bcl-2蛋白相对表达量明显降低,p-JAK2、p-STAT3、胞核NF-κB p65、Bax、C-Cas-3、C-Cas-9蛋白相对表达量及p-JAK2/JAK2、p-STAT3/STAT3、胞核NF-κB p65/胞浆NF-κB p65表达比值明显升高(P<0.05)。见图 7、图 8、图 9。

|
| 注:A,Normal组;B,Model组;C,Tan ⅡA组;D,Tan ⅡA+AG490组;E,Tan ⅡA+C-A1组。 图 7 Tan ⅡA对CAG大鼠胃黏膜组织JAK2/STAT3通路相关蛋白表达的影响 Fig. 7 Effects of ⅡA on the expression of JAK2/STAT3 pathway related proteins in gastric mucosa of CAG rats |
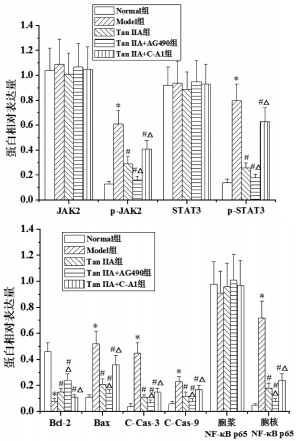
|
| 注:与Normal组比较,*P<0.05;与Model组比较,#P<0.05;与Tan Ⅱ A组比较,△P<0.05。 图 8 Tan ⅡA对CAG大鼠胃黏膜组织JAK2/STAT3通路相关蛋白相对表达量的影响 Fig. 8 Effects of ⅡA on the relative expression of JAK2/ STAT3 pathway related proteins in gastric mucosa of CAG rats |
|
| 注:与Normal组比较,*P<0.05;与Model组比较,#P<0.05;与Tan ⅡA组比较,△P<0.05。 图 9 Tan ⅡA对CAG大鼠胃黏膜组织p-JAK2/JAK2、pSTAT3/STAT3、胞核NF-κB p65/胞浆NF-κB p65表达比值的影响 Fig. 9 Effects of ⅡA on the expression ratio of p-JAK2/ JAK2, p-STAT3/STAT3, nuclear NF-κB p65/cytoplasmic NF-κB p65 in gastric mucosa of CAG rats |
CAG动物模型的制备方法主要有化学制剂诱导法、幽门螺杆菌感染法、手术法、综合法等,其中综合造模法具有造模时间短、模型稳定性好、病理特点与人类近似等优点,是目前最常用的造模方法。MNNG为公认的CAG化学诱导制剂,易渗透至胃底黏膜,可诱导DNA部分碱基烷化而发挥致癌作用[17]。本研究采用MNNG+雷尼替丁+饥饱失常饮食的综合法制备CAG大鼠模型,结果显示,CAG模型大鼠胃黏膜血流量和血清GAS、血浆MTL水平均明显降低;胃黏膜呈现厚度降低,腺体萎缩、数量减少、排列无序,固有层炎性细胞浸润,上皮细胞增生,部分肠上皮化生等病理学改变,与李学永等[18]报道一致。Tan ⅡA为中药丹参的主要活性成分之一,本研究发现Tan ⅡA能够明显提高CAG大鼠胃黏膜血流量和血清GAS、血浆MTL水平,明显改善胃黏膜病理学改变、降低萎缩评分。说明Tan ⅡA对CAG大鼠胃黏膜结构和功能损伤具有保护作用。
炎症和细胞凋亡在CAG病理机制中扮演着重要角色。戴秋红等[19]报道CAG患者血清TNF-α、IL-1β、IL-6水平明显高于正常者。TNF-α可诱导巨噬细胞等活化并大量释放TNF-α、IL-6等促炎因子而加重炎症反应,胡掌朝等[20]研究发现CAG病情严重程度与血清TNF-α水平呈正相关。IL-6和IL-1β则能够刺激内皮细胞分泌血管细胞黏附分子、细胞间黏附分子等黏附因子而促进炎性浸润,进而扩大炎症损伤[21]。线粒体通路是细胞凋亡的经典通路,Bcl-2家族蛋白(Bcl-2、Bax等)和半胱氨酸蛋白酶(Caspase)家族蛋白在细胞线粒体凋亡通路中发挥着关键调控作用。定位于线粒体外膜的Bax可促进线粒体外膜小孔形成并刺激线粒体通透性转换孔异常开放,一是使Ca2+由线粒体释放进入细胞质,导致胞质Ca2+超载而引发细胞凋亡[22];二是使细胞色素C(Cyt C)释放进入细胞质,Cyt C可诱导活化Cas-9,C-Cas-9则剪切活化Caspase-3,C-Cas-3可剪切破坏DNA结构,通过损伤DNA修复酶而抑制DNA修复,进而引发细胞凋亡[23]。Bcl-2能够与Bax聚合而抑制其生理活性,表现出抑凋亡活性。本研究发现,Tan ⅡA能够明显降低CAG大鼠胃黏膜TNF-α、IL-1β、IL-6水平,改善胃黏膜细胞凋亡状况,提高胃黏膜Bcl-2表达量并降低Bax、C-Cas-3、C-Cas-9表达量,说明Tan ⅡA对CAG大鼠胃黏膜炎症损伤和细胞凋亡具有抑制作用,其对细胞凋亡的抑制作用可能与线粒体凋亡通路有关。
JAK2/STAT3是调控炎症反应和细胞凋亡的关键信号通路,可被IL-6等因子诱导磷酸化而活化[24]。NF-κB是一种与炎症反应密切相关的核转录因子,核转位后其p65亚基可促进多种炎症因子转录表达,TNF-α、IL-1β等均为NF-κB p65靶基因,而p-STAT3对NF-κB表达与核转位具有促进作用[25]。此外,p-STAT3可通过下调Bax表达并上调Bcl-2表达而促进细胞凋亡[26]。本研究发现,Tan ⅡA能够明显降低CAG大鼠胃黏膜JAK2、STAT3 mRNA表达量,降低p-JAK2、p-STAT3、胞核NF-κB p65蛋白表达量及p-JAK2/JAK2、p-STAT3/STAT3、胞核NF-κB p65/胞浆NF-κB p65比值,说明Tan ⅡA对CAG大鼠胃黏膜炎症和细胞凋亡的作用可能与抑制JAK2/STAT3通路活化及NF-κB核转位有关。为了验证上述推论,本实验设置了Tan ⅡA+ JAK2抑制剂AG490组和Tan ⅡA+JAK2激动剂C-A1组,结果显示,AG490能够明显增强Tan ⅡA对CAG大鼠胃黏膜血流量、胃功能、炎症反应、胃黏膜病理学改变、细胞凋亡、JAK2/STAT3通路相关mRNA和蛋白表达的调控作用,C-A1则能够明显逆转Tan ⅡA对CAG大鼠上述各检测指标的调控作用,从而进一步证实了Tan ⅡA对CAG大鼠胃黏膜的影响与抑制JAK2/STAT3通路活化及NF-κB核转位有关。
综上所述,Tan ⅡA可能通过抑制JAK2/STAT3通路活化及NF-κB核转位,减轻炎症反应和细胞凋亡,从而减轻CAG大鼠胃黏膜结构和功能损伤。本研究结果为Tan ⅡA用于CAG治疗提供了理论依据,但本研究中所用实验动物均为雄性,以排除雌激素和孕激素对结果的影响,未能阐明本实验结果是否适用于雌性动物,课题组下一步拟对本研究中的不足之处进行进一步深入探讨。
| [1] |
YIN Y, LIANG H L, WEI N, et al. Prevalence of chronic atrophic gastritis worldwide from 2010 to 2020:an updated systematic review and meta-analysis[J]. Annals of Palliative Medicine, 2022, 11(12): 3697-3703. DOI:10.21037/apm-21-1464 |
| [2] |
田家豪, 石悰悰, 费素娟. 小檗碱通过抑制凋亡和炎症减轻大鼠慢性萎缩性胃炎病变的效果[J]. 世界中医药, 2023, 18(2): 200-205. |
| [3] |
ZHANG J, WANG H H. Morroniside protects against chronic atrophic gastritis in rat via inhibiting inflammation and apoptosis[J]. American Journal of Translational Research, 2019, 11(9): 6016-6023. |
| [4] |
陈鹏, 丁志杰, 金永增. 大蒜素调控JAK2/STAT3信号通路对大鼠慢性萎缩性胃炎的影响[J]. 中医学报, 2023, 38(5): 1053-1060. |
| [5] |
董利洋, 孔慧, 罗娟, 等. 基于JAK2/STAT3信号通路探究半夏泻心汤对慢性萎缩性胃炎大鼠的影响[J]. 中医药导报, 2023, 29(3): 5-10. |
| [6] |
李昆阳, 刘华一. 基于网络药理学探索丹参饮治疗慢性萎缩性胃炎的机制研究[J]. 环球中医药, 2020, 13(8): 1323-1332. DOI:10.3969/j.issn.1674-1749.2020.08.006 |
| [7] |
王德芳, 赵明, 董笑一, 等. 基于络病理论观察丹参饮加味治疗慢性萎缩性胃炎胃络瘀阻证的临床疗效及机制[J]. 中国实验方剂学杂志, 2022, 28(23): 122-127. |
| [8] |
LIU Y N, TONG C C, TANG Y S, et al. Tanshinone ⅡA alleviates blast-induced inflammation, oxidative stress and apoptosis in mice partly by inhibiting the PI3K/Akt/FoxO1 signaling pathway[J]. Free Radical Biology&Medicine, 2020, 152: 52-60. |
| [9] |
CHEN G Y, SHU Y C, CHUANG D Y, et al. Inflammatory and apoptotic regulatory activity of tanshinone ⅡA in Helicobacter pylori-infected cells[J]. The American Journal of Chinese Medicine, 2016, 44(6): 1187-1206. DOI:10.1142/S0192415X1650066X |
| [10] |
ZHANG M Q, TU J F, CHEN H, et al. Janus kinase/signal transducer and activator of transcription inhibitors enhance the protective effect mediated by tanshinone ⅡA from hypoxic/ischemic injury in cardiac myocytes[J]. Molecular Medicine Reports, 2015, 11(4): 3115-3121. DOI:10.3892/mmr.2014.3063 |
| [11] |
DU X X, WANG X Y, CUI K Y, et al. Tanshinone ⅡA and astragaloside Ⅳ inhibit miR-223/JAK2/STAT1 signalling pathway to alleviate lipopolysaccharide-induced damage in nucleus pulposus cells[J]. Disease Markers, 2021, 2021: 6554480. |
| [12] |
白雪峰, 谭娟, 高枫. 理中汤对慢性萎缩性胃炎模型大鼠胃黏膜保护作用及对ADAM17、EGFR蛋白的影响[J]. 中医药导报, 2021, 27(10): 32-36, 41. |
| [13] |
林玲, 韩涛, 陆璐, 等. 慢性萎缩性胃炎及胃癌前病变动物模型的总结应用与评述[J]. 中国实验方剂学杂志, 2019, 25(2): 220-227. |
| [14] |
陈琳珊, 冯甜, 陆震丰, 等. 橙皮苷介导JAK2/STAT3通路改善急性牙髓炎模型大鼠牙髓组织损伤的机制研究[J]. 解剖学研究, 2023, 45(4): 374-378. |
| [15] |
刘远婷, 李慧, 丁甜甜, 等. 加味沙参麦冬汤调节EGFR/MAPK信号通路对慢性萎缩性胃炎大鼠的保护作用研究[J]. 吉林中医药, 2022, 42(7): 812-816. |
| [16] |
DIXON M F, GENTA R M, YARDLEY J H, et al. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994[J]. The American Journal of Surgical Pathology, 1996, 20(10): 1161-1181. DOI:10.1097/00000478-199610000-00001 |
| [17] |
于春月, 李依聪, 苏泽琦, 等. MNNG负荷多因素致大鼠慢性萎缩性胃炎中医病证结合动物模型研究进展[J]. 中华中医药杂志, 2020, 35(1): 292-296. |
| [18] |
李学永, 康维娜, 温进平, 等. 白芍总苷对慢性萎缩性胃炎大鼠胃黏膜的保护作用及机制[J]. 现代中西医结合杂志, 2023, 32(12): 1638-1644, 1740. DOI:10.3969/j.issn.1008-8849.2023.12.006 |
| [19] |
戴秋红, 董瑾操, 郝冉, 等. 半夏泻心汤联合荆花胃康胶丸对慢性萎缩性胃炎患者CA724 PG1水平的影响[J]. 河北医学, 2022, 28(8): 1404-1408. DOI:10.3969/j.issn.1006-6233.2022.08.036 |
| [20] |
胡掌朝, 安俊丽, 程帅师, 等. 慢性萎缩性胃炎患者Hp感染与IL-8、PCT、TNF-α表达水平及严重程度的关系分析[J]. 热带医学杂志, 2021, 21(6): 731-734. DOI:10.3969/j.issn.1672-3619.2021.06.013 |
| [21] |
江钰, 胡金霞, 赵翠霞, 等. 基于炎症免疫调节探讨秦皮素抗动脉粥样硬化的作用及机制研究[J]. 中国免疫学杂志, 2022, 38(4): 402-408. DOI:10.3969/j.issn.1000-484X.2022.04.004 |
| [22] |
肖元元, 尹晓晨, 曾明. 重金属诱导细胞钙超载致细胞凋亡的分子机制研究进展[J]. 实用预防医学, 2020, 27(2): 252-257. |
| [23] |
HU Z X, LAI Y J, MA C Y, et al. Cordyceps militaris extract induces apoptosis and pyroptosis via caspase-3/PARP/GSDME pathways in A549 cell line[J]. Food Science&Nutrition, 2021, 10(1): 21-38. |
| [24] |
王玉娇, 韩艳珺, 夏红, 等. IL-6/JAK2/STAT3信号通路在小儿轮状病毒性肠炎中的表达与机制[J]. 中华医院感染学杂志, 2022, 32(19): 3021-3024. |
| [25] |
ZHU J Y, ZHU Z, REN Y P, et al. LINGO-1 shRNA protects the brain against ischemia/reperfusion injury by inhibiting the activation of NF-κB and JAK2/STAT3[J]. Human Cell, 2021, 34(4): 1114-1122. DOI:10.1007/s13577-021-00527-x |
| [26] |
欧慧萍, 吴趋荟, 袁多, 等. 桃红四物汤通过JAK2/STAT3信号通路对肺纤维化模型大鼠凋亡及EMT的影响[J]. 中国药理学通报, 2023, 39(8): 1577-1583. DOI:10.12360/CPB202201055 |
2. Handan Shexian Hospital, Handan 056400, China
 2024, Vol. 41
2024, Vol. 41