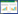文章信息
- 潘华荣, 高圣柠, 申晨卉, 等.
- PAN Huarong, GAO Shengning, SHEN Chenhui, et al.
- 丹参多酚酸盐调控Nrf2/HO-1信号通路对膜性肾病大鼠氧化应激的影响
- Effect of Nrf 2/HO-1 signaling regulated by salvia miltiorrhiza polyphenols on oxidative stress in rats with membranous nephropathy
- 天津中医药, 2024, 41(7): 922-928
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 922-928
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.20
-
文章历史
- 收稿日期: 2024-01-22
2. 河北省中医院, 石家庄 050011;
3. 河北医科大学第四医院, 石家庄 050000;
4. 河北医科大学第二医院, 石家庄 050000
膜性肾病(MN)是以肾小球基底膜外侧、上皮细胞下免疫复合物沉积,伴基底膜弥漫增厚为特征的一组疾病[1]。MN发病率高,以中老年人多见,虽然有约三分之一的自发缓解率,但仍然存在向终末期肾功能衰竭(ESRF)和尿毒症转归的危险[1-2]。临床治疗MN多使用免疫抑制剂,虽能缓解病情,但随着服用周期的增加,副作用也会随之显现。因此,寻找更安全、更有效的药物治疗MN仍是当下的难题。氧化应激(OS)是在各种有害刺激作用机体后,体内活性氧和抗氧化防御作用失衡后机体所处的一种状态。近年来诸多证据显示,MN发病机制与OS存在紧密联系,且OS在所有因素中占比较高[3]。MN中存在的OS可通过各种途径造成肾脏细胞损伤,因此干预OS会保护肾功能,进而阻止MN进一步发展[4]。
研究表明,血清核转录因子2/血红蛋白氧合酶-1(Nrf2/HO-1)通路在氧化应激和炎性反应的发生与调控中起重要作用,也是目前国内外氧化应激和炎性疾病发生、发展机制中的研究热点[5]。Nrf2/HO-1信号通路在细胞氧化应激和炎症反应过程中发挥着关键调控作用,激活Nrf2/HO-1信号通路,能够抑制氧化应激和炎症反应而减轻糖尿病肾病肾损伤[6]。
近年来,大量研究表明中医药在保护肾功能、延缓肾脏疾病进展发挥重要作用[7-8]。丹参多酚酸盐是一种中成药制剂具有抗氧化、保护肾脏血管内皮细胞功能等作用。本团队前期研究发现丹参多酚酸盐对MN的治疗作用可能与减少OS有关[9]。但丹参多酚酸盐对MN大鼠Nrf2/HO-1信号通路的影响少有人报道,故本研究以Nrf2/HO-1信号通路为切入点,深入探究丹参多酚酸盐对MN肾脏OS的影响及其可能作用机制,为MN的临床治疗提供新依据。
1 材料 1.1 动物选取80只SPF级雄性SD大鼠,均为8周龄,体质量(150±20)g,购自河北医科大学动物实验中心[SCXK(冀)2018-004]。大鼠饲养于河北中医学院动物实验中心,自由饮水、普通饲料[SCXK(冀)2018-003]饲养,该实验经河北中医药大学动物伦理学研究中心审批通过(DWLL202208004)。
1.2 药品及试剂丹参多酚酸盐(上海绿谷药业,产品批号Z20050246,每瓶200 mg);盐酸贝那普利(北京诺华制药,批号:X1902,规格10 mg/片);阳离型牛血清白蛋白(C-BSA,北京Chondrex CorPoration,批号:190203);弗氏不完全佐剂(美国Sigma CorPoration,批号SLCB8385);兔来源一抗NRF2抗体(武汉赛维尔生物科技有限公司,批号GB113808);兔二抗(武汉赛维尔生物科技有限公司,批号GB23303);鼠来源一抗HO-1抗体(武汉赛维尔生物科技有限公司,批号GB12014);鼠二抗(武汉赛维尔生物科技有限公司,批号GB23301)。碘酸六胺银染剂(PASM,北京索莱宝技术公司,批号G1120);锇酸(成都贝斯特化学试剂厂,B00427002)。
1.3 仪器H-7650型透射电镜(日本日立公司);721型尿蛋白(24 h)分光光度计(上海第三分析仪器厂);BX53型显微镜(日本OlymPus公司);Kodak Image Station 2000 MM成像系统(美国Kodak公司)。
2 方法 2.1 动物模型制备大鼠饲养1周后,用尿蛋白试纸条检测尿蛋白水平,判定尿蛋白均为阴性后,随机分为对照组20只和造模组60只。依据改进的Border法[10]复制MN大鼠模型:首先将含2 mg/L C-BSA 0.5 mL与等量的弗氏不完全佐剂混合,待其完全混匀乳化后进行预免疫,分别在大鼠双后肢腋窝处及双侧腹股沟部位进行多点皮下注射,每次注入乳剂0.3 mL,隔日1次,共3次。1周后进行正式免疫,将2 mg/L C-BSA与等体积磷酸盐缓冲溶液(PBS)混匀后经大鼠尾部静脉注射给药,每次0.5 mL,1周3次,隔日1次,连续注射4周。正常组大鼠于同一时间段,以同样的方法注入等量的生理盐水。在给药完成后,检查大鼠24 h尿蛋白定量(24 h UTP),以24 h UTP>20 mg作为MN大鼠模型制备成功的标准,并从造模组和正常对照组中随机选择3只大鼠,包埋固定后进行病理染色,观察大鼠肾脏病理学改变,进而确定MN大鼠模型建立成功。
2.2 分组、干预、取材及固定MN大鼠模型建立成功后将大鼠随机分为模型组,盐酸贝那普利组(10 mg/kg),丹参多酚酸盐低、中、高剂量(16.7、33.3、66.7 mg/kg)组,每组各留有10只。根据人与大鼠的体表面积折算等效剂量[11],盐酸贝那普利组按照10 mg/kg灌胃,丹参多酚酸盐组分别按照丹参多酚酸盐16.7、33.3、66.7 mg/kg灌胃,相当于人临床用量的6.3倍,正常组大鼠和模型组大鼠则给予等体积的生理盐水,每日1次,连续灌胃4周。4周以后,留取各组大鼠24 h尿液,离心取尿液上清液,放于4 ℃冰箱中保存备用。大鼠禁食水12 h后,充分吸入异氟烷使其麻醉,然后迅速打开大鼠腹腔,腹主动脉取血,3 000 r/min离心15 min(离心半径10 cm)后分离得到血清,置于4 ℃冰箱保存备用;然后将取得的大鼠肾脏组织,一部分肾皮质放于-80 ℃冰箱保存备用,一部分固定在4%的多聚甲醛溶液中,另外一部分固定于2.5%的戊二醛溶液。
2.3 PASM和电镜扫描观察大鼠肾脏病理学的变化将大鼠肾组织在4%多聚甲醛中固定48 h后,再经过乙醇梯度浓度脱水后,使用二甲苯将肾组织进行透明、浸蜡,最后用石蜡包埋。并且切成4~5 μm的薄片进行PASM染色;另将大鼠肾组织从2.5%的戊二醛固定液中取出,置于PBS中浸洗,再经由1%的锇酸固定,经过丙酮逐级脱水,丙酮树脂浸透包埋聚合、超薄切片,然后用醋酸双氧铀和酸铅进行双重染色,最后在电镜下观察并拍照。
2.4 免疫荧光法观察MN大鼠肾小球补体C3、IgG沉积使用冰冻切片机快速冷冻大鼠的新鲜肾组织10 min,并切成4 μm的切片。丙酮固定切片,PBS中浸洗后,滴加免疫球蛋白IgG和补体C3的抗体(稀释度为1∶200),37 ℃孵育30 min。PBS清洗后用甘油密封盖玻片,使用荧光显微镜观察。免疫荧光半定量分析:在每张切片里随机选取5个视野(×400倍),使用Image J软件计算每个视野的总荧光强度和阳性结果面积。
2.5 酶联免疫吸附测定法(ELISA)检测大鼠血清中超氧化物歧化酶(SOD)、丙二醛(MDA)含量,使用ELISA试剂盒检测大鼠血清中SOD、MDA的含量水平。
2.6 Real-time PCR检测大鼠肾脏中Nrf2/HO-1 mRNA的表达水平将保存在液氮中的肾组织取出,利用TRIzol法提取总RNA,反转录cDNA,配置反应体系,在95 ℃ 10 min预变性、95 ℃ 15 s、60 ℃ 60 s,40个循环条件下进行PCR扩增。使用2-ΔΔCt法计算Nrf2/HO-1 mRNA表达水平。引物序列见表 1。
将液氮中的大鼠肾皮质组织均匀研磨并补充RIPA裂解缓冲液。以12 000 r/min离心25 min(离心半径8 cm),收集上清液,采用BCA法测定总蛋白浓度。将制备好的蛋白质样品进行SDS-PAGE凝胶电泳分离,随后进行PVDF膜转移,在室温下进行30 min的封闭步骤,然后添加一抗NRF2(1∶1 000)和HO-1(1∶1 000)并在4 ℃孵育过夜。TBST洗膜后,用TBST按1∶5 000的比例稀释二抗,室温轻轻振荡30 min,TBST洗3次。扫描PVDF膜,并使用Image J软件分析灰度值。以β-actin为内参,以目的蛋白与β-actin的灰度值比值作为半定量分析指标。
2.8 统计学分析使用SPSS 23.0软件进行统计分析。数据以均数±标准差(x±s)表示。所有数据均经过正态性和方差齐性检验。如果数据满足这些假设,则使用单因素方差分析(ANOVA)进行组间比较,然后使用Student-Newman-Keuls(SNK)方法进行组间多重比较。如果数据不满足正态性或方差同质性假设,则采用非参数秩和检验,P<0.05为差异有统计学意义。
3 结果 3.1 丹参多酚酸盐对MN大鼠24 h UTP和BUN、SCr水平的影响与正常组相比,模型组大鼠24 h UTP水平显著升高(P<0.01),而血尿素氮(BUN)和血清肌酐(SCr)差异无统计学意义;与模型组相比,各治疗组24 h-UTP水平均有不同程度降低(P<0.05或P<0.01),见表 2。
|
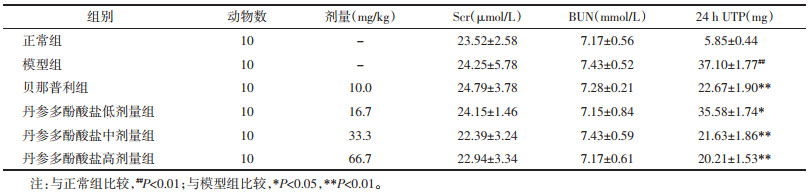
与正常组相比,模型组大鼠ALB、TP显著降低(P<0.01),TC、TG水平显著增高(P<0.01);与模型组相比,各治疗组ALB、TP水平均不同程度增高,TC、TG呈现不同程度降低。其中,盐酸贝那普利组、丹参多酚酸盐中、高剂量组ALB、TP水平显著增高(P<0.01),而TC、TG水平显著下降(P<0.05或P<0.01),见表 3。
|
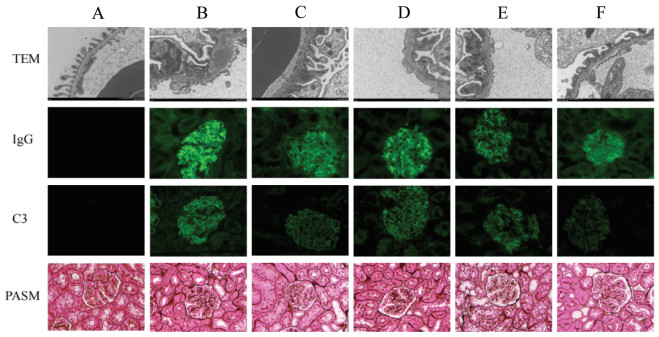
电镜下,正常组大鼠肾小球形态结构完整,基底膜未见增厚;然而模型组大鼠表现出明显的肾小球基底膜增厚,并伴有足突的融合与丧失。相比之下,各治疗组大鼠肾组织形态学改变明显改善,肾小球基底膜增厚程度减轻,足细胞损伤减轻。
免疫荧光下,正常组大鼠肾组织无异常,未见补体C3、IgG沉积的证据。与之相反的是,模型组大鼠肾组织免疫荧光强度升高,补体C3和IgG呈颗粒状沉积,并沿着肾小球毛细血管袢分布,并伴有系膜区沉积。盐酸贝那普利组和丹参多酚酸盐各剂量组与模型组相比,荧光强度降低,表明补体C3和IgG沉积减少。此外,随着丹参素酚酸盐剂量的增加,免疫荧光强度逐渐降低。
PASM染色结果显示,正常组肾组织未见明显病理改变。相对于正常组大鼠来说,模型组大鼠肾组织病理改变明显,肾小球基底膜明显增厚,呈钉突样改变,系膜基质增生。相较于模型组来说,盐酸贝那普利组和丹参多酚酸盐各剂量组大鼠肾小球基底膜增厚和钉突样改变都有着不同程度的减轻。见图 1。
|
| 注:A,正常组;B,模型组;C,盐酸贝那普利组;D,丹参多酚酸盐低剂量组;E,丹参多酚酸盐中剂量组;F,丹参多酚酸盐高剂量组。 图 1 丹参多酚酸盐对MN大鼠肾组织病理形态的影响(×400) Fig. 1 Effect of salvia miltiorrhiza polyphenols on the pathological morphology of nephropathy in MN rats(×400) |
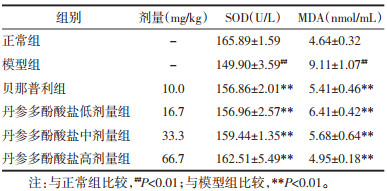
相对于正常组来说,模型组大鼠血清中MDA水平明显升高(P<0.01),血清中SOD水平明显降低(P<0.01);同模型组相比较,各给药组大鼠SOD水平均有显著的升高,MDA水平明显降低(P<0.01)。见表 4。
|
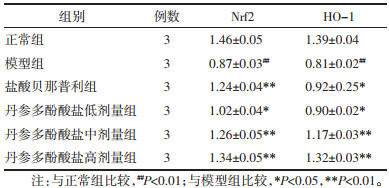
与正常组比较,模型组大鼠肾组织Nrf2/HO-1 mRNA表达明显降低(P<0.01);与模型组比较,丹参多酚酸盐中、高剂量组和盐酸贝那普利组大鼠肾组织Nrf2/HO-1 mRNA表达显著升高(P<0.05或P<0.01),丹参多酚酸盐低剂量组Nrf2/HO-1 mRNA表达明显升高(P<0.05),见表 5。
|
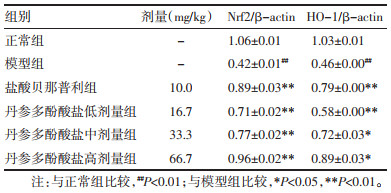
与正常组相比,模型组Nrf2、HO-1表达明显降低(P<0.01);与模型组相比,盐酸贝那普利组和中药各剂量组Nrf2、HO-1表达均有所升高(P<0.05或P<0.01),见表 6、图 2。
|

|
| 图 2 各组大鼠肾组织Nrf2、HO-1蛋白表达水平的比较 Fig. 2 Comparison of Nrf2 and HO-1 protein expression levels in kidney tissues of rats |
MN以免疫复合物沿肾小球毛细血管襻广泛沉积为病理特征,常因大量蛋白尿的产生形成肾病综合征。据统计,肾病综合征中以MN为病理类型的患者约占肾脏疾病的20%[12]。临床治疗MN多以糖皮质激素、细胞毒类、免疫抑制剂及降脂利尿类药物对症治疗,但面临着停药后复发率高及长期服用激素后出现的各种不良反应。近年研究发现中医药可减轻免疫抑制剂等疗法的毒副作用并提高治疗效果,故而临床中逐渐重视中医药在治疗MN中发挥的重要作用。
中医将MN多归于“肾风”“水肿”等范畴,多认为是由于脾肾不足,内生水湿;或感受外邪,邪伏肾络,致使血行受阻,瘀血停滞,最终形成肾络瘀阻的病机。临床上治疗MN常应用中药丹参活血化瘀,疏通肾络。研究表明,益气活血通络方可能通过晚期糖基化终末产物受体(RAGE)/烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)/活性氧(ROS)通路减少了糖尿病肾病大鼠ROS的生成,缓解OS,减少蛋白尿,从而起到明显的减轻肾脏损害及延缓病程进展作用[13];丹参多酚酸盐能增加糖尿病肾病模型小鼠SOD和谷胱甘肽过氧化物酶(GSH-Px)的含量,减少MDA生成,改善小鼠肾脏病理结构,提示丹参多酚酸盐能够有效抑制组织氧化应激损伤[14];冠心丹参方通过上调雌激素受体α(ERα)及其下游Nrf2介导的HO-1水平,从而发挥缓解糖尿病肾脏病中OS的作用[15]。以上研究表明,活血化瘀药物在OS中发挥重要作用。丹参多酚酸盐作为丹参的主要成分,同样具备化瘀通络的功效,研究显示丹参多酚酸盐可改善肾功能,延缓慢性肾脏疾病进展[16-17]。团队前期研究发现丹参多酚酸盐对MN大鼠肾脏的保护作用可能是通过改变MN大鼠肾组织CD2AP及Desmin蛋白表达水平,进而起到减缓肾小球滤过膜受损及足细胞损伤的作用[9]。本研究以Nrf2/HO-1信号通路为切入点,从OS角度探究丹参多酚酸盐对MN肾脏可能的保护作用机制,为丹参多酚酸盐临床治疗MN提供新的作用依据。结果显示,MN大鼠经过丹参多酚酸盐干预后,有效降低MN大鼠24 h尿蛋白、血清TG、TC水平并提高TP、ALB水平;病理染色显示,丹参多酚酸盐能减轻肾小球基底膜增厚,改善MN大鼠肾组织病理损害。
MN主要发病机制是由于补体活化,导致C5b-9膜攻击复合物的形成,而后通过多种途径损伤足细胞,引起蛋白尿。既往研究表明,OS是MN发生发展的主要机制之一。ROS是一类具有高反应活性的氧自由基,当内源性刺激或有害性外源刺激作用于机体时,机体便会产生大量ROS,并且超过机体清除能力。过量的ROS则会损伤分子、细胞和机体[18]。MDA是ROS攻击不饱和脂肪酸后而产生的一种过氧化终产物,其不仅会损伤肾小球细胞,而且是检测氧化应激损伤程度的常用指标。SOD属于一种抗氧化物质,能消除氧自由基,对机体起保护作用[19]。OS可以通过SOD活性和MDA含量进行评估。在MN中,补体攻击或膜攻击复合物C5b-9通过刺激肾小球细胞,使过量的ROS在肾脏中生成而损伤足细胞,使肾脏发生氧化应激损伤[20]。本实验显示模型组大鼠SOD水平下降,MDA水平上升,说明MN大鼠肾脏出现氧化损伤,经药物干预后,大鼠SOD水平增加,MDA水平下降,说明丹参多酚酸盐增加了机体抗氧化反应。
Nrf2/HO-1是抗氧化应激的经典信号通路。Nrf2是调节细胞氧化应激并影响细胞内氧化还原稳态维持的关键转录因子[21]。HO-1是由Nrf2调控的关键抗氧化酶。MN中OS发生时,Nrf2被转运至细胞核,激活抗氧化反应元件(ARE)依赖性基因转录,消除ROS,并上调SOD、HO-1等抗氧化基因,来维持细胞内氧化还原稳态[22]。但在长期抵抗氧化应激后,由于受到氧化损伤,Nrf2的表达水平会逐渐降低[23]。在本研究中,模型组大鼠出现明显氧化损伤,Nrf2、HO-1表达水平降低,经药物干预后,盐酸贝那普利组和中药组Nrf2、HO-1表达增加,说明丹参多酚酸盐可能是激活了Nrf2/HO-1通路来抑制OS,减轻MN大鼠肾脏损伤。
综上,本研究发现,丹参多酚酸盐可能通过激活Nrf2/HO-1通路,发挥抗氧化作用,减轻大鼠病理损伤,延缓疾病进展,可为临床应用提供依据。但是本研究尚存在一些局限性,如仅做了动物实验,未进行细胞实验,未对其他抗氧化通路进行验证,这些局限性将在本课题组以后的研究中进一步解决。
| [1] |
王海燕. 肾脏病学[M]. 3版. 北京: 人民卫生出版社, 2008.
|
| [2] |
杜昕, 袁国栋, 刘明, 等. 加味升降散对膜性肾病大鼠肾保护作用及对肾组织线粒体活性氧表达的影响[J]. 中国实验方剂学杂志, 2019, 25(12): 97-103. |
| [3] |
彭素英. 内质网应激与氧化应激在膜性肾病中的作用及机制[D]. 泸州: 四川医科大学, 2015.
|
| [4] |
李绍慧, 高飞, 郝文霞, 等. 加味升降散调控HIF-1α/NOX4信号通路对膜性肾病大鼠氧化应激和凋亡的影响[J]. 中国实验方剂学杂志, 2021, 27(19): 66-72. |
| [5] |
于馨雅, 申元英, 郭乐. Nrf2/HO-1通路在氧化应激和炎性反应中的作用[J]. 医学研究杂志, 2023, 52(7): 19-22. |
| [6] |
HUANG Q, OUYANG D S, LIU Q. Isoeucommin a attenuates kidney injury in diabetic nephropathy through the Nrf2/HO-1 pathway[J]. FEBS Open Bio, 2021, 11(8): 2350-2363. DOI:10.1002/2211-5463.13251 |
| [7] |
关欣, 吴鸿莉, 邱辉, 等. 中西医结合治疗特发性膜性肾病Meta分析[J]. 中医学报, 2020, 35(2): 446-452. |
| [8] |
吴成态, 张铭, 张静, 等. 健脾益肾法治疗特发性膜性肾病的Meta分析[J]. 中华中医药学刊, 2020, 38(7): 163-168. |
| [9] |
陈素枝, 陈文军, 张卓, 等. 丹参多酚酸盐对阳离子化牛血清白蛋白致膜性肾病大鼠的影响[J]. 中草药, 2018, 49(8): 1877-1883. |
| [10] |
BORDER W A, WARD H J, KAMIL E S, et al. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen[J]. The Journal of Clinical Investigation, 1982, 69(2): 451-461. DOI:10.1172/JCI110469 |
| [11] |
徐叔云. 药理实验方法学[M]. 3版. 北京: 人民卫生出版社, 2002.
|
| [12] |
郭宁, 王娜, 吕国庆. 特发性膜性肾病磷脂酶A2受体抗原表达情况与临床特征、预后的关系[J]. 中国医师杂志, 2020, 22(7): 1026-1029. DOI:10.3760/cma.j.cn431274-20190614-00702 |
| [13] |
强家维, 靳贺超, 梁胜然, 等. 益气活血通络方对糖尿病肾病大鼠肾组织RAGE/NOX4/ROS信号通路及氧化应激的影响[J]. 暨南大学学报(自然科学与医学版), 2022, 43(3): 244-255. |
| [14] |
杨冰, 高飞, 刘令今, 等. 丹参多酚酸盐减轻糖尿病肾病小鼠肾纤维化的机制研究[J]. 广州中医药大学学报, 2021, 38(5): 1018-1024. |
| [15] |
张彬, 张雪涟, 张晨阳, 等. 冠心丹参方调控Nrf2信号通路治疗糖尿病肾病的作用研究[J]. 中国中药杂志, 2020, 45(11): 2595-2600. |
| [16] |
姚冲, 刘兵兵, 黄馥菡, 等. 丹参多酚酸盐治疗慢性肾功能衰竭有效性及安全性的系统评价[J]. 中国实验方剂学杂志, 2015, 21(14): 203-208. |
| [17] |
邵命海, 王琛, 杨婧, 等. 丹参多酚酸盐对慢性肾功能衰竭大鼠肾功能和肾内氧耗的影响[J]. 上海中医药大学学报, 2012, 26(3): 66-69. |
| [18] |
秦丽, 刘东伟, 王春燕, 等. 氧化应激相关因子在特发性膜性肾病患者中的表达[J]. 中华肾脏病杂志, 2017, 33(3): 175-179. |
| [19] |
林劲, 欧阳辉, 梁春玲, 等. 白芍总苷对膜性肾病大鼠肾脏保护作用及自噬的影响[J]. 中药新药与临床药理, 2019, 30(9): 1025-1031. |
| [20] |
王瑞石, 刘志红. 膜性肾病的发病机制[J]. 肾脏病与透析肾移植杂志, 2006, 15(2): 161-166. |
| [21] |
WANG J Y, LIU Y, WANG Y Q, et al. The cross-link between ferroptosis and kidney diseases[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 6654887. |
| [22] |
YU C W, CHEN H, DU D H, et al. β-Glucan from saccharomyces cerevisiae alleviates oxidative stress in LPS-stimulated RAW264.7 cells via Dectin-1/Nrf2/HO-1 signaling pathway[J]. Cell Stress&Chaperones, 2021, 26(4): 629-637. |
| [23] |
HWANG I, LEE J, HUH J Y, et al. Catalase deficiency accelerates diabetic renal injury through peroxisomal dysfunction[J]. Diabetes, 2012, 61(3): 728-738. |
2. Hebei Hospital of Traditional Chinese Medicine, Shijiazhuang 050011, China;
3. Fourth Hospital of Hebei Medical University, Shijiazhuang 050000, China;
4. Second Hospital of Hebei Medical University, Shijiazhuang 050000, China
 2024, Vol. 41
2024, Vol. 41