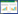文章信息
- 周芳芳, 刘宇, 马双玲, 等.
- ZHOU Fangfang, LIU Yu, MA Shuangling, et al.
- 黄精多糖对妊娠期高血压模型大鼠胎盘组织TGF-β/Smad信号通路的作用研究
- Study on the effect of polygonatum polysaccharides on the TGF-β/Smad signal pathway in placental tissue of pregnancy induced hypertension rats
- 天津中医药, 2024, 41(7): 929-934
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 929-934
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.21
-
文章历史
- 收稿日期: 2024-01-31
妊娠期高血压是一种发生于妊娠20周后,以高血压、蛋白尿为主要症状并伴有多脏器损害的妊娠期特有疾病[1]。目前妊娠期高血压发病机制尚不完全明确,且治疗仍存在较大局限性,故深入探究妊娠期高血压发病机制,探寻新的药物靶点和开发有效安全的治疗药物意义重大。胎盘在胎儿生长发育中起关键作用,其功能异常是妊娠期高血压的主要原因,其中胎盘血管新生障碍、屏障功能受损等均可影响胎盘绒毛完整性、通透性,进一步影响胎儿的发育[2]。紧密连接蛋白-1(ZO-1)、封闭蛋白(OCLN)和血管内皮生长因子(VEGF)都与血管生成有关,ZO-1的改变与细胞通透性的增加有关,OCLN是血管内皮细胞上的一个跨膜蛋白,参与维持内皮细胞的紧密连接和屏障功能,在血管生成过程中,OCLN可以作为血管内皮细胞增殖和迁移的调节因子,参与新生血管的形成;VEGF是一种能促进血管内皮生长的因子,它可以诱导已有血管的再生或者心血管的生长,因此是胚胎发育和血管修复的关键。转化生长因子-β(TGF-β)/Smad信号通路参与高血压、胎儿发育不良、炎症反应和血管生成障碍等病理进程[3]。因而推测,TGF-β/Smad信号通路可能是妊娠期高血压的一个潜在治疗靶点。
近年来,中药提取物及其单体因多靶点、安全、有效等优势在妊娠期高血压治疗中逐渐受到关注。中医学认为高血压的病因病机为本虚标实:虚以肝、脾、肾功能亏虚为主,实多与肝阳上亢、痰瘀痹阻有关。黄精是一味常用中药,有补气养阴、润肺、益肾、健脾的功效;现代药理研究表明,黄精具有同时降血脂、降血糖、降血压等作用,且其功效持久,温和安全。但黄精多糖对妊娠期高血压的防治作用及机制尚未见报道。此外,据报道,TGF-β是黄精多糖发挥生物学活性的重要靶点,黄精多糖可通过调节TGF-β、VEGF等因子表达缓解糖尿病大鼠视网膜血管异常,减轻视网膜损伤[4]。基于此,本研究旨在探究黄精多糖对妊娠期高血压模型大鼠TGF-β/Smad信号通路及胎盘功能的影响,以期为妊娠期高血压的防治提供新药物选择。
1 材料与方法 1.1 实验动物SPF级健康SD大鼠(雄性35只、雌性70只),7~8周龄,体质量230~280 g,购自河南省郑州市惠济区华兴实验动物养殖场,生产许可证号SCXK(豫)2019-0002。所有大鼠在温度23~25 ℃、相对湿度50%~60%、光/暗循环周期12 h、自由摄食和饮水的环境下统一饲养。适应性饲养7 d后大鼠以雌性∶雄性=2∶1合笼饲养,次日清晨阴道涂片检查雌性大鼠中是否存在精子,若存在精子则表明受孕成功,并记为受孕第0天。所有动物实验程序均严格按照中华人民共和国科学技术部颁布的《实验动物管理条例》执行,一切努力都是为了减少动物的痛苦。本研究经新乡市中心医院动物实验伦理委员会审核批准(审批号ZZU-LAC20220616)。
1.2 药物、试剂与仪器L-精氨酸甲酯、黄精多糖,上海源叶生物科技有限公司;硫酸镁注射液,河北天成药业股份有限公司;考马斯亮蓝,上海雅吉生物科技有限公司;苏木素-伊红(HE)染色试剂盒,北京solarbio公司;白介素(IL)-6、IL-10、肿瘤坏死因子-α(TNF-α)酶联免疫吸附实验(ELISA)试剂盒,湖北武汉elabscience公司;兔源一抗ZO-1、VEGF、p-Smad3,美国Invitroge公司;兔源一抗OCLN、TGF-β1、Smad3、三磷酸-甘油醛-3-磷酸脱氢酶(GAPDH)和二抗辣根过氧化物酶(HRP)标记羊抗兔IgG,英国Abcam公司。动物无创血压仪,美国IITC公司;iMark酶标,伯乐生命医学产品(上海)有限公司;Nikon Eclipse Ci生物显微镜,日本Nikon公司;DYCZ-24DN双垂直电泳仪、WD-9413C凝胶成像分析系统,北京六一仪器厂。
1.3 实验方法 1.3.1 动物分组、造模及给药受孕成功的60只雌性大鼠随机分为对照组、模型组、黄精多糖(低、中、高)剂量组和硫酸镁组,每组10只。除对照组外,其余组大鼠从受孕第13天起,连续4 d皮下注射125 mg/kg L-精氨酸甲酯(1次/d)构建妊娠期高血压模型[5]。对照组同时间皮下注射等量的生理盐水。于受孕第13、16天检测大鼠尾静脉收缩压(即血压),若血压增加20 mmHg(1 mmHg≈0.133 kPa,下同)且高于115 mmHg,则提示妊娠期高血压大鼠模型构建成功。于受孕第17天,黄精多糖(低、中、高)剂量组大鼠分别灌胃100、200、400 mg/kg黄精多糖[6];硫酸镁组大鼠尾部肌肉注射100 mg/kg硫酸镁注射液[7];对照组、模型组大鼠灌胃和尾部肌肉注射等量生理盐水,连续4 d,1次/d。
1.3.2 血压、24 h蛋白尿检测于受孕第20天末次给药6 h后,使用代谢笼收集大鼠24 h尿液,考马斯亮蓝检测24 h尿蛋白。于受孕第21天,采用动物无创血压仪测定血压。
1.3.3 胎鼠体质量、胎盘质量检测血压测定结束后立即进行剖宫术,小心取出胎鼠,并称量胎鼠体质量;同时取出胎盘,称质量。
1.3.4 胎盘组织病理学检测胎盘称质量后部分胎盘组织使用4%多聚甲醛固定,部分组织剪碎制备新鲜组织匀浆液,剩余组织保存于-80 ℃冰箱。将4%多聚甲醛固定24 h后的胎盘组织制备成4 μm厚的石蜡切片,参照HE试剂盒说明进行苏木素和伊红染色,使用光学显微镜观察胎盘组织病理学变化。
1.3.5 胎盘组织炎症因子检测胎盘组织匀浆液3000 r/min离心15 min(离心半径10 cm),获取上清液,BCA法检测蛋白浓度,参照各自试剂盒说明,通过ELISA法检测IL-6、IL-10、TNF-α含量。
1.3.6 Western Blot-80 ℃冰箱保存的胎盘组织使用裂解液充分裂解,12 000 r/min离心5 min(离心半径10 cm),获取总蛋白,BCA法检测蛋白浓度。SDS-PAGE分离等量变性蛋白,并电转移至PVDF膜,5% BSA封闭膜1.5 h,膜分别与对应的一抗(ZO-1、OCLN、VEGF、TGF-β1、p-Smad3、Smad3、GAPDH,1∶1 000)4 ℃孵育过夜,与二抗(HRP标记羊抗兔IgG,1∶5 000)室温孵育1 h,ECL试剂显色。Image J软件分析蛋白条带灰度(以待测蛋白与内参蛋白GAPDH的灰度值比值表示待测蛋白表达)。
1.4 统计学方法SPSS 25.0软件统计分析实验数据,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步组间两两比较采用SNK-q法。P<05表示差异具有统计学意义。
2 结果 2.1 黄精多糖对妊娠期高血压模型大鼠血压、24 h尿蛋白的影响与对照组比较,模型组大鼠血压、24 h尿蛋白显著升高(P<05)。与模型组比较,黄精多糖低、中、高剂量组和硫酸镁组大鼠血压、24 h尿蛋白显著降低(P<05);硫酸镁组与黄精多糖高剂量组大鼠血压、24 h尿蛋白水平差异无统计学意义(P>0.05)。见表 1。该结果表明黄精多糖可缓解妊娠期高血压模型大鼠高血压、蛋白尿症状,与阳性药物硫酸镁作用效果相似。
|
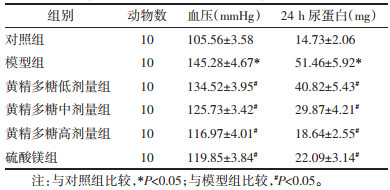
与对照组比较,模型组大鼠胎鼠体质量、胎盘质量显著降低(P<05)。与模型组比较,黄精多糖低、中、高剂量组和硫酸镁组大鼠胎鼠体质量、胎盘质量显著升高(P<05);硫酸镁组与黄精多糖高剂量组大鼠胎鼠体质量、胎盘质量差异无统计学意义(P>0.05)。见表 2。该结果表明黄精多糖可促进妊娠期高血压模型大鼠胎盘和胎鼠生长发育,与阳性药物硫酸镁作用效果相似。
|
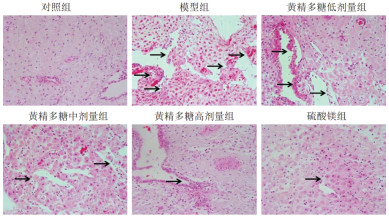
对照组大鼠胎盘组织结构和形态正常。与对照组比较,模型组大鼠胎盘组织结构萎缩、绒毛数目偏少。与模型组比较,黄精多糖低、中、高剂量组和硫酸镁组大鼠胎盘组织结构萎缩减轻、绒毛数目增多,且黄精多糖低、中、高剂量组大鼠胎盘组织病理损伤程度依次减轻,硫酸镁组与黄精多糖高剂量组大鼠胎盘组织病理损伤程度接近。见图 1。该结果表明黄精多糖可减轻妊娠期高血压模型大鼠胎盘组织病理学损伤,与阳性药物硫酸镁作用效果相似。
|
| 注:箭头表示胎盘组织结构萎缩、绒毛数目减少。 图 1 各组大鼠胎盘组织病理学情况(HE,×400) Fig. 1 Placenta histopathology of rats in each group (HE, ×400) |
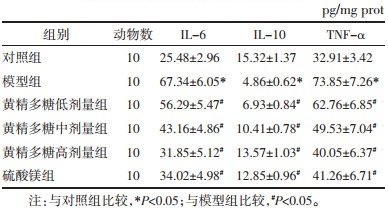
与对照组比较,模型组大鼠胎盘组织IL-6、TNF-α含量显著升高,IL-10含量显著降低(P<05)。与模型组比较,黄精多糖低、中、高剂量组和硫酸镁组大鼠胎盘组织IL-6、TNF-α含量显著降低,IL-10含量显著升高(P<05);硫酸镁组与黄精多糖高剂量组大鼠胎盘组织IL-6、IL-10、TNF-α含量差异无统计学意义(P>0.05)。见表 3。该结果表明黄精多糖可降低妊娠期高血压模型大鼠胎盘组织炎性因子IL-6、TNF-α含量,升高抗炎因子IL-10含量,减轻炎症反应,与阳性药物硫酸镁作用效果相似。
|
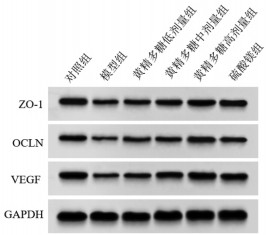
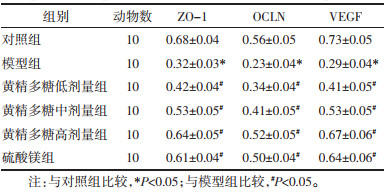
与对照组比较,模型组大鼠胎盘组织ZO-1、OCLN、VEGF蛋白表达显著降低(P<05)。与模型组比较,黄精多糖低、中、高剂量组和硫酸镁组大鼠胎盘组织ZO-1、OCLN、VEGF蛋白表达显著升高(P<05);硫酸镁组与黄精多糖高剂量组大鼠胎盘组织ZO-1、OCLN、VEGF蛋白表达差异无统计学意义(P>0.05)。见图 2、表 4。该结果表明黄精多糖可升高妊娠期高血压模型大鼠胎盘组织ZO-1、OCLN、VEGF蛋白表达,促进妊娠期高血压模型大鼠胎盘组织血管生成,改善胎盘屏障功能障碍,与阳性药物硫酸镁作用效果相似。
|
| 图 2 各组大鼠胎盘组织ZO-1、OCLN、VEGF蛋白表达 Fig. 2 ZO-1, OCLN, and VEGF protein maps of placental tissue of rats in each group |
|
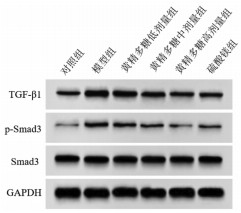
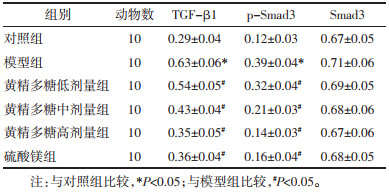
与对照组比较,模型组大鼠胎盘组织TGF-β1、p-Smad3蛋白表达显著升高(P<05)。与模型组比较,黄精多糖低、中、高剂量组和硫酸镁组大鼠胎盘组织TGF-β1、p-Smad3蛋白表达显著降低(P<05);硫酸镁组与黄精多糖高剂量组大鼠胎盘组织TGF-β1、p-Smad3蛋白表达差异无统计学意义(P>0.05)。见图 3、表 5。该结果表明黄精多糖可抑制妊娠期高血压模型大鼠胎盘组织TGF-β/Smad信号通路激活,与阳性药物硫酸镁作用效果相似。
|
| 图 3 各组大鼠胎盘组织TGF-β1、p-Smad3、Smad3蛋白表达 Fig. 3 Expression maps of TGF-1β, p-Smad3, and Smad3 proteins in placental tissue of rats in each group |
|
胎盘是妊娠期母体与胎儿接触的重要器官,胎儿在子宫内发育靠胎盘从母体取得营养以维持正常妊娠;妊娠高血压会导致母体全身小动脉痉挛,胎盘血管痉挛、变细,影响胎盘灌注引起供氧不足,从而导致胎盘功能下降;目前,妊娠期高血压疾病仍然是全世界妊娠相关孕产妇和围产儿不良结局的主要原因之一,降低血压是药物的首要治疗目标[8]。硫酸镁是妊娠期高血压临床治疗的一线药物,尽管疗效显著,但存在一定不良反应[9]。因此,仍十分有必要探究妊娠期高血压的新型治疗药物。研究表明,中药复方或单体治疗妊娠期高血压可能具有一定疗效[10-11]。黄精作为中国重要的药食同源中药材,可补气养阴、润肺、益肾、健脾,其多糖、皂苷等化学成分具有抗炎、抗氧化应激、抗肿瘤、调节血糖血脂等多种药理活性,且以黄精多糖的药理作用报道较多[12]。已有研究初步表明黄精多糖具有一定的降血压作用,但黄精多糖在妊娠期高血压中的作用及机制尚未可知。
静脉注射L-精氨酸甲酯可建立大鼠妊娠期高血压模型,该造模方法简单、成功率高、大鼠死亡率低[7]。据报道,黄精多糖可降低糖尿病肾病大鼠24 h尿蛋白水平[13]。本研究通过皮下注射L-精氨酸甲酯构建了妊娠期高血压模型,结果显示,模型组大鼠血压、24 h尿蛋白较对照组升高,表明妊娠期高血压模型构建成功。而不同剂量黄精多糖治疗后妊娠期高血压模型大鼠血压、24 h尿蛋白均有所降低,且呈一定的剂量依赖性,表明黄精多糖可缓解高血压、蛋白尿症状,与阳性药物硫酸镁作用效果相似。进一步分析发现,黄精多糖可升高妊娠期高血压模型大鼠胎鼠体质量、胎盘质量,并减轻胎盘组织结构萎缩,使绒毛数目增多。表明黄精多糖能够减轻妊娠期高血压模型大鼠胎盘组织病理学损伤,促进胎盘和胎鼠生长发育。以上研究结果说明,黄精多糖作为黄精中含量最高且药理作用广泛的一种化合物[14],可能是治疗妊娠期高血压的潜在药物。
胎盘可通过胎盘屏障功能对胎儿发挥保护作用,但当胎盘屏障功能发生障碍时,表达于胎盘滋养层细胞和内皮细胞中的紧密连接蛋白ZO-1、OCLN以及血管生成相关因子VEGF等合成异常,使血管重塑受损,胎盘生长发育受到影响,进而导致胎儿不良结局[15]。此外,妊娠期高血压发生时,胎盘缺氧缺血可刺激促炎细胞因子(IL-6、TNF-α等)的合成与释放,并抑制抑炎细胞因子(IL-10等)表达[16]。本研究结果显示,模型组大鼠胎盘组织中ZO-1、OCLN、VEGF蛋白表达和IL-10含量较对照组显著降低,IL-6、TNF-α含量较对照组升高,表明妊娠期高血压模型大鼠胎盘组织血管新生异常,存在胎盘屏障功能障碍和炎症反应。据报道,黄精多糖可调节高脂饮食大鼠肠组织中ZO-1、OCLN蛋白表达促进肠道通透性屏障的恢复并减轻炎症反应[17],通过促进VEGF等表达利于胫骨骨折模型大鼠骨折愈合[18]。本研究中,给予不同剂量黄精多糖治疗后,妊娠期高血压模型大鼠胎盘组织中ZO-1、OCLN、VEGF蛋白表达和IL-10含量均显著升高,同时IL-6、TNF-α含量显著降低,提示黄精多糖可能通过升高ZO-1、OCLN、VEGF、IL-10表达并降低IL-6、TNF-α表达,促进妊娠期高血压模型大鼠胎盘组织血管生成,改善胎盘屏障功能障碍,减轻炎症反应。
TGF-β1是一种具有多种功能的细胞因子,与妊娠期高血压的发生密切相关[19]。Smad家族是介导TGF-β信号从胞质进入核内的重要分子,其中Smad3是TGF-β1的关键下游调节因子,Smad3磷酸化激活后可进一步调节靶基因表达,进而影响胎盘中滋养层细胞的生物学功能,调控胎盘发育[20]。据报道,抑制TGF-β1/Smad3信号通路的激活可上调ZO-1和OCLN的表达[21];且增加Smad3的磷酸化可抑制VEGF的表达[22]。本研究结果显示,模型组大鼠胎盘组织中TGF-β1、p-Smad3蛋白表达较对照组显著升高,表明TGF-β/Smad信号通路参与妊娠期高血压发病过程,与LI等[3]研究结果具相似性。而经不同剂量黄精多糖治疗后妊娠期高血压模型大鼠胎盘组织中TGF-β1、p-Smad3蛋白表达显著降低,提示黄精多糖改善妊娠期高血压模型大鼠胎盘屏障功能障碍、降血压等作用,可能与抑制胎盘中TGF-β/Smad信号通路激活有关。
综上所述,黄精多糖可抑制妊娠期高血压模型大鼠胎盘中TGF-β/Smad信号通路激活,减轻炎症反应,促进血管生成,改善胎盘屏障功能障碍,降低血压和蛋白尿,从而有利于胎盘和胎鼠生长发育。本研究为黄精多糖应用于妊娠期高血压治疗提供了实验依据,但本研究观察指标有限,且未特异性干预通路等,仍有待后续进一步完善,从而增加说服力。
| [1] |
GAROVIC V D, DECHEND R, EASTERLING T, et al. Hypertension in pregnancy: diagnosis, blood pressure goals, and pharmacotherapy: a scientific statement from the American heart association[J]. Hypertension, 2022, 79(2): e21-e41. |
| [2] |
IVES C W, SINKEY R, RAJAPREYAR I, et al. Preeclampsia-pathophysiology and clinical presentations: JACC state-of-the-art review[J]. Journal of the American College of Cardiology, 2020, 76(14): 1690-1702. DOI:10.1016/j.jacc.2020.08.014 |
| [3] |
LI J Y, JIN Y, CAO Y M, et al. MiR-140-5p exerts a protective function in pregnancy-induced hypertension via mediating TGF-β/Smad signaling pathway[J]. Hypertension in Pregnancy, 2022, 41(2): 116-125. DOI:10.1080/10641955.2022.2056195 |
| [4] |
WANG Y, LAN C J, LIAO X, et al. Polygonatum sibiricum polysaccharide potentially attenuates diabetic retinal injury in a diabetic rat model[J]. Journal of Diabetes Investigation, 2019, 10(4): 915-924. DOI:10.1111/jdi.12976 |
| [5] |
陈丽敏, 汪佳佳, 金苏菊. 丹参素对妊娠高血压大鼠妊娠结局的影响[J]. 中国临床药理学杂志, 2021, 37(8): 977-980. |
| [6] |
ZHU X Y, WU W, CHEN X Y, et al. Protective effects of Polygonatum sibiricum polysaccharide on acute heart failure in rats 1[J]. Acta Cirurgica Brasileira, 2018, 33(10): 868-878. DOI:10.1590/s0102-865020180100000001 |
| [7] |
刘莎莎, 孙国强, 吴利荣. 丹参素治疗妊娠期高血压大鼠效果及机制探讨[J]. 山东医药, 2021, 61(8): 46-50. |
| [8] |
SINKEY R G, BATTARBEE A N, BELLO N A, et al. Prevention, diagnosis, and management of hypertensive disorders of pregnancy: a comparison of international guidelines[J]. Current Hypertension Reports, 2020, 22(9): 66. DOI:10.1007/s11906-020-01082-w |
| [9] |
CHANG R X, MIAO H, CUI A L, et al. Clinical effect of nimodipine combined with magnesium sulfate on pregnancy-induced hypertension syndrome[J]. Journal of Healthcare Engineering, 2022, 2022: 7217543. |
| [10] |
谷少华, 刘巧方, 李向南. 杞菊地黄丸对肝肾阴虚证型妊娠期高血压疾病血清因子水平的影响及机制探究[J]. 中华中医药学刊, 2021, 39(2): 248-251, 290. |
| [11] |
关琦, 张化莲, 张珊珊, 等. 竹节参总皂苷对妊娠期高血压胎盘滋养细胞氧化应激损伤与过度自噬的影响[J]. 中草药, 2021, 52(14): 4255-4261. DOI:10.7501/j.issn.0253-2670.2021.14.017 |
| [12] |
陈宇, 周芸湄, 李丹, 等. 黄精的现代药理作用研究进展[J]. 中药材, 2021, 44(1): 240-244. |
| [13] |
刘赫, 李函舟, 张辉, 等. 黄精多糖对糖尿病肾病大鼠铁死亡的影响[J]. 中国中医药信息杂志, 2023, 30(8): 126-130. |
| [14] |
周忠光, 宫铭海, 王晓慧, 等. 黄精多糖药理作用及机制研究进展[J]. 辽宁中医药大学学报, 2021, 23(12): 1-4. |
| [15] |
ZHANG Y, ZHAO H J, XIA X R, et al. Hypoxia-induced and HIF1α-VEGF-mediated tight junction dysfunction in choriocarcinoma cells: implications for preeclampsia[J]. Clinica Chimica Acta, 2019, 489: 203-211. DOI:10.1016/j.cca.2017.12.010 |
| [16] |
DUAN B D, LI Y, GENG H, et al. Naringenin prevents pregnancy-induced hypertension via suppression of JAK/STAT3 signalling pathway in mice[J]. International Journal of Clinical Practice, 2021, 75(10): e14509. |
| [17] |
GU W, WANG Y F, ZENG L X, et al. Polysaccharides from Polygonatum kingianum improve glucose and lipid metabolism in rats fed a high fat diet[J]. Biomedecine&Pharmacotherapie, 2020, 125: 109910. |
| [18] |
王一飞, 薛锋. 黄精多糖对胫骨骨折大鼠骨折愈合的作用机制[J]. 中国老年学杂志, 2021, 41(17): 3803-3807. |
| [19] |
QU H M, KHALIL R A. Vascular mechanisms and molecular targets in hypertensive pregnancy and preeclampsia[J]. American Journal of Physiology Heart and Circulatory Physiology, 2020, 319(3): H661-H681. |
| [20] |
BRKIĆ J, DUNK C, SHAN Y N, et al. Differential role of Smad2 and Smad3 in the acquisition of an endovascular trophoblast-like phenotype and preeclampsia[J]. Frontiers in Endocrinology, 2020, 11: 436. |
| [21] |
ZHOU Y, HUANG F Y, LIU Y, et al. TGF-β1 relieves epithelial-mesenchymal transition reduction in hypospadias induced by DEHP in rats[J]. Pediatric Research, 2020, 87(4): 639-646. |
| [22] |
LI X M, LI X L, LV X H, et al. Smad4 inhibits VEGF-A and VEGF-C expressions via enhancing Smad3 phosphorylation in colon cancer[J]. Anatomical Record, 2017, 300(9): 1560-1569. |
 2024, Vol. 41
2024, Vol. 41