文章信息
- 于丽, 苗蓓亮, 刘学焕, 等.
- YU Li, MIAO Beiliang, LIU Xuehuan, et al.
- 微生物-肠-脑轴视域下认知障碍的发病机制及中医药治疗进展
- Exploring the pathogenesis of cognitive impairment from the perspective of microbiota-gut-brain axis and advances in traditional Chinese medicine treatment
- 天津中医药, 2024, 41(7): 945-952
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 945-952
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.24
-
文章历史
- 收稿日期: 2024-01-28
2. 南开大学人民医院, 天津 300121;
3. 南开大学附属第四中心医院, 天津 300140
认知障碍是一种以获得性认知功能损害为核心,主要表现为不同程度的记忆、理解、判断及视觉空间能力等损害,影响患者正常日常生活、社会交往和工作能力的综合征[1]。随着人口老龄化的日益加剧,认知障碍发病率也逐年上升。一项全国性横断面调查发现,全国老年人群认知障碍患病率高达22.24%[2]。相关Meta分析,纳入了53项研究,123 766例受试者,结果表明中国老年人轻度认知功能障碍的总患病率为15.4%[3]。提示认知障碍已成为影响老年人群健康的常见精神类疾病[4]。其中神经退行性改变导致的阿尔茨海默病(AD),脑血管疾病导致的血管性认知障碍(VCI)及帕金森病痴呆(PDD)为最常见的认知障碍类疾病。目前防治手段主要包括控制生活方式、危险因素及应用胆碱酯酶抑制剂和NMDA受体拮抗剂,但目前仍缺乏逆转此病的有效治疗方法[5]。因此,探索认知障碍受损的新机制,拓展治疗的新途径成为目前研究关注的重点。近年许多研究表明,微生物-肠-脑轴(MGBA)为认知障碍发病的重要新机制之一,为认知障碍的治疗提供了新视域[6-8]。同时,临床实践证明中医药对认知障碍具有良好的临床疗效,其机制与MGBA密切相关[9-10]。基于此,笔者拟从MGBA视域探讨认知障碍的发病机制及中医药治疗进展。
1 微生物-肠-脑轴(MGBA)19世纪40年代,William通过实验发现,情绪状态会对消化速度产生影响,提示大脑会影响肠道功能,大脑与肠道之间存在轴线交流关系[11]。大量研究进一步表明,中枢神经系统(CNS)可以通过自主神经系统(ANS)直接参与肠道功能的调节,与肠道神经系统(ENS)共同维持肠道稳态[12]。也可通过刺激下丘脑-垂体-肾上腺轴(HPAA),以促进去甲肾上腺素和促肾上腺皮质激素的释放,导致肠道微生物和肠道功能改变[13]。亦可直接刺激免疫系统释放炎症因子和细胞因子,导致肠道炎症,破坏肠道屏障通透性,引起肠道菌群紊乱[14]。同时,随后许多研究也表明,消化道状态、胃肠道功能的改变及肠屏障的受损也会引起复杂的中枢神经系统疾病[15-17]。肠道信息可通过ENS和迷走神经系统上行传递于大脑,进而影响大脑功能,参与疾病调控。HPAA也可因胃肠道病变产生的炎症因子而被激活,导致皮质醇分泌增加,进而发挥调控大脑功能[18]。由此可见,中枢神经系统可通过神经、内分泌等途径调节肠道功能、维持胃肠道稳态。肠道信息亦可通过多途径到达中枢神经系统以调控大脑功能。这种双向、复杂的相互交流信号通路被称为脑-肠轴。
许多研究表明,肠道微生物群为脑-肠轴交流中不可或缺的角色[19]。微生物可通过神经、内分泌、免疫等途径作用于CNS,调节神经的发生、发育及相关中枢神经疾病的发展。同时也可调控肠道自身的神经系统。因此,肠道微生物可通过脑-肠轴进而影响大脑及肠道的功能,导致相关疾病的产生[20]。
由上述讨论可知,MGBA是指肠道菌群、肠道与CNS通过ANS、ENS及内分泌、免疫等方式进行交流的一种双向应答交流通路系统。
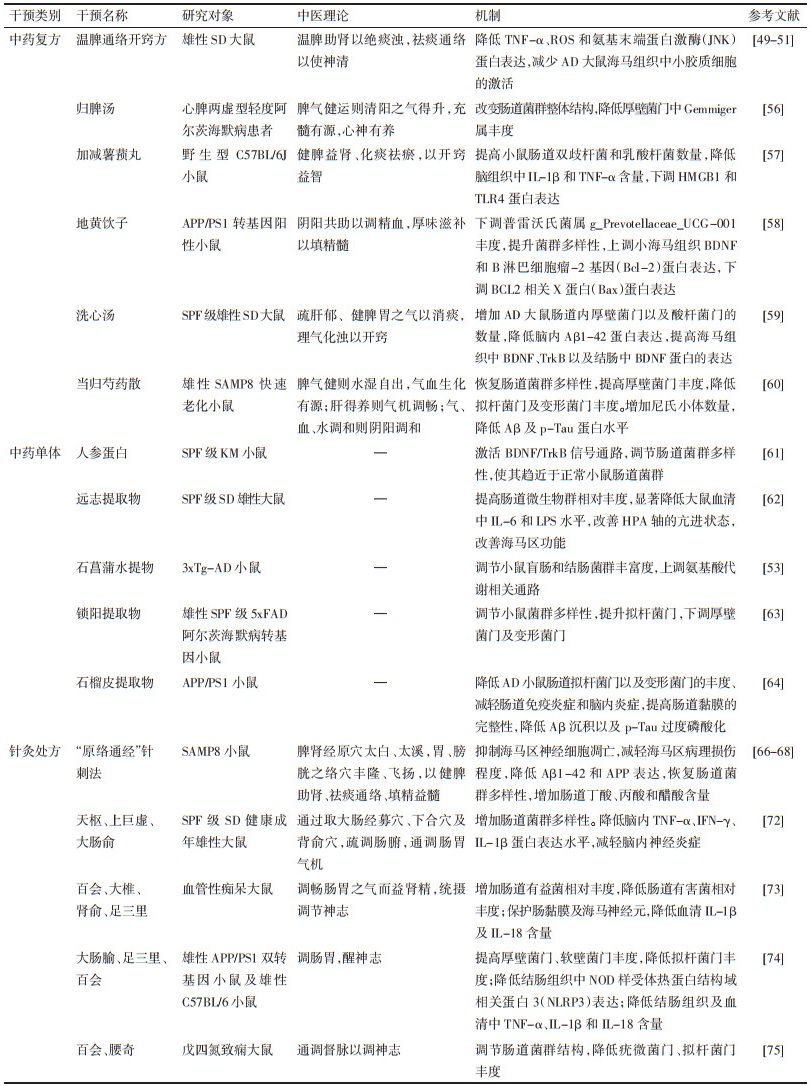
2 MGBA视域下认知障碍的发病机制许多遗传和环境因素影响了认知障碍的易感性,大脑、肠道之间的双向信息交流也会导致各种神经退行性疾病和精神疾病[21]。肠道微生物与宿主相互作用可产生大量影响机体健康的物质[22]。研究表明,胃肠道内常驻细菌的组成可直接影响大脑的认知及行为能力[23-24]。肠道微生物也可以通过神经-免疫炎症-内分泌信号通道与中枢神经系统沟通而引起认知障碍的发生[25]。可见,MGBA为认知障碍发病的重要机制之一,具体机制见图 1。
|
| 图 1 MGBA视域下认知障碍的发病机制图 Fig. 1 Pathogenesis of cognitive impairment from the perspective of MGBA |
既往研究表明,进行性记忆障碍和认知能力下降与神经炎症所致的神经元受损密切相关[26]。肠道微生物产生的细菌内毒素及代谢产物可通过MGBA影响炎症核心网络,引起中枢神经系统炎症,进而影响大脑神经元功能[27]。如肠源性脂多糖(LPS)与Toll样受体4(TLR4)受体结合,引起肠道炎症,改变肠黏膜通透性,刺激炎症因子TLR-2、白介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)产生,通过血脑屏障,活跃大脑中的常驻免疫效应细胞—小胶质细胞,促使TLRs及活性氧(ROS)增加,介导神经炎症,损伤神经元,导致AD和PDD等多种神经退行性认知障碍疾病的发生[28]。同时,Kesika等[29]研究发现,小胶质细胞的炎症性功能改变会削弱β-淀粉样蛋白的清除能力,进而加重AD的进程。Sun等[27]研究表明肠道微生物失调与TLR4/TNF-α信号通路介导的肠道炎症及神经炎症在PD发病中的重要作用。
研究发现,脑血管病变后认知障碍患者肠道微生物群生态多样性降低,其中以微生物活性代谢物短链脂肪酸(SCFA)含量下降最为显著[30]。而SCFA有利于Treg淋巴细胞转化,具有局部抗炎作用,并可影响淋巴细胞透过血脑屏障后引起的脑部免疫环境变化,进而抑制小胶质细胞的激活。卒中后由于SCFA含量降低,削弱了对小胶质细胞激活的间接抑制能力,使得小胶质细胞过度活化,导致小胶质细胞相关的炎症细胞死亡通路过度激活及促炎因子分泌增加,引发严重的脑损伤和神经炎症,进而影响神经元功能恢复[31]。因此,肠道微生物失调已成为神经退行性疾病的重要危险因素[32]。
2.2 神经途径肠道微生物群和大脑之间的神经信号交流涉及到CNS、ANS与ENS。当肠道微生物群出现失调,肠道微生物群产生的5-羟色胺(5-HT)、多巴胺、γ-氨基丁酸(GABA)等神经递质前体受到影响,神经递质前体进入血液循环并通过血脑屏障进入大脑,进一步影响CNS中神经递质的合成,导致与记忆、学习、计算等脑功能相关的神经元与胶质细胞之间信号传输异常,使患者出现不同程度的认知障碍[33]。如Bravo等[34]研究表明,鼠李糖杆菌(JB-1)可以降低海马和杏仁核中GABA B1b受体的表达,导致CNS中可利用的GABA减少,最终导致认知功能障碍。肠源性神经递质虽不能通过血脑屏障[35],但其可直接作用于ENS,通过调控胃肠道功能,影响局部神经递质及前体水平,进一步影响中枢神经系统[36]。同时,肠源性神经递质还能够通过刺激ANS中的迷走神经快速向大脑传递信号[37]。肠道菌群的失调后,神经递质对ENS及ANS的异常刺激可能会进一步影响中枢神经元,从而影响认知功能。
此外,有研究证实了迷走神经在脑-肠轴双向交流中也发挥着非常重要的作用。研究发现长期使用鼠李糖乳杆菌能明显增加小鼠的探索行为,而切断迷走神经后该现象不复存在[38]。同时,研究发现,一些肠道微生物代谢物如人型肝炎杆菌分泌的细胞外囊泡、α-突触核蛋白,可能会通过迷走神经进入大脑从而对认知功能产生影响[39-40]。
2.3 内分泌途径肠道内共有20多种内分泌细胞,是人体最大的内分泌器官。肠道微生物可通过产生或调节内分泌细胞释放相关激素与大脑沟通,进而影响机体认知功能[41-42]。研究表明,HPAA的异常与机体神经发育和脑认知功能紊乱密切相关。而肠道菌群可通过影响肾上腺皮质激素的产生影响宿主HPAA,进而影响脑部功能活动[43]。宿主微生态失调状态下,HPAA的异常激活,又会使肾上腺皮质激素的分泌进一步受到影响,肾上腺皮质激素进而作用于海马、额叶等脑功能区的神经元活动,影响认知功能[44]。实验研究也发现,补充益生菌可以减轻LPS诱导的HPAA编程[45]。
除此之外,肠道微生物也可通过直接影响其他认知相关激素的产生,如神经肽Y(NPY)、胆囊收缩素(CCK)、胰高血糖素样肽-1(GLP-1)等,通过内分泌途径作用于中枢神经系统中相关受体,进而影响认知功能[46-47]。
3 MGBA视域下的中医认识中医学中未明确提出MGBA,但很早就认识到人的思维情志活动与脾胃运化密切相关。《素问·阴阳应象大论》言脾“在志为思”,《灵枢·本神》言“脾藏营,营舍意”,即“脾主藏意”。“意”如《灵枢·本神》曰“心有所忆谓之意”,《类经·藏象类》曰“意,思忆也。谓一念之生,心有所向而未定者,曰意”。以上记载均表明,人之意念记忆等思维活动与脾密切相关。脾运化水谷精气,化生气血精微,借脾气上升,充养脑髓,是产生记忆思维活动的物质基础。脾气健运,脑髓得养,则意念记忆正常。若思虑、饮食伤脾,脾弱则伤意,而见心神不宁,健忘等病症。脑为元神之府,脑具有主宰生命活动,统摄一身精神意识,思维活动的功能。若脑的统摄能力下降,感知减退,影响脾胃的运化能力,产生腹胀、腹泻等症状。同时,脾经在口和心中与督脉相接,胃经阳气也要输注于督脉,而督脉循行络脑,由此强化了脾胃与脑的联系。手足阳明经在大椎穴、人中穴与督脉相通,督脉入通于脑,临床上这两个穴位常用于治疗神志功能相关的疾病。且大肠经左右交叉的循行与大脑神经左右交叉支配的功能也有类似之处。因此,有学者认为MGBA可以理解为中医的脾胃-经络-脑之间的联系[48]。
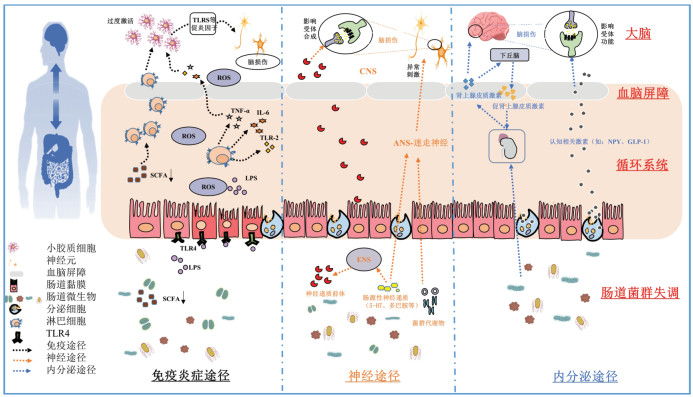
4 MGBA视域下的中医药治疗如前所述,中医药虽然未明确提出此概念,但在五脏一体的整体观指导下一直实践着此理念。中药复方、中药单体、针灸等均已被证实可通过调控肠道微生物(肠道菌群构成、多样性、丰度等)对认知障碍起到一定的防治作用,见表 1。
现阶段,对中药复方改善认知功能的作用机制进行了相关研究,部分研究聚焦于MGBA。复方治疗主要是从脾胃论治,同时兼顾其他脏腑,达到中央运,四旁健。
4.1.1 从脾胃论治吴林等[49-51]根据AD的临床表现,强调从脾胃论治,创立了温脾通络开窍方。研究发现,该方能够显著降低AD大鼠海马组织中小胶质细胞的激活及促炎因子TNF-α的表达,对老年性痴呆的临床症状有明显减轻和控制作用。同时,温脾通络开窍方中的黄芪、益智仁、何首乌、石菖蒲、绞股蓝、三七均被证实能够影响肠道微生物群的结构及种类,改善机体代谢状态[52-55]。
4.1.2 从脾心论治脾主运化,为后天之本,脾气健运则清阳之气得升,充髓有源,心神有养。姜洋等[56]观察归脾汤治疗轻度VCI疗效,通过对比患者服用归脾汤前后的肠道菌群结构发现,服药后患者肠道中厚壁菌门、拟杆菌门、变形菌门等丰度变化显著,提示调节肠道菌群是VCI治疗的重要环节。
4.1.3 从脾肾论治痴呆多发于老年人,脾胃后天失调无以养先天,则易出现肾虚而五脏亏损之象。陈延等[57]从先后天理论出发,以薯蓣丸加减治疗AD小鼠,观察其对肠道菌群及高迁移率族蛋白B1(HMGB1)炎症通路的影响。研究发现,薯蓣丸能够提升肠道双歧杆菌及乳酸杆菌的数量,降低脑组织中IL-1β和TNF-α的含量及海马组织中HMGB1、TLR4和NF-κB p65蛋白含量的表达,表明薯蓣丸可通过调节肠道菌群,抑制免疫炎症相关HMGB1通路,改善AD小鼠的认知功能。陈靖等[58]亦以先天养后天思路为指导,发现地黄饮子能够有效改善淀粉样前体蛋白(APP)/突变人早老蛋白1(PS1)转基因阳性小鼠的神经功能,调节小鼠肠道菌群结构,提升菌群多样性,抑制海马组织中神经细胞的凋亡,保护神经,改善学习和认知能力。
4.1.4 从脾肝论治脾肝密切相关,脾土虚则肝木易乘之,久之则成肝郁气滞,脾虚痰浊壅积之象。临床以疏肝健脾为思路,气畅痰除而神自清,洗心汤为代表方。王登坤等[59]研究发现,洗心汤能够显著增加AD大鼠肠道内厚壁菌门以及酸杆菌门的数量,降低脑内β淀粉样多肽1-42(Aβ1-42)蛋白表达,提高海马组织中脑源性神经营养因子(BDNF)、酪氨酸激酶受体B(TrkB)以及结肠中BDNF蛋白的表达,进而减轻海马CA1区神经损伤程度,提高大鼠的空间学习记忆能力。田小平等[60]观察当归芍药散对SAMP8小鼠的认知改善情况,发现当归芍药散能够显著降低小鼠海马组织中β淀粉样蛋白(Aβ)沉积及磷酸化微管蛋白(p-Tau)的聚集,且药物干预后小鼠肠道内厚壁菌门数量显著上调,而拟杆菌和变形菌门丰度显著下调,而肠道菌群的改变趋势与Aβ以及p-Tau的表达存在相关性,证实了MGBA是当归芍药散改善认知功能的机制之一。
4.2 中药单体目前主要对临床常用的益气化痰中药有效成分进行了相关筛选,开展了相关中药单体的现代药理研究。如益气中药人参提取物人参蛋白能够通过MGBA改善认知障碍小鼠的空间学习记忆能力。人参蛋白能够使菌群丰度趋近于正常小鼠,激活BDNF通路,提高BDNF蛋白表达[61]。远志和石菖蒲是豁痰开窍常用中药。现代药理研究表明,远志提取物能够改善大鼠肠道微生物群结构,提高肠道微生物群相对丰度,显著降低大鼠血清中IL-6和LPS水平,降低HPAA的亢进状态,改善海马区功能[62]。石菖蒲水提物能够提高痴呆小鼠的认知能力,提高AD小鼠结肠与盲肠中微生物群的物种丰度,改善肠道微生物群的组成和结构[53]。李鑫洁等[63]发现锁阳乙酸乙酯提取物可以提高阿尔茨海默病小鼠菌群的多样性,影响肠道厚壁杆菌及拟杆菌数量,对大鼠记忆学习能力有明显改善。石榴皮提取物安石榴苷也被发现能够降低AD模型小鼠肠道拟杆菌门及变形菌门的丰度,减轻肠道免疫炎症,提高肠道黏膜的完整性,同时减少中枢神经炎症反应,降低Aβ蛋白沉积以及p-Tau蛋白的过度磷酸化[64]。以上研究结果均表明,中药单体可通过调节肠道微生物群的种类及丰度,调控MGBA的免疫炎症、神经及内分泌途径,进而改善认知功能。
4.3 针灸治疗认知障碍虽病位在脑,但脑髓发育不仅依赖于先天精气之充养,更依赖于后天水谷精微濡养。如《灵枢·五癃津液别》言“五谷之津液……内渗入于骨空,滋补脑髓”,阐述了脾胃与脑髓的生理联系,为MGBA的选穴组方提供了基础。同时现代研究也证实,针灸能够有效的调控肠道菌群,为认知障碍的临床组方更提供了重要的借鉴[65]。如前所述,微生物-肠-脑轴可以理解为中医的脾胃-经络-脑之间的关系,针灸治疗更契合该理论。
4.3.1 脾肾-督脉-脑史珊怡等[66]采用原络配伍法制定了“原络通经”针法,选取脾肾原穴太白、太溪,胃膀胱之络穴丰隆、飞扬,以健脾益肾、填精益髓,能够有效改善患者认知功能。动物实验表明,“原络通经”针法能够有效恢复痴呆大鼠的肠道微生物群多样性,增加肠道SCFA含量,改善其学习记忆能力[67-68]。
4.3.2 脾胃-阳明经-脑大肠经募穴、下合穴及背俞穴是治疗肠道功能失调,调畅肠道气机之效穴。许多研究证明,这些腧穴能够增加肠道菌群的多样性,改善胃肠道症状[69-71]。郑之俊等[72]通过观察针刺PD模型大鼠天枢、上巨虚及大肠俞后大鼠脑内炎症因子的变化趋势,探讨针刺基于MGBA发挥作用的潜在机制。研究发现,针刺后PD模型大鼠脑内TNF-α、干扰素-γ(IFN-γ)、白介素-1β(IL-1β)蛋白表达水平明显下降,证实针刺能够通过调节MGBA的免疫通路,减轻脑内神经炎症,从而对PD的发生发展起到缓解作用。
4.3.3 阳明经-督脉-脑陈丹凤等[73]对比基础针刺(百会、大椎、肾俞)与加刺足三里穴的脑肠共治对VCI的疗效差异。结果发现脑肠共治可通过调节肠道微生态环境,进而减轻神经炎症,保护神经元,改善认知功能。廖冬梅等[74]通过电针干预APP/PS1双转基因小鼠大肠俞、足三里及百会穴,观察小鼠的认知功能改善情况。经电针干预后,小鼠认知能力得到显著改善,结肠组织及血清中炎症因子TNF-α、IL-1β和IL-18含量显著降低,进行菌群多样性分析发现,电针干预后小鼠肠道菌群多样性明显升高,认知功能相关的乳杆菌、双歧杆菌丰度升高,且肠道炎症相关的厚壁菌门和拟杆菌门比值(F/B)得到一定程度的提高,提示电针可以通过调控菌群丰度降低肠源性免疫炎症反应,从而提高认知功能。
4.3.4 其他文立杨等[75]通过电针癫痫大鼠的百会及腰奇。研究结果发现,电针百会及腰奇穴不仅具有抗痫效果,同时具有改善癫痫大鼠认知功能的作用,进一步研究发现针刺后大鼠肠道内厚壁菌门和变形菌门丰度显著高于对照组,认为针刺治疗可能是通过恢复肠道菌群平衡改善癫痫大鼠的学习和记忆能力。
5 小结与展望综上所述,MGBA可通过免疫炎症、神经及内分泌途径影响认知障碍的发生发展。同时,相关中药复方、中药单体及针灸治疗手段可通过调节MGBA改善认知功能,为中医药治疗认知障碍提供了较好的现代阐释。
但目前也存在一些问题。如MGBA的相关生物标志与不同认知障碍类疾病严重程度的关系;不同复方疗程、不同针刺手法及选穴对MGBA的影响等。同时,目前已有的研究大多局限于免疫炎症通路的机制探讨,关于神经途径及内分泌途径的研究开展相对较少。且目前关于免疫炎症通路研究中,MGBA的因果关系不能得到很好的体现与验证。期待未来进一步完善研究方法,更细致地阐释MGBA在认知障碍中的发病机制,更好的揭示中医药治疗认知障碍的具体机制,以便为认知障碍的逆转提供中国方案。
| [1] |
PÉREZ PALMER N, TREJO ORTEGA B, JOSHI P. Cognitive impairment in older adults: Epidemiology, diagnosis, and treatment[J]. The Psychiatric Clinics of North America, 2022, 45(4): 639-661. DOI:10.1016/j.psc.2022.07.010 |
| [2] |
QIN F, LUO M, XIONG Y, et al. Prevalence and associated factors of cognitive impairment among the elderly population: A nationwide cross-sectional study in China[J]. Frontiers in Public Health, 2022, 10: 1032666. DOI:10.3389/fpubh.2022.1032666 |
| [3] |
DENG Y, ZHAO S Q, CHENG G W, et al. The prevalence of mild cognitive impairment among Chinese people: A meta-analysis[J]. Neuroepidemiology, 2021, 55(2): 79-91. DOI:10.1159/000512597 |
| [4] |
赵明, 戚立权, 董明英. 中老年人无认知障碍预期寿命研究[J]. 中国人口科学, 2023, 37(2): 52-67. |
| [5] |
LANGA K M, LEVINE D A. The diagnosis and management of mild cognitive impairment: A clinical review[J]. JAMA, 2014, 312(23): 2551-2561. DOI:10.1001/jama.2014.13806 |
| [6] |
SHI H L, GE X, MA X, et al. A fiber-deprived diet causes cognitive impairment and hippocampal microglia-mediated synaptic loss through the gut microbiota and metabolites[J]. Microbiome, 2021, 9(1): 223. DOI:10.1186/s40168-021-01172-0 |
| [7] |
CHEN C, LIAO J M, XIA Y Y, et al. Gut microbiota regulate Alzheimer's disease pathologies and cognitive disorders via PUFA-associated neuroinflammation[J]. Gut, 2022, 71(11): 2233-2252. DOI:10.1136/gutjnl-2021-326269 |
| [8] |
沈馨, 孙志宏. 微生物-肠-脑轴与神经系统疾病的研究进展[J]. 生物工程学报, 2021, 37(11): 3781-3788. |
| [9] |
张卫佳, 赵宁宁, 师冉. 基于数据挖掘及网络药理学探讨中医药治疗卒中后认知障碍的用药规律[J]. 中医药导报, 2023, 29(3): 167-174. |
| [10] |
肖梦露, 张娟娟, 王莹, 等. 中医药治疗轻度认知障碍的系统评价再评价[J]. 世界科学技术-中医药现代化, 2022, 24(10): 3979-3986. |
| [11] |
BROWNING K N, TRAVAGLI R A. Central nervous system control of gastrointestinal motility and secretion and modulation of gastrointestinal functions[J]. Comprehensive Physiology, 2014, 4(4): 1339-1368. |
| [12] |
CRYAN J F, O'RIORDAN K J, COWAN C S M, et al. The microbiota-gut-brain axis[J]. Physiological Reviews, 2019, 99(4): 1877-2013. DOI:10.1152/physrev.00018.2018 |
| [13] |
BERMÚDEZ-HUMARÁN L G, SALINAS E, ORTIZ G G, et al. From probiotics to psychobiotics: Live beneficial bacteria which act on the brain-gut axis[J]. Nutrients, 2019, 11(4): 890. DOI:10.3390/nu11040890 |
| [14] |
DOROSZKIEWICZ J, GROBLEWSKA M, MROCZKO B. The role of gut microbiota and gut-brain interplay in selected diseases of the central nervous system[J]. International Journal of Molecular Sciences, 2021, 22(18): 10028. DOI:10.3390/ijms221810028 |
| [15] |
EL-HAKIM Y, BAKE S, MANI K K, et al. Impact of intestinal disorders on central and peripheral nervous system diseases[J]. Neurobiology of Disease, 2022, 165: 105627. DOI:10.1016/j.nbd.2022.105627 |
| [16] |
MA Q Q, XING C S, LONG W Y, et al. Impact of microbiota on central nervous system and neurological diseases: The gut-brain axis[J]. Journal of Neuroinflammation, 2019, 16(1): 53. DOI:10.1186/s12974-019-1434-3 |
| [17] |
PELLEGRINI C, FORNAI M, D'ANTONGIOVANNI V, et al. The intestinal barrier in disorders of the central nervous system[J]. The Lancet Gastroenterology&Hepatology, 2023, 8(1): 66-80. |
| [18] |
刘兰香, 王海洋, 谢鹏. 肠道微生物紊乱诱导抑郁的肠-脑分子机制研究[J]. 重庆医科大学学报, 2021, 46(9): 1003-1007. |
| [19] |
TRAN S M S, MOHAJERI M H. The role of gut bacterial metabolites in brain development, aging and disease[J]. Nutrients, 2021, 13(3): 732. DOI:10.3390/nu13030732 |
| [20] |
CHEN Y W, ZHOU J H, WANG L. Role and mechanism of gut microbiota in human disease[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 625913. DOI:10.3389/fcimb.2021.625913 |
| [21] |
LIU L S, HUH J R, SHAH K. Microbiota and the gut-brain-axis: Implications for new therapeutic design in the CNS[J]. E Bio Medicine, 2022, 77: 103908. |
| [22] |
NICHOLSON J K, HOLMES E, KINROSS J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336(6086): 1262-1267. DOI:10.1126/science.1223813 |
| [23] |
MATHEE K, CICKOVSKI T, DEORAJ A, et al. The gut microbiome and neuropsychiatric disorders: Implications for attention deficit hyperactivity disorder (ADHD)[J]. Journal of Medical Microbiology, 2020, 69(1): 14-24. DOI:10.1099/jmm.0.001112 |
| [24] |
BRUNT V E, LAROCCA T J, BAZZONI A E, et al. The gut micro-biome-derived metabolite trimethylamine N-oxide modulates neuroinflammation and cognitive function with aging[J]. GeroScience, 2021, 43(1): 377-394. DOI:10.1007/s11357-020-00257-2 |
| [25] |
OSADCHIY V, MARTIN C R, MAYER E A. Gut microbiome and modulation of CNS function[J]. Comprehensive Physiology, 2019, 10(1): 57-72. |
| [26] |
AMANOLLAHI M, JAMEIE M, HEIDARI A, et al. The dialogue between neuroinflammation and adult neurogenesis: Mechanisms involved and alterations in neurological diseases[J]. Molecular Neuro-biology, 2023, 60(2): 923-959. |
| [27] |
SUN M F, ZHU Y L, ZHOU Z L, et al. Neuroprotective effects of fecal microbiota transplantation on MPTP-induced Parkinson's disease mice: Gut microbiota, glial reaction and TLR4/TNF-α signaling pathway[J]. Brain, Behavior, and Immunity, 2018, 70: 48-60. DOI:10.1016/j.bbi.2018.02.005 |
| [28] |
LOFFREDO L, ETTORRE E, ZICARI A M, et al. Oxidative stress and gut-derived lipopolysaccharides in neurodegenerative disease: Role of NOX2[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 8630275. |
| [29] |
KESIKA P, SUGANTHY N, SIVAMARUTHI B S, et al. Role of gut-brain axis, gut microbial composition, and probiotic intervention in Alzheimer's disease[J]. Life Sciences, 2021, 264: 118627. DOI:10.1016/j.lfs.2020.118627 |
| [30] |
LIU Y Q, KONG C, GONG L, et al. The association of post-stroke cognitive impairment and gut microbiota and its corresponding metabolites[J]. Journal of Alzheimer's Disease, 2020, 73(4): 1455-1466. DOI:10.3233/JAD-191066 |
| [31] |
SADLER R, CRAMER J V, HEINDL S, et al. Short-chain fatty acids improve poststroke recovery via immunological mechanisms[J]. The Journal of Neuroscience, 2020, 40(5): 1162-1173. DOI:10.1523/JNEUROSCI.1359-19.2019 |
| [32] |
NING J, HUANG S Y, CHEN S D, et al. Investigating casual associations among gut microbiota, metabolites, and neurodegenerative diseases: A Mendelian randomization study[J]. Journal of Alzheimer's Disease: JAD, 2022, 87(1): 211-222. DOI:10.3233/JAD-215411 |
| [33] |
ZARAGOZÁR. Transport of amino acids across the blood-brain barrier[J]. Frontiers in Physiology, 2020, 11: 973. DOI:10.3389/fphys.2020.00973 |
| [34] |
BRAVO J A, FORSYTHE P, CHEW M V, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(38): 16050-16055. |
| [35] |
YANO J M, YU K, DONALDSON G P, et al. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis[J]. Cell, 2015, 161(2): 264-276. DOI:10.1016/j.cell.2015.02.047 |
| [36] |
CHEN Y J, XU J Y, CHEN Y. Regulation of neurotransmitters by the gut microbiota and effects on cognition in neurological disorders[J]. Nutrients, 2021, 13(6): 2099. DOI:10.3390/nu13062099 |
| [37] |
KAELBERER M M, BUCHANAN K L, KLEIN M E, et al. A gut-brain neural circuit for nutrient sensory transduction[J]. Science, 2018, 361(6408): eaat5236. DOI:10.1126/science.aat5236 |
| [38] |
LIU Y P, SANDERSON D, MIAN M F, et al. Loss of vagal integrity disrupts immune components of the microbiota-gut-brain axis and inhibits the effect of Lactobacillus rhamnosus on behavior and the corticosterone stress response[J]. Neuropharmacology, 2021, 195: 108682. DOI:10.1016/j.neuropharm.2021.108682 |
| [39] |
LEE K E, KIM J K, HAN S K, et al. The extracellular vesicle of gut microbial Paenalcaligenes hominis is a risk factor for vagus nerve-mediated cognitive impairment[J]. Microbiome, 2020, 8(1): 107. DOI:10.1186/s40168-020-00881-2 |
| [40] |
KIM S, KWON S H, KAM T I, et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease[J]. Neuron, 2019, 103(4): 627-641. DOI:10.1016/j.neuron.2019.05.035 |
| [41] |
FARZI A, FROHLICH E E, HOLZER P. Gut microbiota and the neuroendocrine system[J]. Neurotherapeutics, 2018, 15(1): 5-22. DOI:10.1007/s13311-017-0600-5 |
| [42] |
AGIRMAN G, HSIAO E Y. SnapShot: The microbiota-gut-brain axis[J]. Cell, 2021, 184(9): 2524-2524. e1. DOI:10.1016/j.cell.2021.03.022 |
| [43] |
LABAD J. The role of cortisol and prolactin in the pathogenesis and clinical expression of psychotic disorders[J]. Psychoneuroendocri-nology, 2019, 102: 24-36. DOI:10.1016/j.psyneuen.2018.11.028 |
| [44] |
LIGHTMAN S L, BIRNIE M T, CONWAY-CAMPBELL B L. Dynamics of ACTH and cortisol secretion and implications for disease[J]. Endocrine Reviews, 2020, 41(3): bnaa002. DOI:10.1210/endrev/bnaa002 |
| [45] |
SMITH K B, MURRAY E, GREGORY J G, et al. Pubertal probiotics mitigate lipopolysaccharide-induced programming of the hypothalamic-pituitary-adrenal axis in male mice only[J]. Brain Research Bulletin, 2021, 177: 111-118. DOI:10.1016/j.brainresbull.2021.09.017 |
| [46] |
AUTIO J, STENB?CK V, GAGNON D D, et al. Neuro peptides, physical activity, and cognition[J]. Journal of Clinical Medicine, 2020, 9(8): 2592. DOI:10.3390/jcm9082592 |
| [47] |
ERBIL D, EREN C Y, DEMIREL C, et al. GLP-1's role in neuroprotection: A systematic review[J]. Brain Injury, 2019, 33(6): 734-819. DOI:10.1080/02699052.2019.1587000 |
| [48] |
席晓明, 毕鸿雁, 曹海豪, 等. 基于脑肠轴理论的帕金森病中医康复模式述要[J]. 山东中医杂志, 2022, 41(1): 120-125. |
| [49] |
温惠娟, 吴林, 杨进平, 等. 温脾通络开窍法对Aβ1-42诱导小胶质细胞炎性因子的影响[J]. 中西医结合心脑血管病杂志, 2014, 12(2): 215-217. DOI:10.3969/j.issn.1672-1349.2014.02.045 |
| [50] |
吴林, 陈炜, 张其瑞, 等. 温脾通络开窍法治疗老年性痴呆的临床体会[J]. 辽宁中医杂志, 2009, 36(11): 1901-1902. |
| [51] |
陈炜, 李兴峰, 陈业文, 等. 温脾通络开窍方通过抑制TNF-α/ROS/JNK分子改善阿尔兹海默症大鼠海马区病变[J]. 辽宁中医杂志, 2021, 48(11): 177-180, 226. |
| [52] |
钟方为, 李庚喜, 曾立. 基于肠道菌群和短链脂肪酸代谢探讨绞股蓝总皂苷改善大鼠非酒精性脂肪肝病的实验研究[J]. 中国中药杂志, 2022, 47(9): 2500-2508. |
| [53] |
林路宁, 姬丽婷, 傅云波, 等. 石菖蒲水提物对3xTg-AD小鼠肠道菌群的影响[J]. 浙江中医杂志, 2020, 55(7): 471-474. DOI:10.3969/j.issn.0411-8421.2020.07.002 |
| [54] |
张超, 加秀凤, 黄万凌, 等. 首乌丸调节肠道菌群延缓D-半乳糖模型大鼠脑衰老作用及机制研究[J]. 北京中医药大学学报, 2023, 46(1): 65-76. |
| [55] |
倪雅丽, 姚宇剑, 汤灿, 等. 缩泉益肾方与益智仁对糖尿病肾脏疾病小鼠疗效及肠道菌群的影响差异研究[J]. 海南医学院学报, 2021, 27(11): 820-826. |
| [56] |
姜洋, 王燕萍, 刘雪珍, 等. 基于高通量测序技术研究归脾汤对心脾两虚型轻度阿尔茨海默病患者肠道菌群多样性的影响[J]. 新中医, 2021, 53(1): 17-22. |
| [57] |
陈延, 黄敏, 汪慧, 等. 加减薯蓣丸对阿尔茨海默病小鼠模型肠道菌群和HMGB1通路相关蛋白的影响[J]. 中药药理与临床, 2023, 39(3): 15-19. |
| [58] |
陈靖, 梁喜才, 王健, 等. 基于肠脑轴探讨地黄饮子对APP/PS1转基因阳性小鼠神经功能的改善作用及机制[J]. 中国药房, 2022, 33(24): 2978-2984. DOI:10.6039/j.issn.1001-0408.2022.24.07 |
| [59] |
王登坤, 第五永长, 苟于瑞, 等. 洗心汤对阿尔茨海默病模型大鼠海马BDNF、TrkB蛋白表达及肠道菌群多样性的影响[J]. 中医杂志, 2021, 62(15): 1362-1369. |
| [60] |
田小平, 夏军, 卫静雯, 等. 基于16S rDNA测序研究当归芍药散调控肠道菌群改善SAMP8小鼠认知能力的作用机制[J]. 中国实验方剂学杂志, 2022, 28(24): 26-34. |
| [61] |
李昶, 雷天荣, 王思明, 等. 人参蛋白对阿尔茨海默病小鼠肠道菌群及BDNF/TrkB信号通路的影响[J]. 中成药, 2023, 45(4): 1319-1323. |
| [62] |
陈启军, 于岚, 赵文文, 等. 远志提取物对抑郁大鼠肠道菌群的作用研究[J]. 中草药, 2021, 52(8): 2313-2323. |
| [63] |
李鑫洁, 陈建新, 鲁艺. 锁阳乙酸乙酯提取物对阿尔茨海默病小鼠肠道菌群紊乱的调节作用[J]. 中医学报, 2022, 37(1): 126-134. |
| [64] |
许萍, 杨成武, 黄淑芸, 等. 安石榴苷基于调整肠道菌群改善APP/PS1阿尔兹海默病小鼠认知功能的实验研究[J]. 中国临床药理学杂志, 2022, 38(18): 2181-2186. |
| [65] |
王照钦, 钟蕊, 高崚, 等. 针刺对帕金森病模型小鼠肠道菌群多样性的调节作用[J]. 中华中医药杂志, 2020, 35(5): 2265-2270. |
| [66] |
史珊怡, 邢菁, 陈奥, 等. "原络通经"针刺法治疗痴呆小鼠学习记忆能力机制研究[J]. 辽宁中医药大学学报, 2022, 24(5): 198-203. |
| [67] |
徐佳, 陈奥, 史珊怡, 等. "原络通经"针法调节痴呆小鼠肠道菌群微生态及肠道SCFA代谢的机制研究[J]. 辽宁中医药大学学报, 2022, 24(9): 161-166. |
| [68] |
郭文海, 颜敬彧, 邢菁, 等. "原络通经"针法对SAMP8小鼠病理形态学及NMDAR表达的影响[J]. 针灸临床杂志, 2022, 38(6): 69-74. |
| [69] |
周钰点, 杨姝瑞, 王雅媛, 等. 不同腧穴配伍电针对肥胖大鼠肠道炎性反应和肠道菌群的影响[J]. 中国针灸, 2022, 42(10): 1145-1152. |
| [70] |
汪逍, 刘智斌. 基于脑肠轴理论探讨针刺对帕金森病便秘和抑郁的双向性调节[J]. 中医药学报, 2021, 49(6): 56-59. |
| [71] |
袁伟渠, 杨卓欣, 周玉梅, 等. 基于阴阳平衡理论探讨针灸与肠道微生态的关系[J]. 世界科学技术-中医药现代化, 2020, 22(11): 4009-4016. DOI:10.11842/wst.20200516002 |
| [72] |
郑之俊, 肖伟, 梁发俊, 等. 基于"肠脑轴"理论探讨针刺对帕金森病模型大鼠脑内炎症反应的影响[J]. 中西医结合研究, 2020, 12(6): 379-382. DOI:10.3969/j.issn.1674-4616.2020.06.006 |
| [73] |
陈丹凤, 张泓, 谢菊英, 等. 从"脑病治肠"探讨电针对血管性痴呆大鼠肠道菌群及血清IL-1β及IL-18的影响[J]. 针刺研究, 2022, 47(3): 216-223. |
| [74] |
廖冬梅, 庞芳, 杨云昊, 等. 基于肠道菌群探讨电针对APP/PS1小鼠认知能力的改善机制[J]. 中国病理生理杂志, 2021, 37(10): 1774-1783. DOI:10.3969/j.issn.1000-4718.2021.10.006 |
| [75] |
文立杨, 程为平, 程光宇, 等. 电针"百会""腰奇"对癫痫模型大鼠行为学及肠道菌群的影响[J]. 中医药信息, 2021, 38(4): 46-51. |
2. Nankai University People's Hospital, Tianjin 300121, China;
3. The Fourth Affiliated Central Hospital of Nankai University, Tianjin 300140, China
 2024, Vol. 41
2024, Vol. 41