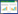文章信息
- 张佳, 袁金凤, 柴冲冲, 等.
- ZHANG Jia, YUAN Jinfeng, CHAI Chongchong, et al.
- 基于UPLC指纹图谱和多组分化学计量学探究白及饮片变色对其质量的影响
- Study on the influence of discoloration Baiji slices on its quality based on the UPLC fingerprint and multi-component chemometrics
- 天津中医药, 2024, 41(8): 1039-1046
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(8): 1039-1046
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.08.16
-
文章历史
- 收稿日期: 2024-02-28
中药白及是兰科白及属植物白及[Bletilla striata(Thunb.)Reichb. f.]的干燥块茎,又名“白芨”“白根”“甘根”等,分布于贵州、四川、湖南、陕西等地[1]。白及性味苦、甘、涩,微寒,归肺、肝、胃经,具有收敛止血、消肿生肌的功效[2]。《本草纲目》记载白及“洗面黑,祛斑”,具有美白、祛斑、除皱等作用,应用于抗氧化、抗衰老等医药美容产业[3]。作为中国传统珍稀名贵中药,白及已被《国家重点保护野生植物名录》(第2批)列为二级保护植物[4]。目前,中药市场出现了大量的白及混伪品,如小白及[Bletilla formosana(Hayata)Schltr.]、黄花白及[Bletilla ochracea Schltr.]等白及的近缘种,外观性状极为相似,难以鉴别。2015版《中国药典》仅收载了外观性状、显微鉴别、薄层色谱、水分、总灰分及二氧化硫5项检测,直至2020版《中国药典》才首次以白及苷作为含量测定的指标性成分[2]。在中药行业,外观性状一直以来都是划分中药饮片等级的重要依据之一,即“看货评级,分档议价”[5]。2020版《中国药典》记载:白及“外表皮灰白色至灰棕色,或黄白色。切面类白色至黄白色”[2]。在对白及研究过程中,发现白及存在变绿的现象。在饮片厂,发绿部分较多的白及个子都会在炮制之前挑选出来,不作为原药材使用,作为传统名贵中药,发绿药材的剔除势必对饮片企业造成一定的经济损失,使人们提出饮片变绿是否影响白及饮片的质量和药用价值的疑问。
近年来,很多学者通过多成分检测结合化学计量学的方法对白及的质量进行研究,为市场上白及饮片的鉴别提供借鉴[6-9]。例如,朱环等[8]建立了36批次白及样品的高效液相色谱法(HPLC)指纹图谱,指认了6个共有峰,并通过聚类分析(HCA)和偏最小二乘回归分析(PLS-DA)分为两组,筛选出1个质量差异标志物。张涵瑞等[7]通过UPLC建立了不同采收时间的鄂产白及UPLC指纹图谱,指认了7个共有成分,同样通过HCA、主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA)等化学计量学方法筛选出天麻素、白及苷等3个差异标志物,并采用优劣解距离(TOPSIS)法对不同采收时间的白及质量进行了评价。在前期研究中,本课题组对24批白及正常饮片中的白及苷(militarine)含量进行研究,发现其含量范围为18.98~44.87 mg/g,整体质量基本一致[9]。在查阅大量文献之后,并未找到有关白及饮片或者药材变绿与其质量的相关研究。
基于此,文章从黄曲霉毒素、UPLC指纹图谱,及多成分含量测定等方面入手,对白及正常与偏绿饮片的质量进行多因素比较研究,以期探究颜色变绿对白及饮片质量的影响。
1 仪器与材料 1.1 仪器Waters ACQUITY UPLC(美国沃特世科技有限公司,TUV检测器,Empower色谱工作站);Agilent ZORBAX Eclipse XDB C18色谱柱(4.6 mm×250 mm,5 μm);Waters 2695型高效液相色谱仪;RF-20A荧光分光检测器(日本岛津公司);CM-5分光测色仪(日本柯尼卡美能达公司);紫外-可见分光光度计(TU1810,普析通用公司)。
1.2 药品与试剂白及苷(上海同田生物科技有限公司,批号58139234,纯度≥98%);白及对照药材(中国食品药片检定研究院,批号121262201706);乙腈为色谱纯(美国Fisher公司);无水葡萄糖(源叶生物科技有限公司,批号S08J6G1S08J6G1,纯度≥98%);水合氯醛试液、甘油(分析纯,国药集团化学试剂有限公司);其余试剂均为分析纯(北京化工厂)。
从收集到的24批次市售白及饮片中,筛选出饮片颜色存在偏绿现象的5个批次,经北京中医药大学中药学院杨瑶珺教授鉴定为兰科植物白及干燥块茎的加工品。将以上5批白及饮片中相应批次的颜色正常及颜色有偏绿部分的饮片分别挑出,进行编号,样品信息见表 1。
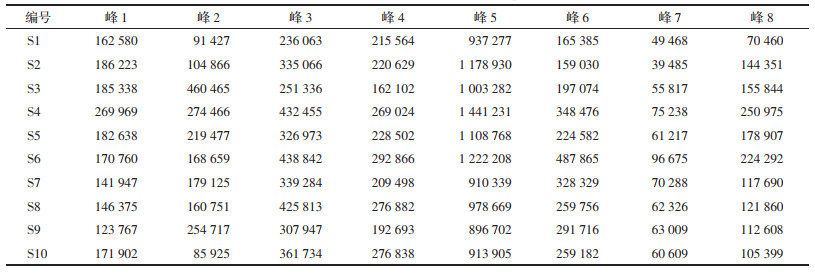
取白及饮片观察其外表皮与断面颜色,可见正常饮片外表皮多呈灰白色或黄白色,切面类白色。偏绿色饮片外表皮和切面均呈现一定程度的绿色。见图 1和表 2。

|
| 图 1 白及偏绿饮片(左)和正常(右)饮片外观 Fig. 1 Appearance of Rhizoma Bletillae (left) and normal (right) pieces. |
|
分别称取各组白及饮片适量,粉碎,过60目筛,装入测色皿中,起止波长350~750 nm,色彩空间CIE,L*、a*、b*,仪器测量口径8 mm,视场选择10度视角,测量光源为D65,标准偏差ΔE* ≤ 0. 04,数据处理软件为SpectraMagic NX。分别记录代表饮片粉末颜色的L*(亮度)、a*(红绿相)、b*(黄蓝相)值,重复3次,取平均值,并计算E*(总色值)=(L*2+a*2+b*2)1/2。
由表 2可知,白及偏绿饮片的L*、a*、E*值低于同批次的正常饮片,b*值高于同批次正常饮片,从颜色量化上验证了白及偏绿饮片在色度上较正常饮片偏暗、绿和黄色。
2.2 黄曲霉毒素检测研究采用免疫亲和柱-光化学衍生联合高效液相色谱荧光检测器抽检了3批白及正常饮片和3批偏绿饮片的黄曲霉毒素G2、G1、B2、B1的含量。
2.2.1 色谱条件Cloversil-C18(4.6 mm×150 mm,5 μm),以甲醇(A)-纯水(B)为流动相,等度洗脱(A∶B=45∶55,V∶V),流速0.8 mL/min,激发波长360 nm,发射波长440 nm,进样量20 μL。
2.2.2 供试品溶液的制备取白及饮片,粉碎过4号筛,称取2.5 g粉末置入50 mL离心管,加入0.5 g氯化钠,加入12.5 mL 70%甲醇-水溶液,混合均匀。用摇床混合30 min,3 000 r/min离心5 min,离心半径为10 cm(下同),准确移取5 mL滤液,并加入15 mL水稀释,混匀,备用。
2.2.3 检测结果免疫亲和柱-光化学衍生联合高效液相色谱荧光检测结果[见开放科学计划(OSID)二维码]表明,白及样本中黄曲霉毒素G2、G1、B2、B1含量均为0 μg/g,表明白及正常和偏绿饮片中均无黄曲霉毒素G2、G1、B2、B1,黄曲霉毒素并不是导致部分白及饮片变绿的原因。
2.3 UPLC指纹图谱的建立及相似度评价为进一步对比白及两种颜色饮片的质量差别,研究建立两种颜色白及饮片的指纹图谱,表征其整体化学成分的差异。
2.3.1 色谱条件ACQUITY UPLC?誖BEH C18色谱柱(2.1 mm×150 mm,1.7 μm),以乙腈(A)和纯水(B)作为流动相,梯度洗脱(0~5 min,2%~6% A;5~7 min,6%~10% A;7~8 min,10%~16% A;8~9 min,16%~19% A;9~14 min,19%~23% A;14~17 min,23%~30% A;17~25 min,30%~31% A;25~26 min,31% A;26~29 min,31%~55% A;29~34 min,55% A),流速0.3 mL/min,检测波长270 nm,柱温46 ℃,进样量2 μL,理论塔板数不低于100 000。
2.3.2 对照品溶液的制备取白及苷对照品适量,精密称定,加50%甲醇溶解,摇匀,制成每1 mL含白及苷1.6 mg的溶液。
2.3.3 供试品溶液的制备取白及饮片,粉碎过4号筛,称取粉末1 g,精密称定,置锥形瓶中,精密加入50%甲醇25 mL,称定质量,超声处理40 min(功率600 W,频率40 Hz),放置室温,用50%甲醇补足减失的质量,摇匀,滤过,100 000 r/min离心10 min,即得。
2.3.4 方法学考察 2.3.4.1 精密度实验精密吸取同一白及饮片供试品溶液2 μL,按上述色谱条件连续进样测定6次,记录色谱图,以白及苷为参照峰,计算各色谱峰的相对保留时间和相对峰面积,结果各色谱峰的相对保留时间的RSD值均小于0.36%,相对峰面积的RSD值均小于0.83%,结果表明仪器的精密度良好。
2.3.4.2 稳定性实验精密吸取同一白及饮片供试品溶液2 μL,分别于0、2、4、6、8,12、24 h按上述色谱条件进样测定,记录色谱图。以白及苷为参照峰,计算特征峰的相对保留时间和相对峰面积,结果各色谱峰的相对保留时间的RSD值均小于0.95%,相对峰面积的RSD值均小于2.7%,表明供试品溶液在24 h内稳定性良好。
2.3.4.3 重复性实验取同一批白及饮片样品粉末6份,精密称定,按2.3项下方法分别制备供试品溶液,精密吸取供试品溶液2 μL,分别进样测定,记录色谱图。以白及苷为参照峰,计算特征峰的相对保留时间和相对峰面积,结果各色谱峰的相对保留时间的RSD值均小于0.54%,相对峰面积的RSD值均小于1.6%,表明该方法重复性良好。
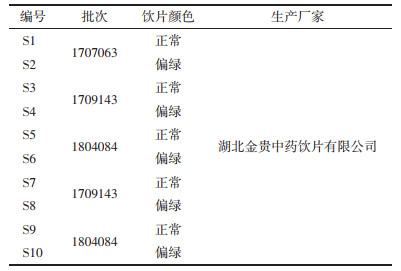
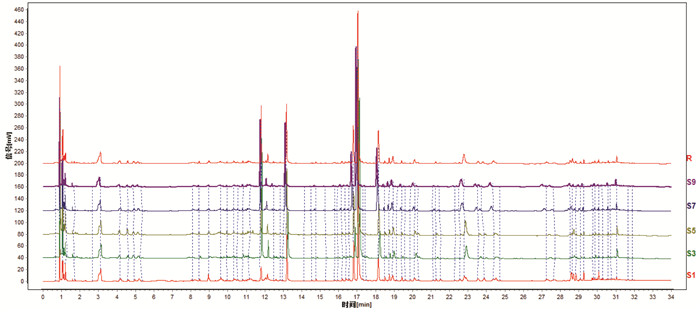
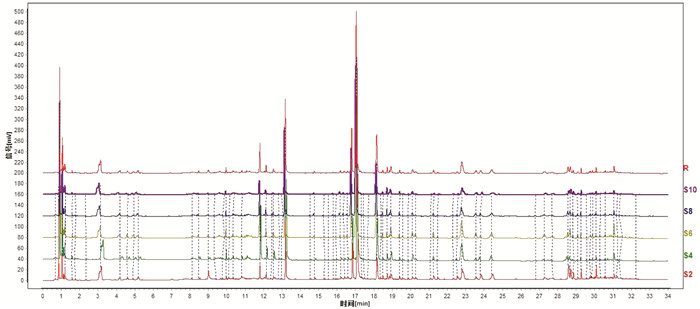
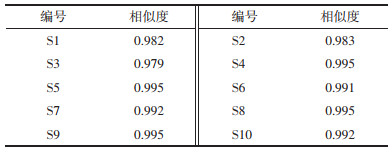
2.3.5 指纹图谱的建立和相似度评价分别对5批两种颜色白及(S1~S10)建立指纹图谱,5批白及正常饮片的相似度为0.979~0.995,以白及苷为参照,8个共有峰的相对保留时间RSD值小于0.79%,相对峰面积RSD值在0%~55%之间。见图 2,5批偏绿饮片的相似度分别为0.983~0.995,以白及苷为参照,偏绿饮片的8个共有峰的相对保留时间RSD值小于2.6%,相对峰面积RSD值在0~36%之间,见图 3。
|
| 图 2 5批白及正常饮片的UPLC叠加图谱 Fig. 2 UPLC spectra of 5 batches of normal Rhizoma Bletillae slices |
|
| 图 3 5批白及偏绿饮片的UPLC叠加图谱 Fig. 3 UPLC spectra of 5 batches of green Rhizoma Bletillae slices |
|
通过对比正常和偏绿饮片的指纹图谱,发现其整体基本一致,无明显特征色谱峰,标注了8个共有峰。通过比较峰面积大小,发现正常白及饮片中峰3、峰4、峰5的峰面积均小于同批来源的偏绿饮片,变化具有规律性,而其他5个特征共有峰未发现规律性变化,见表 4。其中,5号峰为白及苷,3号峰和4号峰经UPLC-Q-TOF/MS分别鉴定为dactylorhin A和gymnoside Ⅲ。
精密称定干燥至恒质量的无水葡萄糖对照品10 mg,置50 mL容量瓶中,加水定容,摇匀,即可。
2.4.2 供试品溶液的制备精密称取白及样品粉末0.2 g(过4号筛),精密加水40 mL,称质量,回流提取40 min(保持微沸),放冷,用水补质量,摇匀,过滤。精确量取续滤液5 mL,加80%乙醇30 mL,摇匀,静置1 h,离心3 000 r/min处理15 min,弃去上清液,沉淀用一定量的热水溶解,放冷,置50 mL容量瓶中,用水定容,摇匀,即可。
2.4.3 方法学考察 2.4.3.1 线性关系考察精密量取对照品溶液0.1、0.2、0.4、0.6、0.7、0.9 mL,分别置于10 mL试管中,各加水至2 mL,摇匀,精密加蒽酮-硫酸溶液4.5 mL,混匀,置沸水浴中加热3 min,取出,冷水中冷却10 min,以相应试剂为空白对照。在波长625 nm处测定吸光度,以吸光度为纵坐标、葡萄糖浓度为横坐标,绘制标准曲线,线性方程为Y=37.802X-0.277 4,r=0.999 9,表明多糖含量在4.698 5~42.286 2 μg/mL范围内线性关系良好。
2.4.3.2 重复性实验取同一白及样品6份,按2.4.2溶液制备项下方法制备供试品溶液,精密量取1 mL供试品溶液,按照上述显色方法进行显色,625 nm波长处测定吸光度。计算RSD值为0.39%,表明该方法重复性良好。
2.4.3.3 稳定性实验取4号白及供试品溶液1.0 mL,按照上述显色条件显色,以相应试剂做空白,分别于0、0.5、1、1.5、2、2.5、3 h在波长625 nm处测定吸光度值。计算RSD值为1.6%,表明供试品溶液在3 h内稳定性良好。
2.4.3.4 加样回收率实验取已知含量的白及饮片样品共6份,按照2.4.2项下方法制备供试品溶液,分别精密量取供试品溶液与无水葡萄糖对照溶液各0.5 mL,按照上述显色条件显色,625 nm波长处测定吸光度,计算加样回收率,结果平均回收率为101.35%,RSD值为2.5%,表明该方法准确可靠。
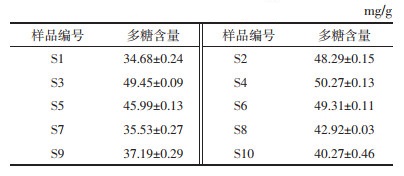
2.4.4 多糖含量的检测精密量取供试品溶液1.0 mL,置于10 mL试管中,加水稀释到2.0 mL,加0.2%蒽酮-硫酸溶液4.5 mL显色,同时取蒸馏水2.0 mL,置于10 mL试管中,加蒽酮-硫酸溶液4.5 mL作为空白,置紫外-可见分光光度计上在625 nm波长处检测,并计算多糖的含量,见表 5。
|
经检测,5批白及正常饮片的多糖含量范围为34.68~49.45 mg/g,5批偏绿饮片的多糖含量范围为40.27~50.27 mg/g,正常饮片的多糖含量均低于相同批次的偏绿饮片,且差异具有统计学意义(P < 0.01),表明白及饮片变绿导致其多糖含量升高。
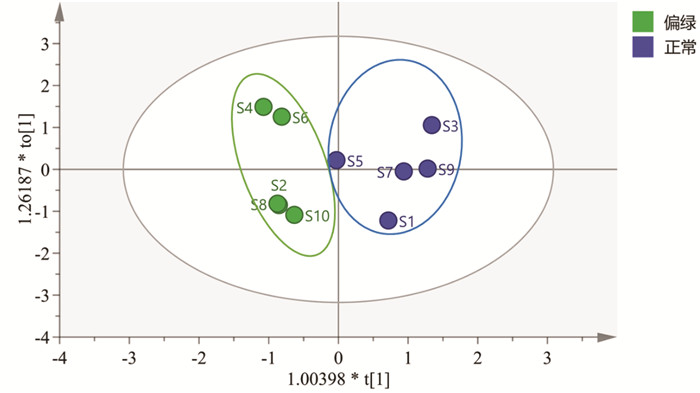
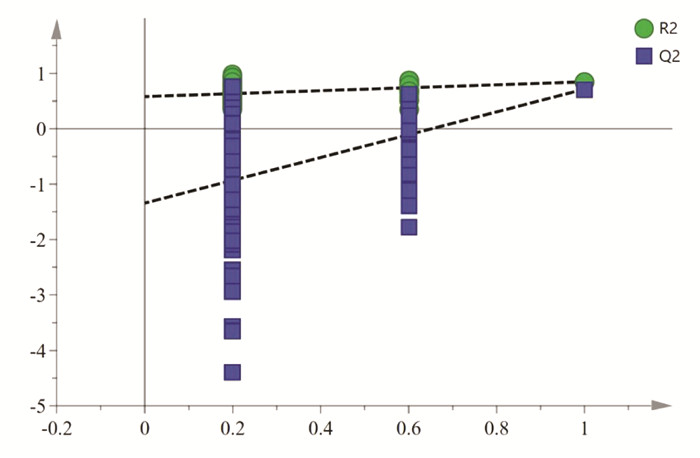
2.5 化学计量学分析为探究白及正常和发绿饮片的差异,文章利用有监督模式的OPLS-DA对S1~S10进行识别分析,并筛选出对组间差异贡献率较大的成分。首先,将白及指纹图谱中的8个共有色谱峰的峰面积和多糖含量做归一化处理,作为变量导入SIMCA 14.1软件,进行OPLS-DA建模,得到模型的具体参数为:R2X=0.894,R2Y=0.846,Q2=0.716,均大于0.5,表明所建立的模型稳定性和预测能力较好。OPLS-DA得分图见图 5,S1~S10可分为正常和偏绿2组,说明有8种共有化学成分的峰面积和多糖含量可以作为区分白及正常和变绿饮片的指标。为防止所建立的OPLS-DA模型出现过拟合而影响结果准确性,利用200次置换检验模型进行内部验证,结果见图 6,右上角的R2和Q2的纵坐标值高于最左边的R2和Q2,斜率为正值,Q2点的蓝色回归线与纵轴(左侧)相交点低于零点,说明所建模型可靠,未出现过度拟合现象,结果可用于标志物的筛选。
|
| 图 5 5批白及饮片的OPLS-DA得分图 Fig. 5 OPLS-DA score plot for 5 batches of Rhizoma Bletillae slices |
|
| 图 6 5批白及饮片的OPLS-DA模型置换检验 Fig. 6 Permutation test of OPLS-DA for 5 batches of Rhizoma Bletillae slices |
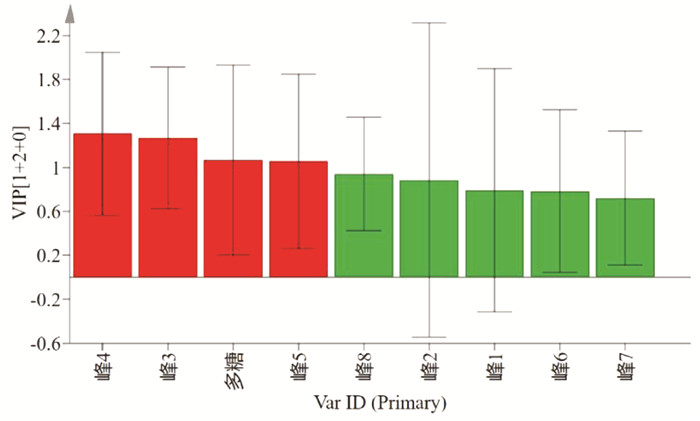
利用变量重要性投影(VIP)值是筛选质量差异标志物的重要指标,可直观反映共有峰引起的组间差异的权重大小。进一步对8个共有峰和多糖含量进行VIP分析,结果见图 7。以VIP大于1作为阈值,筛选出4个差异标志物,分别为峰4(gymnoside Ⅲ)、峰3(dactylorhin A)、多糖、峰5(白及苷),说明这4种成分对于区分白及颜色变异饮片贡献较大。
|
| 图 7 5批白及饮片中化学成分的VIP Fig. 7 VIP values for 5 batches of Rhizoma Bletillae slices |
白及饮片颜色的变化可能与成分有关,偏绿饮片中的3种成分含量均高于正常饮片,故有必要利用UPLC法测定3种成分的含量,结合白及饮片粉末颜色色度的L*、a*、b*值,及总色值E*,利用典型相关分析探究白及饮片的颜色与3种成分含量的相关性。
2.6.1 多成分含量测定 2.6.1.1 线性关系考察精密吸取2.3.2项下白及苷对照品溶液0.1、0.2、0.4、0.8、1.2、1.6、2.0 mL,分别置于2 mL容量瓶中,用50%甲醇稀释至刻度,分别精密吸取上述稀释后的对照品溶液各2 μL,按2.1项下色谱条件进行测定,以峰面积为纵坐标(Y),白及苷浓度为横坐标(X),绘制标准曲线,得回归方程。白及苷回归方程Y=723 038X-1 883.9,r=0.999 9,白及苷在1.617 0~3.234 2 μg有良好的线性关系。
2.6.1.2 精密度实验取S1号样品,按照2.3.3项下方法制备供试品溶液,按2.3.1项下色谱条件测定,连续进样6次,每次2 μL,测定白及苷的峰面积,计算RSD为0.15%,小于2.0%,表明仪器精密度良好。
2.6.1.3 重复性实验取S1号样品6份,按2.3.3项下方法制备供试品溶液,按2.3.1项下色谱条件,测定白及苷的峰面积,计算RSD为0.15%,小于1.0%,表明本方法重复性良好。
2.6.1.4 稳定性实验取S1号样品,按2.3.3项下方法制备供试品溶液,按2.3.1项下色谱条件,分别于0、2、4、8、12、24 h进样2 μL,测定白及苷的色谱峰面积,计算RSD为0.29%,小于2.0%,表明供试品溶液在24 h内稳定性良好。
2.6.1.5 加样回收率实验取6份已知含量的白及样品粉末,每份约0.5 g(白及苷含量6.86 mg/g),精密称定,分别精密加入对照品适量,按照2.3.3项下供试品溶液制备方法制备,2.3.1项下色谱条件测定白及苷的峰面积,计算其含量,平均回收率为101.02%,RSD为0.70%,表明该方法准确可靠。
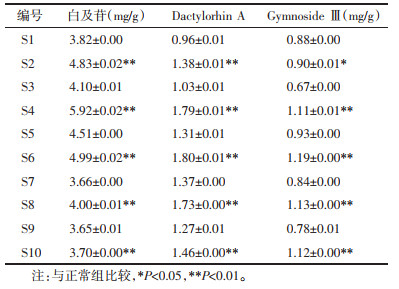
2.6.1.6 样品含量测定称取不同批次的白及饮片粉末各3份,每份1.0 g,精密称定,按照2.3.3项下方法制备供试品溶液,按照2.3.1项下色谱条件进行测定(n=3),记录峰面积,按照2.6.1.1项下线性回归方程计算白及苷的含量,并计算dactylorhin A和gymnoside Ⅲ的相对含量,结果见表 6。
|
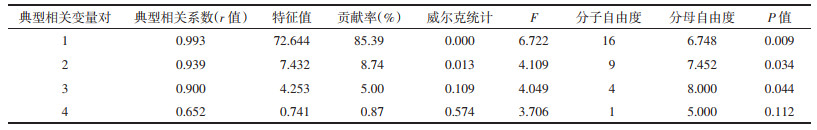
典型相关分析是从整体上研究两类因素之间的相关情况,解释两组变量之间的相关性及其相互关系的统计分析方法[10]。把dactylorhin A、gymnoside Ⅲ、白及苷的相对含量,及多糖含量作为自变量X1、X2、X3、X4,把L*、a*、b*、E*当做因变量Y1、Y2、Y3、Y4,用SPSS 24统计软件做典型相关分析,结果见表 7。
|
由表 7可知,共得到4对典型相关变量,前3对均存在统计学意义(P < 0.05)。尤其是第一对典型相关变量的相关系数为0.993,特征值贡献率为85.39%,表明4种主要成分的含量和色度值具有显著相关性(P < 0.01)。以上结果表明,随着白及饮片变绿,L*、a*、E*值减小,b*值升高,白及苷、dactylorhin A、gymnoside Ⅲ以及多糖的含量也随之升高。
3 结论与讨论中药饮片是中医临床“辨证施治”的根本,中药饮片的质量事关中医临床的安全和有效。在中医药发展的历史长河中,中药产业逐渐形成了一套通过“看、尝、嗅、听、手摸”来鉴定中药饮片真伪和优劣的独到方法。其中,外观性状作为饮片最显著的特征,是评判饮片质量的重要依据之一。近年来,有很多论文报道了中药饮片的色度值和有效成分的含量具有显著的相关关系[11-14],验证了利用外观颜色作为评判饮片质量标准的科学性。“饮片变色”指的是饮片外观或切面发生了不正常的颜色变化,传统观念认为饮片变色一般指示中药饮片质量发生改变。例如,黄芩在冷水中变绿,白芍和槟榔在空气中暴露变红等现象都被证明其实质是发生了化学变化[15],但目前关于颜色的研究大多聚焦在于炮制过程颜色的变化,鲜有研究关注饮片的非正常变色现象。
文章聚焦白及饮片变绿的异常现象,在排除黄曲霉毒素的原因后,通过指纹图谱和多组分含量测定后发现,变绿的白及饮片中多糖、白及苷、dactylorhin A和gymnoside Ⅲ的含量均高于同一批次的正常饮片。进一步通过OPLS-DA模型,这4种成分也是白及正常和偏绿饮片的质量差异标志物,可以用来区分白及正常和变绿饮片。此外,饮片的色度值与4种成分的含量存在显著性相关关系,即随着饮片变绿,L*、a*、E*值减小,b*值升高,白及苷、dactylorhin A、gymnoside Ⅲ以及多糖的含量也随之升高。文献报道,多糖类成分是白及发挥止血[16]、抗炎[17]、愈伤[18-20]等生物活性的有效成分之一,而2020版《中国药典》首次将白及苷作为白及含量测定的标准物质,要求不少于2%。因此,白及变绿并没有降低其有效成分的含量,相反,变绿的饮片具有潜在的药用价值。白及苷、dactylorhin A、gymnoside Ⅲ均为苹果酸葡萄糖氧基苄酯类化合物,长时间暴露于空气中,易发生酯键断裂、苷键水解等反应,从而生成两分子的对羟基苯甲醇,进一步可氧化为对羟基苯甲醛,共轭增长,可能是造成饮片颜色加深的潜在原因。本研究仅局限于多组分化学成分的检测,至于白及饮片变绿的深层次原因,以及临床安全性和有效性还有待于进一步的实验探究。
| [1] |
孙乐乐, 杨永红, 刘军凯, 等. 白及的本草考证[J]. 中药材, 2010, 33(12): 1965-1968. |
| [2] |
国家药典委员会. 《中国药典》2020版一部[S]. 北京: 中国医药科技出版社, 2020: 107.
|
| [3] |
谢珺, 胡雨涛, 叶欣, 等. 中药白及的药理活性及在新型创伤敷料方面的应用[J]. 海南医学, 2022, 33(3): 371-373. |
| [4] |
张曼, 韩亭亭, 胡春芳, 等. 白及产业现状及可持续发展策略[J]. 中草药, 2019, 50(20): 5103-5108. |
| [5] |
李鹏英, 王海洋, 李健, 等. 中药材商品规格等级的形成和演变[J]. 中国中药杂志, 2016, 41(5): 764-768. |
| [6] |
穆开朗, 刘育辰, 刘刚, 等. 基于指纹图谱-化学计量分析-网络药理学的白及饮片质量标志物研究[J]. 中药新药与临床药理, 2023, 34(3): 404-413. |
| [7] |
张涵瑞, 方敬贤, 孙志滢, 等. 基于指纹图谱和成分定量评价不同采收时间鄂产白及质量[J]. 中药材, 2023, 46(9): 2254-2259. |
| [8] |
朱环, 谢秉湘, 张崇生, 等. 基于HPLC指纹图谱和化学计量学评价白及饮片质量[J]. 温州医科大学学报, 2021, 51(5): 389-393. |
| [9] |
刘娜, 袁金凤, 彭诗涛, 等. 基于militarine含量结合UPLC指纹图谱的不同产地白及饮片质量分析[J]. 天津中医药, 2020, 37(5): 583-589. DOI:10.11656/j.issn.1672-1519.2020.05.20 |
| [10] |
孙振球, 徐勇勇. 医学统计学[M]. 北京: 医学卫生出版社, 2016.
|
| [11] |
郑晓倩, 徐超, 金传山, 等. 基于颜色变化的"九蒸九晒"黄精炮制火候及内外在质量的相关性研究[J]. 中草药, 2022, 53(6): 1719-1729. |
| [12] |
邓延文, 钟凌云, 刘洪, 等. 炆黄精炮制工艺优化及其成分与色泽相关性分析[J]. 中成药, 2023, 45(10): 3334-3341. |
| [13] |
杨柳, 杜伟锋, 葛卫红, 等. 蜜百合炮制过程色度值与主要成分相关性分析[J]. 中华中医药杂志, 2023, 38(9): 4309-4314. |
| [14] |
杜伟锋, 赵明方, 汤璐璐, 等. 醋延胡索炮制过程中色度值与生物碱含量相关性研究[J]. 中成药, 2023, 45(10): 3327-3334. |
| [15] |
李飞, 陆兔林. 中药炮制学[M]. 北京: 人民卫生出版社, 2022.
|
| [16] |
董永喜, 刘星星, 董莉, 等. 白及多糖对血热出血模型大鼠的止血作用及机制研究[J]. 中国药房, 2016, 27(31): 4347-4350. |
| [17] |
LUO L, ZHANG Z, JUAN X, et al. Bletilla striata polysaccharide has a protective effect on intestinal epithelial barrier disruption in TA Ainduced cirrhotic rats[J]. Experimental and Therapeutic Medicine, 2018, 16(3): 1715-1722. |
| [18] |
ZHANG C, HE Y, CHEN Z, et al. Effect of polysaccharides from Bletilla striata on the healing of dermal wwounds in mmice[J]. Evidence-based Complementary and Alternative Medicine, 2019, 2019: 1-9. |
| [19] |
ZHANG Q, QI C, WANG H, et al. Biocompatible and Degradable Bletilla striata Polysaccharide Hemostasis Sponges Constructed from Natural Medicinal Herb Bletilla striata[J]. Carbohydrate Polymers, 2019, 226: 115304. |
| [20] |
HUANG Y B, SHI F L, WANG L M, et al. Preparation and evaluation of Bletilla striata polysaccharide/carboxymethyl chitosan/Carbomer 940 hydrogel for wound healing[J]. International Journal of Biological Macromolecules, 2019, 132: 729-737. |
 2024, Vol. 41
2024, Vol. 41