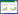文章信息
- 马悦宁, 郭思佳, 李云辉.
- MA Yuening, GUO Sijia, LI Yunhui.
- 丹龙口服液对肺间质纤维化小鼠肺组织病变的影响
- Effect of Danlong oral liquid on pulmonary tissue lesion in mice with pulmonary fibrosis
- 天津中医药, 2024, 41(9): 1161-1166
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(9): 1161-1166
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.09.15
-
文章历史
- 收稿日期: 2024-03-28
2. 国家中医针灸临床医学研究中心, 天津 300381;
3. 天津中医药大学第二附属医院, 天津 300250
肺间质纤维化(PF)是临床多种肺部疾病的终末期结局,常导致不可逆的瘢痕性纤维化[1]。其发病机制学界普遍认为由炎症浸润引起,肺泡上皮、肺血管等持续性微损伤后异常修复的过程[2]。目前肺间质纤维化研究较为广泛,但临床治疗多以缓解症状为主,缺乏有效的治疗方案[3]。其在中医学中常从“肺痿”“肺痹”或“喘证”论治[4]。丹龙口服液以治疗支气管哮喘“热哮证”为主,其临床表现常为喘息、咳嗽,症见痰黄质黏难咯[5]。肺间质纤维化在发作期亦存在类似的症状,故本研究尝试使用丹龙口服液治疗肺间质纤维化小鼠。本研究利用博来霉素制作小鼠肺间质纤维化病理模型,观察丹龙口服液干预肺间质纤维化小鼠的一般情况、肺组织形态、肺泡炎、肺间质纤维化评分及血清和肺泡灌洗液中促纤维化因子水平的改变,初步探讨丹龙口服液对肺间质纤维化小鼠的防治作用。
1 材料与方法 1.1 实验动物健康SPF级别昆明小鼠40只,雄性,体质量20~22 g,实验动物由北京华阜康生物技术股份有限公司提供。动物引进参照《试验动物引进标准操作规程》进行,实验动物中心许可证号SCXK(京)2019-0008。饲养条件:清洁级,室内温度18~22 ℃,相对湿度50%~70%,光照时间固定,每天照明12 h,照明时间为8:00 am~8:00 pm,水、食物自由摄取。适应性喂养1周,期间动物可自由进水取食。
1.2 药物丹龙口服液产自浙江康德药业集团股份有限公司。吡非尼酮胶囊(Pirfenidone)产自北京康蒂尼药业有限公司,商品名:艾思瑞。注射用博来霉素(15 USP),产自海正辉瑞制药有限公司,配制成1 mg/mL的溶液。
1.3 主要试剂及仪器主要试剂:苏木精染液、伊红染液(天津市化学试剂三厂);Masson染料(上海源叶生物科技有限公司);转化生长因子-β1(TGF-β1)酶联免疫吸附实验(ELISA)试剂盒、血小板衍生生长因子(PDGF)ELISA试剂盒、结缔组织生长因子(CTGF)ELISA试剂盒(上海凡科维生物科技有限公司);羟脯氨酸(HYP)试剂盒(南京建成生物工程研究所)。主要仪器:医用离心机、酶标检测仪、紫外分光光度计、高速低温组织研磨仪、病理切片机、包埋机、组织摊片机等。
1.4 分组、造模方法及伦理审查 1.4.1 分组将小鼠根据随机数字表法分为空白对照组、模型组、中成药丹龙口服液组及西药吡非尼酮组共4组,每组10只,另取3只小鼠进行造模成功判定。造模第15天起,各组均给予灌胃4周处理,丹龙口服液组及吡非尼酮组分别给予对应的药物灌胃治疗,空白对照组及模型组给予等体积的蒸馏水灌胃治疗。
1.4.2 造模方法给药剂量参照徐叔云《药理实验方法学》[6]“人和动物间按体表面积折算的等效剂量比值表”计算,具体方法如下:人(70 kg)与小鼠(20 g)之间系数为0.002 6。丹龙口服液组按日推荐用药量30 mL计算,20 g小鼠日灌胃量0.2 mL。按患者每日推荐吡非尼酮剂量为1 800 mg计算,20 g小鼠为每日4.68 mg,即234 mg/kg,以10 mL/kg灌胃。空白组及模型组采用10 mL/kg蒸馏水灌胃。所有组小鼠均每日灌胃1次,连续灌胃28 d。
本实验采用鼻腔滴入博来霉素溶液法造模,除空白对照组外其余各组在适应性饲养7 d后造模。在实验开始第1天,小鼠吸入5 %异氟烷麻醉后经气道滴入5 mg/kg博来霉素生理盐水溶液制作肺间质纤维化疾病动物模型,第14天造模检测造模是否成功;空白对照组小鼠气道内滴入等体积生理盐水。
1.4.3 伦理审查本实验已通过易生源基因科技(天津)有限公司实验动物伦理委员会审查,审批编号为YSY-DWLL-2023270。
1.5 标本采集灌胃结束后第1天,用戊巴比妥钠水溶液(80 mg/kg)腹腔注射麻醉后,暴露气管,行气管插管术,进行小鼠肺功能测定;后经眼眶取血0.5~0.7 mL,去针头沿管壁缓缓注入促凝管中,4 ℃静置2~3 h,4 ℃、3 000 r/min,离心半径14.91 cm,离心15 min后吸取上清液,负80 ℃保存备用;打开胸腔,结扎单侧肺,进行肺泡灌洗液收集;最后取双肺组织。
1.6 观察指标及方法 1.6.1 小鼠的一般情况观察并记录各组小鼠的饮食、大便、呼吸、毛发光泽度、行为活动状态、精神状态等一般情况,并记录体质量变化和死亡情况。
1.6.2 小鼠肺功能测定用戊巴比妥钠水溶液(80 mg/kg)腹腔注射麻醉后,仰卧位固定于操作台上,纵行切开颈部皮肤约1 cm,机械钝性分离皮下组织暴露气管,在环状软骨下两个气管环处切一倒“T”型切口,行气管插管并固定,气管插管接小动物肺功能测定仪。测定小鼠0.1 s内用力呼气量、用力肺活量、0.1 s内用力呼气量与用力肺活量比值、深吸气量等肺功能指标。
1.6.3 小鼠肺组织病理学切片染色取收集的肺组织置于10%中性福尔马林水溶液中固定48 h,常规苏木精-伊红(HE)染色和Masson染色,制作肺组织病理切片。首先在光镜下进行定性观察,而后对肺组织HE染色切片进行炎症评分以半定量评估其炎症的严重程度,对肺组织Masson染色切片进行Ashcroft评分以半定量评估其纤维化的严重程度。
1.6.4 肺组织HYP含量测定应用酸水解法测定肺组织HYP含量,具体操作参照试剂盒说明书严格执行。
1.6.5 血清和肺泡灌洗液促纤维化细胞因子表达水平测定应用ELISA测定小鼠血清和肺泡灌洗液中TGF-β1、PDGF和CTGF等促纤维化细胞因子表达水平,具体操作参照试剂盒说明书严格执行。
1.7 造模成功的判定采用Masson染色Ashcroft纤维化评分进行造模成功与否判定。0分,正常肺组织。1分,肺泡或细支气管壁出现轻微纤维增厚。2分,肺组织结构未出现明显破坏,肺泡壁中度增厚。3分,肺组织出现实质改变,结构受损,形成纤维带或纤维团块。4分,肺组织遭到严重破坏,大面积肺间质纤维化,可能伴有蜂窝肺的形成。5分,肺间质纤维化累及全肺,肺组织完成闭塞坏死。
本实验取Ashcroft纤维化评分≥3分认定为造模成功。造模14 d后,3只小鼠Ashcroft评分均处于3~4分,造模成功。
1.8 统计学方法统计学采用SPSS26.0统计软件,计量资料以均数±标准差(x±s)表示,符合正态分布,组内自身比较采用配对t检验法,多组比较进行单因素方差分析;非正态分布采用秩和检验。以P<0.05为差异有统计学意义。
2 实验结果 2.1 小鼠一般情况空白对照组小鼠一般情况良好,进食进水量正常,活动正常,毛发光泽。博来霉素造模后各组均出现毛发枯黄,活动量明显减少,饮食量减少等表现。丹龙口服液干预后进食量略好转,精神状态略好转,活动能力较造模后灵活,未观察到明显呼吸系统症状;吡非尼酮干预组进食量未见好转,毛发枯黄,活动能力较造模后缓解,未观察到明显呼吸系统症状;模型组各项状态持续下降,实验结束时,模型组少数小鼠出现精神状态极差,活动极少等濒临死亡症状。
2.2 小鼠体质量变化情况本研究分别于造模0 d、造模1周末、造模2周末(给药日)、造模4周末、造模6周末(取材日)记录各组小鼠体质量。结果显示,各组小鼠在造模前体质量比较无统计学差异(P>0.05)。造模后,各造模组小鼠体质量增长缓慢;其中造模1周末,小鼠体质量较空白对照组出现差异,各组与空白对照组比较,差异均具有统计学意义(P<0.05)。造模4周末(给药2周末),小鼠体质量与空白对照组比较,差异有统计学意义(P<0.01)。造模6周末(给药4周末),小鼠体质量与空白对照组比较,差异有统计学意义(P<0.01),丹龙口服液组对比模型组体质量,差异具有统计学意义(P<0.01),与吡非尼酮组比较,差异具有统计学意义(P<0.05)。见表 1。
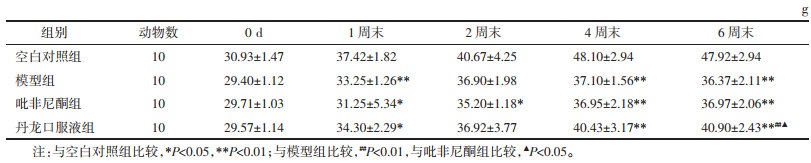
各组小鼠肺功能水平检测结果显示:与空白对照组比较,各组小鼠肺功能用力肺活量(FVC)、0.1 s用力呼气量(FEV0.1)差异具有统计学意义(P<0.05),模型组、吡非尼酮组深吸气量(IC)水平下降,差异有统计学意义(P < 0.01),丹龙口服液组IC有下降趋势,但差异无统计学意义(P > 0.05)。与模型组比较,各给药组小鼠肺功能水平均得到不同程度的改善,但差异无统计学意义;与西药吡非尼酮比较,各肺功能指标差异无统计学意义(P > 0.05);各组FEV0.1/FVC均未出现明显变化,符合限制性通气功能障碍特点。见表 2。
空白组肺组织结构基本正常,视野内肺泡上皮细胞胞核圆润,肺泡壁薄,未见增厚,肺泡结构完整,轮廓清晰,大小正常;支气管上皮细胞排列整齐紧密,未见脱落;组织未见明显炎症细胞浸润。
模型组肺组织结构重度异常,视野内肺泡结构紊乱,轮廓不清晰;少量支气管上皮细胞脱落,组织可见大量炎症细胞浸润,泡沫细胞数量明显增多。
吡非尼酮组肺组织结构轻度异常,视野内肺泡上皮细胞胞核圆润,肺泡壁薄,未见增厚,肺泡结构完整,轮廓清晰,大小正常;支气管管腔内可见少量蛋白黏液,组织可见少量炎症细胞浸润。
中成药组肺组织结构中度异常,视野内局部肺泡上皮细胞增生,肺泡壁增厚;支气管上皮细胞排列整齐紧密,未见脱落;组织未见明显炎症细胞浸润。
经比较可见,空白对照组基本正常;模型组病理变化最明显,损伤最严重;丹龙口服液组及吡非尼酮组出现轻度受损。主要病变为肺泡壁增厚和炎症细胞浸润。见图 1。
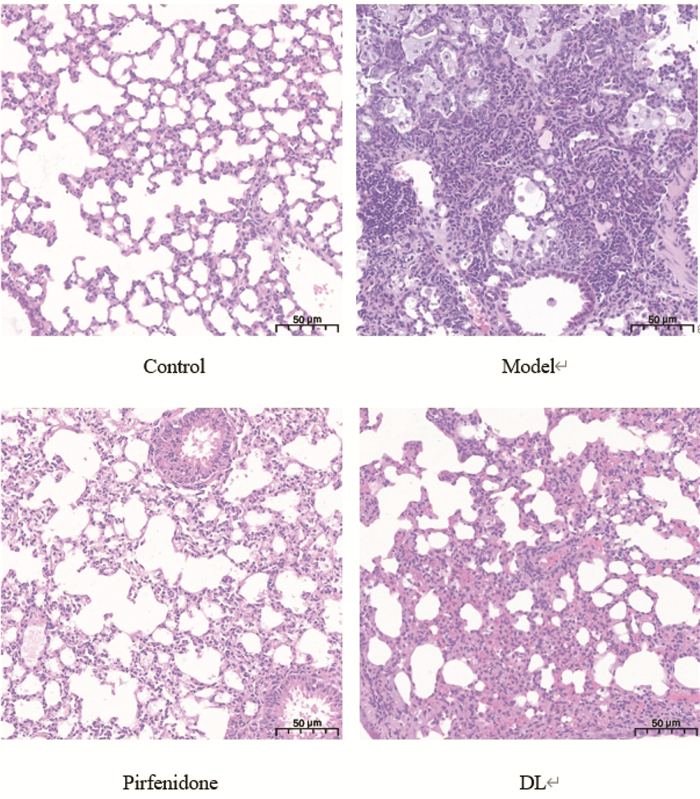
|
| 图 1 各组小鼠HE染色观察(×200) Fig. 1 H&E staining observation of mice in each group(×200) |
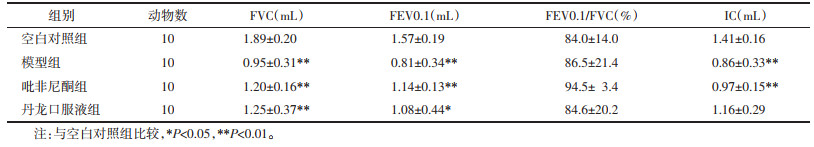
对肺组织进行炎症程度半定量分析,炎症程度评分如下:0分:无肺泡炎;1分:轻度肺泡炎,局部可见单核细胞浸润,面积小于20%,肺泡结构大致正常;2分:中度肺泡炎,病变面积占20%~50%;3分:重度肺泡炎和肺间质纤维化,病变面积大于50%,肺泡腔内偶有单核细胞和/或出血造成实变。
各组小鼠Szapiel评分(肺泡炎评分)检测结果显示:与空白对照组相比,各组小鼠肺功能Szapiel评分均出现不同程度升高,模型组及吡非尼酮组升高有统计学差异(P < 0.05);与模型组相比,各给药组小鼠Szapiel评分均得到不同程度的改善,丹龙口服液组改善明显(P < 0.05)。见表 3。
肺组织纤维化的明显特征之一为细胞外基质的沉积,常用Masson染色表示。空白对照组肺组织结构基本正常,可在支气管壁附近见到少量胶原沉积;模型组可在肺组织肺泡壁、支气管壁等周围见到大量胶原沉积,在全肺中呈弥漫性分布;丹龙口服液组可见胶原沉积减少;吡非尼酮组亦可在肺泡壁周围见到弥漫性胶原沉积,较丹龙口服液组相似。见图 2。
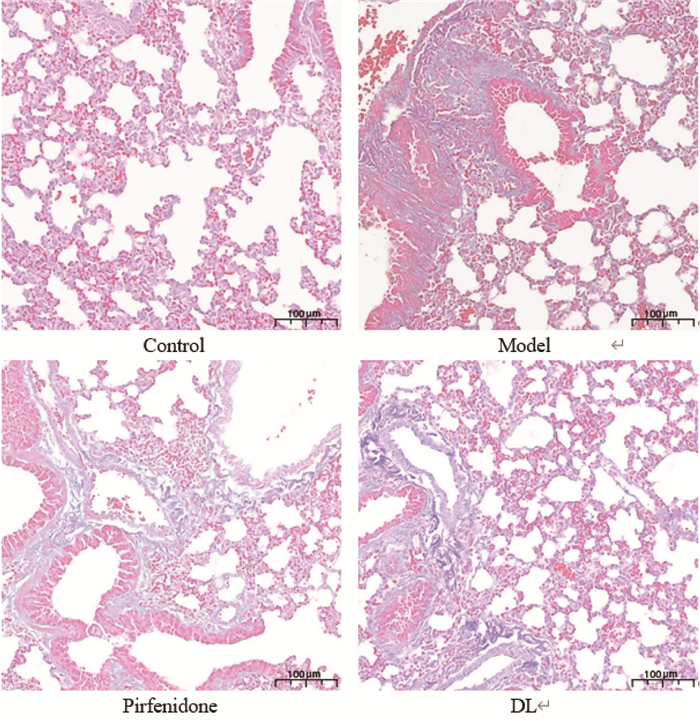
|
| 图 2 各组小鼠Masson染色观察(×200) Fig. 2 Observation of Masson staining in each group of mice(×200) |
各组小鼠Ashcroft评分水平显示:因空白对照组未出现明显肺组织结构改变,Ashcroft评分为0分,所有干预组较空白对照组比较,差异均具有统计学意义(P<0.01);与模型组比较,丹龙口服液组及吡非尼酮组小鼠Ashcroft评分均得到改善(P<0.05,P<0.01),改善程度吡非尼酮组更佳。见表 4。
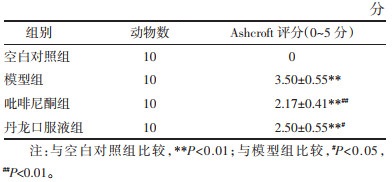
|
各组小鼠HYP检测结果显示:与空白对照组比较,各组小鼠HYP水平出现不同程度上升,差异具有统计学意义(P<0.01);与模型组比较,各给药组小鼠HYP水平均得到不同程度的改善(P<0.05),丹龙口服液组及吡啡尼酮组改善相似。见表 5。
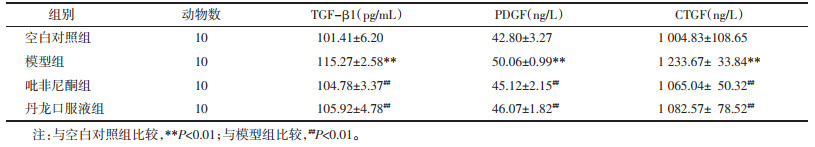
各组小鼠血清中促纤维化因子检测结果显示:与空白对照组比较,各组小鼠TGF-β1、PDGF、CTGF水平出现不同程度上升,模型组差异具有统计学意义(P<0.01),其余各组恢复较好;与模型组比较,各给药组小鼠促纤维化因子水平均得到明显改善(P<0.01),丹龙口服液药与吡啡尼酮水平相似,见表 6。各组小鼠肺泡灌洗液中促纤维化因子检测结果显示与血清促纤维化因子变化结果基本相似,模型组出现较空白对照组出现显著升高,丹龙口服液药及吡啡尼酮组水平大体相似,见表 7。
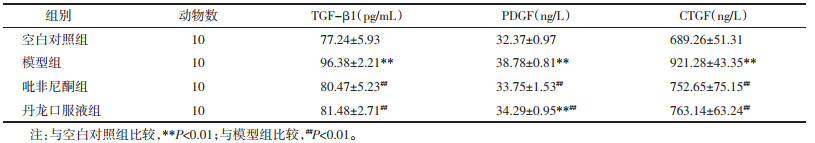
|
|
肺间质纤维化是一种主要累积肺间质和(或)肺泡为特征的特殊异质性疾病[7]。临床中常以咳嗽、气喘及进行性呼吸困难为主要临床表现[8]。目前临床中治疗肺间质纤维化的中成药种类较少,主要以活血化瘀类药物及补肺益气类药物为主[9-11]。丹龙口服液主要由麻黄、地龙、丹参、浙贝母、黄芩组成,其可清热平喘、豁痰化瘀,中医中对于肺间质纤维化的核心病机也存在相似的认识[12]。丹龙口服液兼顾益气、活血,同时加入止咳平喘的药物,治疗肺纤维化可标本兼治,内外同调,取得更为良好的治疗效果,实验结果显示其在缓解临床症状及改善组织损伤中均存在一定的作用。丹龙口服液治疗肺间质纤维化尤以缓解发作期症见咳嗽黄痰的患者最为有效。
实验结果显示,丹龙口服液在各指标中均与吡非尼酮治疗肺间质纤维化呈现相似或更佳水平。在体质量变化及一般情况中中成药较西药治疗更佳,可能与吡非尼酮存在较强不良反应相关,正因如此,限制了吡非尼酮的临床应用[13]。在肺功能水平中,两者较模型组比较均不存在统计学意义,但仍存在一定程度的改善,可能与肺纤维化治疗难度较高,实验周期较短相关。肺部炎症是引发肺间质纤维化的重要原因之一[14],通过HE染色及Szapiel评分显示,丹龙口服液及吡非尼酮均可在一定程度上减轻肺泡炎症,两者呈现相似的水平。肺组织Masson染色及Ashcroft评分显示西药较中成药更佳。在肺组织HYP及血清、肺泡灌洗液中TGF-β1、PDGF、CTGF等促纤维化因子表达水平中,两组呈现相似水平。实际临床中,应用吡非尼酮患者也常有相似表现,虽肺部症状或HRCT显示患者病情好转,但患者常自觉全身不适,中药及中成药的使用可以在很大程度中缓解西药治疗中的不足。
肺间质纤维化作为难治病,其病程长,治疗难度大,目前中医西医治疗本病仍缺乏有效明确的治疗方案。目前实验研究显示,肺间质纤维化的发病机制主要与肺泡上皮细胞的损伤与修复、成纤维细胞灶的形成、上皮细胞-间质细胞相互作用相关[15]。丹龙口服液治疗本病存在实际临床应用,本研究在机制上进行了初步研究,证明丹龙口服液可以对防治小鼠肺间质纤维化中起到一定的作用,其作用可能与抑制肺组织炎症及降低促纤维化因子水平相关。
但本研究存在些许不足,缺乏不同剂量丹龙口服液对肺纤维化的影响,后期将进一步实验完善;缺乏分子生物学研究,希望后期研究可以在分子生物学中进一步探讨,挖掘其具体作用机制,为中医药治疗肺间质纤维化提供进一步的参考。
| [1] |
SPAGNOLO P, MOLYNEAUX P L, BERNARDINELLO N, et al. The role of the lung's microbiome in the pathogenesis and progression of idiopathic pulmonary fibrosis[J]. International Journal of Molecular Sciences, 2019, 20(22): 5618. DOI:10.3390/ijms20225618 |
| [2] |
WUYTS W A, WIJSENBEEK M, BONDUE B, et al. Idiopathic pulmonary fibrosis: best practice in monitoring and managing a relentless fibrotic disease[J]. Respiration, 2020, 99(1): 73-82. DOI:10.1159/000504763 |
| [3] |
刘南飞, 郭思佳, 宋雅琳, 等. 芪术抗纤颗粒对肺纤维化大鼠肺组织病变防治作用的研究[J]. 中华中医药杂志, 2021, 36(6): 3182-3186. |
| [4] |
郭丽娅, 焦以庆, 王亚南, 等. 王玉光从肺痹、肺痿、喘脱三期论治间质性肺疾病经验[J]. 北京中医药, 2023, 42(12): 1313-1316. |
| [5] |
刘小凡, 李明权, 邵良碧, 等. 丹龙口服液治疗儿童支气管哮喘急性发作期(热哮证)的多中心临床研究[J]. 药物评价研究, 2019, 42(12): 2393-2397. |
| [6] |
徐叔云. 药理实验方法学[M]. 北京: 人民卫生出版社, 2002.
|
| [7] |
岑泽凯, 吴挺挺, 邓在春. 进展性肺纤维化预后血清生物标志物的研究进展[J]. 浙江医学, 2023, 45(17): 1895-1900, 1904. |
| [8] |
RAGHU G, REMY-JARDIN M, RICHELDI L, et al. Idiopathic pulmonary fibrosis(an update) and progressive pulmonary fibrosis in adults: an official ATS/ERS/JRS/ALAT clinical practice guideline[J]. American Journal of Respiratory and Critical Care Medicine, 2022, 205(9): e18-e47. DOI:10.1164/rccm.202202-0399ST |
| [9] |
王慧颖. 血栓通注射液抗博来霉素诱导大鼠肺纤维化药效和机制研究[D]. 北京: 中国中医科学院, 2023.
|
| [10] |
杨晗. 基于TGF-β/Smad/ERK信号转导通路的补阳还五汤拮抗肺纤维化机制研究[D]. 成都: 成都中医药大学, 2013.
|
| [11] |
肖雪, 李龙. 黄芪注射液通过抑制EMT过程中pERK1/2信号通路减轻肺纤维化[J]. 中国免疫学杂志, 2022, 38(19): 2342-2345. |
| [12] |
魏媛, 郭思佳, 王强, 等. 孙增涛教授辨治慢性致纤维化性间质性肺炎经验[J]. 世界中西医结合杂志, 2019, 14(12): 1680-1684. |
| [13] |
白子娜, 李幸彬. 吡非尼酮治疗特发性肺纤维化的研究进展[J]. 中国新药与临床杂志, 2023, 42(9): 560-565. |
| [14] |
MEYER K C. Pulmonary fibrosis, part Ⅰ: epidemiology, pathogenesis, and diagnosis[J]. Expert Review of Respiratory Medicine, 2017, 11(5): 343-359. |
| [15] |
鞠善良, 王在义. 特发性肺间质纤维化发病机制最新进展[J]. 临床肺科杂志, 2013, 18(1): 121-123. |
2. National Clinical Research Center for Chinese Medicine Acupuncture Moxibustion, Tianjin 300381, China;
3. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
 2024, Vol. 41
2024, Vol. 41