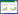文章信息
- 牟睿宇, 牛潇菲, 廖洋, 等.
- MOU Ruiyu, NIU Xiaofei, LIAO Yang, et al.
- 消岩汤联合甲磺酸阿帕替尼对胃癌荷瘤小鼠移植瘤的抑瘤作用及机制研究
- Inhibitory effect and mechanism of Xiaoyan Decoction combined with Apatinib Mesylate on transplanted tumor of gastric cancer bearing mice
- 天津中医药, 2024, 41(9): 1167-1172
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(9): 1167-1172
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.09.16
-
文章历史
- 收稿日期: 2024-05-09
2. 国家中医针灸临床医学研究中心, 天津 300381
胃癌是常见的消化道肿瘤,其发病率和病死率[1]近几年来不断上升,属于全球范围内的高发癌种。据中国最新流行病学统计[2],中国胃癌发病人数可达35.87万例,死亡人数可达26.4万例,严重危害国人的生命健康。磷脂酰肌醇3-激酶(PI3K)/丝苏氨酸蛋白激酶(AKT)信号通路是介导肿瘤发生发展的一条重要的信号通路[3],其可介导肿瘤的增殖、凋亡、自噬、周期阻滞、侵袭转移、血管新生、能量代谢以及免疫微环境等众多生物学过程[4-5],在肺癌、胃癌、乳腺癌、肝癌、结肠癌、前列腺癌等众多癌种中都占据着重要地位[6-7]。基质金属蛋白酶家族(MMPs),在肿瘤的侵袭转移以及血管生成等过程中占据重要地位,是驱动血管新生的关键因子[8-9]。作为MMPs家族的一员,基质金属蛋白酶(MMP)-9[10]可以促进肿瘤细胞突破基底膜和细胞外基质,增强其侵袭转移能力,同时促进肿瘤血管新生,加速肿瘤进展。消岩汤作为天津中医药大学第一附属医院贾英杰教授的经验方,已在临床应用十余年,并取得了良好的临床疗效。本研究团队的前期网络药理学研究和体外实验均证实,消岩汤可有效抑制胃癌细胞的增殖,诱导胃癌细胞凋亡,在胃癌治疗中发挥抗肿瘤作用。临床研究[11]结果显示,消岩汤联合甲磺酸阿帕替尼可有效延长晚期胃癌患者的中位生存时间,显著改善胃癌患者的生存质量,增强胃癌患者免疫力,减轻阿帕替尼相关不良反应。但消岩汤联合阿帕替尼的抗肿瘤作用机制尚不明确,基于此,本研究从体内实验入手,进一步探讨消岩汤联合阿帕替尼对MFC胃癌小鼠移植瘤的影响及其作用机制。
1 实验材料 1.1 实验动物及细胞BALB/c雄性小鼠25只,4~6周龄,体质量16~20 g,SPF级,由北京华阜康生物科技股份有限公司提供[许可证:SCXK(京)2019-0008];鼠源胃癌MFC细胞株,购自武汉普诺赛生命科技有限公司。
1.2 实验药品消岩汤(药物组成:黄芪30 g,郁金10 g,姜黄10 g,太子参15 g,白花蛇舌草10 g,夏枯草10 g,牡蛎15 g)购自天津中医药大学第一附属医院国药堂;甲磺酸阿帕替尼购自江苏恒瑞医药股份有限公司;0.9%无菌生理盐水购自辰欣药业股份有限公司。
1.3 主要实验试剂磷酸盐缓冲液(PBS)、蛋白上样缓冲液、彩虹180广谱蛋白Marker、TBST,均购自北京索莱宝科技有限公司;RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂、电泳液、转膜液、封闭液、一抗二抗稀释液、一抗二抗去除液,均购自上海碧云天生物技术有限公司;SDS-PAGE凝胶制备试剂盒、BCA蛋白浓度测定试剂盒、辣根过氧化物酶(HRP)羊抗兔免疫球蛋白G(IgG)(H+L)、HRP羊抗鼠IgG(H+L)、超特敏ECL化学发光即用型底物,均购自武汉博士德生物工程有限公司;p-PI3K抗体、p-AKT抗体,均购自美国CST公司;血管内皮生长因子A(VEGFA)抗体、血管内皮生长因子受体-2(VEGFR-2)抗体、MMP-9抗体、MMP-2抗体、Cleaved Caspase-9抗体、Bcl-2抗体、Bax抗体、GAPDH抗体,均购自Affinity公司。
1.4 主要实验仪器电子天平(上海海康电子仪器厂);游标卡尺(郑州康佳医疗器械有限公司);灌胃针(郑州康佳医疗器械有限公司);一次性无菌注射器(郑州康佳医疗器械有限公司);台式高速冷冻离心机(美国Thermo公司);组织研磨仪(南京先欧仪器制造有限公司);干式恒温金属浴(美国Thermo公司);小型垂直电泳槽、小型转印槽、电泳仪电源(美国Bio-Rad公司);凝胶成像分析系统(德国Jena公司)。
2 实验方法 2.1 胃癌小鼠移植瘤造模取对数期生长的MFC细胞,制备细胞悬液并将其细胞浓度调整为2.5×106个/mL,置于冰上保存,接种前要充分混匀,BALB/c小鼠右侧腋下消毒,用一次性无菌注射器吸取0.2 mL细胞悬液,接种于小鼠皮下,接种完成后每隔3 d观察小鼠肿瘤的生长情况。
2.2 实验分组与给药将造模成功的小鼠随机分为4组,每组5只,分别为荷瘤模型组、消岩汤组、阿帕替尼组以及联合用药组,未造模的5只小鼠为空白对照组。空白对照组给予0.9%无菌生理盐水每只小鼠0.2 mL/d,灌胃;荷瘤模型组给予0.9%无菌生理盐水每只小鼠0.2 mL/d,灌胃;消岩汤组给予浓度为1.4 g/mL的消岩汤每只小鼠0.2 mL/d,灌胃;阿帕替尼组给予甲磺酸阿帕替尼200 mg/(kg·d),灌胃;联合用药组给予甲磺酸阿帕替尼200 mg/(kg·d)+1.4 g/mL的消岩汤每只小鼠0.2 mL/d,灌胃,连续给药14 d。
2.3 观察与样本采集自接种之日起隔日观察各组小鼠的精神状态、外观及皮毛状态、活动状况、进食量、饮水情况、肿瘤体积等,做好记录。所有实验小鼠在药物干预14 d后脱颈处死,将小鼠皮下瘤组织完整剥离,拍照称质量,将肿瘤组织在离体0.5 h内迅速置于液氮罐中保存备用。
肿瘤体积计算公式:肿瘤体积(mm3)=长径(mm)×短径(mm)×短径(mm)/2
抑瘤率计算公式:抑瘤率=(模型组平均瘤质量-实验组平均瘤质量)/模型组平均瘤质量×100%
2.4 蛋白免疫印迹(Western Blotting)检测瘤组织中相关蛋白的表达情况称取约20 mg的小鼠肿瘤组织样本并将其剪碎,磷酸盐缓冲液(PBS)洗2次,加入2 mm研磨珠以及配好的裂解液(RIPA裂解液∶蛋白酶抑制剂∶磷酸酶抑制剂=100∶1∶1),放入组织研磨机中研磨3~5次,冰上裂解30 min,4 ℃离心10 min,离心半径10 cm,取上清液。利用BCA法对蛋白浓度进行检测,并将各组蛋白样本调整为相同浓度,加入等体积的2×蛋白上样缓冲液,95 ℃变性5 min。将Maker及各组蛋白样品分别加入各个泳道,恒压电泳,并按“三明治”法进行转膜,转膜完成后,取出PVDF膜,根据目的蛋白的分子量范围进行剪膜,加入封闭液封闭30~60 min,1×TBST洗3次,加入一抗4 ℃孵育过夜,1×TBST洗3次,加入二抗室温孵育1 h,1×TBST洗3次。利用凝胶成像系统曝光显影,并使用Image J软件对不同条带进行光密度分析。对于分子量重合的蛋白条带可利用去除液进行抗体洗脱。
2.5 统计学方法运用SPSS Statistics 21.0软件对实验结果进行分析,计量资料数据用均数±标准差(x±s)表示,若数据呈正态分布且方差齐,采用单因素方差分析,若方差不齐,则采用Welch Anova检验;若数据呈偏态分布,则采用Kruskal-Wallis秩和检验。P < 0.05表示差异具有统计学意义。
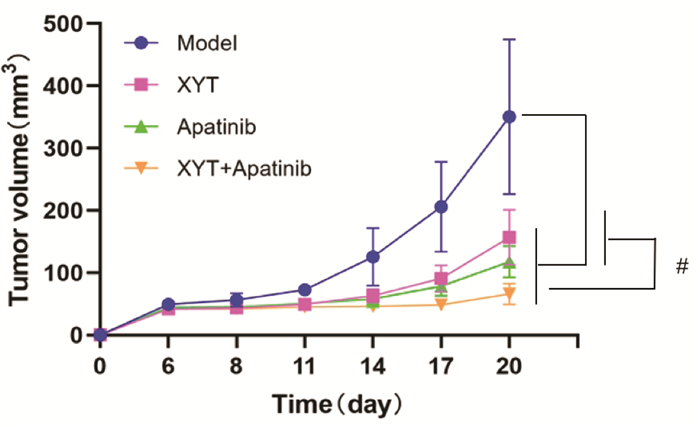
3 实验结果 3.1 消岩汤联合阿帕替尼对胃癌小鼠移植瘤体积的影响各组小鼠肿瘤体积随天数增长的变化见图 1。随着天数增长,各组小鼠的肿瘤体积逐渐增大,与模型组比较,消岩汤组、阿帕替尼组以及联合用药组的肿瘤生长趋势较为缓慢,其中联合用药组的增长趋势最为缓慢。给药14 d后的小鼠移植瘤情况见图 2。与荷瘤模型组(350.800±124.252)mm3比较,消岩汤组、阿帕替尼组以及联合用药组的肿瘤体积明显减小,分别为(157.063±44.417)(117.813±25.133)和(66.175±16.867)mm3。消岩汤组、阿帕替尼组以及联合用药组的抑瘤率分别为55.23%、66.42%、81.14%,与模型组比较,消岩汤组、阿帕替尼组以及联合用药组均具有统计学差异(P < 0.05),联合用药组与消岩汤组及阿帕替尼组比较,差异具有统计学意义(P < 0.05)。
|
| 注:Model,模型组;XYT,消岩汤组;Apatinib,阿帕替尼组;XYT+Apatinib,联合用药组。n=5。横坐标为种瘤天数,于第6天开始给药;与模型组比较,*P < 0.05;与联合用药组比较,#P < 0.05。 图 1 各组小鼠移植瘤体积变化折线图 Fig. 1 Line chart of volume changes of transplanted tumors of mice in each group |
|
| 注:Model,模型组;XYT,消岩汤组;Apatinib,阿帕替尼组;XYT+Apatinib,联合用药组。 图 2 各组小鼠移植瘤体积比较 Fig. 2 Comparison of transplanted tumor volumes of mice in different groups |
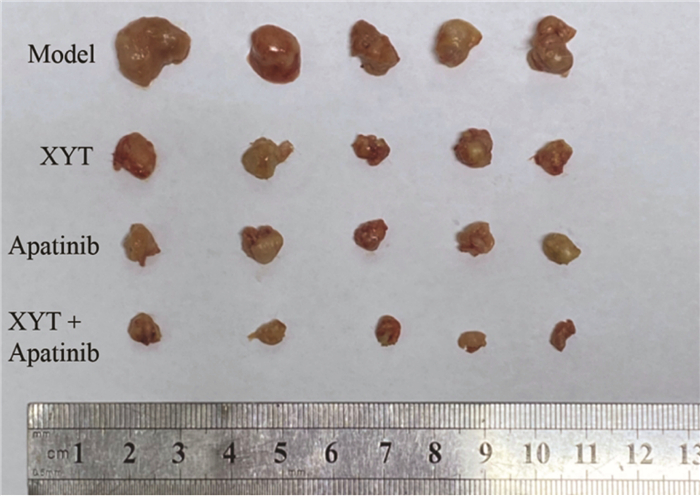
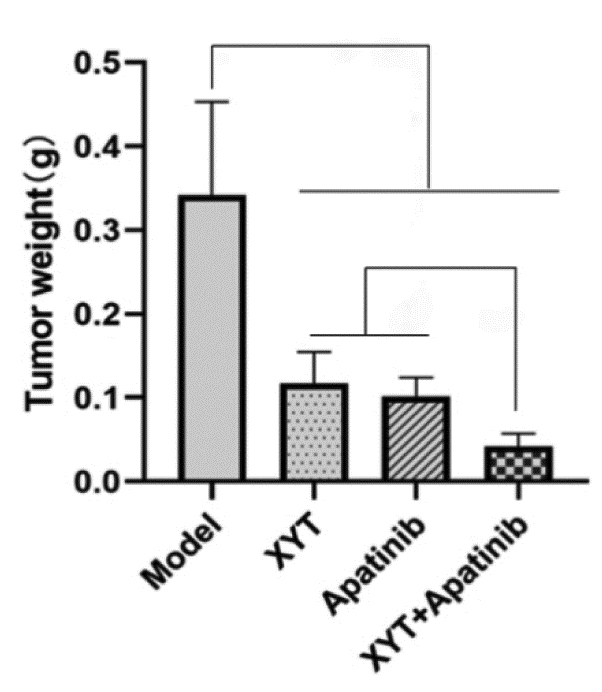
各组小鼠肿瘤质量结果见图 3,与模型组(0.342±0.111)g比较,消岩汤组、阿帕替尼组以及联合用药组的肿瘤质量均明显降低,分别为(0.117±0.037)(0.101±0.023)和(0.042±0.016)g,差异具有统计学意义(P < 0.05)。消岩汤组、阿帕替尼组以及联合用药组的抑瘤率分别为65.66%、70.39%、87.80%,与模型组比较,消岩汤组、阿帕替尼组以及联合用药组均具有统计学差异(P < 0.01);联合用药组与消岩汤组及阿帕替尼组比较,差异具有统计学意义(P < 0.01)。
|
| 注:Model,模型组;XYT,消岩汤组;Apatinib,阿帕替尼组;XYT+Apatinib,联合用药组。n=5。与模型组比较,**P < 0.01;与联合用药组比较,##P < 0.01。 图 3 各组小鼠移植瘤质量比较 Fig. 3 Comparison of tumor transplantation quality of mice in each groups |
通过Western Blot检测各组小鼠移植瘤组织中PI3K/AKT信号通路相关蛋白的表达情况,结果见图 4。相较于模型组,消岩汤组、阿帕替尼组以及联合用药组的p-PI3K、p-AKT、Bcl-2蛋白的表达量明显下调,Cleaved Caspase-9、Bax蛋白的表达量明显上调,差异均具有统计学意义(P < 0.05)。与消岩汤组和阿帕替尼组比较,联合用药组的p-PI3K、p-AKT、Bcl-2蛋白表达下调更为显著,Bax蛋白表达上调也更为显著,差异均具有统计学意义(P < 0.05),Cleaved Caspase-9蛋白表达上调并不显著,差异无统计学意义(P > 0.05)。
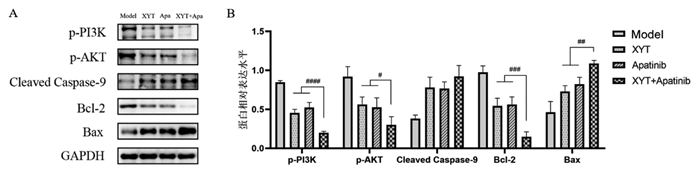
|
| 注:A,各组蛋白表达的情况;B,各组蛋白的相对表达水平的统计情况。Model,模型组;XYT,消岩汤组;Apatinib,阿帕替尼组;XYT+Apatinib,联合用药组。n=5。与模型组比较,**P < 0.01,***P < 0.001,****P < 0.000 1;与联合用药组比较,#P < 0.05,##P < 0.01,###P < 0.001,####P < 0.000 1。 图 4 各药物组对胃癌小鼠移植瘤组织中PI3K/AKT信号通路相关蛋白表达的影响 Fig. 4 Effects of different drug groups on the expression of PI3K/AKT signaling pathway related proteins in transplanted tumor tissues of gastric cancer mice |
通过Western Blot检测各组小鼠移植瘤组织中血管新生相关指标蛋白的表达情况,结果见图 5。与模型组比较,消岩汤组、阿帕替尼组以及联合用药组的MMP-9、MMP-2、VEGFA和VEGFR-2的蛋白表达水平均明显下调,差异均具有统计学意义(P < 0.05)。与消岩汤和阿帕替尼组比较,联合用药组的MMP-9、MMP-2和VEGFR-2蛋白表达水平下调更为显著,差异均具有统计学意义(P < 0.05),VEGFA蛋白表达水平下调并不显著,差异无统计学意义(P > 0.05)。
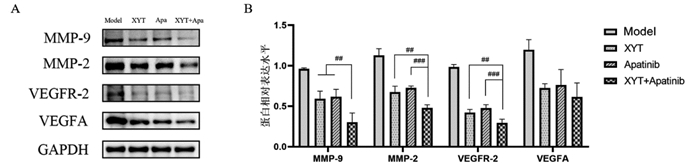
|
| 注:A,各组蛋白表达的情况;B,各组蛋白的相对表达水平的统计情况。Model,模型组;XYT,消岩汤组;Apatinib,阿帕替尼组;XYT+Apatinib,联合用药组。n=5。与模型组比较,**P < 0.01,***P < 0.001,****P < 0.000 1;与联合用药组比较,##P < 0.01,###P < 0.001。 图 5 各药物组对胃癌小鼠移植瘤组织中血管新生相关指标蛋白表达的影响 Fig. 5 Effects of different drug groups on the expression of angiogenic related protein markers in transplanted tumor tissues of gastric cancer mice |
血管新生[12]是恶性肿瘤的基本特征之一,在肿瘤的生长和转移过程中占据着重要地位,参与调控血管新生的相关因子及通路众多,其中血管内皮生长因子(VEGF)及其受体(VEGFR)是研究最为广泛且深入的血管生成特异性调控因子[13-14]。阿帕替尼[15]就是一种具有高度选择性的VEGFR-2拮抗剂,目前广泛应用于胃癌患者的临床治疗中,其可与胞内VEGFR-2的ATP结合位点竞争性结合,抑制其磷酸化过程,从而阻断下游信号通路的激活,抑制肿瘤血管生成。相关研究[16]发现,阿帕替尼除了抗血管生成作用之外,还可以促进胃癌SGC-7901和MKN-45细胞的凋亡和自噬,改变细胞周期分布,抑制胃癌细胞的侵袭和迁移。另有研究[17-18]表明,阿帕替尼可以显著下调VGEFR2/PI3K/AKT/MTOR信号通路中多种蛋白的磷酸化水平(p-VGEFR2、p-PI3K、p-AKT、p-MTOR),并改变凋亡相关基因的表达而促进凋亡,抑制肿瘤细胞增殖。
消岩汤是贾英杰教授的经验方,其药物组成主要包括黄芪、太子参、白花蛇舌草、夏枯草、生牡蛎、姜黄和郁金。研究发现,方中多味中药均具有抗肿瘤效果。黄芪提取物[19]可以有效抑制胃癌SGC-7901细胞增殖,诱导其凋亡;白花蛇舌草[20]可以阻滞细胞周期,同时还可以通过Caspase外源性通路诱导胃癌细胞发生凋亡;夏枯草提取物[21]可以通过抑制Wnt/β-catenin信号通路从而缓解MNNG诱导的大鼠胃癌;郁金[22]可以通过减少瘤体内MVD的表达从而抑制人胃癌裸鼠原位移植瘤生长和转移。
前期研究显示,消岩汤能有效抑制人胃癌MGC-803细胞增殖,诱导凋亡以及S期阻滞,抗胃癌作用机制与其对VEGF/PI3K/AKT信号通路的调控相关[23]。本研究从体内探讨了消岩汤联合阿帕替尼治疗胃癌的作用机制,分别对不同药物组作用后的胃癌小鼠移植瘤组织的PI3K/Akt信号通路相关蛋白表达水平进行了检测,结果显示消岩汤组、阿帕替尼组以及联合用药组的p-PI3K、p-AKT、Bcl-2的蛋白表达水平均显著下调(P < 0.05),Cleaved Caspase-9、Bax的蛋白表达水平均显著上调(P < 0.05),联合用药组对相关蛋白的调节作用要优于其他两组。这说明消岩汤、阿帕替尼及其联合用药均可通过PI3K/Akt信号通路调节下游Bax、Bcl-2以及Cleaved Caspase-9的表达,从而达到诱导肿瘤细胞凋亡的效果,联合用药组的调节作用更为理想。消岩汤组、阿帕替尼组以及联合用药组均可有效抑制胃癌小鼠移植瘤组织中VEGFA和VEGFR-2的表达(P < 0.05),联合用药组的表达较其他两组而言更低。
PI3K和AKT是这条信号通路中两个关键的作用分子[24],活化后的AKT可通过多条途径介导细胞凋亡[25],不仅可以磷酸化Bcl-2家族的Bad、Bax等,阻止其与Bcl-xL或Bcl-2结合,抑制细胞凋亡,还可以直接抑制Caspase-9磷酸化使其失活,从而抑制细胞凋亡。VEGF是目前研究最为广泛和深入的血管生成调控因子,VEGF家族成员主要包括VEGFA、VEGFB、VEGFC、VEGFD、VEGFE以及PLGF等[13]。相关研究[14, 26]表明,大多数恶性肿瘤都伴有VEGF高表达,VEGF可刺激血管内皮细胞的增殖,促进血管新生,进而促进肿瘤的生长增殖。VEGFR-2是VEGF的主要作用受体,当VEGF与VEGFR结合后,可以激活下游多条信号通路介导血管内皮细胞增殖,如:PI3K/Akt信号通路[27]、Ras-Raf-MEK-ERK信号通路[28]等。MMP-2和MMP-9均属于MMPs,在肿瘤的侵袭转移以及血管生成等过程中占据重要地位,是驱动血管新生的关键因子[8-9]。MMP-2[9, 29-30]可降解基底膜和细胞外基质蛋白成分,促进VEGF的分泌,从而促进血管新生。MMP-9[10]同样可以通过促进肿瘤细胞突破基底膜及细胞外基质向周围组织及脉管内侵袭,增强肿瘤的侵袭和转移能力,同时促进肿瘤新生血管的形成,加速肿瘤的进展,并影响预后。本研究利用Western Blot检测各组小鼠移植瘤组织中的MMP-9和MMP-2蛋白表达情况,结果显示消岩汤组、阿帕替尼组以及联合用药组均可有效抑制MMP-9和MMP-2的蛋白表达水平(P < 0.05),且与其他两组比较,联合用药组的抑制作用更为显著(P < 0.05),进一步证实了消岩汤联合阿帕替尼对血管生成的抑制作用。
阿帕替尼作为抗血管生成药物,其对VEGF和VEGFR-2的抑制作用之前就已被证实[31],结合其对PI3K/Akt信号通路相关蛋白的调节作用,推测消岩汤联合阿帕替尼主要通过调控VEGF/PI3K/Akt信号通路抑制血管生成,抑制胃癌小鼠移植瘤的生长,起到抗肿瘤效果。但中药复方的作用途径往往不是单一的,消岩汤联合阿帕替尼是否可以通过其他信号通路介导抗肿瘤作用,还值得进一步深入研究。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中国肿瘤杂志, 2024, 46(3): 221-231. |
| [3] |
TEWARI D, PATNI P, BISHAYEE A, et al. Natural products targeting the PI3K-Akt-mTOR signaling pathway in cancer: a novel therapeutic strategy[J]. Seminars in Cancer Biology, 2022, 80: 1-17. DOI:10.1016/j.semcancer.2019.12.008 |
| [4] |
HOXHAJ G, MANNING B D. The PI3K-AKT network at the interface of oncogenic signalling and cancer metabolism[J]. Nature Reviews Cancer, 2020, 20(2): 74-88. DOI:10.1038/s41568-019-0216-7 |
| [5] |
YANG Q, JIANG W, HOU P. Emerging role of PI3K/AKT in tumor-related epigenetic regulation[J]. Seminars in Cancer Biology, 2019, 59: 112-124. DOI:10.1016/j.semcancer.2019.04.001 |
| [6] |
FATTAHI S, AMJADI-MOHEB F, TABARIPOUR R, et al. PI3K/AKT/mTOR signaling in gastric cancer: epigenetics and beyond[J]. Life Sciences, 2020, 262: 118513. DOI:10.1016/j.lfs.2020.118513 |
| [7] |
DUAN Y, HAYBAECK J, YANG Z H. Therapeutic potential of PI3K/AKT/mTOR pathway in gastrointestinal stromal tumors: rationale and progress[J]. Cancers, 2020, 12(10): 2972. DOI:10.3390/cancers12102972 |
| [8] |
ZHANG J, WANG R R, CHENG L, et al. Celastrol inhibit the proliferation, invasion and migration of human cervical HeLa cancer cells through down-regulation of MMP-2 and MMP-9[J]. Journal of Cellular and Molecular Medicine, 2021, 25(11): 5335-5338. DOI:10.1111/jcmm.16488 |
| [9] |
LI H Q, ZHAO J, JIA X M, et al. MiR-21 promotes growth, invasion and migration of lung cancer cells by AKT/P-AKT/cleaved-caspase 3/MMP-2/MMP-9 signaling pathway[J]. International Journal of Clinical and Experimental Pathology, 2020, 13(4): 692-700. |
| [10] |
吴贤毅, 应敏刚. MMP-9表达与胃癌血管生成的关系及其临床意义[J]. 福建医药杂志, 2006, 28(6): 103-104, 182. |
| [11] |
石文君. 消岩汤联合甲磺酸阿帕替尼治疗晚期胃癌的回顾性研究[D]. 天津: 天津中医药大学, 2018.
|
| [12] |
PAVLOVA N N, THOMPSON C B. The emerging hallmarks of cancer metabolism[J]. Cell Metabolism, 2016, 23(1): 27-47. DOI:10.1016/j.cmet.2015.12.006 |
| [13] |
WISZNIAK S, SCHWARZ Q. Exploring the intracrine functions of VEGF-A[J]. Biomolecules, 2021, 11(1): 128. DOI:10.3390/biom11010128 |
| [14] |
GERSHTEIN E S, KOROTKOVA E A, PETROSYAN A P, et al. Prognostic significance of VEGF signaling system components and matrix metalloproteinases in blood serum of gastric cancer patients[J]. Klinicheskaia Laboratornaia Diagnostika, 2021, 66(11): 650-654. |
| [15] |
SCOTT L J. Apatinib: a review in advanced gastric cancer and other advanced cancers[J]. Drugs, 2018, 78(7): 747-758. DOI:10.1007/s40265-018-0903-9 |
| [16] |
LIU X, ZHENG Q Y, YU Q F, et al. Apatinib regulates the growth of gastric cancer cells by modulating apoptosis and autophagy[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2021, 394(5): 1009-1018. DOI:10.1007/s00210-020-02018-6 |
| [17] |
PENG H, ZHANG Q Y, LI J L, et al. Apatinib inhibits VEGF signaling and promotes apoptosis in intrahepatic cholangiocarcinoma[J]. Oncotarget, 2016, 7(13): 17220-17229. DOI:10.18632/oncotarget.7948 |
| [18] |
ZHANG H, CAO Y M, CHEN Y R, et al. Apatinib promotes apoptosis of the SMMC-7721 hepatocellular carcinoma cell line via the PI3K/Akt pathway[J]. Oncology Letters, 2018, 15(4): 5739-5743. |
| [19] |
尹波, 侯续伟, 李迪诺, 等. 黄芪提取物诱导人胃癌SGC-7901细胞凋亡的机制研究[J]. 中药药理与临床, 2014, 30(6): 112-114. |
| [20] |
江静, 肖刚, 侯俊明. 基于CASPASE信号通路探讨白花蛇舌草调控胃癌凋亡的影响[J]. 四川中医, 2018, 36(3): 65-67. |
| [21] |
刘萍, 王伟, 罗章梅. 夏枯草提取物对MNNG诱导的大鼠胃癌组织Wnt/β-catenin信号通路的影响[J]. 四川中医, 2021, 39(12): 52-55. |
| [22] |
蔡利军, 吕宾, 包海标, 等. 温郁金对人胃癌裸鼠原位移植瘤中MVD表达的影响[J]. 中华中医药学刊, 2010, 28(3): 638-640. |
| [23] |
牟睿宇, 李小江, 牛潇菲, 等. 基于VEGF/PI3K/AKT通路探讨消岩汤联合阿帕替尼抑制胃癌MGC-803细胞增殖的作用机制研究[J]. 天津中医药, 2024, 41(3): 354-359. |
| [24] |
JIANG N N, DAI Q J, SU X R, et al. Role of PI3K/AKT pathway in cancer: the framework of malignant behavior[J]. Molecular Biology Reports, 2020, 47(6): 4587-4629. |
| [25] |
SONG G, OUYANG G L, BAO S D. The activation of Akt/PKB signaling pathway and cell survival[J]. Journal of Cellular and Molecular Medicine, 2005, 9(1): 59-71. |
| [26] |
MA Y P, WANG W Y, LIU L L, et al. Co-expression of VEGF-B and FLT-1 correlates with malignancy and prognosis of gastric cancer[J]. Biomarkers in Medicine, 2021, 15(7): 481-488. |
| [27] |
ZHANG L X, TIAN Y G, ZHAO P, et al. Electroacupuncture attenuates pulmonary vascular remodeling in a rat model of chronic obstructive pulmonary disease via the VEGF/PI3K/Akt pathway[J]. Acupuncture in Medicine, 2022, 40(4): 389-400. |
| [28] |
YU J P. Apatinib affects the proliferation, migration and apoptosis of esophageal cancer cells both in vitro and in xenografts by regulating Ras/Raf/MEK/ERK and JAK2/STAT3 signaling pathways[J]. Journal of Clinical Oncology, 2019, 37(15_suppl): e15501. |
| [29] |
王博, 田霖丽, 刘鸣. MMP-2与喉癌关系的研究进展[J]. 现代肿瘤医学, 2018, 26(9): 1470-1472. |
| [30] |
ZHAO Y, WANG Q R, ZENG Y, et al. Gastrin/CCK-B receptor signaling promotes cell invasion and metastasis by upregulating MMP-2 and VEGF expression in gastric cancer[J]. Journal of Cancer, 2022, 13(1): 134-145. |
| [31] |
王爽. 阿帕替尼联合长春瑞滨对体内外乳腺癌细胞生长的抑制作用及其机制[D]. 长春: 吉林大学, 2019.
|
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China
 2024, Vol. 41
2024, Vol. 41