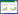文章信息
- 王佳丽, 李军祥, 石磊, 等.
- WANG Jiali, LI Junxiang, SHI Lei, et al.
- 基于Wnt/β-catenin通路研究芪地通便方对慢传输型便秘小鼠的影响
- Effects of Qidi Tongbian Prescription on mice with slow transit constipation based on Wnt/β-catenin pathway
- 天津中医药, 2024, 41(9): 1173-1181
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(9): 1173-1181
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.09.17
-
文章历史
- 收稿日期: 2024-03-04
2. 科学技术部科技人才交流开发服务中心, 北京 100864
便秘是临床上的一种常见病症,功能性便秘根据病理生理机制可分为慢传输型便秘(STC)、正常传输型便秘、排便障碍型便秘及混合型便秘[1]。STC是功能性便秘的重要类型,其特征为结肠传输速度减慢,以排便困难,排便次数减少,块状便或硬便及排便不尽感等为主要表现[2]。全球范围原发性便秘(FC)的合并患病率为15.3%[3],55%的便秘患者为STC[4]。中国人群FC的合并患病率为8.5%[5],结肠传输试验发现STC占53%左右[6]。部分长期便秘患者会出现腹胀、腹痛等不适,易产生抑郁、焦虑等精神心理障碍。便秘也是心脑血管病致命的危险因素[7]。可见便秘严重影响患者的生活质量,甚至是生命健康。
STC发病机制目前仍未完全明确,西医多认为与肠道菌群失调[8]、结肠运动减慢[9-10]、肠道屏障障碍[11-12]及水电解质失衡[13]等问题相关。STC的主要治疗目标是缓解临床症状,提高患者生存质量。目前国内外对于STC的治疗包括一般疗法、西药、微生物相关疗法、生物反馈疗法、生物电调节疗法、外科手术等。但长期服用泻剂可能会发生腹胀、腹泻等不良反应[14]。盐类泻剂可能诱发电解质紊乱[15]。粪菌移植的来源存在一定风险[16]。生物反馈疗法常用于排便障碍型便秘[17],STC较少应用。手术治疗患者损伤大,术后并发症多[18]。
中医药在解决STC临床问题中展现出了巨大潜力,李军祥教授系首届岐黄学者,北京中医药大学消化病研究院院长,从医30余年,治疗便秘经验丰富独到,创立芪地通便方治疗功能性便秘临床疗效良好,且该方已成功转化。但该方治疗便秘的作用机制尚不十分清楚。新近研究表明,Wnt信号会在各个点影响细胞周期,从而促进细胞增殖,对于维持肠道干细胞(ISC)处于自我更新状态至关重要[19]。受Wnt信号影响的ISC增殖分化形成的肠上皮细胞、内分泌细胞、间质细胞及其相关蛋白都对STC的发病有重要作用。因此本研究目的是为探索芪地通便方对STC小鼠药效学作用及基于Wnt/β-catenin信号的调节机制。
1 材料 1.1 实验动物BALB/c雄性小鼠,20~22 g,8~10周,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2021-0006。饲养于北京中医药大学SPF级动物房。该动物研究得到了北京中医药大学动物伦理委员会的审查和批准,批准文号:BUCM-4-2021081201-3131。
1.2 主要仪器与试剂酶标仪(RT-6100),深圳雷杜生命科学股份有限公司;正置光学显微镜(Eclipse E100)、成像系统(DS-U3)、正置荧光显微镜(Eclipse C1),Nikon公司,日本;荧光定量聚合酶链C反应(PCR)仪Applied Biosystems 7500,Thermo Fisher Scientific公司,美国;凝胶成像系统(Tanon 1600),上海天能科技有限公司。
β-Catenin rabbit polyclonal antibody(GB11015)、辣根过氧化物酶(HRP)标记山羊抗兔组化二抗(GB23303)、CY3标记山羊抗兔荧光二抗(GB21303)、组化试剂盒DAB显色剂(G1211),武汉赛维尔生物科技有限公司;TRNzol总RNA提取试剂(DP405-02),天根生化科技(北京)有限公司;PrimeScriptTM RT reagent Kit with gDNA Eraser(RR047B)、TB Green® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)(RR820A),TaKaRa宝日医生物技术(北京)有限公司;Anti-Wnt-3a抗体(ab219412)、Anti-TMEM16A抗体(ab64085),Abcam;小鼠Occludin(ml06348)、5-HT(ml00189)、AQP3(ml001869),上海酶联生物科技有限公司Elisa试剂盒。
1.3 药物芪地通便方配方颗粒是由生黄芪15 g,生地黄15 g,枳实9 g,白术9 g,肉苁蓉9 g,火麻仁10 g,威灵仙9 g,瓜蒌10 g,皂角刺6 g组成,购自北京中医药大学东方医院颗粒药房。盐酸洛哌丁胺(HY-B0418A),MedChemExpress公司。乳果糖L812332-5G,Macklin公司。
2 方法 2.1 实验分组、STC模型建立及药物干预30只小鼠适应性喂养7 d后,随机将其分为空白组、模型组、芪地通便方低剂量组、芪地通便方中剂量组、芪地通便方高剂量组及阳性对照组,每组5只。
盐酸洛哌丁胺[1 mg/(kg·d)]予除空白对照组外的小鼠,空白组则予无菌水,均灌胃0.1 mL,1次/日,共14 d。第15天起,持续造模的同时开始药物干预。芪地通便方各剂量组予对应剂量的芪地通便方灌胃给药(芪地通便方高剂量组:18.906 g/kg,相当于临床患者的标准用量;芪地通便方中剂量组:9.453 g/kg,中剂量组小鼠所需生药量为高剂量组的0.5倍;芪地通便方低剂量组:4.727 g/kg,低剂量组小鼠所需生药量为中剂量组的0.5倍),阳性对照组予乳果糖(3 g/kg),空白组和模型组予无菌水,均灌胃0.1 mL,1次/日,共14 d。第29天予炭末混悬液灌胃30 min后,吸入过量二氧化碳后处死小鼠。结肠取材后立即保存于冻存管,液氮中速冻后转移至-80 ℃冰箱保存,以备后续检测。
2.2 观察指标记录小鼠的体质量、粪便情况。最后1 d收集每只小鼠5粒粪便,称湿质量,60 ℃烘箱内干燥12 h,称干质量。最后1 d收集3 h内粪便计数。末次给药后,小鼠禁食不禁水12 h,5%阿拉伯树胶与10%活性炭配制的炭末混悬液灌胃,0.2 mL/只,30 min后吸入过量二氧化碳(CO2)麻醉处死,剖腹取小肠,测小肠推进率。
粪便含水率(%)=(湿质量-干质量)/湿质量×100%。
小肠推进率(%)=炭末在小肠移动的距离/幽门至回盲部上端的小肠全长×100%。
2.3 组织病理学结肠取材后于4%甲醛溶液固定,石蜡包埋,切3 μm切片,脱蜡至水,苏木精-伊红(HE)染色,脱水封固,镜下观察。
依据以上药效学评价指标,从芪地通便方低、中、高剂量组中筛选出最佳剂量组,结合空白组、模型组、阳性对照组进行以下机制研究。
2.4 荧光实时定量聚合酶链反应(Real-time PCR)检测结肠Wnt-3a、β-catenin mRNA采用TRNzol总RNA提取试剂进行样本RNA提取。采用PrimeScriPtTM RT reagent Kit with gDNA Eraser进行cDNA反转录,实验操作按产品说明书进行。基因引物由北京恩吉思生物科技有限公司设计,由生工生物合成,引物序列如下:Ctnnb1:上游AAGGTGCTGTCTGTCTGCTCTA,下游GCACAGGTGACCACATTTATATC;Wnt-3a:上游ACCCAACTTCTGCGAACCTA,下游GTAGCAGCACCAATGGAAAAC;GAPDH:上游AAATTCAACGGCACAGTCAA,下游TAGACTCCACGACATACTCAGCA。按TB Green® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)说明书配置反应体系并加样,于Applied Biosystems 7500 PCR仪检测。按以下程序进行:95 ℃,30 s;40个PCR循环(95 ℃,5 s;60 ℃,40 s);95 ℃,10 s;60 ℃,60 s;95 ℃,15 s;并从60 ℃缓慢加热到99 ℃,每个样本检测3个复孔。数据采用2-ΔΔCT法进行分析。
2.5 免疫组化法检测结肠Wnt-3a、β-catenin蛋白将石蜡切片脱蜡至水,用EDTA抗原修复缓冲液(pH9.0)修复抗原,3%双氧水阻断内源性过氧化物酶,加3% BSA血清封闭,加一抗(Wnt-3a,1∶500;β-catenin,1∶1 500)、二抗(HRP标记,1∶200)覆盖组织,加DAB显色,苏木精复染细胞核,脱水封片,镜检。每张原图放大至20 μm,从上下左右中间各拍一张图片,每个标本共计5张图。Image Pro Plus 6.0分析平均光密度值(MOD)。
2.6 免疫荧光法检测结肠Ano1蛋白将石蜡切片脱蜡至水,用EDTA抗原修复缓冲液(pH9.0)修复抗原,加自发荧光淬灭剂淬灭组织自发荧光,加BSA血清封闭,加一抗(Ano1,1∶100)、加二抗(CY3标记,1∶300),DAPI复染细胞核,加抗荧光淬灭封片剂封片,镜检。每张原图放大至20 μm,从上下左右中间各拍一张图片,每个标本共计5张图。Image J分析平均荧光强度(AU)。
2.7 ELISA检测结肠Occludin、5-HT、AQP3蛋白称20 mg结肠组织,加入200 μL磷酸盐缓冲液(PBS)置于冰上匀浆,4 ℃,3 000 r/min,离心半径为10 cm,离心10 min取上清液;按说明书步骤检测,酶标仪在450 nm波长处测定各孔的OD值。通过标准曲线计算样本蛋白含量。
2.8 统计学方法采用SPSS 23.0统计分析,正态分布的计量资料采用均数±标准差(x±s)进行描述,多组间比较采用单因素方差分析,两两比较,方差齐采用LSD检验,方差不齐采用Tamhane’s T2检验。非正态分布的计量资料采用中位数和四分位数间距M(P25,P75)进行描述,多组间比较采用Kruskal-Wallis非参数检验。以P < 0.05为差异有统计学意义。
3 结果 3.1 一般状况实验中6组小鼠均死亡1只,每组余4只小鼠。空白组小鼠毛顺,精神反应好。造模期间,予洛哌丁胺的小鼠毛糙,精神反应差。给药期间,芪地通便方中剂量组和高剂量组和阳性对照组小鼠背毛和精神反应逐渐改善,芪地通便方低剂量组小鼠一般状况无明显改善。实验中6组体质量增长趋势小于空白组,见图 1。给药14 d后,模型组体质量增加小于空白组(P < 0.01),芪地通便方高剂量组与阳性对照组体质量增加大于模型组(P < 0.01)。见表 1。肉眼观察小鼠粪便情况,与空白组比较,模型组粪便稍干硬、颗粒小;与模型组比较,芪地通便方高剂量组与阳性对照组粪便较软润、颗粒大,见图 2。
|
| 图 1 各组小鼠体质量增长趋势 Fig. 1 Weight gain trend of mice in each group |
|

|
| 图 2 各组小鼠粪便情况 Fig. 2 Fecal situation of mice in each group |
模型组小鼠粪便含水率与数量及小肠推进率小于空白组,差异有统计学意义(P < 0.01)。芪地通便方高剂量组与阳性对照组粪便含水率、数量及小肠推进率大于模型组,差异有统计学意义(P < 0.05,P < 0.01);芪地通便方中剂量组粪便数量大于模型组(P < 0.05),差异有统计学意义。见表 1。小肠炭末推进实验见图 3。

|
| 图 3 各组小肠炭末推进实验情况 Fig. 3 Small intestinal charcoal powder propulsive experiment in each group |
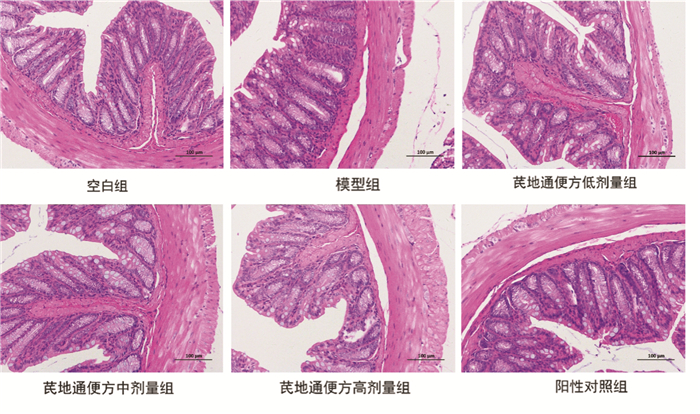
HE染色结果肉眼观察,6组结肠组织结构完整,杯状细胞数量、大小未见明显改变。尽管模型组固有肌层较薄,肠上皮稍不规整,隐窝排列略紊乱。但整体而言,6组小鼠的结肠病理学差别不明显,见图 4。
|
| 图 4 各组小鼠结肠病理学表现(HE染色,×200) Fig. 4 Histopathological main festations of colon tissues of mice in each group(He staining, ×200) |
综合上述各指标,芪地通便方高剂量组为最佳剂量组。选取空白组、模型组、芪地通便方高剂量组(h)及阳性对照组进一步探究芪地通便方对Wnt/β-catenin通路的影响。
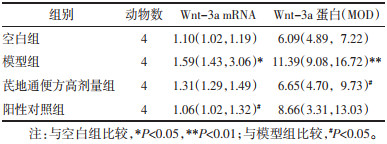
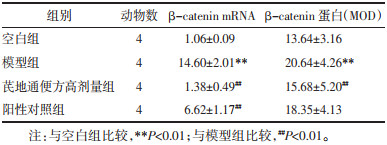
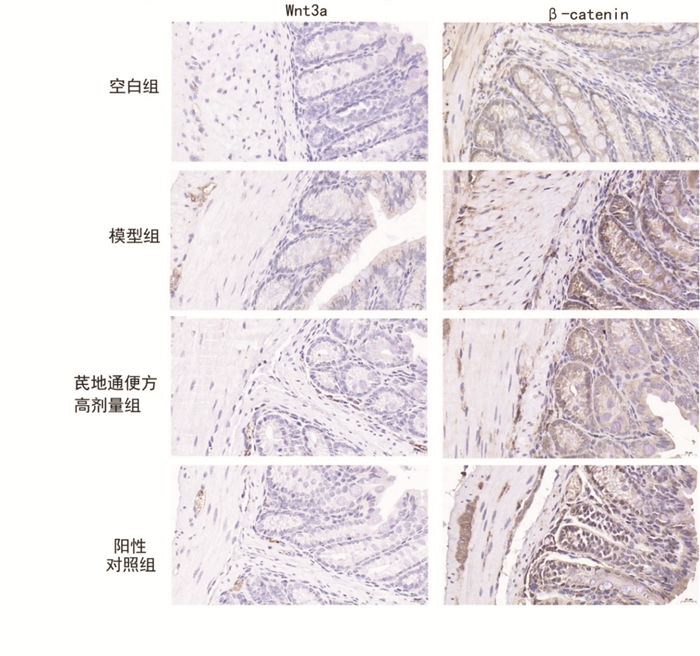
3.4 结肠Wnt-3a、β-catenin mRNA和蛋白水平模型组小鼠Wnt-3a mRNA和Wnt-3a蛋白表达,β-catenin mRNA和β-catenin蛋白表达均大于空白组,差异有统计学意义(P < 0.05,P < 0.01)。芪地通便方高剂量组Wnt-3a蛋白表达、β-catenin mRNA和β-catenin蛋白表达小于模型组,差异有统计学意义(P < 0.05,P < 0.01);阳性对照组Wnt-3a mRNA和β-catenin mRNA小于模型组,差异有统计学意义(P < 0.05,P < 0.01)。见表 2、表 3。Wnt-3a、β-catenin蛋白免疫组化染色见图 5。
|
|
|
| 图 5 4组小鼠结肠免疫组化染色情况(×400) Fig. 5 Immunohistochemical staining of colon tissue of mice in four groups(×400) |
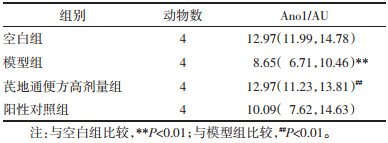
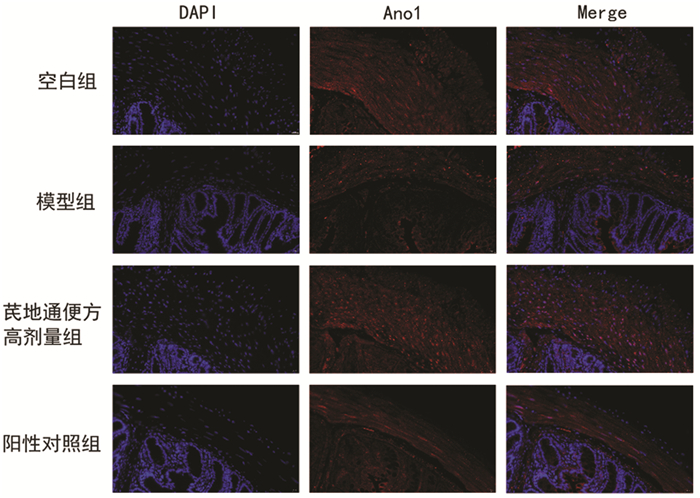
模型组小鼠Ano1蛋白表达小于空白组,差异有统计学意义(P < 0.01)。芪地通便方高剂量组Ano1蛋白表达大于模型组,差异有统计学意义(P < 0.01)。见表 4。Ano1蛋白免疫荧光染色见图 6。
|
|
| 图 6 4组小鼠结肠免疫荧光染色情况(×400) Fig. 6 Immunofluorescence staining of colon of mice in four groups(×400) |
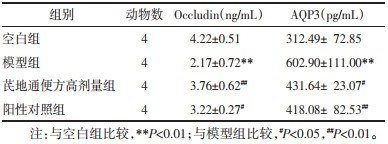
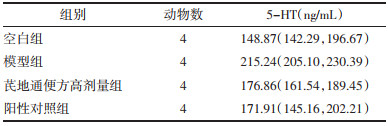
模型组小鼠Occludin和AQP3表达与空白组比较,差异具有统计学意义(P < 0.01);芪地通便方高剂量组和阳性对照组小鼠Occludin和AQP3表达与模型组比较,差异具有统计学意义(P < 0.05,P < 0.01);模型组小鼠5-HT表达与空白组比较,以及芪地通便方高剂量组和阳性对照组5-HT与模型组比较,差异均无统计学意义(P > 0.05)。见表 5、表 6。
|
|
芪地通便方对72例功能性便秘患者的临床研究结果发现:芪地通便方治疗功能性便秘临床疗效好,安全性高,能够改善排便困难程度、增加排便频率、减少排便时间,并能提高便秘患者的生活质量[20]。但该方作用机制尚不明确。因此,本研究在前期临床研究的基础上,结合前期报道[21],采用10 mg/kg盐酸洛哌丁胺灌胃BLAB/c小鼠14 d的方法诱导STC模型,随后以芪地通便方配方颗粒及阳性对照药乳果糖进行干预,观察其治疗STC的疗效。研究结果显示,与空白组比较,模型组小肠推进率、粪便数量和含水率明显降低,且结肠无明显病理改变,符合功能性便秘的特征,证明STC造模成功。与模型组比较,高剂量的芪地通便方与阳性药物乳果糖均能提高小肠推进率、粪便数量和含水率。乳果糖作为渗透性泻剂是功能性便秘首选的维持疗法,临床中较为常用,其疗效毋庸置疑,但乳果糖也存在腹痛、腹胀的不良反应[22],而芪地通便方临床研究显示临床疗效好,安全性高,且无明显不良反应,基于以上考量,本研究采用了乳果糖作为阳性对照药物来探究芪地通便方治疗便秘的具体机制。研究中也发现,在芪地通便方的3种剂量组中,芪地通便方高剂量组在各个指标中体现出疗效最佳,且其疗效与乳果糖相当。故机制研究采用了芪地通便方高剂量组,以及空白组、模型组和阳性对照组。
Wnt信号是一种保守的,与细胞增殖、分化及迁移相关的信号通路,也是调节肠上皮稳态的关键信号机制之一[23]。Wnt信号传导是由Wnt激活的多种信号转导步骤介导的。最经典的信号传导是Wnt/β-catenin途径,包括4个阶段:细胞外信号段、膜段、细胞质段和核段。细胞外信号主要由Wnt配体介导,如Wnt-3a;细胞膜段主要包含Wnt配体与Wnt受体Frizzled(特异性七倍跨膜受体Frizzled蛋白)和LRP5/6(共受体低密度脂蛋白受体相关蛋白5或6)结合;细胞质段主要包括Wnt配体和受体结合诱导破坏复合物(结肠腺瘤性息肉蛋白,支架蛋白AXIN,酪蛋白激酶1和糖原合酶激酶3)被破坏,导致β-catenin不能被降解而蓄积在细胞质中;核段主要包括β-catenin易位到细胞核并与其中的T细胞因子/淋巴增强因子(TCF/LEF)结合以激活靶基因转录[24]。众所周知,便秘存在肠道屏障的受损,β-catenin是肠机械屏障黏附连接(AJ)的关键成分[25],IBS-C患者的末端回肠黏膜中β-catenin的mRNA表达较健康对照人群更高[26],便秘动物模型表现出Wnt、β-catenin蛋白相对表达水平比空白组更高[27],因此,便秘可能存在Wnt、β-catenin的过度激活。本研究结果与以上前人研究趋势一致,通过Real Time PCR和免疫组织化学染色检测Wnt-3a和β-catenin mRNA和蛋白表达水平发现,与空白组比较,模型组结肠Wnt和β-catenin mRNA和蛋白含量明显升高,芪地通便方干预可能抑制Wnt、β-catenin的过度激活,明显降低了便秘小鼠结肠Wnt和β-catenin蛋白及β-catenin mRNA含量。
Cajal间质细胞(ICC)是的胃肠道运动起搏细胞[28],结肠ICC减少以及分布、结构、功能异常会损害慢波传播,且最终损害肠道的运动和运输[29],导致STC发生。相比ICC的另一种标记物KIT,Ano1不标记肥大细胞,是比KIT更靠谱的ICC标志物[30],因此,Ano1可以作为ICC在健康和疾病状态下的独立替代标志物。采用Ano1的免疫反应性检测STC患者结肠组织,表现出ICC的耗竭[31]。众多动物实验也证实了洛哌丁胺诱导的便秘小鼠结肠组织c-Kit和Ano1mRNA表达和蛋白水平的降低。最近研究表明,Wnt/β-catenin信号传导的长期过度激活则会导致肠ICC干细胞生长停滞,进而使ICC耗竭[32],本研究中,免疫荧光染色检测ICC独特标记物Ano1的蛋白表达水平发现,模型组Ano1含量较空白组低,与以上前人研究趋势相符,与模型组比较,芪地通便方能提高STC小鼠Ano1的表达,使ICC含量向正常水平靠近,维持ICC的正常增殖。
肠屏障功能结构的正常也是结肠正常运动的重要因素。其重要成分是机械屏障中的TJ[33]。Occludin是构成细胞之间TJ的重要跨膜蛋白[34]。便秘涉及到Occludin表达下调导致的肠机械屏障受损,与健康对照人群比较,在IBS-C患者的结肠活检中能观察到Occludin水平降低[35],洛哌丁胺诱导的便秘小鼠模型也表现出结肠组织中Occludin蛋白下调[36]。有研究表明,β-catenin可以特异性诱导屏障TJ蛋白的表达[37],肠干细胞的异常增殖在某种程度上意味着肠屏障受损,而抑制Wnt/β-catenin信号传导能限制肠干细胞增殖,从而可以恢复屏障稳态[38]。5-HT是一种由肠嗜铬细胞和肌间神经丛的5-HT能神经元合成的旁分泌信使,能促进肠黏膜上皮分泌和结肠运动,是肠神经系统重要的神经递质[39]。有报道显示,STC患者黏膜层5-HT3和5-HT4受体表达明显降低,5-HT升高[40-41]。最新研究显示肠道微生物群能通过利用5-HT促进ISC中的Wnt/β-catenin信号传导以促进其自我更新[42],ISC的更新增殖可能进一步意味着分化形成的包括嗜铬细胞在内各种肠上皮细胞更多,5-HT产生也相应增加。有研究称5-HT可调控AQP3的表达,结肠嗜铬细胞过量分泌的5-HT会被转运蛋白带入上皮细胞内,进而激活过氧化物酶体增殖物激活受体γ信号通路,最终导致下游AQP3 mRNA的表达升高[43]。可在FC患者的结肠活检中观察到AQP3的上调[44],洛哌丁胺诱导的便秘小鼠模型也表现出结肠上皮细胞中AQP3水平的升高[45]。本研究发现STC可能存在结肠Wnt/β-catenin信号过度激活,而芪地通便方可以抑制其过度激活,进一步采用ELISA检测4组小鼠结肠Occludin、5-HT和AQP3蛋白含量发现,与空白组比较,模型组结肠Occludin蛋白含量明显降低,体现出肠屏障结构功能受损,模型组5-HT含量与空白组比较虽无统计学差异,但有升高的趋势,可能意味着结肠运动障碍,AQP3蛋白含量明显升高,体现出水液失衡,芪地通便方干预后,明显提高了Occludin的含量,降低了AQP3的含量,芪地通便方高剂量组5-HT含量与模型组比较虽无统计学差异,但有降低趋势,可能有益于肠屏障恢复稳态,降低结肠水吸收,促进结肠运动,使水分能尽可能多地保留在肠腔中,从而利于粪便含水率提高使粪便软化,便于排出。
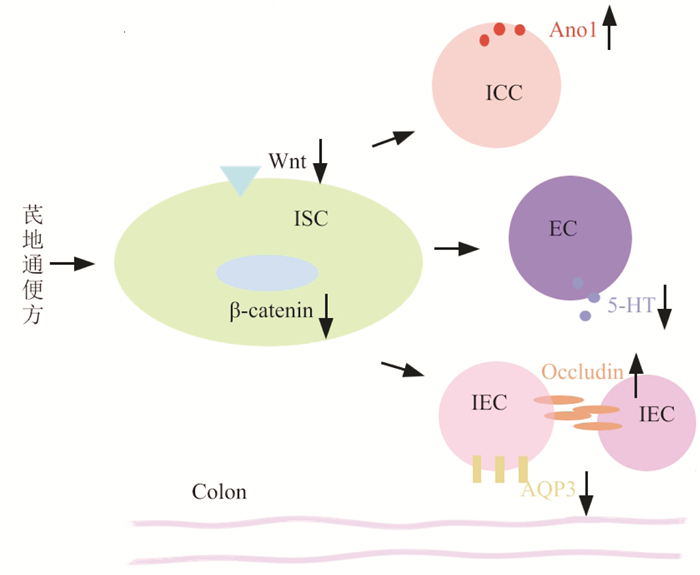
5 结论芪地通便方可能通过抑制Wnt/β-catenin的过度激活,上调Ano1蛋白水平,维持ICC的正常增殖,上调Occludin,下调5-HT、AQP3蛋白水平(见图 7),改善结肠运动、肠屏障结构功能和水的运输,增加小肠推进率、粪便含水率和数量,促进排便,从而发挥治疗STC的作用。但由于Wnt/β-catenin通路较为复杂,且涉及下游成员之间的关系,其治疗STC的确切机制需进一步深入研究。
|
| 图 7 芪地通便方治疗慢传输型便秘潜在的作用环节 Fig. 7 Potential role of Qidi Tongbian Prescription in the treatment of slow transit constipation |
| [1] |
中华医学会消化病学分会胃肠动力学组, 中华医学会消化病学分会功能性胃肠病协作组. 中国慢性便秘专家共识意见(2019, 广州)[J]. 中华消化杂志, 2019, 39(9): 577-598. DOI:10.3760/cma.j.issn.0254-1432.2019.09.001 |
| [2] |
MEARIN F, LACY B E, CHANG L, et al. Bowel Disorders[J]. Gastroenterology, 2016, 150: 1393-1407. DOI:10.1053/j.gastro.2016.02.031 |
| [3] |
BARBERIO B, JUDGE C, SAVARINO E V, et al. Global prevalence of functional constipation according to the Rome criteria: a systematic review and meta-analysis[J]. The Lancet Gastroenterology & Hepatology, 2021, 6(8): 638-648. |
| [4] |
TANNER S, CHAUDHRY A, GORAYA N, et al. Prevalence and clinical characteristics of dyssynergic defecation and slow transit constipation in patients with chronic constipation[J]. Journal of Clinical Medicine, 2021, 10(9): 2027. DOI:10.3390/jcm10092027 |
| [5] |
CHEN Z, PENG Y Y, SHI Q Y, et al. Prevalence and risk factors of functional constipation according to the Rome criteria in China: a systematic review and meta-analysis[J]. Frontiers in Medicine, 2022, 9: 815156. DOI:10.3389/fmed.2022.815156 |
| [6] |
王娅琼. 结肠传输试验对慢性功能性便秘诊断和分型的临床研究[D]. 蚌埠: 蚌埠医学院, 2019.
|
| [7] |
吕恒刚, 宋云平, 郭莘. 便秘的危害及预防[J]. 解放军预防医学杂志, 2019, 37(8): 198. |
| [8] |
EMMANUEL A V, TACK J, QUIGLEY E M, et al. Pharmacological management of constipation[J]. Neurogastroenterology & Motility, 2009, 21: 41-54. |
| [9] |
BASSOTTI G, ROBERTO G D, CASTELLANI D, et al. Normal aspects of colorectal motility and abnormalities in slow transit constipation[J]. World Journal of Gastroenterology, 2005, 11(18): 2691-2696. DOI:10.3748/wjg.v11.i18.2691 |
| [10] |
XU C, CONG J Y, LIU T T, et al. The colonic motility and classification of patients with slow transit constipation by high-resolution colonic manometry[J]. Clinics and Research in Hepatology and Gastroenterology, 2022, 46(9): 101998. DOI:10.1016/j.clinre.2022.101998 |
| [11] |
GAO X Y, HU Y F, TAO Y F, et al. Cymbopogon citratus(DC.) Stapf aqueous extract ameliorates loperamide-induced constipation in mice by promoting gastrointestinal motility and regulating the gut microbiota[J]. Frontiers in Microbiology, 2022, 13: 1017804. DOI:10.3389/fmicb.2022.1017804 |
| [12] |
ZHAN Y, WEN Y, DU L J, et al. Effects of Maren pills on the intestinal microflora and short-chain fatty acid profile in drug-induced slow transit constipation model rats[J]. Frontiers in Pharmacology, 2022, 13: 804723. DOI:10.3389/fphar.2022.804723 |
| [13] |
ZHAO Q, CHEN Y Y, XU D Q, et al. Action mode of gut motility, fluid and electrolyte transport in chronic constipation[J]. Frontiers in Pharmacology, 2021, 12: 630249. DOI:10.3389/fphar.2021.630249 |
| [14] |
LI H, ZHANG P F, XUE Y Z. A comparison of the safety and efficacy of polyethylene glycol 4 000 and lactulose for the treatment of constipation in pregnant women: a randomized controlled clinical study[J]. Annals of Palliative Medicine, 2020, 9(6): 3785-3792. DOI:10.21037/apm-20-1674 |
| [15] |
SOUTHWELL B R. Treatment of childhood constipation: a synthesis of systematic reviews and meta-analyses[J]. Expert Review of Gastroenterology & Hepatology, 2020, 14(3): 163-174. |
| [16] |
BLASER M J. Fecal microbiota transplantation for dysbiosis-predictable risks[J]. The New England Journal of Medicine, 2019, 381(21): 2064-2066. DOI:10.1056/NEJMe1913807 |
| [17] |
SHARMA A, RAO S S C, KEARNS K, et al. Review article: diagnosis, management and patient perspectives of the spectrum of constipation disorders[J]. Alimentary Pharmacology & Therapeutics, 2021, 53(12): 1250-1267. |
| [18] |
CORSETTI M, BROWN S, CHIARIONI G, et al. Chronic constipation in adults: contemporary perspectives and clinical challenges. 2:conservative, behavioural, medical and surgical treatment[J]. Neurogastroenterology and Motility, 2021, 33(7): e14070. DOI:10.1111/nmo.14070 |
| [19] |
NUSSE R, CLEVERS H. Wnt/β-catenin signaling, disease, and emerging therapeutic modalities[J]. Cell, 2017, 169(6): 985-999. DOI:10.1016/j.cell.2017.05.016 |
| [20] |
杨志然, 李军祥, 陈润花, 等. 芪地通便方治疗功能性便秘患者的临床疗效分析[J]. 中国中西医结合消化杂志, 2022, 30(12): 820-825. DOI:10.3969/j.issn.1671-038X.2022.12.02 |
| [21] |
HUANG J Q, LI S Y, WANG Q, et al. Pediococcus pentosaceus B49 from human colostrum ameliorates constipation in mice[J]. Food & Function, 2020, 11(6): 5607-5620. |
| [22] |
中华医学会, 中华医学会杂志社, 中华医学会消化病学分会, 等. 慢性便秘基层诊疗指南(2019年)[J]. 中华全科医师杂志, 2020, 19(12): 1100-1107. DOI:10.3760/cma.j.cn114798-20201030-01109 |
| [23] |
KRIZ V, KORINEK V. Wnt, RSPO and hippo signalling in the intestine and intestinal stem cells[J]. Genes, 2018, 9(1): 20. DOI:10.3390/genes9010020 |
| [24] |
LIU J Q, XIAO Q, XIAO J N, et al. Wnt/β-catenin signalling: function, biological mechanisms, and therapeutic opportunities[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 3. DOI:10.1038/s41392-021-00762-6 |
| [25] |
CHO Y E, KIM D K, SEO W, et al. Fructose promotes leaky gut, endotoxemia, and liver fibrosis through ethanol-inducible cytochrome P450-2E1-mediated oxidative and nitrative stress[J]. Hepatology, 2021, 73(6): 2180-2195. DOI:10.1002/hep.30652 |
| [26] |
WANG X J, CARLSON P, CHEDID V, et al. Differential mRNA expression in ileal mucosal biopsies of patients with diarrhea- or constipation-predominant irritable bowel syndrome[J]. Clinical and Translational Gastroenterology, 2021, 12(4): e00329. DOI:10.14309/ctg.0000000000000329 |
| [27] |
吕高波, 姚远, 王亚儒. 白芍总苷通过调控Wntβ/catenin信号通路对便秘大鼠胃肠功能的治疗作用及机制研究[J]. 临床和实验医学杂志, 2021, 20(10): 1055-1058. DOI:10.3969/j.issn.1671-4695.2021.10.013 |
| [28] |
SANDERS K M. Spontaneous electrical activity and rhythmicity in gastrointestinal smooth muscles[J]. Advances in Experimental Medicine and Biology, 2019, 1124: 3-46. |
| [29] |
MAWE G M, HOFFMAN J M. Serotonin signalling in the gut: functions, dysfunctions and therapeutic targets[J]. Nature Reviews Gastroenterology & Hepatology, 2013, 10(8): 473-486. |
| [30] |
AL-AHMADI A, MOHAMMED R A, ATTEYA M, et al. Anoctamin 1 and c-Kit immunohistochemical study of interstitial cells of Cajal in the muscularis externa of human gastrointestinal tract[J]. Folia Morphologica, 2023, 82(1): 147-157. DOI:10.5603/FM.a2021.0138 |
| [31] |
KASHYAP P, GOMEZ-PINILLA P J, POZO M J, et al. Immunoreactivity for Ano1 detects depletion of Kit-positive interstitial cells of Cajal in patients with slow transit constipation[J]. Neurogastroenterology and Motility, 2011, 23(8): 760-765. DOI:10.1111/j.1365-2982.2011.01729.x |
| [32] |
HAYASHI Y, ASUZU D T, BARDSLEY M R, et al. Wnt-induced, TRP53-mediated cell cycle arrest of precursors underlies interstitial cell of Cajal depletion during aging[J]. Cellular and Molecular Gastroenterology and Hepatology, 2021, 11(1): 117-145. DOI:10.1016/j.jcmgh.2020.07.011 |
| [33] |
DANEMAN R, RESCIGNO M. The gut immune barrier and the blood-brain barrier: are they so different?[J]. Immunity, 2009, 31(5): 722-735. DOI:10.1016/j.immuni.2009.09.012 |
| [34] |
ZHANG J, CAO L, SUN Y, et al. The regulatory effects of licochalcone a on the intestinal epithelium and gut microbiota in murine colitis[J]. Molecules, 2021, 26(14): 4149. DOI:10.3390/molecules26144149 |
| [35] |
ANNAHÁZI A, FERRIER L, BÉZIRARD V, et al. Luminal cysteine-proteases degrade colonic tight junction structure and are responsible for abdominal pain in constipation-predominant IBS[J]. The American Journal of Gastroenterology, 2013, 108(8): 1322-1331. DOI:10.1038/ajg.2013.152 |
| [36] |
CAO J H, WANG K, LI N X, et al. Soluble dietary fiber and cellulose from Saccharina japonica by-product ameliorate Loperamide-induced constipation via modulating enteric neurotransmitters, short-chain fatty acids and gut microbiota[J]. International Journal of Biological Macromolecules, 2023, 226: 1319-1331. DOI:10.1016/j.ijbiomac.2022.11.243 |
| [37] |
CONG X, KONG W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease[J]. Cellular Signalling, 2020, 66: 109485. DOI:10.1016/j.cellsig.2019.109485 |
| [38] |
METIDJI A, OMENETTI S, CROTTA S, et al. The environmental sensor AHR protects from inflammatory damage by maintaining intestinal stem cell homeostasis and barrier integrity[J]. Immunity, 2019, 50(6): 1542. DOI:10.1016/j.immuni.2019.05.024 |
| [39] |
ISRAELYAN N, DEL COLLE A, LI Z S, et al. Effects of serotonin and slow-release 5-hydroxytryptophan on gastrointestinal motility in a mouse model of depression[J]. Gastroenterology, 2019, 157(2): 507-521.e4. DOI:10.1053/j.gastro.2019.04.022 |
| [40] |
SJ?LUND K, FASTH S, EKMAN R, et al. Neuropeptides in idiopathic chronic constipation(slow transit constipation)[J]. Neurogastroenterology and Motility, 1997, 9(3): 143-150. DOI:10.1046/j.1365-2982.1997.d01-46.x |
| [41] |
LI Y W, YU Y J, LI S Y, et al. Isobaric tags for relative and absolute quantification-based proteomic analysis that reveals the roles of progesterone receptor, inflammation, and fibrosis for slow-transit constipation[J]. Journal of Gastroenterology and Hepatology, 2018, 33(2): 385-392. DOI:10.1111/jgh.13873 |
| [42] |
ZHU P P, LU T K, WU J Y, et al. Gut microbiota drives macrophage-dependent self-renewal of intestinal stem cells via niche enteric serotonergic neurons[J]. Cell Research, 2022, 32(6): 555-569. DOI:10.1038/s41422-022-00645-7 |
| [43] |
KON R, IKARASHI N, HAYAKAWA A, et al. Morphine-induced constipation develops with increased aquaporin-3 expression in the colon via increased serotonin secretion[J]. Toxicological Sciences: an Official Journal of the Society of Toxicology, 2015, 145(2): 337-347. DOI:10.1093/toxsci/kfv055 |
| [44] |
LIN C H, HE H Q, KIM J J, et al. Osmotic pressure induces translocation of aquaporin-8 by P38 and JNK MAPK signaling pathways in patients with functional constipation[J]. Digestive and Liver Disease, 2023, 55(8): 1049-1059. DOI:10.1016/j.dld.2023.01.162 |
| [45] |
WANG L P, XIE S Y, JIANG X, et al. Therapeutic effects of Bombax ceiba flower aqueous extracts against loperamide-induced constipation in mice[J]. Pharmaceutical Biology, 2023, 61(1): 125-134. DOI:10.1080/13880209.2022.2157841 |
2. Exchange, Development & Service Center for Science & Technology Talents, Beijing 100864, China
 2024, Vol. 41
2024, Vol. 41