文章信息
- 胡哲铭, 皮紫月, THOMAS JOHN OSILAMA, 等.
- HU Zheming, PI Ziyue, THOMAS JOHN OSILAMA, et al.
- HPLC-UV法测定银杏内酯A、B、C
- HPLC-UV analysis of ginkgolide A, B, C
- 天津中医药, 2024, 41(9): 1182-1186
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(9): 1182-1186
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.09.18
-
文章历史
- 收稿日期: 2024-02-23
银杏内酯(ginkgolide)是银杏叶提取物中的主要生物活性化合物主要包括倍半萜内酯和二萜内酯。二萜内酯主要包括银杏内酯A、银杏内酯B、银杏内酯C、银杏内酯M、银杏内酯J[1],具有重要的药用价值。
银杏内酯A具有多种生物活性[2]包括抗炎、抗肿瘤、抗焦虑、抗动脉粥样硬化[3],以及对神经系统[4]和肝脏的神经保护作用。一项临床试验表明银杏内酯A在改善稳定型心绞痛和抑郁症患者的心绞痛频率和生活质量方面具有有效性和安全性[5]。银杏内酯B具有抗炎、抗过敏、抗氧化、神经保护的特性[6],可减轻神经细胞凋亡[7],从而预防缺血性中风[8-9]。银杏内酯C除了表现出抗炎[10]和抗凋亡[11]效果外,还对百草枯中毒引起的急性肺损伤具有保护作用[12]。
目前,中华人民共和国药典(2020版)对银杏内酯的含量测定采用高效液相色谱蒸发光(ELSD)检测器[13]。然而,对于生物样本中的多种化合物、痕量或其他复杂化合物的同时测定,通常采用高效液相色谱串联质谱联用(LC-MS)技术。尽管ELSD检测器在某些应用中具有价值,但其样品蒸发过程可能会使温度敏感的化合物变性,从而影响准确性。尽管LC-MS具有强大的分析能力,但由于高昂的购置和维护成本,相对复杂的操作,其广泛应用受到限制。本研究建立了高效液相色谱-紫外检测器(HPLC-UV)法进行分析。该方法操作简便,非常适合对银杏内酯进行定量分析和质量评估。
1 材料与方法 1.1 药品、试剂和仪器银杏内酯A(批号:110862-202213),银杏内酯B(批号:110863-202312),银杏内酯C(批号:110863-202312),均购自中国食品药品检定研究院;银杏内酯(批号:NZ220723,成都埃法生物科技有限公司),甲酸(色谱纯,Mreda公司);磷酸(色谱纯,Fisher公司);三乙胺(色谱纯,Macklin公司);乙腈(色谱纯,Adamas公司);Agilent 1260高效液相色谱仪(Agilent公司,美国);Agilent 5 TC-C18色谱柱(Agilent公司,美国)、Shimadzu Shim-pack GIST-C18色谱柱(岛津公司,日本);Kromasil 100-5-C18色谱柱(Kromasil公司,瑞典);Diamonsil-C18色谱柱(钻石公司,美国)和GL Sciences Inertsil ODS C18色谱柱(岛津公司,日本);PX223ZH电子分析天平(奥豪斯仪器有限公司);Milli-Q超纯水机(Millipore公司,美国)。
1.2 溶液的制备 1.2.1 对照品溶液的制备精密称取银杏内酯A、银杏内酯B、银杏内酯C对照品适量,加甲醇配制成质量浓度分别为4.00、2.00、1.00 mg/mL的对照品溶液,使用前作为储备液4 ℃保存。
1.2.2 供试品溶液的制备精确称量0.25 g银杏内酯,置于具塞锥形瓶中,精密加入50 mL甲醇,称定质量,超声(250 W,40 kHz)5 min,放冷,再称定质量,用甲醇补足失质量,摇匀,用0.22 μm滤膜过滤。取续滤液,即得。
1.3 色谱条件考察色谱柱:Agilent 5 TC-C18色谱柱(250 mm × 4.6 mm,5 μm);流动相:30%甲醇(A)-70%水(B),等度洗脱;柱温:30 ℃;紫外检测器检测;流速:1.0 mL/min;检测波长:220 nm;进样量:20 μL。
1.3.1 检测波长考察在保持相同的色谱条件下,采用全波长扫描法测试并记录对照品溶液的色谱图,挑选合适的检测波长。
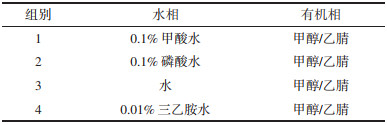
1.3.2 流动相系统考察根据分组设定研究不同流动相体系对分析银杏内酯功效的影响见表 1。评价标准包括清晰的色谱峰数量、均匀的色谱峰分布、优异的色谱峰分辨率以及稳定的基线。
在相同的色谱条件下,取“1.3.2”项下具有3个色谱峰结果的流动相系统通过改变流动相比例进行优化,以样品色谱图为依据,追求更为清晰的色谱峰、均匀的色谱峰分布以及主要成分色谱峰的明显分离。
1.3.4 进样体积考察在相同的色谱条件下,系统研究了不同进样量(5、10、15和20 μL)对样品溶液中银杏内酯分离效率的影响。以样品色谱图中色谱峰的响应和分辨率为依据选择合适的进样体积。
1.3.5 流速的考察在保持色谱条件不变的情况下,系统考察了不同洗脱流速(0.8、0.9、1.0和1.1 mL/min)对试样溶液中银杏内酯分离效率的影响。选择标准是样品色谱图的色谱峰保留时间适中、主要成分色谱峰分离效率高、色谱峰分布均匀。
1.3.6 柱温的考察在相同的色谱条件下,考察了20、30和40 ℃色谱柱温度对银杏内酯分离的影响,以期通过优化色谱柱温度进一步提高色谱峰的分离度。
1.4 方法学考察 1.4.1 专属性考察按照“1.2”部分所述的方法制备银杏内酯样品,制成试液,并用等体积的甲醇作为空白溶剂。按照“1.3”规定的条件进行色谱分析,并记录色谱图。
1.4.2 线性关系考察分别精密量取“1.2”项下单一对照品储备液,梯度稀释配制成质量浓度为100、200、400、500、1 000 μg/mL的对照溶液,按照“1.3”项下色谱条件进行测定,测定各自峰面积,以峰面积为纵坐标(Y),进样量为横坐标(X),绘制标准曲线,计算得回归方程及线性范围。
1.4.3 精密度实验按照“1.2”中的方法制备银杏内酯样品,并按照“1.3”中规定的色谱条件连续进样6次[14],并计算主成分峰的峰面积的相对标准偏差(RSD)。
1.4.4 稳定性考察按照“1.2”部分所述的方法制备银杏内酯样品和试液。按照“1.3”中的色谱条件,在配制后0、2、4、6、8、10、12和24 h进样分析。
1.4.5 重复性考察取同一批次银杏内酯样品(批号:NZ220723),精密称定6份,按照“1.2”中的方法制备银杏内酯样品,并按照“1.3”中规定的色谱条件进样分析。
1.4.6 加样回收率考察按“1.2”所述方法制备银杏内酯样品,并将按“1.2”所述方法制备的等量标准溶液均匀混合。然后按照“1.3”中规定的条件进行色谱分析,并记录色谱图,然后计算回收率。
 |
取银杏内酯样品,按照“1.2”中的方法制备银杏内酯样品1份,分别采用Agilent 5 TC-C18色谱柱(5 μm,250 mm×4.6 mm)、Shimadzu C18色谱柱(5 μm,250 mm×4.6 mm)、Kromasil 100-5-C18色谱柱(5 μm,250 mm×4.6 mm)、Diamonsil C18色谱柱(5 μm,250 mm×4.6 mm)和GL Sciences C18 column(3.5 μm,150 mm×4.6 mm)色谱柱,并按照“1.3”中规定的色谱条件进样分析,记录色谱图。
1.4.7.2 不同仪器考察取银杏内酯样品,按照“1.2”中的方法制备银杏内酯样品1份,分别采用Agilent 1200 series型,Agilent 1260 Infinity II型和Shimadzu LC型液相色谱仪,按照“1.3”中规定的色谱条件进样分析,记录色谱图。
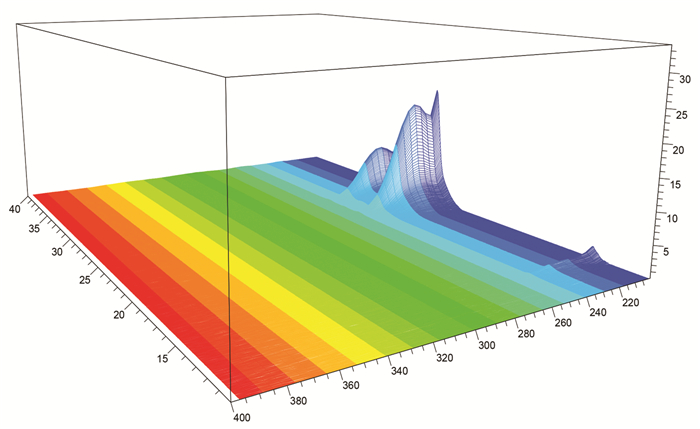
2 结果 2.1 检测波长的确定结果表明,在220 nm波长下,银杏内酯的色谱峰面积较大,峰响应值分布更均匀。因此,220 nm被确定为银杏内酯分析的最佳波长。见图 1。
|
| 图 1 银杏内酯分析方法供试品3D吸收图 Fig. 1 3D absorption diagram of ginkgolides |
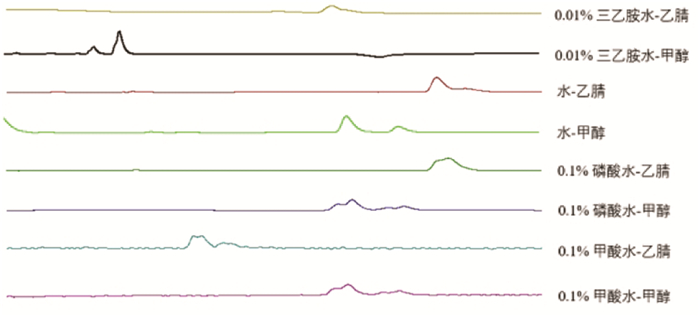
结果表明,水-甲醇体系(70%水∶30%甲醇)显示出最稳定的基线、均匀的峰值分布以及主要成分峰的最佳分离效果,见图 2。
|
| 图 2 银杏内酯分析方法不同流动相系统考察色谱图 Fig. 2 Fingerprint analysis of ginkgolides-investigation of the chromatogram of the mobile phase system |
结果显示,使用水-甲醇流动相得到的样品溶液显示出更多清晰的色谱峰,基线稳定,分离度和峰形更优。因此,最终决定采用水-甲醇流动相,见图 3。
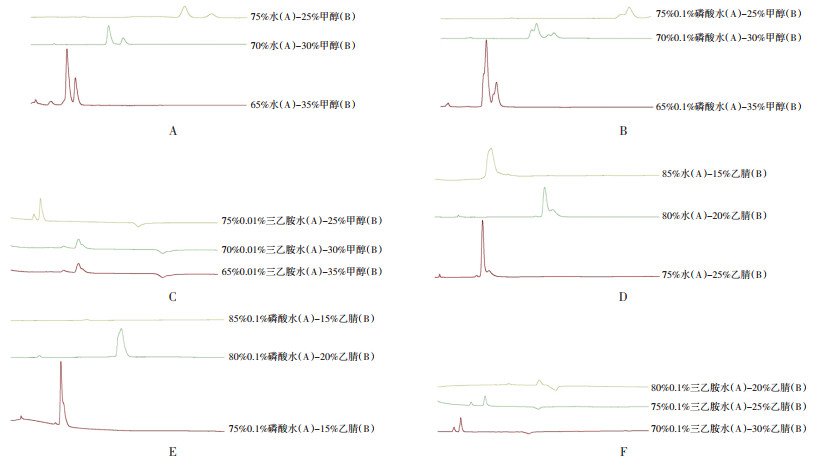
|
| 注:A,水-甲醇系统的优化色谱图;B,0.1% 磷酸水-甲醇系统的优化色谱图;C,0.01% 三乙胺水-甲醇系统的优化色谱图;D,水-乙腈系统的优化色谱图;E,0.1% 磷酸水-乙腈系统的优化色谱图;F,0.01% 三乙胺水-乙腈系统的优化色谱图。 图 3 银杏内酯分析方法流动相不同比例色谱图 Fig. 3 Fingerprint analysis of ginkgolides-optimized chromatogram of the mobile phase gradient |
结果表明,不同进样量下的色谱图无明显差异。然而,随着进样量的增加,峰间分离效率逐渐提高。最终选择了20 μL的进样量,见图 4。
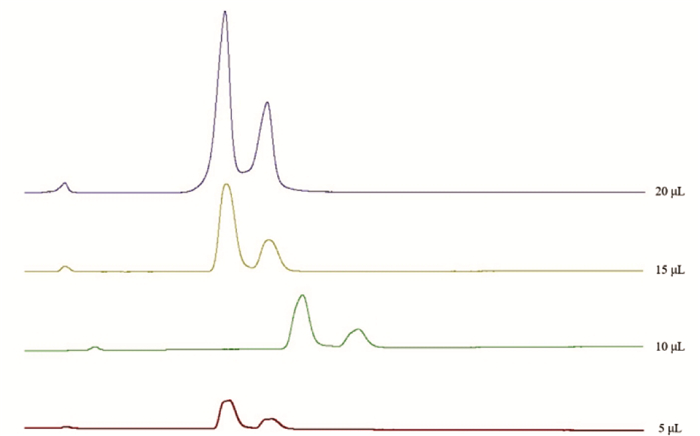
|
| 图 4 银杏内酯分析方法不同进样体积考察色谱图 Fig. 4 Fingerprint analysis of ginkgolides-the chromatogram of different injection volume |
结果表明,当洗脱流速设定为1.0 mL/min时,测试样品的色谱图表现出适中的峰保留时间、较高的峰分离效率和均匀的分布,是最佳的流速,见图 5。
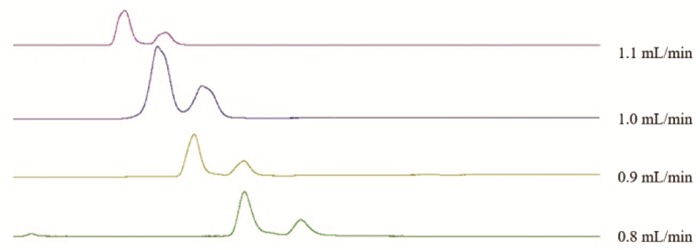
|
| 图 5 银杏内酯分析方法不同流速考察色谱图 Fig. 5 Fingerprint analysis of ginkgolides-the chromatogram of different flow rate |
结果表明,柱温为30 ℃时,主峰的分离度最好,最终选择30 ℃作为银杏内酯分离的最终柱温,见图 6。
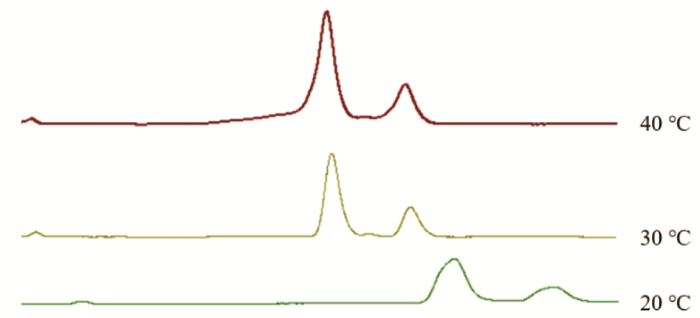
|
| 图 6 银杏内酯分析方法色谱柱柱温考察色谱图 Fig. 6 Fingerprint analysis of ginkgolides-the chromatogram of different column temperature |
结果表明,在色谱条件下,空白试液的吸收量极小,这表明对银杏内酯的色谱分析没有干扰。这表明所建立的方法具有极佳的专属性。见图 7。
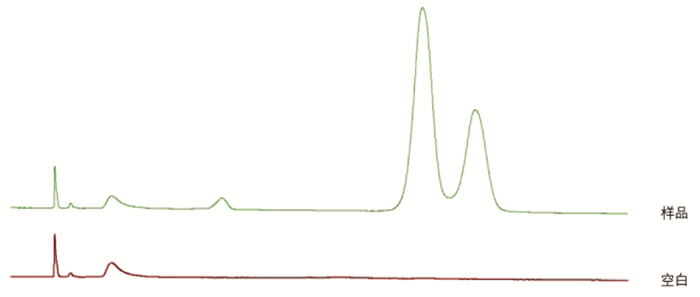
|
| 图 7 银杏内酯分析方法专属性考察色谱图 Fig. 7 Fingerprint analysis of ginkgolides-the chromatogram of specificity study |
实验结果表明,3个内酯成分在各自线性范围内线性关系良好,见表 2。
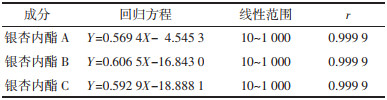
|
计算得银杏内酯A、B和C的峰面积RSD分别为1.23%、1.21%和3.02%表明仪器的精密度符合要求。
2.7.4 稳定性经计算银杏内酯A、B和C的峰面积RSD分别为0.40%、0.25%和0.98%,结果表明试液在24 h内基本保持稳定。
2.7.5 重复性经计算得银杏内酯A、B、C的峰面积RSD分别为0.25%、0.40%和0.98%,表明该方法的重现性符合要求。
2.7.6 加样回收率经计算得银杏内酯A和B的回收率98%~102%,银杏内酯C的回收率96%~105%,表明样品处理过程的有效性和准确性。
2.7.7 方法耐用性该方法一般适用于不同的色谱柱,且该方法基本适用于不同液相色谱仪器的分析。不过,检测结果表明,不同仪器获得的色谱图仍存在一些差异。因此,建议始终使用同一台液相色谱仪对样品进行分析,以尽量减少因仪器差异造成的样品质量评估误差。见图 8、图 9。
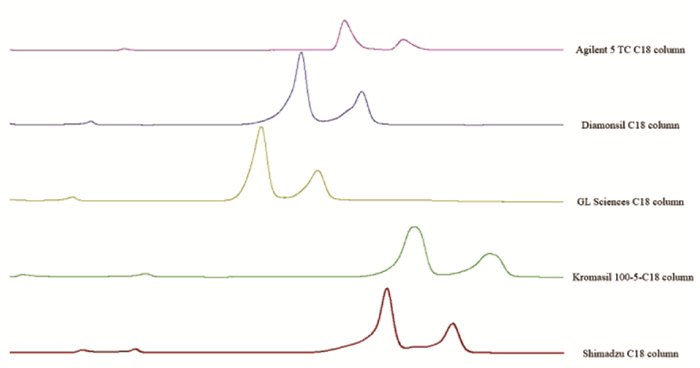
|
| 图 8 银杏内酯分析方法不同色谱柱考察色谱图 Fig. 8 Fingerprint analysis of ginkgolides-the chromatogram of investigation of different columns |
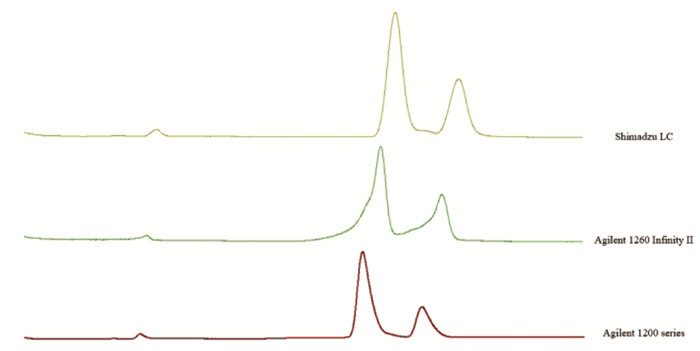
|
| 图 9 银杏内酯分析方法不同仪器考察色谱图 Fig. 9 Fingerprint analysis of ginkgolides-the chromatogram of investigation of different instruments |
方法学考察结果表明,本研究建立的银杏内酯高效液相色谱法能满足方法学考察的要求,且操作简单,可应用于银杏内酯的高效液相色谱分析。
| [1] |
LIU L M, WANG Y T, ZHANG J C, et al. Advances in the chemical constituents and chemical analysis of Ginkgo biloba leaf, extract, and phytopharmaceuticals[J]. Journal of Pharmaceutical and Biomedical Analysis, 2021, 193: 113704. DOI:10.1016/j.jpba.2020.113704 |
| [2] |
SARKAR C, QUISPE C, JAMADDAR S, et al. Therapeutic promises of ginkgolide A: a literature-based review[J]. Biomedecine & Pharmacotherapie, 2020, 132: 110908. |
| [3] |
高明, 徐丽丽, 王利存, 等. 基于TLR4/NF-κB信号通路探讨银杏二萜内酯对糖尿病大鼠视网膜病变的影响[J]. 天津中医药, 2023, 40(5): 654-661. |
| [4] |
杜雨芯, 操娇娇, 张倩霞, 等. 银杏二萜内酯通过拮抗PAFR和调节SIRT1/STAT3抑制氧化应激诱导的PC12神经元衰老研究[J]. 中草药, 2023, 54(9): 2793-2801. |
| [5] |
MA L G, WANG S Y, TAI F D, et al. Effects of bilobalide on anxiety, spatial learning, memory and levels of hippocampal glucocorticoid receptors in male Kunming mice[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2012, 20(1): 89-96. DOI:10.1016/j.phymed.2012.09.015 |
| [6] |
XIA S H, FANG D C. Pharmacological action and mechanisms of ginkgolide B[J]. Chinese Medical Journal, 2007, 120(10): 922-928. DOI:10.1097/00029330-200705020-00013 |
| [7] |
CAO Y L, YANG L, CHENG H. Ginkgolide B protects against ischemic stroke via targeting AMPK/PINK1[J]. Frontiers in Pharmacology, 2022, 13: 941094. DOI:10.3389/fphar.2022.941094 |
| [8] |
李延珍. 银杏二萜内酯葡胺注射液对离体心脏缺血再灌注损伤保护作用的实验研究[J]. 天津中医药, 2018, 35(8): 616-620. |
| [9] |
石鑫慧, 吕明, 朱彦. 基于"异病同治"理论的银杏叶提取物及其活性成分防治心脑血管疾病共同靶标分析[J]. 天津中医药, 2018, 35(1): 72-76. |
| [10] |
LI B, ZHANG B K, LI Z Y, et al. Ginkgolide C attenuates cerebral ischemia/reperfusion-induced inflammatory impairments by suppressing CD40/NF-κB pathway[J]. Journal of Ethnopharmacology, 2023, 312: 116537. DOI:10.1016/j.jep.2023.116537 |
| [11] |
MA T W, JIA L N, ZHAO J H, et al. Ginkgolide C slows the progression of osteoarthritis by activating Nrf2/HO-1 and blocking the NF-κB pathway[J]. Frontiers in Pharmacology, 2022, 13: 1027553. DOI:10.3389/fphar.2022.1027553 |
| [12] |
ZHANG R, ZHAO C R, GONG X W, et al. Ginkgolide C alleviates acute lung injury caused by paraquat poisoning via regulating the Nrf2 and NF-κB signaling pathways[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 7832983. |
| [13] |
DING Y H, SUN Y C, WANG Z Z, et al. Establishment of fingerprint of Ginkgo biloba leaves and study on its quality evaluation[J]. Chinese Traditional and Herbal Drugs, 2015, 46(6): 901-905. |
| [14] |
乔晓莉, 曹宁宁, 王清果, 等. 清热利胆片HPLC指纹图谱建立及多成分含量测定研究[J]. 天津中医药, 2023, 40(11): 1457-1465. |
 2024, Vol. 41
2024, Vol. 41