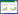文章信息
- 王晓东, 邵军欢, 张建坤, 等.
- WANG Xiaodong, SHAO Junhuan, ZHANG Jiankun, et al.
- 白藜芦醇调控LncRNA-UCA1/Wnt/β-catenin信号通路抑制非小细胞肺癌的机制研究
- Mechanism study of resveratrol regulating LncRNA UCA1/Wnt/β-catenin signaling pathway inhibition of non small cell lung cancer
- 天津中医药, 2024, 41(9): 1192-1199
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(9): 1192-1199
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.09.20
-
文章历史
- 收稿日期: 2024-04-07
2. 淄博市第四人民医院病理科, 淄博 255000;
3. 淄博市第四人民医院检验科, 淄博 255000;
4. 淄博市第四人民医院放射科, 淄博 255000
非小细胞肺癌是全球发病率较高的癌症,据2020年统计,每年全球约有220万新发病例以及180万死亡病例[1],其主要包括3种组织学亚型:腺癌(ADC)、鳞状细胞癌(SCC)和大细胞癌(LCC)[1-2]。目前针对非小细胞肺癌的治疗策略需要依据肿瘤的准确的分期以确定,包括手术、放疗、化疗和免疫靶向治疗等[3]。尽管目前针对该疾病有如此多的治疗手段,但是其预后仍然很差,5年患者生存率低于20%[4]。
白藜芦醇是一种二苯乙烯分子,其通常从许多天然植物中提取、制备,并被作为补充和替代药物广泛用于预防和治疗包括癌症在内的多种疾病[5-7]。现阶段关于白藜芦醇的研究越来越多集中于其抗氧化、抗衰老以及抗肿瘤领域的作用。大量研究表明白藜芦醇可以在体外呈剂量及时间依赖性地抑制肿瘤细胞的增殖,同时还可以引起肿瘤细胞细胞周期的停滞以及细胞的凋亡[8]。在非小细胞肺癌中,白藜芦醇可以通过调节P53蛋白表达、线粒体膜的完整性、细胞周期蛋白的表达以及Caspase信号通路来调节A549细胞的增殖以及凋亡,但是其抑制非小细胞肺癌生长的具体机制目前仍尚不清楚[9-10]。
本研究结果首先显示了白藜芦醇可以呈现剂量依赖性抑制非小细胞肺癌细胞的增殖、迁移和侵袭,并促进细胞的凋亡。此外,进一步利用长链非编码RNA(LncRNA)微阵列技术探究白藜芦醇影响非小细胞肺癌细胞生物活性的可能内在机制,结果发现尿路上皮癌抗原1(UCA1)在非小细胞肺癌细胞系中高表达,而白藜芦醇可以抑制其表达,同时过表达LncRNA-UCA1可以通过上调Wnt/β-catenin信号通路促进非小细胞肺癌细胞的增殖、迁移和侵袭,而加入白藜芦醇后可以抑制上述效应。因此,根据本研究结果可知,白藜芦醇可以通过抑制LncRNA-UCA1的表达进而抑制Wnt/β-catenin信号通路从而抑制非小细胞肺癌细胞生物学功能。
1 材料与方法 1.1 微阵列分析本研究中使用的微阵列基因表达数据来源于A549、Hcc827、H1975 3株非小细胞肺癌。lncRNA微阵列由NimbleGen杂交系统(Arraystar公司,美国)提供,原始数据用NimbleScan v2.5软件(Roche NimbleGen公司,美国)进行标准化,最后使用Agilent GeneSpring GXTM软件(11.0版)进行进一步的数据分析,用于筛选差异基因,确定上调或下调基因的阈值为倍数变化 > 1。
1.2 细胞培养肺癌细胞系BEAS-2B、A549、HCC827和H1975均购自协和细胞库。所有细胞均在含有10%胎牛血清(Gibco公司,美国),90% RPMI-1640培养基(Gibco公司,美国)中进行培养,在37 ℃、95%湿度和5%二氧化碳(CO2)的培养箱中进行孵育。根据先前研究报道[11],加入相应剂量及时间的白藜芦醇对细胞进行孵育。
1.3 实时荧光定量逆转录聚合酶链反应(RT-qPCR)检测UCA1水平收集各组细胞用于提取总RNA并且测定其浓度和纯度。将5 μg总RNA逆转录为cDNA,将cDNA、引物、荧光染料等加入到反应体系(TaKaRa公司,日本)中,根据试剂说明书进行RT-qPCR的检测。聚合酶链反应(PCR)反应条件为95 ℃,10 min;95 ℃,15 s;60 ℃,1 min,总共40个循环,所有检测重复3次。
1.4 细胞活力检测(CCK-8)法检测细胞增殖前1 d将细胞以1×104个细胞/mL的密度,接种于96孔板中,每孔100 μL,于37 ℃、5% CO2培养箱培养过夜。第2天加入一定浓度的白藜芦醇孵育72 h,或者将转染的细胞以1×104个细胞/mL的密度接种在96孔板中,每孔100 μL,继续孵育24 h。之后向细胞中加入10 μL CCK-8溶液(5 mg/mL,Sigma-Aldrich公司,美国)。孵育4 h后弃掉上清液。通过微孔板读取器(BioTek公司,美国)在450 nm波长处测量每个孔在72 h的吸收值。所有检测重复3次。
1.5 细胞划痕实验检测细胞迁移前1 d将细胞按每2×105个/孔的密度均匀铺于24孔板中,次日,待细胞密度达80%~90%时,用200 μL枪头在孔板底部轻轻划宽度均一、方向一致的直线。之后弃掉上清液与悬浮的细胞,用磷酸盐缓冲液(PBS)轻轻洗涤2次。加入含有特定浓度白藜芦醇培养基继续培养,于培养0 h与72 h时用显微镜拍照并分析细胞划痕的愈合情况。
1.6 流式细胞术检测细胞凋亡于实验前1 d将细胞均匀铺于6孔板中,待贴壁后加入不同浓度的白藜芦醇孵育72 h后弃去原培养基,将细胞消化下来后,2 500 r/min,离心半径10 cm,离心5 min后收集细胞,用PBS洗涤3次,加入1×binding buffer重悬细胞,将密度调节为1×106个/mL。然后取100 μL细胞悬液,每管加入5 μL Annexin-FITC、10 μL的PI染料(Sigma-Aldrich公司,美国),避光孵育15 min。孵育完成后,每孔加入400 μL 1×binding buffer,重悬细胞,之后用流式细胞仪检测细胞凋亡情况。另设经凋亡诱导的正常细胞、PI单染、Annexin-FITC单染3个对照组。
1.7 Transwell检测细胞侵袭在测定细胞侵袭能力之前,用聚赖氨酸和稀释的Matrigel胶(Invitrogen公司,美国)预涂板子。将无血清的培养基(500 μL)独立添加到上下室,然后在37℃下孵育以进行水合。将细胞重悬于无血清培养基中。然后,将200 μL细胞悬浮液接种于上室中,并将500 μL含有10%胎牛血清的RPMI-1640加入到下室中。37 ℃孵育48 h后,用棉签轻轻擦去未浸润的细胞,然后用4%的多聚甲醛和苏木精进行细胞的固定和染色。用显微镜(×200)在5个区域随机拍照后评估细胞数量,然后进行统计分析。
1.8 Western Blot法检测蛋白表达孵育结束后收集各组细胞,利用RIPA中提取细胞总蛋白,然后用BCA法定量各组蛋白浓度[β-catenin,CyclinD1,c-myc蛋白(Invitrogen公司,美国)]。将样品进行10% SDS聚丙烯酰胺凝胶电泳、转膜、封闭。之后将一抗1∶1 000的比例,4 ℃孵育过夜,第2天洗膜后,再进行辣根过氧化物酶(HRP)标记的二抗杂交、化学发光显色等步骤,每个样品重复测量3次。本实验以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参照物。
1.9 UCA1过表达用于建立pcDNA3.1-lncRNA UCA1质粒的cDNA和PCR引物购自美国Invitrogen公司。使用Lipofectamine 2000(Invitrogen公司,美国)进行pcDNA3.1-UCA1质粒对A549细胞进行转染。
1.10 统计分析所有数据使用GraphPad 9.0与SPSS 22.0进行统计分析,均以均数±标准差(x±s)表示,组间比较采用单因素方差分析(One-way ANOVA),以P < 0.05为差异具有统计学意义。
2 结果 2.1 白藜芦醇对非小细胞肺癌细胞系迁移、侵袭和凋亡的影响为了探究白藜芦醇对肺癌细胞迁移、侵袭和凋亡的影响,本研究选取了A549和Hcc827细胞系作为研究对象。首先利用细胞划痕实验检测白藜芦醇刺激72 h后对肿瘤细胞迁移的影响,结果显示白藜芦醇在30与50 μmol/L对A549和Hcc827细胞的迁移有明显的抑制作用,见图 1A、图 1B。Transwell实验结果显示白藜芦醇可显著抑制A549和Hcc827细胞的侵袭能力,且呈现剂量依赖性,见图 1C、图 1D。另外,利用流式细胞术检测了经白藜芦醇孵育72 h后A549和HCC827细胞的凋亡情况,结果显示,白藜芦醇可以呈剂量依赖性地促进A549和Hcc827的细胞凋亡,见图 1E、图 1F。综上,白藜芦醇可以呈现剂量依赖性的抑制非小细胞肺癌细胞(A548和Hcc827)的迁移、侵袭并促进其凋亡。
|
| 注:A-B,划痕实验结果显示白藜芦醇可以剂量依赖性的抑制A549和Hcc827细胞的细胞迁移;C-D,Transwell实验结果显示白藜芦醇可剂量依赖性的显著抑制A549和Hcc827细胞的侵袭(×200);E-F,流式细胞术结果显示白藜芦醇可以剂量依赖性的促进A549和Hcc827细胞的凋亡。与对照组(0 μmol/L)比较,**P<0.01。 图 1 白藜芦醇对非小细胞肺癌细胞系迁移、侵袭和凋亡的影响 Fig. 1 Effects of resveratrol on migration, invasion and apoptosis of non-cellular lung cancer cell lines |
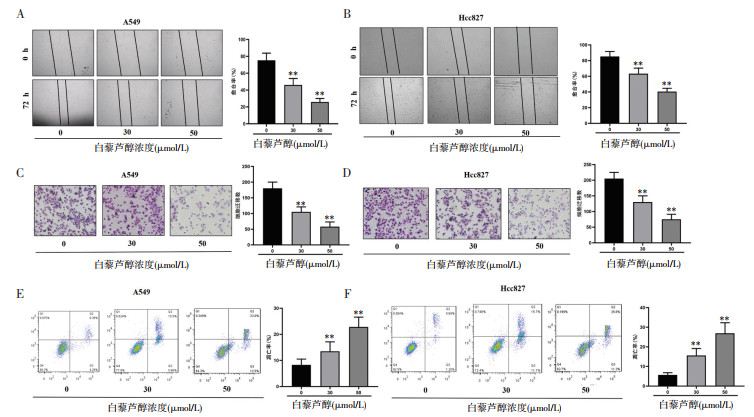
为了验证白藜芦醇对Wnt/β-catenin相关通路蛋白的影响,利用Western Blot对其关键蛋白进行了检测,结果显示,白藜芦醇孵育72 h后可以显著降低A549和Hcc827中β-catenin,CyclinD1,c-myc的蛋白表达,并呈现剂量依赖性,见图 2。
|
| 注:A-B,Western Blot结果显示,白藜芦醇孵育72 h后可以呈剂量依赖性的降低A549和Hcc827中β-catenin,CyclinD1,c-myc的蛋白表达。与对照组(0 μmol/L)比较,**P<0.01。 图 2 白藜芦醇对相关通路蛋白的影响 Fig. 2 Effects of resveratrol on related pathway proteins |
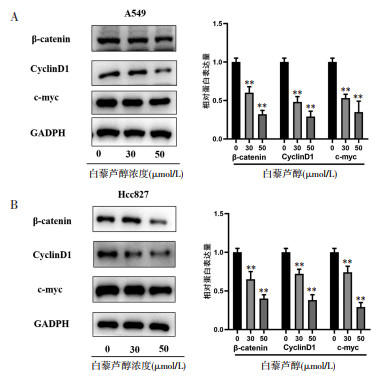
进一步通过微阵列分析筛选差异表达的基因,结果显示白藜芦醇孵育的非小细胞肺癌细胞系A549、Hcc827、H1975与空白对照组比较,LncRNA的表达出现统计学差异,其中经白藜芦醇刺激后有224个基因出现上调,75个基因下调,而LncRNA-UCA1的变化差异均较为明显,见图 3A、图 3B。进一步发现,与人正常肺支气管上皮细胞BEAS-2B比较,LncRNA-UCA1在非小细胞肺癌细胞系A549、Hcc827、H1975中高表达,并且加入白藜芦醇刺激以后,可以显著地降低其表达水平,见图 3C。另外,加入白藜芦醇刺激以后发现这3株细胞的增殖明显受到抑制,并呈现剂量依赖性,见图 3D。由以上结果可知,LncRNA-UCA1在非小细胞肺癌细胞系A549、Hcc827、H1975中高表达,但是加入白藜芦醇后可以降低其水平,并且白藜芦醇可以显著抑制这几株细胞的增殖,尤以在A549、Hcc827细胞中最为明显,因此,推测LncRNA-UCA1可能在非小细胞肺癌的发生和发展中扮演了重要角色。
|
| 注:A,热图显示在非小细胞肺癌细胞系A549、Hcc827、H1975中加入白藜芦醇孵育以后UCA1的水平显著降低。B,火山图显示UCA1在非小细胞肺癌系细胞中表达量显著偏高。绿色圆点代表下调的基因,而红色圆点代表上调的基因。图中的虚线表示选择条件(|log2FC|>1,FDR< 0.05)。C,非小细胞肺癌细胞系A549、Hcc827、H1975相比于正常的肺上皮细胞BEAS-2B的UCA1的相对表达量明显偏高,但是加入白藜芦醇孵育后可以显著降低UCA1在非小细胞肺癌细胞系中的表达量。D,白藜芦醇可以剂量依赖性的抑制A549、Hcc827、H1975细胞的增殖。与对照组(BEAS-2B)比较,**P<0.01,##P<0.01。 图 3 微阵列分析测定白藜芦醇干预后LncRNAs在非小细胞肺癌细胞中的表达 Fig. 3 Expression of LncRNAs in non-small cell lung cancer cells after resveratrol intervention was determined by microarray analysis |
为了探究LncRNA-UCA1对非小细胞肺癌细胞系中细胞生物学功能的影响,在A549细胞中将LncRNA-UCA1进行过表达,见图 4A。由实验的结果可知,与对照组(pcDNA3.1)比较,LncRNA-UCA1过表达可以使A549细胞增殖、迁移与侵袭能力明显增强,但是加入白藜芦醇共同培养以后上述生物学功能被显著抑制;同时A549细胞的生物活性在LncRNA-UCA1过表达+白藜芦醇组和对照组间没有统计学差异,见图 4B、图 4C、图 4D。流式细胞术结果显示LncRNA-UCA1过表达以后与pcDNA3.1组比较,A549细胞凋亡比例有所减少,但是无论LncRNA-UCA1是否过表达,加入白藜芦醇孵育以后,A549细胞凋亡比例都显著增加;同时A549细胞的凋亡在LncRNA-UCA1过表达+白藜芦醇组和对照组间没有统计学差异,见图 4E。由以上结果可知,LncRNA-UCA1的过表达可以促进A549细胞的增殖,迁移和侵袭并抑制细胞凋亡,但是白藜芦醇可以抑制上述现象的产生。
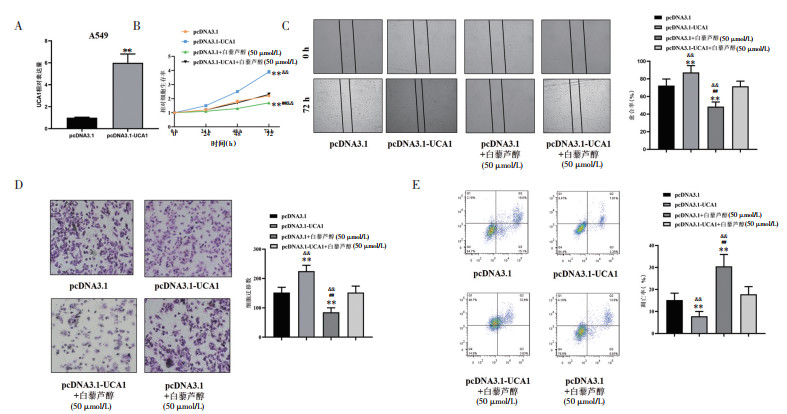
|
| 注:A,PCR结果显示LncRNA-UCA1在A549细胞成功过表达;B,CCK8结果显示LncRNA-UCA1过表达可以使A549细胞增殖增强,但是加入白藜芦醇孵育后可以抑制上述作用;C,划痕实验结果显示LncRNA-UCA1过表达可以使A549细胞迁移能力增强,但是加入白藜芦醇孵育后可以抑制上述作用;D,Transwell实验结果显示LncRNA-UCA1过表达可以使A549细胞迁移能力增强,但是加入白藜芦醇孵育后可以抑制上述作用(×200);E,流式细胞术结果发现LncRNA-UCA1过表达可以使A549细胞的凋亡比例减少,但是加入白藜芦醇孵育后可以抑制上述作用。与对照组比较,**P<0.01;与LncRNA-UCA1过表达组比较,##P<0.01;与LncRNA-UCA1过表达+白藜芦醇组比较,&&P<0.01。 图 4 LncRNA-UCA1过表达对非小细胞肺癌细胞系的影响 Fig. 4 Effects of LncRNA-UCA1 overexpression on lung cancer cell lines |
为了验证LncRNA-UCA1过表达对Wnt/β-catenin通路蛋白的影响,利用Western Blot对其关键蛋白进行了检测。结果显示,LncRNA-UCA1过表达后可以显著提高A549中β-catenin、CyclinD1、c-myc的蛋白表达。但是无论LncRNA-UCA1是否过表达,加入白藜芦醇孵育后使β-catenin、CyclinD1、c-myc的蛋白量均显著降低,并且LncRNA-UCA1过表达+白藜芦醇组和对照组间的蛋白表达量没有统计学差异,见图 5。因此,研究结果显示白藜芦醇可能通过抑制LncRNA-UCA1表达,从而抑制Wnt/β-catenin通路进而抑制非小细胞肺癌细胞的生物学功能。
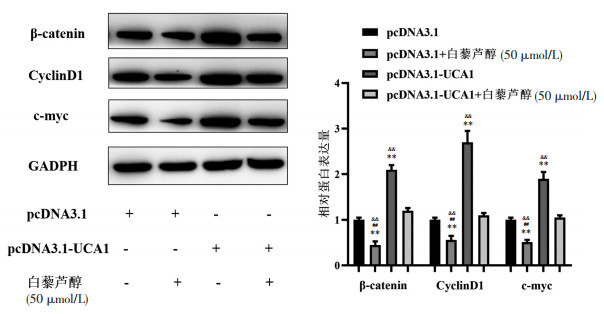
|
| 注:Western Blot结果显示,LncRNA-UCA1的过表可以提高A549中β-catenin、CyclinD1、c-myc的蛋白表达,但是加入白藜芦醇刺激后β-catenin、CyclinD1、c-myc在A549中的表达被明显抑制。与对照组比较,**P<0.01;与LncRNA-UCA1过表达组比较,##P<0.01;与LncRNAUCA1过表达+白藜芦醇组比较,&&P<0.01。 图 5 LncRNA-UCA1过表达对非小细胞肺癌细胞系Wnt/β-catenin通路的影响 Fig. 5 Effects of LncRNA-UCA1 overexpression on Wnt/β-catenin pathway in lung cancer cell lines |
白藜芦醇是一种常见于葡萄、红酒和花生中的天然存在的多酚,其已被确定为一种治疗药物,用于多种癌症的治疗,其机制包括抑制肿瘤细胞的增殖、诱导细胞周期阻滞和促进凋亡[11-13]。在非小细胞肺癌中,白藜芦醇在体外可以通过调控AKT/mTOR、P38-MAPK等信号通路抑制细胞的增殖、促进其凋亡和自噬发挥相应的抗肿瘤作用[14]。在大鼠的非小细胞肺癌的原位模型中,白藜芦醇则可以通过抑制STAT3、HIF-1a、VEGF等信号通路抑制肿瘤的生长[15]。本研究同样也发现白藜芦醇可以呈浓度依赖性地抑制非小细胞肺癌细胞A549和Hcc82的增殖和迁移,同时促进其凋亡,在一定程度上对肿瘤的发生和发展起到抑制作用。虽然大量研究发现了白藜芦醇对肺癌细胞生物活性存在多种影响,例如抑制肿瘤细胞增殖、抑制肿瘤细胞的侵袭和转移、抑制肿瘤细胞血管生成、诱导肿瘤细胞凋亡和自噬及逆转药物耐药及增强药物敏感性等[12],但是白藜芦醇抗肺癌作用机制复杂且仍不明确,需要更多研究解释其作用机制。因此,本研究进一步采用了LncRNA微矩阵技术发现白藜芦醇可以造成非小细胞肺癌细胞系中多种LncRNA的表达出现统计学差异,而LncRNA-UCA1的变化差异是最为明显。
LncRNA是一类长度超过200个核苷酸、不编码任何蛋白的RNA,但其可以通过调节基因转录或者转录后等表观遗传学机制来调控基因的表达[10]。大量证据表明,LncRNA可以作为肿瘤抑制因子或肿瘤促进因子在多种肿瘤的发生发展过程中出现表达异常[16]。近年研究发现,LncRNA的异常表达与非小细胞肺癌的发生发展密切相关,比如LncRNA-ANRIL、LncRNA-AK001796、LncRNA-BCYRN1、LncRNA-HNF1A-AS1的高表达可以促进肺癌细胞的迁移以及肿瘤的侵袭,而LncRNA-HMlincRNA717的下调与非小细胞肺癌的进展有密切关系[17-18]。UCA1属于人类内源性逆转录病毒H家族,全长为1 439 bp,被最早发现于膀胱癌中,同时其也作为生物标志物在多种肿瘤中呈现过表达的现象,比如肝癌、食管癌、卵巢癌及结直肠癌等[19-20]。大量研究已经证实,LncRNA-UCA1在各种癌症中呈现表达异常的状态,通过复杂的信号通路调节细胞的增殖、迁移侵袭、上皮间质化以及细胞凋亡等生物学功能[21-22]。在非小细胞肺癌中,有学者报道了敲降LncRNA-UCA1可以通过抑制MAPK信号通路从而抑制肿瘤细胞的增殖,迁移以及侵袭,而过表达LncRNA-UCA1则可以促进非小细胞肺癌细胞的生长、上皮-间充质转化(EMT)以及迁移等生物学特性[19, 23],如Jun等[24]研究发现LncRNA-UCA1在肺癌组织中显著上调,敲除LncRNA-UCA1可通过诱导肺癌细胞SK-MES-1的G2/M细胞周期停滞、抑制细胞增殖并促进其发生凋亡,同时敲降LncRNA-UCA1还可以抑制SK-MES-1细胞的迁移和侵袭,其作用机制可能是通过调节其下游miR-143的表达从而抑制MAPK信号通路来实现的。另有报道指出,LncRNA-UCA1可能通过参与葡萄糖代谢来调节非小细胞肺癌细胞的增殖,即在A549和H1299这两株非小细胞肺癌细胞株中,通过敲降LncRNA-UCA1的表达,可以明显减少细胞对葡萄糖的消耗以及乳酸的产生,而LncRNA-UCA1的缺失对于葡萄糖代谢的作用可能是通过mTOR信号通路来实现的,因此在非小细胞肺癌中敲降LncRNA-UCA1可以通过抑制mTOR介导的葡萄糖代谢来抑制细胞的增殖[25]。在本次研究中选择了A549和Hcc827两株非小细胞肺癌细胞系进行验证,结果显示,过表达LncRNA-UCA1可以明显促进A549和Hcc827这两株细胞的增殖、迁移和侵袭,并抑制细胞的凋亡,而白藜芦醇可以显著降低肿瘤细胞中的UCA1水平,同时抑制细胞的上述生物学功能。
Wnt/β-catenin是一种经典的Wnt信号通路,其高活化与肿瘤转移、迁移、侵袭和化疗耐药性密切相关,其中非小细胞肺癌的发生发展与Wnt/β-catenin信号通路密切相关,其关键分子如Wnt1、β-catenin、cyclin D1和SOX-2在非小细胞肺癌组织中均有不同程度的表达[26-27]。有研究报道了在切除的非小细胞肺癌组织中,37%至63%的免疫组织化学染色Wnt-1呈阳性,而Wnt-1的染色阳性与低凋亡指数、β-catenin表达异常以及c-Myc、cyclin D1、血管内皮生长因子A(VEGF-A)、MMP-7、Ki-67等蛋白表达的增加呈正相关[28]。更有临床研究分析了576例非小细胞肺癌早期患者切除的肿瘤组织中Wnt/β-catenin信号通路关键蛋白β-catenin及cyclin D1的表达,并结合上述患者的预后进行相关性分析,结果发现β-catenin和cyclin D1的过表达率分别占56%和50%,其表达量的高低与患者的预后呈显著相关[29]。更有研究证实,LncRNA-UCA1可以通过调节Wnt信号参与非小细胞肺癌的发生和发展,前者可以增加Wnt-3a,Wnt-5a和β-catenin蛋白的表达,从而激活Wnt信号通路,而这种活化的Wnt信号可以拮抗姜黄素在非小细胞肺癌细胞中的抗肿瘤作用,同时LncRNA-UCA1还可以通过调节mTOR途径影响非小细胞肺癌的发病和进展[30]。在本研究中发现,过表达LncRNA-UCA1可以显著促进Wnt/β-catenin信号通路的关键蛋白β-catenin,CyclinD1,c-myc的表达,而加入白藜芦醇共培养后可以反转上述通路蛋白的表达,进而部分抑制Wnt/β-catenin信号通路的激活,因此有理由相信白藜芦醇可能通过调控LncRNA-UCA1/Wnt/β-catenin信号通路抑制非小细胞肺癌细胞的生物学功能。
4 结论本研究发现LncRNA-UCA1在非小细胞肺癌细胞系A549、Hcc827、H1975中高表达,且其很可能通过影响Wnt/β-catenin信号通路参与肿瘤细胞的增殖、迁移、侵袭以及细胞凋亡等生物学功能。白藜芦醇可以显著降低非小细胞肺癌细胞系中LncRNA-UCA1的水平,并抑制Wnt/β-catenin信号通路关键蛋白β-catenin、CyclinD1、c-myc的表达,进而抑制肿瘤细胞的增殖,迁移和侵袭的能力,并且促进其细胞凋亡,从而起到抗击非小细胞肺癌的作用,为临床上非小细胞肺癌的治疗提供新的思路。
| [1] |
LEITER A, VELUSWAMY R R, WISNIVESKY J P. The global burden of lung cancer: current status and future trends[J]. Nature Reviews Clinical Oncology, 2023, 20: 624-639. DOI:10.1038/s41571-023-00798-3 |
| [2] |
LI Q Q, WANG R, YANG Z L, et al. Molecular profiling of human non-small cell lung cancer by single-cell RNA-seq[J]. Genome Medicine, 2022, 14(1): 87. DOI:10.1186/s13073-022-01089-9 |
| [3] |
DUMA N, SANTANA-DAVILA R, MOLINA J R. Non-small cell lung cancer: epidemiology, screening, diagnosis, and treatment[J]. Mayo Clinic Proceedings, 2019, 94(8): 1623-1640. DOI:10.1016/j.mayocp.2019.01.013 |
| [4] |
GRIDELLI C, ROSSI A, CARBONE D P, et al. Non-small-cell lung cancer[J]. Nat Rev Dis Primers, 2015, 1: 15009. DOI:10.1038/nrdp.2015.9 |
| [5] |
BRISDELLI F, D'ANDREA G, BOZZI A. Resveratrol: a natural polyphenol with multiple chemopreventive properties[J]. Current Drug Metabolism, 2009, 10(6): 530-546. DOI:10.2174/138920009789375423 |
| [6] |
TIAN B R, LIU J Y. Resveratrol: a review of plant sources, synthesis, stability, modification and food application[J]. Journal of the Science of Food and Agriculture, 2020, 100(4): 1392-1404. DOI:10.1002/jsfa.10152 |
| [7] |
ATANASOV A G, ZOTCHEV S B, DIRSCH V M, et al. Natural products in drug discovery: advances and opportunities[J]. Nature Reviews Drug Discovery, 2021, 20(3): 200-216. DOI:10.1038/s41573-020-00114-z |
| [8] |
KUMAR S, EROGLU E, STOKES J A 3rd, et al. Resveratrol induces mitochondria-mediated, caspase-independent apoptosis in murine prostate cancer cells[J]. Oncotarget, 2017, 8(13): 20895-20908. DOI:10.18632/oncotarget.14947 |
| [9] |
YOUSEF M, VLACHOGIANNIS I A, TSIANI E. Effects of resveratrol against lung cancer: in vitro and in vivo studies[J]. Nutrients, 2017, 9(11): 1231. DOI:10.3390/nu9111231 |
| [10] |
GOLICZ A A. Long intergenic noncoding RNA(lincRNA) discovery from non-strand-specific RNA-seq data[J]. Methods in Molecular Biology, 2022, 2443: 465-482. |
| [11] |
LI X, WANG D, ZHAO Q C, et al. Resveratrol inhibited non-small cell lung cancer through inhibiting STAT-3 signaling[J]. The American Journal of the Medical Sciences, 2016, 352(5): 524-530. DOI:10.1016/j.amjms.2016.08.027 |
| [12] |
GUTHRIE A R, CHOW H S, MARTINEZ J A. Effects of resveratrol on drug- and carcinogen-metabolizing enzymes, implications for cancer prevention[J]. Pharmacology Research & Perspectives, 2017, 5(1): e00294. |
| [13] |
BENITEZ D A, POZO-GUISADO E, ALVAREZ-BARRIENTOS A, et al. Mechanisms involved in resveratrol-induced apoptosis and cell cycle arrest in prostate cancer-derived cell lines[J]. Journal of Andrology, 2007, 28(2): 282-293. DOI:10.2164/jandrol.106.000968 |
| [14] |
WANG J, LI J M, CAO N Q, et al. Resveratrol, an activator of SIRT1, induces protective autophagy in non-small-cell lung cancer via inhibiting Akt/mTOR and activating p38-MAPK[J]. OncoTargets and Therapy, 2018, 11: 7777-7786. DOI:10.2147/OTT.S159095 |
| [15] |
WANG H X, JIA R Z, LV T L, et al. Resveratrol suppresses tumor progression via inhibiting STAT3/HIF-1α/VEGF pathway in an orthotopic rat model of non-small-cell lung cancer(NSCLC)[J]. OncoTargets and Therapy, 2020, 13: 7057-7063. DOI:10.2147/OTT.S259016 |
| [16] |
SHI X F, SUN M, LIU H B, et al. Long non-coding RNAs: a new frontier in the study of human diseases[J]. Cancer Letters, 2013, 339(2): 159-166. DOI:10.1016/j.canlet.2013.06.013 |
| [17] |
HU Q, MA H Y, CHEN H Y, et al. LncRNA in tumorigenesis of non-small-cell lung cancer: From bench to bedside[J]. Cell Death Discovery, 2022, 8(1): 359. DOI:10.1038/s41420-022-01157-4 |
| [18] |
LIU S J, DANG H X, LIM D A, et al. Long noncoding RNAs in cancer metastasis[J]. Nature Reviews Cancer, 2021, 21(7): 446-460. DOI:10.1038/s41568-021-00353-1 |
| [19] |
WAN Y H, YAO D, FANG F Y, et al. LncRNA WT1-AS downregulates lncRNA UCA1 to suppress non-small cell lung cancer and predicts poor survival[J]. BMC Cancer, 2021, 21(1): 104. DOI:10.1186/s12885-020-07767-4 |
| [20] |
WANG H M, LU J H, CHEN W Y, et al. Upregulated lncRNA-UCA1 contributes to progression of lung cancer and is closely related to clinical diagnosis as a predictive biomarker in plasma[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(7): 11824-11830. |
| [21] |
YAO F, WANG Q, WU Q M. The prognostic value and mechanisms of lncRNA UCA1 in human cancer[J]. Cancer Management and Research, 2019, 11: 7685-7696. DOI:10.2147/CMAR.S200436 |
| [22] |
WANG C J, ZHU C C, XU J, et al. The lncRNA UCA1 promotes proliferation, migration, immune escape and inhibits apoptosis in gastric cancer by sponging anti-tumor miRNAs[J]. Molecular Cancer, 2019, 18(1): 115. DOI:10.1186/s12943-019-1032-0 |
| [23] |
JUN T, ZHENG F S, REN K M, et al. Suppression of long non-coding RNA UCA1 inhibits proliferation and invasion and induces apoptosis in human lung cancer cells[J]. European Review for Medical and Pharmacological Sciences, 2018, 22(21): 7274-7281. |
| [24] |
JUN T, ZHENG F S, REN K M, et al. Long non-coding RNA UCA1 regulates the proliferation, migration and invasion of human lung cancer cells by modulating the expression of microRNA-143[J]. European Review for Medical and Pharmacological Sciences, 2018, 22(23): 8343-8352. |
| [25] |
WANG X G, FA X N. Knockdown of UCA1 inhibits viability and glycolysis by suppressing PKM2 expression through the mTOR pathway in non-small cell lung cancer cells[J]. RSC Advances, 2018, 8(19): 10610-10619. DOI:10.1039/C8RA00860D |
| [26] |
LIU J Q, XIAO Q, XIAO J N, et al. Wnt/β-catenin signalling: function, biological mechanisms, and therapeutic opportunities[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 3. DOI:10.1038/s41392-021-00762-6 |
| [27] |
AROS C J, PANTOJA C J, GOMPERTS B N. Wnt signaling in lung development, regeneration, and disease progression[J]. Communications Biology, 2021, 4: 601. DOI:10.1038/s42003-021-02118-w |
| [28] |
STEWART D J. Wnt signaling pathway in non-small cell lung cancer[J]. Journal of the National Cancer Institute, 2014, 106(1): djt356. DOI:10.1093/jnci/djt356 |
| [29] |
KIM Y, JIN D H, LEE B B, et al. Overexpression of β-catenin and cyclin D1 is associated with poor overall survival in patients with stage ⅠA-ⅡA squamous cell lung cancer irrespective of adjuvant chemotherapy[J]. Journal of Thoracic Oncology, 2016, 11(12): 2193-2201. DOI:10.1016/j.jtho.2016.07.021 |
| [30] |
WANG W H, CHEN J, ZHANG B R, et al. Curcumin inhibits proliferation and enhances apoptosis in A549 cells by downregulating lncRNA UCA1[J]. Die Pharmazie, 2018, 73(7): 402-407. |
2. Pathology Department, Zibo Fourth People's Hospital Zibo 255000, China;
3. Clinical Laboratory, Zibo Fourth People's Hospital, Zibo 255000, China;
4. Radiology Department, Zibo Fourth People's Hospital, Zibo 255000, China
 2024, Vol. 41
2024, Vol. 41