文章信息
- 张亚薇, 董洋, 潘丽红, 等.
- ZHANG Yawei, DONG Yang, PAN Lihong, et al.
- 中药治疗功能性便秘潜在机制研究进展
- Research progress in the potential mechanism of Chinese medicine in the treatment of functional constipation
- 天津中医药, 2024, 41(9): 1206-1213
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(9): 1206-1213
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.09.22
-
文章历史
- 收稿日期: 2023-12-26
2. 鲁南制药集团股份有限公司经方与现代中药融合创新全国重点实验室, 临沂 276006;
3. 天津中医药大学中医药研究院, 组分中药国家重点实验室, 天津 301617
功能性便秘是指肠道没有任何器质性病变,机体其他系统没有疾病引发,且排除药物因素等情况下发生的便秘[1]。临床表现有排便困难、排便次数少或排便不尽感,可能伴有腹痛和腹胀。长期便秘可能诱发痔疮、功能性消化不良、胃食管反流等胃肠道病变,甚至会诱发心脑血管疾病、结直肠癌及肝性脑病等重症,危及患者生命。据统计,中国成年人功能性便秘的患病率为8.2%[2],且呈现逐年增加的趋势。目前,治疗功能性便秘的化学药物主要包括渗透性泻药(例如乳果糖和聚乙二醇)和促动力药(例如枸橼酸莫沙必利和普卢卡必利)[3],然而长期使用这些药物可能引起腹胀、维生素吸收障碍、增加药物依赖性等不良反应。
中医理论认为便秘的病因病机包括胃肠积热、气机郁滞、胃肠积热、阴亏血少、阴寒凝滞,针对不同病因病机采用麻子仁丸、六磨汤、济川煎等经典名方进行治疗,可显著缓解便秘症状并降低复发率[4-6]。中医药对功能性便秘的病因病机认识全面,针对疾病不同证型有完备的理法方药,临床治疗效果明确。因此,近年来越来越多的患者选择使用中药治疗便秘。同时,中药治疗功能性便秘的相关研究逐渐增多且不断深入,机制研究表明,中药及其活性成分主要通过促进Cajal间质细胞(ICC)的增殖、调控水通道蛋白表达、维护肠道微生态、增加促胃肠蠕动激素分泌等缓解便秘症状。笔者将主要从这4个方面入手,分别归纳中药方剂、单味药、单体治疗功能性便秘的疗效和作用机制,为进一步开发治疗功能性便秘的中药创新药物研究提供一定的理论参考。
1 中药促进Cajal间质细胞增殖ICC在胃肠传导中发挥重要的调控作用,ICC的形态和数量异常,是便秘发生的重要原因之一。ICC是肠道蠕动反射的起搏器,ICC通过间隙连接与邻近的平滑肌细胞相连,并通过产生内向电流和去极化形成有节奏的电节律性慢波,从而调节平滑肌的兴奋性,进而促进肠蠕动[7]。临床研究和动物实验均表明结肠中ICC的损伤会引起患者和大鼠发生便秘[8-9]。此外,ICC的成熟和发育依赖于酪氨酸激酶受体(c-kit)及其配体干细胞因子(SCF),c-kit与SCF结合后,激活c-kit/SCF信号通路,促进ICC的增殖和分化[10]。
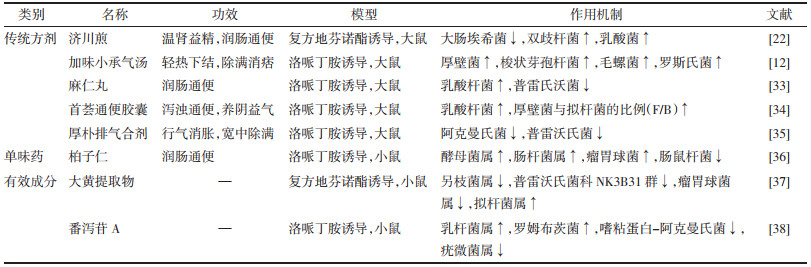
济川煎出自《景岳全书》,是治疗阳虚便秘的代表方,由当归、牛膝、肉苁蓉、泽泻、枳壳5味药组成,具有温肾益精,润肠通便的功效。有研究发现,济川煎显著增加大鼠结肠c-kit mRNA的含量,增加结肠组织中ICC数量,促进大鼠肠蠕动,改善便秘[11]。小承气汤是《伤寒论》的代表方剂,由大黄、厚朴、枳实组成,具有轻热下结,除满消痞的功效。Zhou等[12]在小承气汤的基础上加味黄芪、当归、熟地黄、丹参,灌胃治疗便秘模型大鼠,提取结肠ICCs,通过蛋白质印迹分析和流式细胞术检测细胞中c-kit的表达,结果发现加味小承气汤可以增加c-kit的表达,恢复ICC的损伤,抑制ICC的凋亡。六磨汤出自《世医得效方》,临床上主要用来治疗气滞型便秘,由槟榔、沉香、木香、乌药、枳壳、大黄组成,具有理气调中、行滞通便的作用。王立明等[13]发现六磨汤能够显著上调便秘大鼠结肠组织中c-kit、SCF蛋白表达水平,通过调节c-kit、SCF表达来治疗慢传输型便秘。首荟通便胶囊是临床治疗便秘常用的中成药,该方由何首乌、芦荟、决明子、人参、枸杞子、阿胶、枳实、白术8味中药组成,具有泻浊通便、养阴益气的功效。研究发现,首荟通便胶囊上调c-kit/SCF信号通路,促进Cajal间质细胞增殖,增强肠道神经传递以及肠道动力,明显缩短慢传输型便秘模型小鼠首粒黑便排出时间,提高肠道推进率、粪便含水量及数量,改善便秘症状[14]。
另外,单味药苦杏仁,蔷薇科植物山杏Prunus armeniaca L.var.ansu Maxim.、西伯利亚杏Prunus sibirica L.、东北杏Prunus mandshurica(Maxim.)Koehne或杏Prunus armeniaca L. 的干燥成熟种子,具有润肠通便的功效,常用于治疗肠燥便秘。研究表明,苦杏仁通过上调大鼠结肠组织中SCF、c-kit蛋白及mRNA的表达水平,激活SCF/c-kit信号通路,修复便秘大鼠结肠组织中ICC,从而改善肠道蠕动功能[15]。大黄的有效活性成分大黄素,通过提高便秘小鼠c-kit和SCF的表达水平,修复肠神经系统进而缓解洛哌丁胺诱导的便秘[16]。通过促进ICC增殖治疗功能性便秘的中药见表 1。

|
水通道蛋白(AQPs)是一个在胃肠道中高度表达的跨膜蛋白家族,主要负责胃肠道中水液和离子的转运。目前已知AQPs有13种类型,包括AQP0至AQP12,其中AQP1、AQP3、AQP4、AQP7、AQP8、AQP9和AQP10主要在结肠中表达[17]。它们的表达异常会影响结肠水液代谢、粪便含水量和肠道通透性,导致结肠肠液分泌减少,引发便秘症状[18]。Li等[19]通过建立洛哌丁胺诱导的便秘大鼠模型研究发现,调节结肠组织中AQP4和AQP8的表达可改善水液代谢从而治疗便秘。
治疗热积便秘的中成药麻仁丸,由火麻仁、苦杏仁、大黄、枳实(炒)、姜厚朴、炒白芍组成,用于肠热津亏所致的便秘。在复方地芬诺酯诱导的便秘模型大鼠中发现,麻仁丸显著下调了便秘模型大鼠远端结肠和近端结肠中的AQP3的表达,显著上调AQP9的表达[20]。治疗阴虚型便秘的主方增液汤,出自《温病条辨》卷二,具有增液润燥的功效,在复方地芬诺酯混悬液建立的小鼠便秘模型中,通过下调AQP3、AQP4表达,发挥“增液行舟”效应,治疗小鼠便秘[21]。上文所提到的济川煎,该方剂能够下调环磷酸腺苷(cAMP)、蛋白激酶A(PKA),通过抑制cAMP-PKA信号通路降低AQP3在结肠组织中基因和蛋白的表达,调节肠道水液代谢紊乱,从而治疗功能性便秘[22]。
此外,占煜等[23]研究发现,单味药大黄(蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄Rheum tanguticum Maxim. ex Balf.或药用大黄Rheum officinale Baill.的干燥根和根茎)通过调节结肠中AQP3的表达,增强便秘大鼠的肠传输功能,促进肠道蠕动。也有临床上采用甘草与大黄配伍使用治疗功能性便秘,研究发现,适量的大黄与甘草配伍可以通过血管活性肠肽(VIP)/cAMP/PKA途径调节结肠中AQP3的mRNA和蛋白表达,增加粪便含水量缓解小鼠的便秘症状[24]。单味药当归为伞形科植物当归Angelica sinensis(Oliv.)Diels的干燥根。研究发现,当归可有效改善血虚型便秘,其机制可能是通过调节结肠cAMP-PKA信号通路,下调结肠AQP8的表达,增加粪便含水量[25]。此外,有报道指出大黄中有效活性成分大黄酸通过减少结肠黏膜AQP3的表达,缓解便秘症状[26]。通过调节水通道蛋白的表达治疗功能性便秘的中药见表 2。

|
大量研究表明,便秘患者和便秘动物模型中肠道菌群的种类、数量与正常人群和动物比较具有统计学差异[27-28],主要表现在肠道中有益菌的减少(如乳酸杆菌、罗斯氏菌、类杆菌_S24-7和厚壁菌)和致病菌的增加(如异型葡萄球菌、葡萄球菌和普雷沃茨菌)[29-30]。研究表明,结肠黏膜中拟杆菌的丰度与便秘程度呈正相关,而厚壁菌的丰度与结肠传输速度呈正相关[31]。Hu等[32]发现,与正常对照组比较,便秘小鼠肠道中厚壁菌相对丰度显著降低,而拟杆菌的相对丰度显著增加。
麻仁丸、济川煎、加味小承气汤、首荟通便胶囊等都可以调节肠道菌群的丰度,恢复结肠菌群结构,进而缓解便秘。例如,Zhan等[33]发现麻仁丸能够增加便秘大鼠肠道中乳酸杆菌和减少普雷氏沃菌的丰度,改善便秘模型大鼠结肠菌群结构。杨颖等[22]采用济川煎治疗便秘大鼠8日后发现与模型组比较,给药组大鼠结肠中大肠埃希菌含量显著降低,双歧杆菌和乳酸菌含量则显著升高;加味小承气汤可以通过显著升高便秘大鼠粪便中厚壁菌、梭状芽孢杆菌、毛螺菌和罗斯氏菌的丰度,调节肠道菌群恢复稳态[15];Lin等[34]发现首荟通便胶囊可以增加乳酸杆菌的相对丰度,调节厚壁菌与拟杆菌的比例(F/B)改善洛哌丁胺诱导的大鼠便秘。中成药厚朴排气合剂主要用来治疗气滞便秘,是由厚朴(姜制)、木香、枳实(麸炒)、大黄组成,具有行气消胀,宽中除满的功效。研究发现,厚朴排气合剂能够通过增加结肠内容物阿克曼氏菌的相对丰度以及降低普雷沃氏菌的相对丰度,显著改善便秘大鼠的肠道微生物群[35]。此外,单味药柏子仁,柏科植物侧柏Platycladus orientalis(L.)Franco的干燥成熟种仁。研究发现柏子仁可以调节便秘小鼠的肠道菌群,增加模型小鼠肠道菌群种类,显著增加酵母菌属、肠杆菌属、瘤胃球菌的丰度,减少肠鼠杆菌的丰度,促进肠道蠕动,达到润肠通便的效果[36]。大黄提取物可以通过增加肠道菌群的多样性,改善肠道微环境,进而缓解便秘[37]。番泻苷A是番泻叶发挥泻下作用的有效单体成分,它可以通过调节肠道微生物群:升高乳杆菌属,罗姆布茨菌的丰富度,降低黏蛋白-阿克曼氏菌和疣微菌属的丰度,提高小肠推进率,发挥其通便作用[38]。通过恢复肠道菌群的结构治疗功能性便秘的中药见表 3。
|
结肠的肠肌和黏膜下神经节中分布着许多调控胃肠蠕动的内源性物质,包括P物质(SP)、乙酰胆碱(ACh)、VIP、一氧化氮(NO)、5-羟色胺(5-HT)等。SP和ACh属于兴奋性神经递质,SP分泌增加促进水和电解质从体循环侧向肠腔侧分泌,并引起平滑肌收缩,促进肠道运动,ACh直接作用于肠道平滑肌,促进肠蠕动,加速肠内容物排出[39-40]。研究表明,在便秘小鼠模型中,SP和ACh的表达含量显著低于正常小鼠[39-41];5-HT由肠嗜细胞(EC)分泌,通过作用于5-HT3受体(5-HT3R)和5-HT4受体(5-HT4R)刺激肠道蠕动,增加肠液分泌[42]。研究发现,一些天然多糖通过促进5-HT的分泌[43],或是增加结肠中5-HT4R受体的表达,增强肠道蠕动[44]。VIP是肠道蠕动反射的重要介质,参与抑制性神经肌肉传递,可使胃肠平滑肌舒张[45],在便秘情况下,VIP表达会下调[41, 46]。NO是结肠肠蠕动的主要抑制性神经递质[47],洛哌丁胺诱导的便秘小鼠中,NO含量显著增加[48]。
黄芪汤是治疗气虚便秘的主方,出自于《金匮翼》,由黄芪、陈皮、白蜜、火麻仁组成,有益气润肠通便的功效。虎敏洁[49]通过观察加味黄芪汤对气虚型慢性便秘患者的临床疗效,发现加味黄芪汤治疗后的患者血清5-HT浓度较治疗前升高,表明加味黄芪汤可以通过促进血清5-HT的释放实现对便秘患者的治疗作用。金世峰等[50]发现治疗血虚便秘的归仁润肠颗粒可改善慢传输型便秘小鼠排便情况,其作用机制与上调血清中5-HT和胃动素(MTL)表达及下调NO表达有关。治疗气滞便秘的四磨汤,来源于《济生方》,由乌药、人参、沉香、槟榔组成,功效具有破滞降逆、补气扶正等作用。临床研究发现它可以降低患者体内肠神经递质NO的水平,缓解成人功能性便秘[51]。
单味药芦荟、蜂蜜、肉苁蓉以及有效活性成分白头翁皂苷A都能通过调节胃肠神经递质来缓解便秘症状。芦荟为百合科植物库拉索芦荟Aloe barbadensis Miller、好望角芦荟Aloe ferox Miller或其他同属近缘植物叶的汁液浓缩干燥物,具有通便作用,用来治疗热结便秘。动物实验证实,芦荟通过增加结肠组织中5-HT、SP的分泌,治疗地芬诺酯诱导的小鼠便秘[52]。蜂蜜是蜜蜂科昆虫中华蜜蜂Apis cerana Fabricius或意大利蜂Apis mellifera Linnaeus所酿的蜜。蜂蜜能够提高便秘小鼠结肠组织中兴奋性神经递质SP含量,促进肠动力,同时增加粪便含水量,调节肠道微生态失衡,从而缓解便秘[53]。动物实验表明,肉苁蓉调节便秘模型鼠血浆中胃泌素(GAS)、SP、MTL、VIP的含量,增强小肠推进率,有效治疗便秘[54]。另外,有研究发现,白头翁中的白头翁皂苷A通过调控结肠黏液屏障及5-HT、NO肠神经递质水平改善大鼠便秘症状[55]。通过控制胃肠蠕动调控物质的分泌治疗功能性便秘的中药见表 4。

|
肠道平滑肌的电活动主要有慢波电位和动作电位两种形式,慢波电位又称基本电节律,是由细胞起搏器的自发去极化形成,属于局部电位,来源于纵向肌肉,其作用是调节肠道平滑肌的紧张程度,从而影响食物的推进,但它不能直接导致平滑肌收缩。慢波是平滑肌的起始电位,动作电位需要在慢波电位的基础上产生,当一个动作电位与慢波电位重叠时,就会触发肠道平滑肌的收缩,进而促进结肠活动,使食物在肠道中向前运动[56]。慢波电位是调节肠道平滑肌基础张力的关键因素,而动作电位则负责肠道平滑肌细胞的收缩和放松。在肠道平滑肌的电活动中,这两种电位的变化相互作用,共同调节肠道功能,因此,结肠产生的慢波频率和振幅间接反映结肠功能。
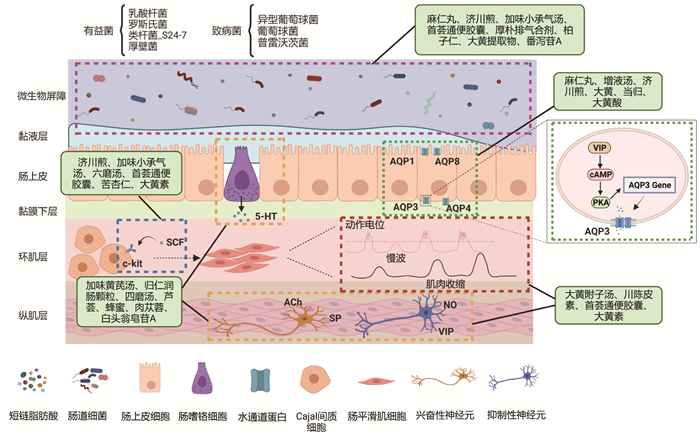
肠道神经系统(ENS)由大量埋在胃肠壁内的神经元组成,其完全独立于中枢神经系统(CNS),是属于胃肠道内在的神经系统,在控制胃肠道运动方面起着重要作用。ENS中的兴奋性和抑制性运动神经元密集支配着胃肠道平滑肌细胞,ENS的损伤,会影响平滑肌细胞的功能,导致肠道蠕动障碍。例如,White等[57]研究表明黄病毒感染激活肠道CD8+ T细胞,引起急性肠道神经元炎症损伤,进而导致肠道转运减慢;另有研究报道,西式饮食喂养小鼠会诱导结肠神经元丢失,导致小鼠结肠松弛受损,引起肠道蠕动延迟[58]。以上提及的中药治疗功能性便秘的潜在机制见图 1。
|
| 注:本图使用BioRender.com绘制。 图 1 中药治疗功能性便秘的潜在机制 Fig. 1 Potential mechanisms for the treatment of functional constipation with Chinese medicine |
大黄附子汤出自《金匮要略》,具有温里散寒,通便止痛的功效,由大黄、附子、细辛组成。史晓燕等[59]给功能性便秘模型大鼠灌胃大黄附子汤7 d发现,与模型组大鼠比较,给药组大鼠的结肠肌电慢波频率加快,振幅增加,大黄附子汤显著改善了功能性便秘大鼠的症状,具有明显的治疗作用。陈皮中的川陈皮素可通过调节结肠肌电慢波的振幅和频率、增强肠道神经传递,进而来治疗小鼠便秘[60]。
在盐酸洛哌丁胺诱导的便秘小鼠的实验中发现,首荟通便胶囊能够促进小肠和结肠中肠神经系统(ENS)的肠神经元生长显著改善实验性便秘小鼠的症状并加速肠动力[61]。大黄的活性成分大黄素也可以通过修复肠神经系统进而缓解洛哌丁胺诱导的小鼠便秘[16]。通过调节平滑肌电活动和肠神经系统治疗功能性便秘的中药见表 5。

|
近年来功能性便秘的发病率逐渐升高,中药治疗基于多途径、多靶点、多环节的特点,整体与局部相结合治疗功能性便秘,取得了良好的治疗效果。目前,中药已成为治疗便秘的补充和替代药物。笔者在分析功能性便秘发病机制的基础上,总结了经典复方、单味药以及有效成分治疗功能性便秘的作用机制,发现中药及其活性物质能够对ICC增殖、水通道蛋白表达、胃肠蠕动调控物质分泌、肠道菌群稳态进行调控,发挥治疗功能性便秘的作用。然而目前的研究仍存在一些不足之处:1)虽然中药治疗功能性便秘的实验研究较多,但是研究缺乏深度,如部分实验单纯停留于血清中胃肠蠕动调控物质的含量检测,药物作用靶点方面的研究缺乏前沿的研究成果,导致来源于中药的治疗功能性便秘的新药研发滞后。2)异常的肠道菌群是导致功能性便秘的关键因素,但目前中药调控肠道菌群治疗便秘的相关研究多局限于菌群丰度及多样性研究,对于肠道菌群与肠神经系统、平滑肌电生理反应、肠内分泌系统之间的复杂调控机制仍未阐明,因此无法确切揭示中药调控肠道菌群治疗功能性便秘的作用机制。3)目前很多中药治疗便秘的相关研究多局限于细胞和动物水平,临床研究较少,部分中药成分生物利用度低、稳定性较差,导致其临床效果与实验结果差异较大,因此,在后续的研究中,需要结合传统中医药临床经验,开展设计严谨的临床大样本研究,并采用现代研究手段更加深入挖掘中药治疗便秘的确切机制,以此为基础开发治疗便秘的新型药物。
| [1] |
SPERBER A D, BANGDIWALA S I, DROSSMAN D A, et al. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome foundation global study[J]. Gastroenterology, 2021, 160(1): 99-114.e3. DOI:10.1053/j.gastro.2020.04.014 |
| [2] |
CHU H K, ZHONG L K, LI H, et al. Epidemiology characteristics of constipation for general population, pediatric population, and elderly population in China[J]. Gastroenterology Research and Practice, 2014, 2014: 532734. |
| [3] |
TACK J, MÜLLER-LISSNER S. Treatment of chronic constipation: current pharmacologic approaches and future directions[J]. Clinical Gastroenterology and Hepatology, 2009, 7(5): 502-508. DOI:10.1016/j.cgh.2008.12.006 |
| [4] |
刘燕妮. 济川煎治疗老年脾肾阳虚便秘临床观察[J]. 光明中医, 2023, 38(13): 2543-2546. |
| [5] |
王银娟, 包世民, 王芬芬. 麻仁丸联合复方嗜酸乳杆菌片治疗老年功能性便秘临床研究[J]. 新中医, 2023, 55(8): 78-81. |
| [6] |
赵志勇. 六磨汤治疗慢传输型便秘的临床疗效观察[J]. 中国现代药物应用, 2022, 16(5): 182-184. |
| [7] |
SANDERS K M, WARD S M, KOH S D. Interstitial cells: regulators of smooth muscle function[J]. Physiological Reviews, 2014, 94(3): 859-907. DOI:10.1152/physrev.00037.2013 |
| [8] |
HUIZINGA J D, HUSSAIN A, CHEN J H. Interstitial cells of Cajal and human colon motility in health and disease[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2021, 321(5): G552-G575. DOI:10.1152/ajpgi.00264.2021 |
| [9] |
LEE S M, KIM N, JO H J, et al. Comparison of changes in the interstitial cells of Cajal and neuronal nitric oxide synthase-positive neuronal cells with aging between the ascending and descending colon of F344 rats[J]. Journal of Neurogastroenterology and Motility, 2017, 23(4): 592-605. DOI:10.5056/jnm17061 |
| [10] |
TONG W D, JIA H J, ZHANG L, et al. Exogenous stem cell factor improves interstitial cells of Cajal restoration after blockade of c-kit signaling pathway[J]. Scandinavian Journal of Gastroenterology, 2010, 45(7/8): 844-851. |
| [11] |
顾尽晖, 何羽, 汤灵娇, 等. 济川煎对结肠慢传输型便秘模型大鼠血浆SP、肠组织ICC与肠推动力等因素影响的研究[J]. 北京中医药, 2018, 37(5): 410-414. |
| [12] |
ZHOU Q, ZHANG D, ZHANG H, et al. Effects of Xiao Chengqi Formula on slow transit constipation by assessing gut microbiota and metabolomics analysis in vitro and in vivo[J]. Frontiers in Pharmacology, 2022, 13: 864598. DOI:10.3389/fphar.2022.864598 |
| [13] |
王立明, 尚惺杰, 朱雅碧, 等. 电针联合六磨汤对慢传输型便秘大鼠的有益作用[J]. 世界华人消化杂志, 2021, 29(11): 585-591. |
| [14] |
郑舒泽, 郭强, 张贵民, 等. 首荟通便胶囊对慢传输型便秘模型小鼠的治疗作用及机制研究[J]. 中国中药杂志, 2021, 46(3): 520-525. |
| [15] |
徐立宇, 陈新宇. 苦杏仁对老年慢传输型便秘大鼠结肠组织干细胞因子、酪氨酸激酶受体、间隙连接蛋白43表达的影响[J]. 中华老年病研究电子杂志, 2020, 7(2): 22-25. |
| [16] |
计树灵, 韩佳瑞, 贺璐璐, 等. 大黄素对洛哌丁胺致小鼠便秘的治疗作用[J]. 中国病理生理杂志, 2019, 35(12): 2262-2268. |
| [17] |
IKARASHI N, KON R, SUGIYAMA K. Aquaporins in the colon as a new therapeutic target in diarrhea and constipation[J]. International Journal of Molecular Sciences, 2016, 17(7): 1172. DOI:10.3390/ijms17071172 |
| [18] |
LIU S L, QIU Y Q, GU F, et al. Niacin improves intestinal health through up-regulation of AQPs expression induced by GPR109A[J]. International Journal of Molecular Sciences, 2022, 23(15): 8332. DOI:10.3390/ijms23158332 |
| [19] |
LI X M, LIU Y, GUAN W, et al. Physicochemical properties and laxative effects of polysaccharides from Anemarrhena asphodeloides Bge. in loperamide-induced rats[J]. Journal of Ethnopharmacology, 2019, 240: 111961. DOI:10.1016/j.jep.2019.111961 |
| [20] |
耿学斯, 罗春华, 肖秋平, 等. 肠润方对功能性便秘大鼠结肠黏膜AQP3、AQP9表达的影响[J]. 中华中医药杂志, 2016, 31(11): 4699-4703. |
| [21] |
刘峰林. 增液汤对慢传输型便秘小鼠水通道蛋白的实验研究[D]. 沈阳: 辽宁中医药大学, 2020.
|
| [22] |
杨颖, 余清华, 王宇, 等. 济川煎对慢传输型便秘大鼠的水通道蛋白影响[J]. 中药药理与临床, 2019, 35(6): 15-19. |
| [23] |
占煜, 申旭龙, 徐红, 等. 大黄对洛哌丁胺便秘模型大鼠结肠水通道蛋白3表达及肠动力的作用研究[J]. 中华中医药学刊, 2016, 34(10): 2315-2320. |
| [24] |
赵琦. 基于水通道蛋白和肠道菌群的甘草缓大黄峻烈之性作用及机制研究[D]. 咸阳: 陕西中医药大学, 2022.
|
| [25] |
杜丽东, 雒军, 吴国泰, 等. 当归对血虚便秘模型小鼠结肠水通道蛋白8表达的影响[J]. 中国中医药信息杂志, 2018, 25(7): 44-48. |
| [26] |
姜洪波, 孙莉莉, 刘伯语, 等. 大黄酸对便秘小鼠肠道传输功能和结肠肌电及结肠黏膜水通道蛋白3表达的影响[J]. 中国老年学杂志, 2017, 37(17): 4169-4172. |
| [27] |
FAN Y D, XU C, XIE L L, et al. Abnormal bile acid metabolism is an important feature of gut microbiota and fecal metabolites in patients with slow transit constipation[J]. Frontiers in Cellular and Infection Microbiology, 2022, 12: 956528. DOI:10.3389/fcimb.2022.956528 |
| [28] |
LIANG Y X, WEN P, WANG Y, et al. The constipation-relieving property of d-tagatose by modulating the composition of gut microbiota[J]. International Journal of Molecular Sciences, 2019, 20(22): 5721. DOI:10.3390/ijms20225721 |
| [29] |
HUANG J Q, LIN B, ZHANG Y, et al. Bamboo shavings derived O-acetylated xylan alleviates loperamide-induced constipation in mice[J]. Carbohydrate Polymers, 2022, 276: 118761. DOI:10.1016/j.carbpol.2021.118761 |
| [30] |
ZHU L X, LIU W S, ALKHOURI R, et al. Structural changes in the gut microbiome of constipated patients[J]. Physiological Genomics, 2014, 46(18): 679-686. DOI:10.1152/physiolgenomics.00082.2014 |
| [31] |
PARTHASARATHY G, CHEN J, CHEN X F, et al. Relationship between microbiota of the colonic mucosa vs feces and symptoms, colonic transit, and methane production in female patients with chronic constipation[J]. Gastroenterology, 2016, 150(2): 367-379.e1. DOI:10.1053/j.gastro.2015.10.005 |
| [32] |
HU T G, WEN P, FU H Z, et al. Protective effect of mulberry(Morus atropurpurea) fruit against diphenoxylate-induced constipation in mice through the modulation of gut microbiota[J]. Food & Function, 2019, 10(3): 1513-1528. |
| [33] |
ZHAN Y, WEN Y, DU L J, et al. Effects of Maren pills on the intestinal microflora and short-chain fatty acid profile in drug-induced slow transit constipation model rats[J]. Frontiers in Pharmacology, 2022, 13: 804723. DOI:10.3389/fphar.2022.804723 |
| [34] |
LIN Q, LIU M, ERHUNMWUNSEE F, et al. Chinese patent medicine Shouhui Tongbian capsule attenuated loperamide-induced constipation through modulating the gut microbiota in rat[J]. Journal of Ethnopharmacology, 2022, 298: 115575. DOI:10.1016/j.jep.2022.115575 |
| [35] |
WANG R X, LU X F, ZHAO L Q, et al. Houpo paiqi mixture promotes intestinal motility in constipated rats by modulating gut microbiota and activating 5-HT-cAMP-PKA signal pathway[J]. Journal of Applied Microbiology, 2023, 134(8): lxad153. DOI:10.1093/jambio/lxad153 |
| [36] |
倪红辉, 吴育, 符映均, 等. 柏子仁及其炮制品对便秘小鼠肠道菌群的影响[J]. 中医药导报, 2020, 26(7): 16-19. |
| [37] |
GAO C C, LI G W, WANG T T, et al. Rhubarb extract relieves constipation by stimulating mucus production in the colon and altering the intestinal flora[J]. Biomedecine & Pharmacotherapie, 2021, 138: 111479. |
| [38] |
ZHANG M M, GONG Z C, ZHAO Q, et al. Time-dependent laxative effect of sennoside A, the core functional component of rhubarb, is attributed to gut microbiota and aquaporins[J]. Journal of Ethnopharmacology, 2023, 311: 116431. DOI:10.1016/j.jep.2023.116431 |
| [39] |
WANG Y J, JIANG H, WANG L J, et al. Luteolin ameliorates loperamide-induced functional constipation in mice[J]. Revista Brasileira De Pesquisas Medicas e Biologicas, 2023, 56: e12466. |
| [40] |
LI Z Y, LI X Y, TANG S H, et al. Moringa oleifera Lam. Leaf improves constipation of rats induced by low-fiber-diet: a proteomics study[J]. Journal of Ethnopharmacology, 2024, 318(Pt A): 116936. |
| [41] |
SU Y G, ZHU R J, PANG C X, et al. Laxative effect of Wenyang Yiqi Decoction on loperamide-induced astriction model mice[J]. Annals of Translational Medicine, 2023, 11(4): 170. DOI:10.21037/atm-23-6 |
| [42] |
KENDIG D M, GRIDER J R. Serotonin and colonic motility[J]. Neurogastroenterology and Motility, 2015, 27(7): 899-905. DOI:10.1111/nmo.12617 |
| [43] |
LI X, ZHANG M, KHOO H E, et al. Effect of polysaccharides from Enteromorpha intestinalis on intestinal function in sprague dawley rats[J]. Frontiers in Pharmacology, 2021, 12: 796734. |
| [44] |
REN X X, LIU L, GAMALLAT Y, et al. Enteromorpha and polysaccharides from Enteromorpha ameliorate loperamide-induced constipation in mice[J]. Biomedecine & Pharmacotherapie, 2017, 96: 1075-1081. |
| [45] |
KEEF K D, SAXTON S N, MCDOWALL R A, et al. Functional role of vasoactive intestinal polypeptide in inhibitory motor innervation in the mouse internal anal sphincter[J]. The Journal of Physiology, 2013, 591(6): 1489-1506. DOI:10.1113/jphysiol.2012.247684 |
| [46] |
GIANCOLA F, TORRESAN F, REPOSSI R, et al. Downregulation of neuronal vasoactive intestinal polypeptide in Parkinson's disease and chronic constipation[J]. Neurogastroenterology & Motility, 2017, 29(5): e12995. |
| [47] |
BALASURIYA G K, NUGAPITIYA S S, HILL-YARDIN E L, et al. Nitric oxide regulates estrus cycle dependent colonic motility in mice[J]. Frontiers in Neuroscience, 2021, 15: 647555. DOI:10.3389/fnins.2021.647555 |
| [48] |
HUANG J Q, LI S Y, WANG Q, et al. Pediococcus pentosaceus B49 from human colostrum ameliorates constipation in mice[J]. Food & Function, 2020, 11(6): 5607-5620. |
| [49] |
虎敏洁. 加味黄芪汤治疗气虚型慢性便秘及其对肠道菌群、短链脂肪酸、5-HT影响的研究[D]. 兰州: 甘肃中医药大学, 2022.
|
| [50] |
金世峰. 归仁润肠颗粒对慢传输型便秘小鼠治疗作用及机制研究[D]. 长春: 长春中医药大学, 2019.
|
| [51] |
相翠玉, 刘洁, 张永洲, 等. 加味四磨汤治疗成人功能性便秘及对肠道神经递质的影响[J]. 中国实验方剂学杂志, 2019, 25(2): 150-155. |
| [52] |
TANG R Y, ZHANG J J, NAN H P, et al. Exploring molecular mechanisms of Aloe barbadmsis miller on diphenoxylate-induced constipation in mice[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2022, 2022: 6225758. |
| [53] |
LI Y Y, LONG S Q, LIU Q C, et al. Gut microbiota is involved in the alleviation of loperamide-induced constipation by honey supplementation in mice[J]. Food Science & Nutrition, 2020, 8(8): 4388-4398. |
| [54] |
范亚楠, 黄玉秋, 贾天柱, 等. 肉苁蓉炮制前后对便秘大鼠的通便作用[J]. 中成药, 2016, 38(12): 2684-2687. |
| [55] |
陈泰宇, 李敏, 赵兵, 等. 白头翁皂苷A对慢传输型便秘大鼠的影响[J]. 中国临床药理学杂志, 2023, 39(7): 1013-1017. |
| [56] |
BAYGUINOV P O, HENNIG G W, SMITH T K. Calcium activity in different classes of myenteric neurons underlying the migrating motor complex in the murine colon[J]. The Journal of Physiology, 2010, 588(3): 399-421. |
| [57] |
WHITE J P, XIONG S S, MALVIN N P, et al. Intestinal dysmotility syndromes following systemic infection by flaviviruses[J]. Cell, 2018, 175(5): 1198-1212.e12. |
| [58] |
YE L, LI G, GOEBEL A, et al. Caspase-11-mediated enteric neuronal pyroptosis underlies Western diet-induced colonic dysmotility[J]. The Journal of Clinical Investigation, 2020, 130(7): 3621-3636. |
| [59] |
史晓燕, 史迎莉, 李倩, 等. 大黄附子汤对大鼠功能性便秘的治疗作用[J]. 新乡医学院学报, 2016, 33(10): 860-863. |
| [60] |
黄礼, 韦祎, 刘英莲. 川陈皮素对慢传输型便秘小鼠的治疗作用及机制研究[J]. 世界科学技术-中医药现代化, 2023, 25(5): 1736-1742. |
| [61] |
BAI J Z, CAI Y J, HUANG Z Y, et al. Shouhui Tongbian Capsule ameliorates constipation via gut microbiota-5-HT-intestinal motility axis[J]. Biomedecine & Pharmacotherapie, 2022, 154: 113627. |
2. State Key Laboratory of Integration and Innovation of Classic Formula and Modern Chinese Medicine, Lunan Pharmaceutical Group Co Ltd Linyi 276006, China;
3. State Key Laboratory of Component-based Chinese Medicine, Institute of Traditional Chinese Medicine Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2024, Vol. 41
2024, Vol. 41