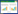文章信息
- 张辉, 徐强, 王保和.
- ZHANG Hui, XU Qiang, WANG Baohe.
- 高尿酸血症对痰瘀互结型急性冠脉综合征患者PCI预后的影响
- Effect of hyperuricemia on the prognosis of acute coronary syndrome patients with intermingled phlegm and blood stasis syndrome after PCI
- 天津中医药, 2025, 42(1): 8-14
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(1): 8-14
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.01.03
-
文章历史
- 收稿日期: 2024-09-09
2. 天津中医药大学第二附属医院, 天津 300250;
3. 天津中医药大学第四附属医院, 天津 300451;
4. 天津中医药大学第一附属医院, 天津 300381
高尿酸血症(HUA)是嘌呤代谢障碍导致的慢性代谢性疾病,近年来在全球范围内患病率不断增加,在中国45岁及以上居民中的总体患病率已达12.38%[1]。HUA早期仅表现为血清尿酸(SUA)浓度增加,又称为无症状HUA,常与高血压、糖尿病等心血管危险因素伴发[2],在心肌损伤相关疾病的发生发展中扮演重要角色[3-4]。急性冠脉综合征(ACS)是冠状动脉粥样硬化斑块糜烂或破裂引发的心肌急性缺血综合征,经皮冠状动脉介入(PCI)是其重要的再灌注方式,研究表明,HUA是ACS发生的独立危险因素,但HUA对ACS患者PCI预后的影响尚不清晰。
中医理论中,证型是重要的分类思维,是对病机共性进行的高度概括。ACS病因病机复杂,不同证型间通常存在显著的理化指标差异,其中痰瘀互结型与代谢异常性疾病高度相关,也是目前ACS常见证型。在痰瘀互结这一具体证型中,厘清HUA与ACS预后的关联性,有助于寻找新的治疗靶点,针对性地探讨中西医结合治疗方案,以进一步降低患者的心血管残余风险。
1 对象与方法 1.1 研究对象课题组通过医院信息系统收集了2019年1月至2023年6月于天津中医药第二附属医院诊断为ACS并行PCI治疗的患者住院资料,本研究提取其中辨证为痰瘀互结型的45岁及以上患者数据进行分析。所有患者住院期间接受指南推荐的西医规范化治疗,包括双联抗血小板、强化降脂等,出院后通过电子通讯手段、门诊复查等形式进行长期随访。
本研究已获得天津中医药大学第二附属医院伦理委员会批准(伦理审查批件号:2022-024-01)。
1.2 诊断及辨证标准 1.2.1 ACS诊断标准及PCI治疗指征参考《急性冠脉综合征急诊快速诊治指南(2019)》[5]和《中国经皮冠状动脉介入治疗指南(2016)》[6]。
1.2.2 痰瘀互结型辨证标准参考《急性心肌梗死中医临床诊疗指南》[7]和《不稳定型心绞痛中医诊疗专家共识》[8]。
主症:剧烈胸痛或胸闷如窒;次症:肢体沉重,头昏目眩,脑胀,口中黏腻,咳嗽痰多,气短,食欲下降,恶心呕吐,腹胀,口唇紫暗;舌象:舌暗或有瘀斑瘀点,舌体胖大,有齿痕,舌苔腻,舌下静脉迂曲或怒张或色紫暗;脉象:脉涩或弦滑。同时具备以上主症、次症各1项,兼具舌脉者,可诊为痰瘀互结。
1.3 纳入标准1)年龄≥45岁,性别不限;2)发病期间诊断为ACS并接受PCI治疗,包括冠状动脉支架置入和(或)经皮冠状动脉球囊扩张成形术;3)中医辨证属痰瘀互结型;4)未发作痛风性关节炎、痛风性肾病,并且入院前2周未服用降尿酸药品。
1.4 排除标准1)PCI失败,未有效血运重建;2)血液疾病、恶性肿瘤等引起的继发性HUA;3)住院期间SUA检测次数<2次;4)术后1年随访记录缺失或失访。
1.5 研究方法与分组由2名经过培训的临床医师通过医院信息系统收集患者基线资料,包括性别、年龄、合并症(高血压、糖尿病、高脂血症)、吸烟史、诊断[ST段抬高型心肌梗死(STEMI)、非ST段抬高型急性冠脉综合征(NSTE-ACS)]、冠状动脉病变程度(单支病变、多支病变)、支架数(>1支或≤ 1支)、院内用药(β受体阻滞剂、血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体阻滞剂(ARB)、中药汤剂[9]),以及住院期间空腹SUA浓度,双人双录入,构建分析数据库。
参考《中国高尿酸血症相关疾病诊疗多学科专家共识(2023年版)》[10],将非同日2次空腹SUA浓度>420 μmol/L的患者定义为HUA组,其余患者为非HUA组。
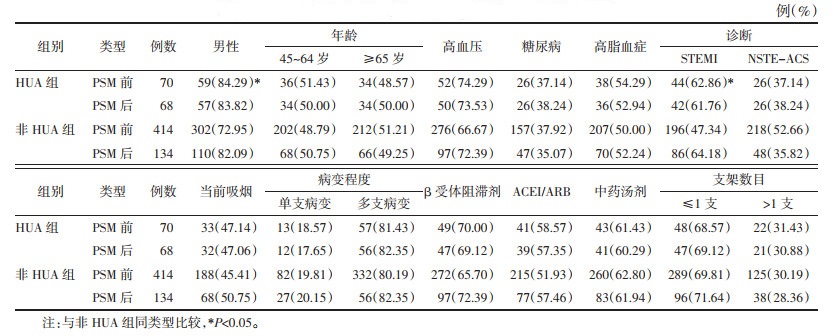
1.6 研究终点 1.6.1 主要终点术后1年内主要不良心脑血管事件(MACCE),系由心源性死亡、非致死性心肌梗死、卒中、新发或加重心力衰竭(HF)组成的复合终点事件。
1.6.2 次要终点心源性死亡、非致死性心肌梗死、卒中、新发或加重HF。
1.7 统计学方法采用SPSS 26及PS matching插件进行数据分析。通过倾向性评分匹配(PSM)排除混杂因素干扰,选择1∶2最邻近匹配法,卡钳值设置为0.1。PSM后样本量减少,假设检验可能存在偏差,故而选择计算标准化均数差异(SD)检验匹配效果,标准化均数差异绝对值(ASD)<10%时说明各组间均衡性较好。
计数资料用例数(百分比)表示,采用卡方检验进行组间比较。以是否发生终点事件为状态变量,事件距PCI时间为时间变量,通过单因素Cox回归、绘制Kaplan-Meier生存曲线描述各组终点事件差异,通过多因素Cox回归校正协变量以明确HUA对终点事件发生风险的影响。P<0.05表示差异有统计学意义。
2 结果 2.1 患者筛选流程及分组2019年1月至2023年6月于天津中医药大学第二附属医院诊断为ACS并行PCI治疗患者904例,辨证属痰瘀互结型患者624例,依次排除其中年龄<45岁患者43例、PCI操作失败患者2例、患痛风性关节炎或正在服用降尿酸药物患者11例、SUA检测次数<2次患者10例,术后12月失访或不配合随访74例,最终纳入484例患者。根据住院期间SUA浓度,分为HUA组70例(14.46%),非HUA组414例(85.54%)。
2.2 基线资料比较PSM前患者平均年龄(63.72±10.18)岁,74.59%为男性,25.41%为女性,15.71%同时患有高血压、糖尿病和高脂血症,HUA组与非HUA组SUA均值平均浓度分别为(490.75±64.43)μmol/L和(309.86±64.45)μmol/L。与非HUA组相比,HUA组男性患者比例更高,诊断为STEMI者更多(P<0.05)。见表 1。
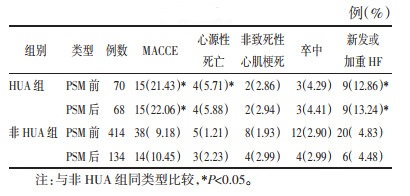
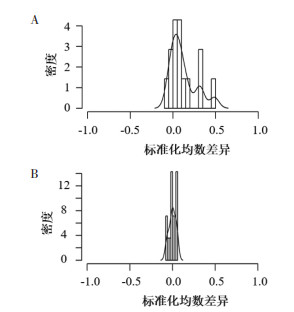
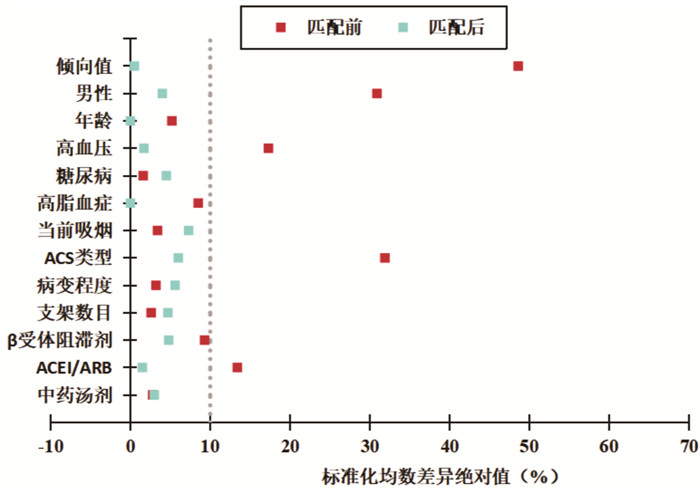
PSM过程中部分HUA组患者未能同时找到有效匹配的非HUA组患者,故匹配后HUA组68例(33.66%),非HUA组134例(66.34%),总计202例患者。PSM后HUA组与非HUA组SUA平均浓度分别为(488.02±59.37)μmol/L和(320.66±62.39)μmol/L,匹配后HUA组和非HUA组倾向值的重叠性较好,匹配效果理想(图 1),SD集中在0附近,提示不再存在系统差异(图 2),匹配前后均衡性明显改变,ASD均小于10%(图 3),提示两组间各协变量分布达到均衡。
|
| 图 1 倾向值分布抖动散点图 Fig. 1 Jitter plots of distribution of propensity score |
|
| 注:图A,匹配前标准化均数差异分布直方图;图B,匹配后标准化均数差异分布直方图。 图 2 PSM前、后标准化均数差异分布直方图 Fig. 2 Histogram of standardized mean difference before and after PSM |
|
| 图 3 PSM前、后标准化均数差异绝对值分布散点图 Fig. 3 Dotplot of absolute standardized mean difference before and after PSM |
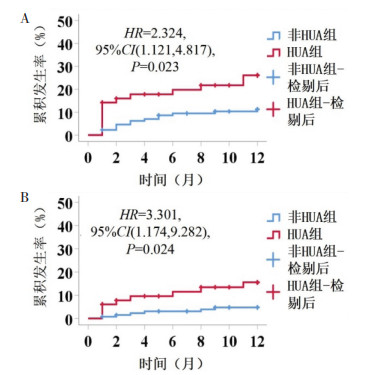
中位随访12月,参与匹配的484例患者中,53例(10.95%)发生MACCE,分别为HUA组21.43%,非HUA组9.18%,差异有统计学意义[HR=2.57,95%CI(1.42,4.68),P < 0.05]。PSM后,两组MACCE发生率分别为HUA组22.06%,非HUA组10.45%,差异有统计学意义[HR=2.32,95%CI(1.12,4.82),P < 0.05]。见表 2和图 4。
|
| 注:图A,PSM后MACCE的Kaplan-Meier曲线;图B,PSM后新发或加重心力衰竭的Kaplan-Meier曲线。 图 4 PSM后两组终点事件的Kaplan-Meier曲线 Fig. 4 Kaplan-Meier curve of terminal events of two groups after PSM |
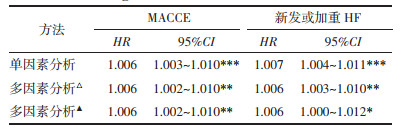
多因素Cox回归校正表 1中所有协变量:较非HUA组,HUA组患者PCI后1年内MACCE发生风险增加139%,差异有统计学意义[HR=2.39,95%CI(1.13,5.07),P<0.05];将SUA均值作为连续变量,SUA浓度每升高1 μmol/L,PCI后1年内MACCE发生风险增加0.6%,差异有统计学意义[HR=1.006,95%CI(1.002,1.010),P<0.05]。见表 3。
|
PSM前、后HUA组心源性死亡、非致死性心肌梗死以及卒中发生率均高于非HUA组,但PSM后两组间上述3个次要终点发生风险差异无统计学意义(P>0.05)。见表 2。
PSM前、后HUA组新发或加重HF发生率均高于非HUA组,差异有统计学意义(P<0.05),见表 2和图 4。多因素Cox回归校正表 1中所有协变量后:较非HUA组,HUA组患者PCI后1年内新发或加重HF发生风险增加272%[HR=3.72,95%CI(1.11,12.48),P<0.05];将SUA均值作为连续变量,SUA浓度每升高1 μmol/L,PCI后12月新发或加重HF发生风险增加0.6%[HR=1.006,95%CI(1.000,1.012),P<0.05]。
2.3.3 亚组分析对性别、年龄、高血压、糖尿病、高脂血症、当前吸烟、诊断以及病变程度进行亚组分析。上述协变量与SUA不存在交互作用(P>0.05)。
与非HUA组相比,HUA组仅在≥65岁亚组[HR=4.07,95%CI(1.63,10.16),P<0.05]、高血压亚组[HR=2.88,95%CI(1.25,6.65),P<0.05]、糖尿病亚组[HR=3.62,95%CI(1.21,10.80),P<0.05]、NSTE-ACS亚组[HR=5.06,95%CI(1.52,16.89),P<0.05]、多支病变亚组[HR=3.41,95%CI(1.45,8.05),P<0.05]新发或加重HF发生风险差异有统计学意义。见图 5。
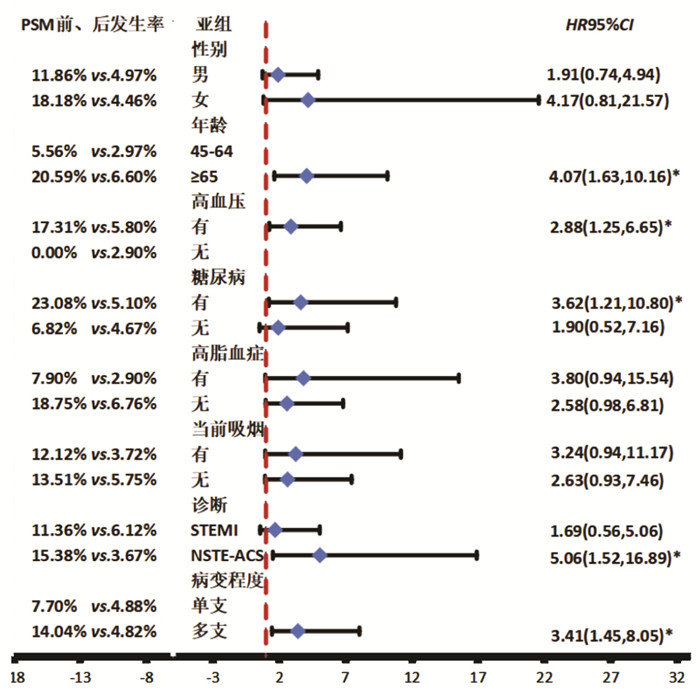
|
| 注:与非HUA组比较,*P<0.05;部分亚组的多因素Cox回归模型P>0.05,故未列出。 图 5 HUA对新发或加重心力衰竭影响的亚组分析森林图 Fig. 5 Forest plot of subgroup analysis on association between HUA and new-onset or aggravated HF |
随着临床证据不断积累,HUA对ACS预后的影响逐渐清晰[11-13]。尽管尚不能证明HUA与ACS病情进展存在因果关系,但本研究表明,在痰瘀互结型ACS患者中,HUA与PCI术后12月内发生MACCE和新发或加重HF显著相关。HF是心功能受损最直观的表现,多种代谢性因素如血糖、血脂等升高均有可能诱发心肌损伤,过程中心肌组织逐渐被纤维化和瘢痕代替,心功能不断受损进而引发或加重HF。SUA升高在HF患者中普遍存在[14],与左室功能障碍独立相关[15],上海1项研究对无任何合并疾病的老年受试者进行了长达4年的随访,结果发现无症状HUA组充血性HF的发生风险是正常受试者的2.34倍,说明HUA或能作为一种潜在的生物标志物,用于预测HF进展[16]。本研究中,HUA与心源性死亡、非致死性心梗、卒中的关联性并不显著,而荟萃分析表明,HUA与CHF患者全因死亡、心血管死亡以及死亡与心脏事件复合终点发生风险呈正相关[17],推测HUA可能通过介入HF发生发展从而引发更差的临床结局。
SUA是嘌呤代谢的终产物,黄嘌呤氧化酶(XOD)能促进次黄嘌呤和黄嘌呤转化为SUA,同时产生过活性氧和活性氮,适当的SUA浓度可发挥抗氧化等积极作用[18]。随着XOD活性增加,SUA不断堆积,高浓度的活性氧会打破氧化还原稳态导致慢性炎症,细胞损伤等病理事件发生[19]。SUA浓度升高是否单独参与心血管疾病发展尚存争议[20],但结合现有研究,推测HUA可能通过直接和间接两种途径干扰心血管功能:大量研究已证实HUA会对心血管结构和功能产生持续不利影响,潜在机制包括诱导血管内皮功能障碍[21],诱导心肌细胞凋亡、间质纤维化[22],促进激活动脉粥样硬化[20],诱导心肌细胞胰岛素抵抗[23]等;另一方面,长期处于SUA升高状态下,主动脉与冠状动脉尿酸盐晶体不断沉积,也会促进局部慢性炎症微环境的发展,导致持续的炎症反应与心血管损伤[24]。
近年来,药物治疗与PCI技术不断完善,极大降低了ACS患者病死率,但与之相反,术后不可逆心肌损伤、HF发生率正逐渐升高,因此,如何进一步降低心血管残余风险是当下研究的热点。降尿酸治疗作为临床实践中一个潜在治疗靶点正逐渐得到重视,研究表明,用于痛风和HUA治疗的别嘌醇、非布司他,在减轻缺血/再灌注期间心肌氧化损伤方面获益明显[25-26]。遗憾的是,尽管越来越多的心血管研究关注了降尿酸疗法(包括促尿酸排泄药物、XOD抑制剂和尿酸酶)可能带来的临床获益,但使用降尿酸药物的安全性尚待临床验证[27]。
中医认为,无症状HUA属于“潜病”阶段,虽无关节疼痛,但常表现出头身困重,食欲不振,大便黏腻等症状,属湿浊为害。湿邪内蕴,久蕴凝浊,湿浊相和,流行血脉,日久阻滞气机,生痰滞血,相互裹挟最终发展为痰瘀胶结难解,因此治疗策略不宜有所偏颇,应以“痰瘀同治”为主。国医大师张伯礼院士“湿浊痰饮类病”学术思想中即指出痰瘀互生为病重所归,应“兼顾合治,分消其势”,强调“化瘀当早”“祛浊需恒”,用药上主张“悉运枢机,用药不远温”“既成之瘀,必投活血队药治之”[28]。温病学家王灿晖在辨治无症状HUA时,常在四妙散、三仁汤除湿化浊基础上,酌加一两味行气通络药以改善微循环,达到促进SUA代谢的目的[29]。另有临床研究表明,标准药物联合由瓜蒌、桃仁、半夏、红花、萆薢等中药组成的化痰祛瘀方治疗4周可有效缓解痰瘀互结型稳定型心绞痛伴HUA患者心绞痛症状,减少硝酸甘油用量,降低SUA浓度[30],进一步佐证了痰瘀同治的可行性。
本研究针对性痰瘀互结这一单独证型进行分析,增强了研究对象间的同质性,研究结果更具现实意义。亚组分析中,HUA对PCI预后的预测价值受年龄、合并症、病变程度、病变类型的影响,在相关研究中,性别也是重要的影响因素[31],导致这种差异的原因有待通过更大样本量、更细致的分层研究进行解答。本研究为单中心研究,结果的外部有效性有待验证,笔者将进一步扩大样本量、延长随访时间,着力于多区域、多中心联动,以增强研究结果的外推性,同时深入分析HUA对不同人群预后的影响。
综上,笔者发现入院时合并无症状HUA与45岁及以上的痰瘀互结型ACS患者PCI预后不良相关,对新发或加重HF可能具有潜在预测价值。
| [1] |
陈蕾, 伍成凯, 康峻鸣, 等. 我国45岁及以上中老年人群高尿酸血症与常见慢性病的关联研究[J]. 中国全科医学, 2021, 24(4): 447-452. |
| [2] |
ELFISHAWI M M, ZLEIK N, KVRGIC Z, et al. The rising incidence of gout and the increasing burden of comorbidities: A population-based study over 20 years[J]. The Journal of Rheumatology, 2018, 45(4): 574-579. DOI:10.3899/jrheum.170806 |
| [3] |
CASIGLIA E, TIKHONOFF V, VIRDIS A, et al. Serum uric acid and fatal myocardial infarction: Detection of prognostic cut-off values: The URRAH (uric acid right for heart health) study[J]. Journal of Hypertension, 2020, 38(3): 412-419. DOI:10.1097/HJH.0000000000002287 |
| [4] |
VON LUEDER T G, GIRERD N, ATAR D, et al. Serum uric acid is associated with mortality and heart failure hospitalizations in patients with complicated myocardial infarction: Findings from the high-risk myocardial infarction database initiative[J]. European Journal of Heart Failure, 2015, 17(11): 1144-1151. DOI:10.1002/ejhf.419 |
| [5] |
张新超, 于学忠, 陈凤英, 等. 急性冠脉综合征急诊快速诊治指南(2019)[J]. 临床急诊杂志, 2019, 20(4): 253-262. |
| [6] |
中华医学会心血管病学分会介入心脏病学组, 中国医师协会心血管内科医师分会血栓防治专业委员会, 中华心血管病杂志编辑委员会. 中国经皮冠状动脉介入治疗指南(2016)[J]. 中华心血管病杂志, 2016, 44(5): 382-400. DOI:10.3760/cma.j.issn.0253-3758.2016.05.006 |
| [7] |
张敏州, 丁邦晗, 林谦. 急性心肌梗死中医临床诊疗指南[J]. 中华中医药杂志, 2021, 36(7): 4119-4127. |
| [8] |
张瑞芬, 苏和, 黄新生, 等. 不稳定型心绞痛中医诊疗专家共识[J]. 中医杂志, 2022, 63(7): 695-700. |
| [9] |
张辉, 冯禾, 王靖阳, 等. 中药汤剂联合标准治疗对急性冠脉综合征PCI术后影响的回顾性队列研究[J]. 天津中医药, 2022, 39(11): 1361-1366. DOI:10.11656/j.issn.1672-1519.2022.11.01 |
| [10] |
方宁远, 吕力为, 吕晓希, 等. 中国高尿酸血症相关疾病诊疗多学科专家共识(2023年版)[J]. 中国实用内科杂志, 2023, 43(6): 461-480. |
| [11] |
李冬云, 林莹, 董文静, 等. 血清尿酸对急性冠脉综合征患者治疗后6个月内再入院的预测价值[J]. 中华老年多器官疾病杂志, 2022, 21(9): 675-678. |
| [12] |
张世宇, 刘鑫, 宋冰雪, 等. 高尿酸血症对合并高血压的ACS患者冠状动脉病变严重程度及PCI术后临床预后的影响[J]. 中国动脉硬化杂志, 2022, 30(5): 416-422. DOI:10.3969/j.issn.1007-3949.2022.05.007 |
| [13] |
NAKAHASHI T, TADA H, SAKATA K, et al. The association between serum uric acid and mortality in patients with acute coronary syndrome after percutaneous coronary intervention[J]. International Heart Journal, 2022, 63(3): 447-453. DOI:10.1536/ihj.21-764 |
| [14] |
PALAZZUOLI A, RUOCCO G, DE VIVO O, et al. Prevalence of hyperuricemia in patients with acute heart failure with either reduced or preserved ejection fraction[J]. The American Journal of Cardiology, 2017, 120(7): 1146-1150. DOI:10.1016/j.amjcard.2017.06.057 |
| [15] |
NAKANISHI K, DAIMON M, YOSHIDA Y, et al. Serum uric acid level and subclinical left ventricular dysfunction: A community-based cohort study[J]. ESC Heart Failure, 2020, 7(3): 1031-1038. DOI:10.1002/ehf2.12691 |
| [16] |
WU X F, JIAN G H, TANG Y Z, et al. Asymptomatic hyperuricemia and incident congestive heart failure in elderly patients without comorbidities[J]. Nutrition, Metabolism, and Cardiovascular Diseases, 2020, 30(4): 666-673. DOI:10.1016/j.numecd.2019.12.008 |
| [17] |
HUANG H, HUANG B T, LI Y L, et al. Uric acid and risk of heart failure: A systematic review and meta-analysis[J]. European Journal of Heart Failure, 2014, 16(1): 15-24. DOI:10.1093/eurjhf/hft132 |
| [18] |
BATTELLI M G, BORTOLOTTI M, BOLOGNESI A, et al. Pro-aging effects of xanthine oxidoreductase products[J]. Antioxidants, 2020, 9(9): 839. DOI:10.3390/antiox9090839 |
| [19] |
SASSETTI E, CLAUSEN M H, LARAIA L. Small-molecule inhibitors of reactive oxygen species production[J]. Journal of Medicinal Che- mistry, 2021, 64(9): 5252-5275. DOI:10.1021/acs.jmedchem.0c01914 |
| [20] |
LU J, SUN M S, WU X J, et al. Urate-lowering therapy alleviates atherosclerosis inflammatory response factors and neointimal lesions in a mouse model of induced carotid atherosclerosis[J]. The FEBS Journal, 2019, 286(7): 1346-1359. DOI:10.1111/febs.14768 |
| [21] |
ZHANG J X, LIN X, XU J X, et al. CTRP3 protects against uric acid-induced endothelial injury by inhibiting inflammation and oxidase stress in rats[J]. Experimental Biology and Medicine, 2022, 247(2): 174-183. DOI:10.1177/15353702211047183 |
| [22] |
YAN M L, CHEN K K, HE L, et al. Uric acid induces cardiomyocyte apoptosis via activation of calpain-1 and endoplasmic reticulum stress[J]. Cellular Physiology and Biochemistry, 2018, 45(5): 2122-2135. DOI:10.1159/000488048 |
| [23] |
JIAO Z Y, CHEN Y Q, XIE Y, et al. Metformin protects against insulin resistance induced by high uric acid in cardiomyocytes via AMPK signalling pathways in vitro and in vivo[J]. Journal of Cellular and Molecular Medicine, 2021, 25(14): 6733-6745. DOI:10.1111/jcmm.16677 |
| [24] |
KLAUSER A S, HALPERN E J, STROBL S, et al. Dual-energy computed tomography detection of cardiovascular monosodium urate deposits in patients with gout[J]. JAMA Cardiology, 2019, 4(10): 1019-1028. DOI:10.1001/jamacardio.2019.3201 |
| [25] |
ZHANG Y S, LU L Q, JIANG Y Q, et al. Allopurinol attenuates oxidative injury in rat hearts suffered ischemia/reperfusion via suppressing the xanthine oxidase/vascular peroxidase 1 pathway[J]. European Journal of Pharmacology, 2021, 908: 174368. DOI:10.1016/j.ejphar.2021.174368 |
| [26] |
WANG S L, LI Y P, SONG X D, et al. Febuxostat pretreatment attenuates myocardial ischemia/reperfusion injury via mitochondrial apoptosis[J]. Journal of Translational Medicine, 2015, 13: 209. DOI:10.1186/s12967-015-0578-x |
| [27] |
NOWAK M M, NIEMCZYK M, GOŁȨBIEWSKI S, et al. Influence of xanthine oxidase inhibitors on all-cause mortality in adults: A systematic review and meta-analysis[J]. Cardiology Journal, 2024, 31(3): 479-487. DOI:10.5603/cj.97807 |
| [28] |
李霄, 金鑫瑶, 吕玲, 等. 张伯礼"湿浊痰饮类病证治"学术思想撮要[J]. 中医杂志, 2022, 63(17): 1620-1624. |
| [29] |
苏奔, 王灿晖, 朱晓琳, 等. 王灿晖教授辨治无症状高尿酸血症思想撷要[J]. 时珍国医国药, 2022, 33(12): 3005-3006. DOI:10.3969/j.issn.1008-0805.2022.12.52 |
| [30] |
周泽宇. 化痰祛瘀法治疗冠心病稳定型心绞痛(痰瘀互结型)伴高尿酸血症的临床疗效观察[D]. 黑龙江中医药大学, 2022.
|
| [31] |
NDREPEPA G, CASSESE S, BRAUN S, et al. A gender-specific analysis of association between hyperuricaemia and cardiovascular events in patients with coronary artery disease[J]. Nutrition, Metabo- lism, and Cardiovascular Diseases, 2013, 23(12): 1195-1201. DOI:10.1016/j.numecd.2013.03.005 |
2. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China;
3. The Fourth Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300451, China;
4. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China
 2025, Vol. 42
2025, Vol. 42