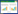文章信息
- 张冠楠, 牛丕莲, 井瑞欣, 等.
- ZHANG Guannan, NIU Pilian, JING Ruixin, et al.
- 芦丁对TGF-β1诱导的心肌成纤维细胞纤维化的影响
- Effect of rutin on TGF-β1 induced fibrosis of cardiac fibroblasts
- 天津中医药, 2025, 42(1): 71-77
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(1): 71-77
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.01.14
-
文章历史
- 收稿日期: 2024-09-20
2. 陕西植物研究所, 西安 710061
《中国心血管健康与疾病报告2022 》显示,中国心血管疾病(CVD)患病人数已达3.3亿,老龄化趋势会使得未来患病人数将持续增加,预估2030年65岁以上老年人CVD患病人数将由现在的1.9亿增加至2.4亿。目前,CVD在城乡居民疾病死亡构成比中占首位,远超恶性肿瘤和呼吸系统等疾病[1]。
组织纤维化是多数慢性和进行性疾病发展的共同途径,影响体内多个器官,如心脏、肺和肾脏等[2]。心肌纤维化(MF)是指在细胞外基质(ECM)中由于胶原纤维过量积聚、ECM合成和降解失衡、各类胶原比例失调、排列紊乱而导致的病理过程。MF是多种CVD的病理基础,与心肌收缩和舒张功能障碍、心律失常和过早死亡有关,严重影响心脏正常工作。心肌成纤维细胞(CFs)的增殖和活化影响ECM的平衡与稳定,在纤维化的发展中起着至关重要的作用[3]。MF具有发病快、机制复杂、病死率高等特点[4]。迄今为止,对于该疾病的治疗缺乏靶向性药物[5]。临床多用治疗高血压的药物来缓解MF的发生和发展,如卡托普利、氯沙坦和达格列净[6]等,但其毒副作用多,因此新的抗心脏纤维化药物亟待研究。
近年来具有广泛药理活性的天然中草药在防治MF方面有着潜在的临床研究价值,并成为研究的新思路。芦丁是一种黄酮类化合物[7],大量存在于槐花、芦丁叶、西红柿、烟草叶和茶中[8-9],药用价值多,有抗氧化、抗菌、抗病毒、抗炎、抗过敏和抗肿瘤等作用[10-11]。本研究拟通过转化生长因子-β1(TGF-β1)构建MF细胞模型,探讨芦丁在MF中的作用及其机制,为芦丁在心血管类疾病的临床治疗中提供新的理论依据。
1 材料与方法 1.1 实验材料芦丁(货号:CAS:153-18-4,上海普优文生物科技有限公司);DMEM培养基(货号:06-1055-57-1,VivaCell公司);胰酶(货号:T1320-100,中国索莱宝公司);全蛋白提取试剂盒(货号:KGP2100,中国南京凯基生物发展有限公司);一抗:α-平滑肌肌动蛋白(α-SMA)、Smad2/3、p-Smad2、p-Smad3(货号:AF1032、AF6367、AF8314、AF8315,Affinit公司);PAGE凝胶快速制备试剂盒(中国,上海雅酶生物科技有限公司);聚偏氟乙烯(PVDF)膜(美国,Millipore公司);DAPI染色液(货号:SL111-01,北京赛文创新生物科技有限公司);4% 多聚甲醛(货号:SL101-01,北京赛文创新生物科技有限公司);HiScriptⅢ All-in-one RT SuperMix Perfect for Qpcr(货号:R333-01;南京诺唯赞生物科技股份有限公司)。
1.2 实验仪器恒温水浴锅(货号:HH-3A,金坛市精达仪器制造有限公司);离心机(货号:75002401,美国Thermo公司);酶标仪(货号:VLBLATGD2,美国GIO-RAD公司);GE化学发光检测仪(货号:GE Amersham Imager600,美国GE公司)。
1.3 细胞水平检测芦丁抗MF活性 1.3.1 CFs培养取出CFs细胞,磷酸盐缓冲溶液(PBS)洗两次,加1.5 mL胰酶消化1 min,将细胞吹打混匀后吸到新的微型离心管中,1 000 r/min离心5 min(离心半径6 cm),弃上清,重悬,加入到含10 mL培养液的培养皿中,混匀。置于培养箱中培养48 h。
1.3.2 CFs形态学鉴定课题组前期实验已成功构建MF模型[12],小鼠CFs培养48 h后通过倒置荧光显微镜观察细胞形态并进行拍照。
1.3.3 CCK-8检测芦丁作用后CFs细胞活力于对数生长期的CFs用胰蛋白酶消化,配制细胞悬液,每孔按5×104个接种到96孔板置于培养箱中培养贴壁。待细胞贴壁后分组处理:空白组(完全培养基)、对照组(培养液和细胞)、给药组(10 ng/mL TGF-β1+25、50、100、200、500 μg/mL芦丁和细胞),每组处理设6个重复,培养48 h。结束时每孔加入10 μL CCK-8工作液,在培养箱内继续孵育3 h,450 nm测定吸光度。
1.3.4 蛋白免疫印记法(Western blot)检测TGF-β1诱导后α-SMA、波形蛋白(Vim)、胶原蛋白Ⅰ(Collage Ⅰ)、胶原蛋白Ⅲ(Collage Ⅲ)、FN、TGF-β1/Smads信号通路蛋白的表达细胞按1×105接种到6孔板,培养24 h后,分组:对照组(完全培养基)、模型组(含10 ng/mL TGF-β1)、阳性对照组(10 ng/mL TGF-β1+10 μmol/L卡托普利)和给药组(10 ng/mL TGF-β1+200 μg/mL的芦丁)。培养48 h后取出裂解,提取总蛋白并进行BCA蛋白浓度定量后进行聚丙烯酰胺凝胶电泳,将其转移至PVDF膜上。5% 脱脂牛奶室温封闭1 h后孵育一抗:actin、Smad2/3、P-Smad2、P-Smad3、α-SMA、Vim、Collage Ⅰ、Collage Ⅲ、FN(注:抗体稀释比例为1∶1 500),4 ℃冰箱的摇床过夜孵育,第2天回收一抗,1×TBST洗3次(10 min/次),室温孵育对应二抗(抗兔或抗鼠,1∶10 000)1 h,TBST洗3次。发光液A、B等体积混合,于化学发光成像仪中显影。
1.3.5 免疫荧光检测α-平滑肌肌动蛋白的表达将细胞爬片放于6孔板中后按1×105个接种细胞,培养24 h后,按如下分组:对照组(完全培养基)、模型组(含10 ng/mL TGF-β1)、给药组(10 ng/mL TGF-β1+200 μg/mL的芦丁)培养后用PBS清洗3次,4% 的多聚甲醛室温固定20 min,PBS清洗,将细胞爬片取出后用擦水纸擦干,并在6孔板中画圈,加0.5%Trition-10通透15 min,5% BSA室温封闭1 h,一抗孵育过夜。隔天回收一抗,PBS清洗后室温孵育荧光二抗1 h,加入200 μL的DAPI静置10 min,将爬片取出吸干周围液体,加10 μL的抗荧光淬灭剂到载玻片后将爬片倒置于载玻片上,周围涂指甲油固定,用荧光显微镜进行拍照。
1.3.6 RT-qPCR检测Acta 2、Vim、FN、CoⅠ、MMP-2和MMP-9 mRNA表达水平通过实时荧光定量聚合酶链式反应(qPCR)检测纤维化相关因子的表达量。CFs分组培养48 h后,使用TRIzol法提取CFs中总RNA,逆转录合成cDNA,逆转录条件为37 ℃、15 min,85 ℃、5 s。参照HiScriptⅢ All-in-one RT SuperMix Perfect for qPCR试剂盒说明书进行RT-qPCR检测。选用GADPH作为内参基因,引物由北京擎科生物科技股份有限公司合成,扩增引物序列见开放科学标识码(OSID)。扩增条件为:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,40个循环。计算2-△△Ct得出各组相对表达量。
1.4 统计学分析所有数据采用均数±标准差(x±s)表示,所有测量至少重复3次。符合正态分布的数据使用单因素方差分析(ANOVA),两两比较采用t检验;不符合正态分布的数据采用非参数检验。使用Excel和Graphpad Prism 9.5.0软件进行数据分析和绘图,P<0.05为差异具有统计学意义。
2 结果 2.1 CFs形态学鉴定通过显微镜观察芦丁对TGF-β1诱导的CFs形态的影响,结果如图 1所示,正常CFs为梭形或不规则多边形(图 1A),TGF-β1诱导后CFs变得更加细长(图 1B),卡托普利和芦丁干预后,细胞形态有所缓解(图 1C、图 1D)。结果表明芦丁对TGF-β1诱导的CFs形态具有一定的缓解作用。
|
| 注:图A,对照组细胞形态;图B,模型组细胞形态;图C,阳性对照组细胞形态;图D,药物组细胞形态。 图 1 药物对TGF-β1诱导CFs后细胞形态的影响(×200) Fig. 1 Effects of drugs on cell morphology of CFs induced by TGF-β1(×200) |
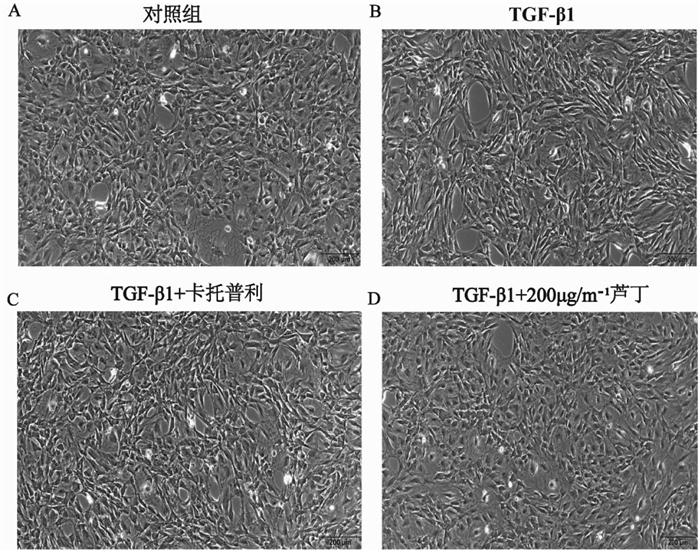
实验结果如图 2所示,CFs在不同浓度芦丁作用48 h后,CFs显著增殖(P<0.05)。芦丁浓度为0~200 μg/mL,细胞活力随着芦丁浓度的增加逐渐增强,芦丁浓度为200 μg/mL时细胞活力最佳。芦丁浓度大于200 μg/mL后,细胞活力随着芦丁浓度的增加逐渐降低。
|
| 图 2 不同浓度芦丁作用后的细胞活力 Fig. 2 Cell viability after the action of different concentrations of rutin |
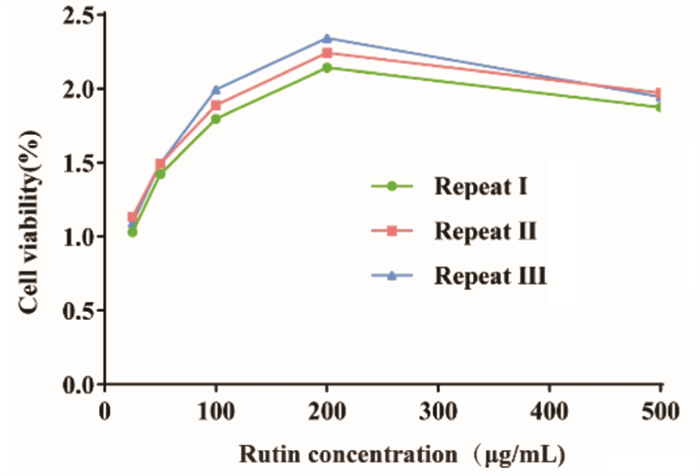
为探究芦丁对TGF-β1诱导MF标志性蛋白表达的影响,进行了Western blot检测。结果如图 3所示:与对照组比较,模型组中Vim蛋白的表达显著上调(P<0.05);经200 μg/mL芦丁干预后,Vim蛋白表达显著降低(P < 0.05)。上述结果表明:TGF-β1诱导CFs后,成功激活了诱导MF标志性蛋白的表达,200 μg/mL芦丁抑制了标志性蛋白的激活从而改善了MF的发生。
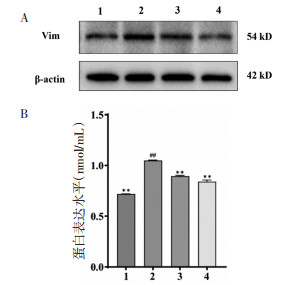
|
| 注:1,对照组;2,TGF-β1模型组;3,TGF-β1+卡托普利阳性对照组;4,TGF-β1+200 μg/mL芦丁给药组。与TGF-β1模型组比较,**P < 0.01;与对照组比较,##P < 0.01。 图 3 芦丁对TGF-β1诱导CFs后Vim蛋白表达的影响(x±s,n=3) Fig. 3 Effect of rutin on Vim protein expression after TGF-β1 induced CFs(x±s, n=3) |
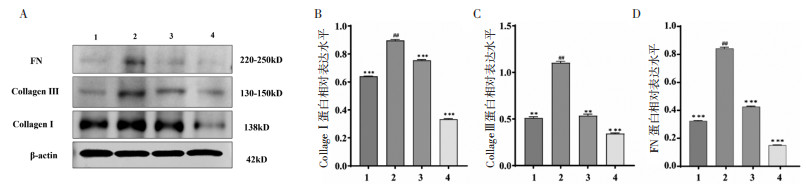
结果如图 4所示,与对照组比较,模型组中CollageⅠ、Collage Ⅲ和FN蛋白的表达显著上调(P<0.05),200 μg/mL芦丁干预后,CollageⅠ、Collage Ⅲ和FN蛋白的表达显著降低(P < 0.05)。上述结果表明:用TGF-β1诱导CFs后,成功激活CollageⅠ、Collage Ⅲ和FN蛋白的表达,200 μg/mL芦丁干预后抑制了CollageⅠ、Collage Ⅲ和FN蛋白的激活从而改善了MF的发生。
|
| 注:1,对照组;2,TGF-β1模型组;3,TGF-β1+卡托普利阳性对照组;4,TGF-β1+200 μg/mL芦丁给药组。与TGF-β1模型组比较,**P < 0.01,***P < 0.001;与对照组比较,##P < 0.01。 图 4 芦丁对TGF-β1诱导CFs后Collage Ⅰ、Collage Ⅲ和FN蛋白表达的影响(x±s,n=3) Fig. 4 Effect of rutin on Collage Ⅰ, Collage Ⅲ, and FN protein expression after TGF-β1 induction of CFs(x±s, n=3) |
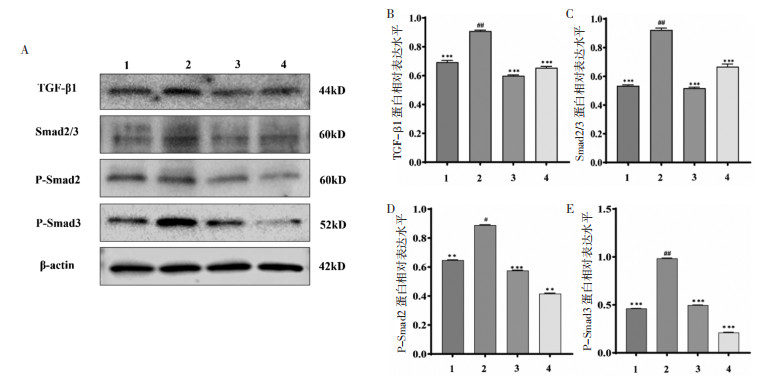
为探究芦丁对TGF-β1/Smad信号通路相关蛋白表达的影响,进行了Western blot检测。结果如图 5所示:与对照组比较,模型组中TGF-β1、Smad 2/3、p-Smad2和p-Smad3蛋白的表达显著上调(P<0.05),200 μg/mL芦丁干预后,TGF-β1、Smad 2/3、p-Smad 2和p-Smad 3蛋白表达显著降低(P < 0.05)。上述结果表明:用TGF-β1诱导CFs后,成功激活TGF-β1/Smad信号通路,而200 μg/mL芦丁干预抑制了TGF-β1/Smad信号通路蛋白的激活从而改善了MF的发生。
|
| 注:1,对照组;2,TGF-β1模型组;3,TGF-β1+卡托普利阳性对照组;4,TGF-β1+200 μg/mL芦丁给药组。与模型组比较,**P < 0.01,***P < 0.001;与对照组比较,#P < 0.05,##P < 0.01。 图 5 芦丁对TGF-β1诱导CFs后TGF-β/Smad信号通路蛋白表达的影响(x±s,n=3) Fig. 5 Effect of rutin on TGF-β/Smad signaling pathway protein in CFs induced by TGF-β1(x±s, n=3) |
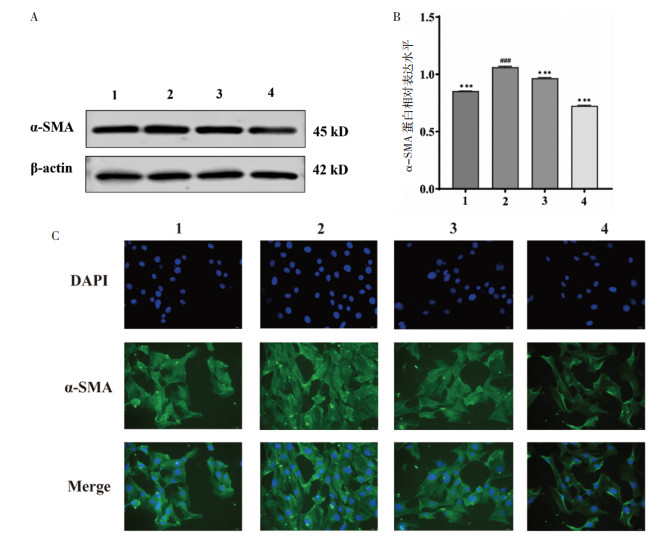
为探究芦丁对α-SMA蛋白表达的影响,进行了Western blot检测。结果如图 6 A、图 6B所示:与对照组比较,模型组中α-SMA蛋白的表达显著上调(P<0.05),200 μg/mL芦丁干预后,α-SMA蛋白表达显著降低(P < 0.05)。如图 6C所示为免疫荧光结果,与对照组相比,TGF-β1模型组中α-SMA绿色荧光强度显著增强;与模型组相比,阳性对照组α-SMA绿色荧光强度明显减弱;200 μg/mL芦丁组与模型组和阳性对照组相比,α-SMA绿色荧光强度明显减弱。实验结果表明200 μg/mL芦丁能抑制TGF-β1诱导的α-SMA表达。
|
| 注:图A和B,芦丁对TGF-β1诱导CFs后α-SMA蛋白表达的影响(n=3,x±s);图C,芦丁对TGF-β1诱导CFs后α-SMA蛋白表达影响的免疫荧光图(×400);1,对照组;2,TGF-β1模型组;3,TGF-β1+卡托普利阳性对照组;4,TGF-β1+200 μg/mL芦丁给药组。与模型组比较,***P < 0.001;与对照组比较,###P < 0.001。 图 6 芦丁对TGF-β1诱导CFs后α-SMA蛋白表达的影响 Fig. 6 Effect ofrutin on α-SMA protein expression after TGF-β1 induced CFs |
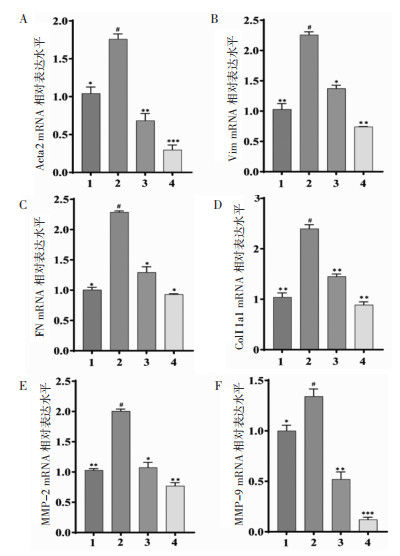
如图 7为RT-qPCR结果,与对照组相比,TGF-β1诱导后,CFs的Acta 2、Vim、FN、ColⅠ1a1、MMP-2和MMP-9 mRNA水平显著增加(P < 0.05),经200 μg/mL芦丁干预后,Acta 2、Vim、FN、ColⅠ1a1、MMP-2和MMP-9 mRNA水平均显著减少(P < 0.05)。
|
| 注:1,对照组;2,TGF-β1模型组;3,TGF-β1+卡托普利阳性对照组;4,TGF-β1+200 μg/mL芦丁给药组。与TGF-β1模型组比较,*P < 0.05,**P < 0.01,***P < 0.001;与对照组比较,#P < 0.05。 图 7 芦丁对TGF-β1诱导CFs后Acta 2、Vim、FN、ColⅠ1a1、MMP-2和MMP-9 mRNA表达的影响(x±s,n=3) Fig. 7 The effects of rutin on the expression of Acta 2, Vim, FN, Col Ⅰ 1a1, MMP-2 and MMP-9 mRNA in CFs induced by TGF-β1(x±s, n=3) |
MF是多种CVD终末期的关键病理变化,会导致不可逆的心力衰竭,严重影响患者的生活质量[13]。MF主要表现为CFs的过度增殖、分化以及心肌中ECM成分的大量积累[14],ECM稳态的维持与纤维状胶原蛋白Collage Ⅰ、Collage Ⅲ、纤连蛋白(FN)、基质金属蛋白酶(MMP)、转化生长因子和炎症因子等表达有关[15-16]。在正常小鼠心脏中,CFs约占心脏细胞群的20%,是MF进展中的主要细胞类型[17]。CFs会分化为高度特化的合成和收缩性肌成纤维细胞[18],同时会增加Collage Ⅰ、Collage Ⅲ和α-SMA(Acta 2基因)的表达[19]。Vim是由间充质细胞和一些造血细胞非特异性表达的Ⅲ型中间丝蛋白,是识别CFs最常用的标志物[5]。基质金属蛋白酶(MMP)在ECM的降解和合成过程中维持组织平衡[20],MMP-2、MMP-9在纤维化细胞中高度表达,可作为鉴定早期MF的标志物。TGF-β1家族成员在多个器官中表达,在促进纤维化发病机制中发挥重要作用[21]。已有研究结果表明TGF-β1可诱导大鼠CFs中胶原蛋白的产生和分泌[22]。在本研究中,笔者结果说明TGF-β1能够促进CFs的增殖,同时也能刺激α-SMA、Vim、CollageⅠ、Collage Ⅲ、FN和TGF-β1/Smad信号通路相关蛋白的表达,证实了TGF-β1对CFs有促纤维化作用。
芦丁是植物中的天然产物,因其独特的活性被研究者们所青睐。有研究表明芦丁在体外和体内通过靶向Toll样受体4(TLR4)和P2X7受体信号通路减轻肝纤维化和炎症[23],芦丁通过降低伤口愈合后期VEGF蛋白的表达来影响血管生成[24],本研究用TGF-β1刺激CFs纤维化后,细胞形态发生变化;Vim、α-SMA、CollageⅠ、Collage Ⅲ、FN、TGF-β1/Smad细胞信号通路蛋白表达显著增加;CFs的Acta 2、Vim、FN、Col Ⅰ、MMP-2和MMP-9 mRNA质量浓度显著增加;α-SMA绿色荧光强度显著增强,证明TGF-β1能诱导CFs中ECM的沉积。200 μg/mL芦丁干预后,细胞形态有所恢复;Vim、α-SMA、CollageⅠ、Collage Ⅲ、FN、TGF-β1/Smad细胞信号通路蛋白表达显著降低;CFs的Acta 2、Vim、FN、ColⅠ1a1、MMP-2和MMP-9 mRNA浓度显著减少;α-SMA绿色荧光强度显著减弱,说明200 μg/mL芦丁能够抑制TGF-β1诱导的CFs活化。
TGF-β1可以结合并激活TGF-β1 I型和Ⅱ型受体,促进Smad2/3通路的磷酸化[25],导致下游信号分子的激活并促进成纤维细胞增殖和细胞外胶原沉积。对MF的研究多集中于各种细胞信号通路,其中TGF-β1/Smad细胞信号通路是被研究最广泛的。已有研究发现黄豆苷元通过调节TGF-β1/Smad2/3信号通路来减少TGF-β1诱导的心脏成纤维细胞活化[26];大黄素在体外减弱TGF-β1诱导的成纤维细胞活化和胶原积累,抑制几种经典(Smad2/3)和非经典(Erk1/2)TGF-β1信号通路的激活[27]等。在本研究中,用芦丁干预MF细胞模型后发现200 μg/mL芦丁可以通过抑制TGF-β1/Smad信号通路相关蛋白的表达,从而影响CollageⅠ、Collage Ⅲ、α-SMA、Vim及FN蛋白的合成,改善MF。
综上所述,芦丁对MF防治作用机制可能与抑制TGF-β1/Smad信号通路相关蛋白的表达,减少心肌胶原蛋白的合成,改善MF有关。该研究结果为芦丁在CVD的临床应用提供了实验基础和数据支持,也为芦丁作为新型治疗药物的开发提供参考。然而,芦丁减缓TGF-β1诱导的CFs纤维化是否可能还涉及其他分子机制,尚有待进一步探索。
| [1] |
韩雅玲. 推进科技自立自强, 紧紧依靠创新提升我国心血管疾病防治水平[J]. 中华心血管病杂志, 2024, 52(1): 1-2. |
| [2] |
KRAMANN R, DIROCCO D P, HUMPHREYS B D. Understanding the origin, activation and regulation of matrix-producing myofibroblasts for treatment of fibrotic disease[J]. The Journal of Pathology, 2013, 231(3): 273-289. DOI:10.1002/path.4253 |
| [3] |
KERR C M, SILVER S E, CHOI Y S, et al. Decellularized heart extracellular matrix alleviates activation of hiPSC-derived cardiac fibroblasts[J]. Bioactive Materials, 2024, 31: 463-474. DOI:10.1016/j.bioactmat.2023.08.023 |
| [4] |
REN Z H, ZHANG Z X, LING L, et al. Drugs for treating myocardial fibrosis[J]. Frontiers in Pharmacology, 2023, 14: 1221881. DOI:10.3389/fphar.2023.1221881 |
| [5] |
MORFINO P, AIMO A, CASTIGLIONE V, et al. Treatment of cardiac fibrosis: From neuro-hormonal inhibitors to CAR-T cell therapy[J]. Heart Failure Reviews, 2023, 28(2): 555-569. |
| [6] |
EGAN B M, POHL F, ANDERSON X, et al. The ACE inhibitor captopril inhibits ACN-1 to control dauer formation and aging[J]. Development, 2024, 151(3): dev202146. DOI:10.1242/dev.202146 |
| [7] |
SAYED H, ZHANG Q Q, TANG Y, et al. Alleviative effect of rutin on Zearalenone-induced reproductive toxicity in male mice by preventing spermatogenic cell apoptosis and modulating gene expression in the hypothalamic-pituitary-gonadal axis[J]. Toxins, 2024, 16(3): 121. DOI:10.3390/toxins16030121 |
| [8] |
CHOI S S, PARK H R, LEE K A. A comparative study of rutin and rutin glycoside: Antioxidant activity, anti-inflammatory effect, effect on platelet aggregation and blood coagulation[J]. Antioxidants, 2021, 10(11): 1696. DOI:10.3390/antiox10111696 |
| [9] |
PANDEY P, KHAN F, QARI H A, et al. Rutin(bioflavonoid) as cell signaling pathway modulator: Prospects in treatment and chemoprevention[J]. Pharmaceuticals, 2021, 14(11): 1069. DOI:10.3390/ph14111069 |
| [10] |
SHANMUGASUNDARAM D, ROZA J M. Assessment of anti-inflammatory and antioxidant activities of a proprietary preparation of quercetin-rutin blend(SophorOxTM) in exercised rats[J]. The Scientific World Journal, 2024, 2024: 9063936. |
| [11] |
MADKOUR D, AHMED M, ELKIRDASY A, et al. Rutin: Chemical properties, Pharmacokinetic properties and Biological activities[J]. Matrouh Journal of Veterinary Medicine, 2024, 4(1): 26-34. DOI:10.21608/mjvm.2024.341806 |
| [12] |
牛丕莲, 周学章, 白明生. 枸杞中绿原酸对转化生长因子-β1诱导心肌成纤维细胞纤维化的影响[J]. 食品科学, 2022, 43(7): 158-164. |
| [13] |
LIANG R Y, FENG X B, SHI D, et al. The global burden of disease attributable to high fasting plasma glucose in 204 countries and territories, 1990-2019: An updated analysis for the global burden of disease study 2019[J]. Diabetes Metabolism Research and Reviews, 2022, 38(8): e3572. DOI:10.1002/dmrr.3572 |
| [14] |
SHINDE A V, FRANGOGIANNIS N G. Mechanisms of fibroblast activation in the remodeling myocardium[J]. Current Pathobiology Reports, 2017, 5(2): 145-152. DOI:10.1007/s40139-017-0132-z |
| [15] |
FRANGOGIANNIS N G. The extracellular matrix in ischemic and nonischemic heart failure[J]. Circulation Research, 2019, 125(1): 117-146. DOI:10.1161/CIRCRESAHA.119.311148 |
| [16] |
DOBACZEWSKI M, DE HAAN J J, FRANGOGIANNIS N G. The extracellular matrix modulates fibroblast phenotype and function in the infarcted myocardium[J]. Journal of Cardiovascular Translational Research, 2012, 5(6): 837-847. DOI:10.1007/s12265-012-9406-3 |
| [17] |
GIBB A A, LAZAROPOULOS M P, ELROD J W. Myofibroblasts and fibrosis: Mitochondrial and metabolic control of cellular differentiation[J]. Circulation Research, 2020, 127(3): 427-447. DOI:10.1161/CIRCRESAHA.120.316958 |
| [18] |
BEI Y H, ZHOU Q L, FU S Y, et al. Cardiac telocytes and fibroblasts in primary culture: Different morphologies and immunophenotypes[J]. PLoS One, 2015, 10(2): e0115991. DOI:10.1371/journal.pone.0115991 |
| [19] |
BEKEDAM F T, SMAL R, SMIT M C, et al. Mechanical stimulation of induced pluripotent stem derived cardiac fibroblasts[J]. Scientific Reports, 2024, 14(1): 9795. DOI:10.1038/s41598-024-60102-w |
| [20] |
NAGASE H, VISSE R, MURPHY G. Structure and function of matrix metalloproteinases and TIMPs[J]. Cardiovascular Research, 2006, 69(3): 562-573. DOI:10.1016/j.cardiores.2005.12.002 |
| [21] |
TAN Z B, JIANG X L, ZHOU W Y, et al. Taohong Siwu decoction attenuates myocardial fibrosis by inhibiting fibrosis proliferation and collagen deposition via TGFBR1 signaling pathway[J]. Journal of Ethnopharmacology, 2021, 270: 113838. DOI:10.1016/j.jep.2021.113838 |
| [22] |
LIJNEN P J, PETROV V V, FAGARD R H. Induction of cardiac fibrosis by transforming growth factor-β1[J]. Molecular Genetics and Metabolism, 2000, 71(1/2): 418-435. |
| [23] |
HOU L S, CUI Z Y, SUN P, et al. Rutin mitigates hepatic fibrogenesis and inflammation through targeting TLR4 and P2X7 receptor signaling pathway in vitro and in vivo[J]. Journal of Functional Foods, 2020, 64: 103700. DOI:10.1016/j.jff.2019.103700 |
| [24] |
DERYUGINA E I, QUIGLEY J P. Tumor angiogenesis: MMP-mediated induction of intravasation- and metastasis-sustaining neovasculature[J]. Matrix Biology, 2015, 44/45/46: 94-112. |
| [25] |
REN Y N, CHEN Y, TANG E H, et al. Arbidol attenuates liver fibrosis and activation of hepatic stellate cells by blocking TGF-β1 signaling[J]. European Journal of Pharmacology, 2024, 967: 176367. DOI:10.1016/j.ejphar.2024.176367 |
| [26] |
SHU J C, HU L Z, WU Y C, et al. Daidzein suppresses TGF-β1-induced cardiac fibroblast activation via the TGF-β1/SMAD2/3 signaling pathway[J]. European Journal of Pharmacology, 2022, 919: 174805. DOI:10.1016/j.ejphar.2022.174805 |
| [27] |
CARVER W, FIX E, FIX C, et al. Effects of emodin, a plant-derived anthraquinone, on TGF-β1-induced cardiac fibroblast activation and function[J]. Journal of Cellular Physiology, 2021, 236(11): 7440-7449. DOI:10.1002/jcp.30416 |
2. Shanxi Institute of Botany, Xi'an 710061, China
 2025, Vol. 42
2025, Vol. 42