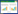文章信息
- 李淼, 李瑞, 杨晓芳, 等.
- LI Miao, LI Rui, YANG Xiaofang, et al.
- 橙皮苷调控mTOR/HIF-1α通路对高糖诱导的肾小球系膜细胞自噬的影响
- Effect of hesperidin on high glucose induced autophagy in glomerular mesangial cells by regulating the mTOR/HIF-1α pathway
- 天津中医药, 2025, 42(1): 78-83
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(1): 78-83
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.01.15
-
文章历史
- 收稿日期: 2024-08-15
糖尿病肾病(DN)是糖尿病诱发的最严重的并发症之一,也是肾衰竭的关键原因,其发病率和患病率呈上升趋势,极大地威胁患者的生命和健康[1-2]。由于没有直接治疗DN的药物,大多数DN患者最终发展为终末期肾病,需要血液透析和肾移植,因此了解其发展机制有助于寻求有效治疗药物[3]。在DN发展过程中,磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)是常见的经典信号通路,阻断该通路可能会减缓DN的进展[4]。先前研究表明自噬对肾脏的稳态、结构和功能至关重要,而PI3K/Akt/mTOR信号通路与许多细胞过程有关,包括细胞凋亡、炎症及自噬[5]。缺氧诱导因子-1α(HIF-1α)是在缺血缺氧的病理状态下表达的一种关键转录调节因子,mTOR作为HIF-1α的上游,参与HIF-1α合成与表达,而HIF-1α作为调节糖酵解相关基因转录的转录因子,抑制HIF-1α表达对DN肾小管损伤有保护作用[6],初步推断mTOR/HIF-1α通路可能参与DN发展,成为治疗DN的潜在靶点。橙皮苷作为黄酮类化合物,具有抗炎及抑制肝、肾等器官纤维化的作用,因此橙皮苷对肾脏及心脏损害等具有保护作用[7],但其在DN中研究甚少。该研究旨在探索橙皮苷对DN的治疗作用及相关机制。
1 实验材料 1.1 细胞来源小鼠肾系膜细胞(SV40 MES-13)从美国典型培养物保藏中心获得,并在含10%胎牛血清的DMEM培养基孵育,其中也含有1%链霉素/青霉素、并置于培养箱中。
1.2 主要材料、仪器Proteintech公司提供通路激活剂-胰岛素样生长因子-1(IGF-1);上海沃凯生物技术有限公司提供橙皮苷;Sigma公司提供噻唑蓝(MTT)试剂;上海碧云天生物技术有限公司提供二甲基亚砜;R&D系统公司提供肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β酶联免疫吸附法(ELISA)试剂盒;大连宝原生物科技有限公司提供DBI SYBR Premix Ex试剂盒;艾美捷提供细胞凋亡检测试剂盒;Abcam公司提供p-PI3K、p-Akt、p-mTOR、PI3K、Akt、mTOR、HIF-1α抗体;凯基生物有限公司提供蛋白含量检测试剂盒。
Leica提供DMI3000-B倒置显微镜;BD生物科学公司提供FACSCalibur流式细胞仪;美国MDSpectramac提供M3多功能酶标仪。
2 实验方法 2.1 细胞分组及处理取生长良好的SV40 MES-13接种于96孔板中,待细胞贴壁生长后,丢弃上清液进行如下分组及处理:对照组,不进行处理;甘露醇组,以含30 mmol/L甘露醇完全培养基处理24 h[8];高糖组,以含30 mmol/L葡萄糖完全培养基处理24 h[8-9];不同剂量橙皮苷组,在高糖刺激的同时,分别以含30 mmol/L、60 mmol/L橙皮苷完全培养基处理24 h[10];60 mmol/L橙皮苷+IGF-1组,在高糖刺激的同时,以含60 mmol/L橙皮苷、100 ng/mL IGF-1完全培养基处理24 h[11]。
2.2 MTT法检测细胞存活率对数生长期的细胞(密度为1×105/mL)接种到96孔板,设置6个复孔,并随后在5% CO2、37 ℃培养箱中培养。在细胞如上所述处理24 h后,将25 μL MTT(5 mg/mL)溶液添加到平板中,将样品孵育4~6 h后,向每个孔中加入100 μL二甲基亚砜,平板振荡后,使用酶标仪测量570 nm处吸光度值。
2.3 5-乙炔基-2'-脱氧尿苷(EdU)检测细胞增殖按照上述分组处理细胞,并在37 ℃的5% CO2培养箱中孵育。随后在室温下用4%多聚甲醛固定,然后用含有3% Triton X-100室温孵育,磷酸缓冲溶液洗涤后,每组细胞在室温下用10 μmol/L EdU处理,加入5 μg/mL 4,6-二脒基-2苯吲哚静置5 min,倒置荧光显微镜从5个随机区域中统计阳性细胞的数量,以EdU阳性细胞数目/总细胞数目×100%计算EdU阳性率。
2.4 ELISA检测TNF-α、IL-1β水平将细胞接种到12孔板中并孵育,按照上述方法处理24 h。收集细胞培养基,4℃条件下,离心1 000 r/min,半径10 cm,随后收集上清液,严格依据试剂盒说明书进行操作,以酶标仪在450 nm波长处依次检测各孔中的OD值,依据OD值绘制的标准曲线分别计算TNF-α、IL-1β水平。
2.5 流式细胞仪检测细胞凋亡水平经上述不同方法处理的细胞用胰蛋白酶消化,收集并制备成单细胞悬液,并用预冷冻的磷酸盐缓冲液洗涤,按照凋亡试剂盒在室温下加入5 μL膜联蛋白V-FITC、5 μL PI避光染色,流式细胞仪进行凋亡分析,并使用FlowJo软件分析凋亡率。
2.6 实时荧光定量PCR(qRT-PCR)检测自噬指标mRNA表达水平使用TRIzol试剂从系膜细胞提取总RNA,DBI SYBR Premix Ex试剂盒用于定量PCR分析,以RAN为模板合成cDNA。PCR反应在7500快速实时PCR系统上进行,热循环条件如下:在94 ℃下初始熔化30 s,然后在94 ℃ 5 s,在51 ℃ 15 s,在72 ℃下10 s,45个循环。β-actin mRNA同时扩增并作为对照。计算微管相关蛋白1轻链3(LC3)、p62、自噬相关基因5(ATG5)表达,mRNA的相对量由2-ΔΔCt分析。引物序列见表 1。
放射免疫沉淀裂解缓冲液用于从细胞匀浆中提取总蛋白,然后测定蛋白质浓度。通过10% SDS-PAGE凝胶分离等量的蛋白质,并转移到PVDF膜上。将膜浸入5%脱脂牛奶中,将膜在5%脱脂牛奶中封闭1 h。然后将膜与p-PI3K(1∶1 000)、p-Akt(1∶1 000)、p-mTOR(1∶500)、PI3K(1∶2 000)、Akt(1∶1 000)、mTOR(1∶1 000)、HIF-1α(1∶1 000)抗体在4 ℃孵育过夜,第2天,与辣根过氧化物酶标记的羊抗鼠IgG二抗(1∶5 000)反应1 h。通过增强化学发光系统并使用Image J软件进行定量。
2.8 统计学分析采用SPSS 26.0软件分析结果,数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步行SNK-q检验,P < 0.05为差异有统计学意义。
3 实验结果 3.1 橙皮苷对各组细胞中增殖的影响与对照组相比,甘露醇组细胞吸光度值、EdU阳性率差异无统计学意义(P > 0.05);高糖诱导细胞后,细胞吸光度值、EdU阳性率较对照组、甘露醇组显著增加(P < 0.05);经不同剂量的橙皮苷处理后,细胞吸光度值、EdU阳性率较高糖组显著降低,组间比较差异有统计学意义(P < 0.05),60 mmol/L橙皮苷联合IGF-1处理细胞,细胞吸光度值、EdU阳性率较60 mmol/L橙皮苷单独处理显著增加(P < 0.05),见表 2,细胞EdU染色变化见开放科学标识码(OSID)。
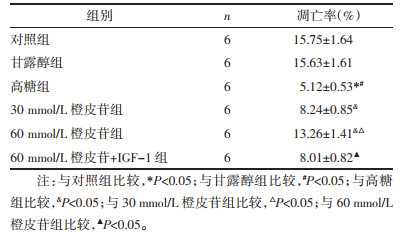
与对照组相比,甘露醇组TNF-α、IL-1β水平差异无统计学意义(P > 0.05);高糖诱导细胞后,TNF-α、IL-1β水平较对照组、甘露醇组显著增加(P < 0.05);经不同剂量的橙皮苷处理后,TNF-α、IL-1β水平较高糖组显著降低,组间比较差异有统计学意义(P < 0.05),60 mmol/L橙皮苷联合IGF-1处理细胞,TNF-α、IL-1β水平较60 mmol/L橙皮苷单独处理显著升高(P < 0.05)。见表 3。
|
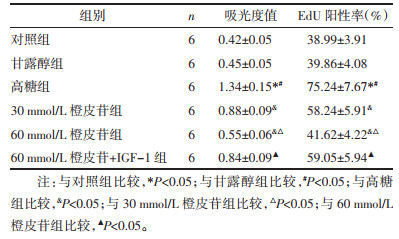
与对照组相比,甘露醇组细胞凋亡差异无统计学意义(P > 0.05);高糖诱导细胞后,凋亡率较对照组、甘露醇组显著降低(P < 0.05);经不同剂量的橙皮苷处理后,凋亡率较高糖组显著增加,组间比较有差异有统计学意义(P < 0.05),60 mmol/L橙皮苷联合IGF-1处理细胞,凋亡率较60 mmol/L橙皮苷单独处理显著降低(P < 0.05),见表 4,细胞凋亡变化图见开放科标识码(OSID)。
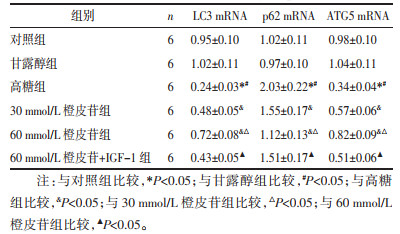
与对照组相比,甘露醇组LC3、p62、ATG5 mRNA表达差异无统计学意义(P > 0.05);高糖诱导细胞后,p62 mRNA表达较对照组、甘露醇组显著增加,LC3、ATG5 mRNA表达显著降低(P < 0.05);经不同剂量的橙皮苷处理后,p62 mRNA表达较高糖组显著降低,LC3、ATG5 mRNA表达显著增加,组间比较差异有统计学意义(P < 0.05),60 mmol/L橙皮苷联合IGF-1处理细胞,p62 mRNA表达较60 mmol/L橙皮苷单独处理显著增加,LC3、ATG5 mRNA表达显著降低(P < 0.05),见表 5。
|
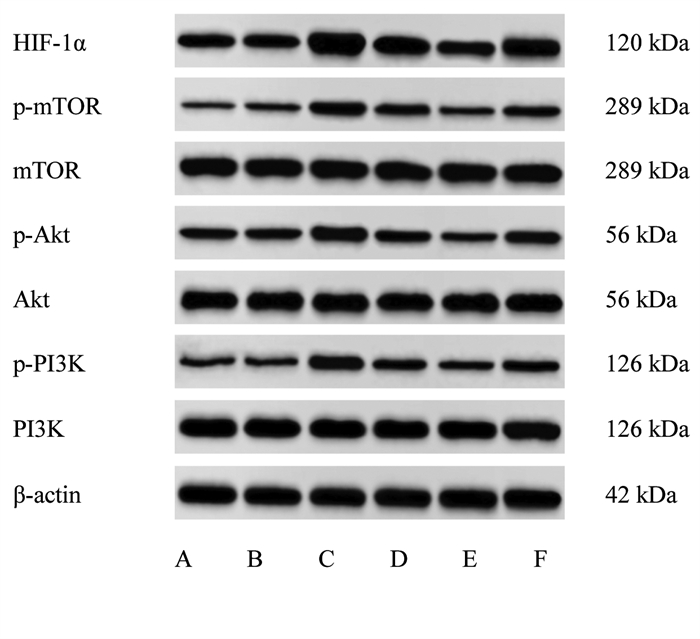
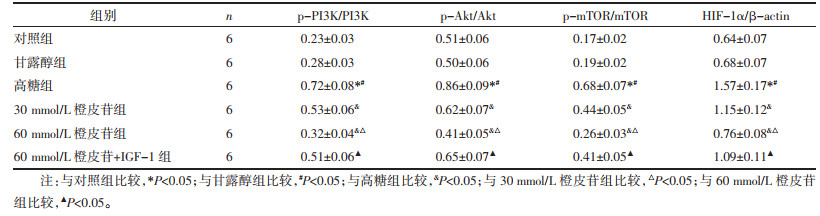
与对照组相比,甘露醇组p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR、HIF-1α表达差异无统计学意义(P > 0.05);高糖诱导细胞后,p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR、HIF-1α表达较对照组、甘露醇组显著增加(P < 0.05);经不同剂量的橙皮苷处理后,p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR、HIF-1α表达较高糖组显著降低,组间比较差异有统计学意义(P < 0.05),60 mmol/L橙皮苷联合IGF-1处理细胞,p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR、HIF-1α表达较60 mmol/L橙皮苷单独处理显著升高(P < 0.05)。见图 1、表 6。
|
| 注:A,对照组;B,甘露醇组;C,高糖组;D,30 mmol/L橙皮苷组;E,60 mmol/L橙皮苷组;F,60 mmol/L橙皮苷+IGF-1组。 图 1 各组细胞蛋白表达比较 Fig. 1 Comparison of the protein expression of cells in each group |
|
DN的主要特征是肾功能下降、丧失,导致肾小球功能障碍,可出现蛋白尿、高血压等症状,如果没有得到有效的治疗,可能诱发肾衰竭而危及生命[12]。目前该疾病发病机制复杂,严格控制血糖、血压和血脂是DN的主要治疗方法,缺乏有效的治疗药物[13],因此研究开发新的治疗方法尤为重要。
肾小球系膜细胞是肾小球的基本组成部分,是一种主要的功能细胞,在调节肾小球渗透、维持肾小球膜基质稳态及肾小球微血管完整性中发挥重要作用,其形态学改变是DN的病理损害之一[14]。研究表明肾小球膜细胞过度增殖及死亡减少是糖尿病介导的破坏肾组织的重要原因,一旦肾小球系膜细胞被破坏,肾小管间质纤维化、肾小球硬化便会出现,最终导致DN[15-16],抑制肾小球系膜细胞的增殖、诱导其凋亡被认为是治疗DN的有效方法。高糖是加速DN发生发展的基本因素,其诱导的过度增殖和凋亡可能是肾小球硬化进展的关键因素[17]。该研究发现高糖诱导细胞后,吸光度值、EdU阳性率显著增加,凋亡率明显降低,表明高糖可诱导SV40 MES-13增殖,抑制其凋亡,与先前研究结果相吻合[18]。炎性反应是DN发展过程中的重要因素,持续的炎性反应可导致肾功能受损[19]。TNF-α、IL-1β水平是常见的炎性因子,其合成与释放影响DN发展[20]。ELISA检测结果显示,高糖诱导细胞后,TNF-α、IL-1β水平明显增加,表明炎性反应在一定程度上促进了DN发展。在传统中医理论中,中草药可广泛用于治疗各种慢性病,其副作用较少,含黄酮类成分的中草药则可缓解高血糖症或糖尿病及其并发症[21]。橙皮苷作为黄酮类化合物之一,Zhang等[22]研究表明橙皮苷可通过抗炎作用对DN小鼠发挥保护作用。本研究经不同剂量的橙皮苷处理后,吸光度值、EdU阳性率及TNF-α、IL-1β水平显著降低,凋亡率明显增加,提示橙皮苷可抑制高糖诱导的细胞增殖及炎症反应,诱导其凋亡,但其机制不明确。
自噬过程是清除细胞中受损蛋白质和衰老细胞器以维持细胞内环境稳定的有效方法,研究表明自噬与DN的发生发展密切相关[23]。ATG5是自噬过程的关键蛋白,可促进LC3的聚集,LC3是一种参与自噬的泛素样蛋白,通过切割LC3以释放胞质LC3-Ⅰ,将其转化为膜结合的LC3-Ⅱ,然后整合到自噬体中[24];p62蛋白作为泛素化蛋白的受体,结合LC3-Ⅱ,随后在自噬体中降解,与自噬强度呈负相关[25]。PI3K/Akt/mTOR信号通路是调节自噬的最典型的信号通路,并且mTOR是自噬调节的关键靶点,并参与DN的发生发展研究[26]。HIF-1α是在缺血缺氧的病理状态下表达的一种关键转录调节因子,在肿瘤、血管新生、缺氧诱导的自噬中起关键作用,HIF-1α位于mTOR下游,mTOR被认为可以增强HIF-1α的转录活性,促进蛋白质合成和细胞增殖,加速细胞代谢并调节细胞自噬[27-28]。该研究结果显示,高糖诱导细胞后,PI3K、Akt、mTOR磷酸化、HIF-1α表达增加,LC3、ATG5 mRNA表达降低,p62 mRNA表达增加,提示高糖诱导细胞,可激活PI3K/Akt/mTOR/HIF-1α信号通路抑制细胞自噬。经不同剂量的橙皮苷处理后,上述指标发生逆转,抑制了细胞增殖,促进其凋亡,表明橙皮苷有望治疗DN,可能与抑制PI3K/Akt/mTOR/HIF-1α信号通路,促进细胞自噬有关。IGF-1作为PI3K/Akt/mTOR通路激活剂,可上调mTOR表达,进一步增加HIF-1α表达,实验引入IGF-1进行验证,结果发现IGF-1联合橙皮苷处理高糖诱导的SV40 MES-13的保护作用远低于单独采用橙皮苷处理结果,进一步表明橙皮苷对高糖诱导细胞的保护作用可能与抑制PI3K/Akt/mTOR/HIF-1α信号通路有关。
综上所述,橙皮苷调控PI3K/Akt/mTOR/HIF-1α信号通路促进高糖诱导的肾小球系膜细胞自噬、凋亡,抑制其增殖及炎性反应,为橙皮苷治疗DN提供了依据。
| [1] |
CHEN X T, XIE H W, LIU Y, et al. Interference of ALOX5 alleviates inflammation and fibrosis in high glucose-induced renal mesangial cells[J]. Experimental and Therapeutic Medicine, 2023, 25(1): 34. |
| [2] |
HUANG H M, YANG M J, TING L I, et al. Neferine inhibits the progression of diabetic nephropathy by modulating the miR-17-5p/nuclear factor E2-related factor 2 axis[J]. Journal of Traditional Chinese Medicine, 2024, 44(1): 44-53. |
| [3] |
BARRO L, HSIAO J T, CHEN C Y, et al. Cytoprotective effect of liposomal puerarin on high glucose-induced injury in rat mesangial cells[J]. Antioxidants, 2021, 10(8): 1177. DOI:10.3390/antiox10081177 |
| [4] |
ZHAO T T, XIANG Q, LIE B F, et al. Yishen Huashi granule modulated lipid metabolism in diabetic nephropathy via PI3K/AKT/mTOR signaling pathways[J]. Heliyon, 2023, 9(3): e14171. DOI:10.1016/j.heliyon.2023.e14171 |
| [5] |
YANG F, QU Q S, ZHAO C Y, et al. Paecilomyces cicadae-fermented Radix astragali activates podocyte autophagy by attenuating PI3K/AKT/mTOR pathways to protect against diabetic nephropathy in mice[J]. Biomedecine & Pharmacotherapie, 2020, 129: 110479. |
| [6] |
JIA Y J, CHEN J Q, ZHENG Z K, et al. Tubular epithelial cell-derived extracellular vesicles induce macrophage glycolysis by stabilizing HIF-1α in diabetic kidney disease[J]. Molecular Medicine, 2022, 28(1): 95. DOI:10.1186/s10020-022-00525-1 |
| [7] |
杨彬, 陈哲, 全虹翰, 等. 橙皮苷对DOCA/Salt高血压大鼠心肾组织损害的保护作用[J]. 中国药理学通报, 2023, 39(9): 1705-1710. DOI:10.12360/CPB202208041 |
| [8] |
方情, 马汝玉, 贺英昊, 等. 阿魏酸对高糖诱导的肾小球系膜细胞炎症及自噬水平的影响[J]. 中国应用生理学杂志, 2022, 38(5): 453-457. |
| [9] |
苏珊珊, 刘慧, 修方睿, 等. MiR-92a-3p靶向同源盒蛋白13对高糖诱导的肾小球系膜细胞损伤的影响[J]. 实用医学杂志, 2022, 38(24): 3037-3042. DOI:10.3969/j.issn.1006⁃5725.2022.24.003 |
| [10] |
徐昊, 黄克强, 黄超. 橙皮苷对人舌癌Tca8113细胞增殖和凋亡的影响及机制研究[J]. 陕西医学杂志, 2022, 51(9): 1149-1152. DOI:10.3969/j.issn.1000-7377.2022.09.025 |
| [11] |
王钢, 秦鲜, 赵顺林, 等. MiR-218靶向PI3K/Akt/mTOR信号通路对甲状腺癌细胞的影响[J]. 河北医学, 2022, 28(10): 1604-1609. |
| [12] |
WAN H, WANG Y P, PAN Q Y, et al. Quercetin attenuates the proliferation, inflammation, and oxidative stress of high glucose-induced human mesangial cells by regulating the miR-485-5p/YAP1 pathway[J]. International Journal of Immunopathology and Pharmacology, 2022, 36: 20587384211066440. DOI:10.1177/20587384211066440 |
| [13] |
SAGOO M K, GNUDI L. Diabetic nephropathy: An overview[J]. Methods in Molecular Biology, 2020, 2067: 3-7. |
| [14] |
LIU H, CHEN W L, LU P, et al. Ginsenoside Rg1 attenuates the inflammation and oxidative stress induced by diabetic nephropathy through regulating the PI3K/AKT/FOXO3 pathway[J]. Annals of Translational Medicine, 2021, 9(24): 1789. DOI:10.21037/atm-21-6234 |
| [15] |
CHEN K, YU B, LIAO J. LncRNA SOX2OT alleviates mesangial cell proliferation and fibrosis in diabetic nephropathy via Akt/mTOR-mediated autophagy[J]. Molecular Medicine, 2021, 27(1): 71. DOI:10.1186/s10020-021-00310-6 |
| [16] |
CHEN C, SHI Y, MA J L, et al. Trigonelline reverses high glucose-induced proliferation, fibrosis of mesangial cells via modulation of Wnt signaling pathway[J]. Diabetology & Metabolic Syndrome, 2022, 14(1): 28. |
| [17] |
NI W J, GUAN X M, ZENG J, et al. Berberine regulates mesangial cell proliferation and cell cycle to attenuate diabetic nephropathy through the PI3K/Akt/AS160/GLUT1 signalling pathway[J]. Journal of Cellular and Molecular Medicine, 2022, 26(4): 1144-1155. DOI:10.1111/jcmm.17167 |
| [18] |
刘强, 姚丽. NORAD在高糖诱导小鼠肾小球系膜细胞增殖及凋亡中的作用及机制[J]. 中华医学杂志, 2021, 101(10): 732-736. |
| [19] |
WU M, HAN W X, SONG S, et al. NLRP3 deficiency ameliorates renal inflammation and fibrosis in diabetic mice[J]. Molecular and Cellular Endocrinology, 2018, 478: 115-125. DOI:10.1016/j.mce.2018.08.002 |
| [20] |
杨朔, 胡俊华, 王亚娟, 等. 雷公藤乙素对糖尿病肾病大鼠肾组织p-p38MAPK TNF-α及IL-1β表达的影响[J]. 中国中医药科技, 2021, 28(6): 897-900. |
| [21] |
MIRZAEI A, MIRZAEI A, NAJJAR KHALILABAD S, et al. Promising influences of hesperidin and hesperetin against diabetes and its complications: A systematic review of molecular, cellular, and metabolic effects[J]. EXCLI Journal, 2023, 22: 1235-1263. |
| [22] |
ZHANG Y H, WANG B, GUO F, et al. Involvement of the TGFβ1-ILK-Akt signaling pathway in the effects of hesperidin in type 2 diabetic nephropathy[J]. Biomedecine & Pharmacotherapie, 2018, 105: 766-772. |
| [23] |
YANG C, CHEN X C, LI Z H, et al. SMAD3 promotes autophagy dysregulation by triggering lysosome depletion in tubular epithelial cells in diabetic nephropathy[J]. Autophagy, 2021, 17(9): 2325-2344. |
| [24] |
郭克磊, 李颖利, 韩立, 等. 益气养阴化浊通络方对高糖诱导小鼠肾足细胞自噬ATG5、Beclin-1及BNIP3表达的影响[J]. 中国医院药学杂志, 2023, 43(16): 1808-1813. |
| [25] |
邓敏贞, 钟晓琴, 高志杰, 等. 益脑康胶囊对缺血再灌注模型小鼠自噬相关因子Beclin-1、LC3B和p62的影响[J]. 西部中医药, 2023, 36(9): 10-14. |
| [26] |
CHEN Y, ZHENG Y F, LIN X H, et al. Dendrobium mixture attenuates renal damage in rats with diabetic nephropathy by inhibiting the PI3K/Akt/mTOR pathway[J]. Molecular Medicine Reports, 2021, 24(2): 590. |
| [27] |
ABD EL-BASET S A, MAZEN N F, ABDUL-MAKSOUD R S, et al. The therapeutic prospect of zinc oxide nanoparticles in experimentally induced diabetic nephropathy[J]. Tissue Barriers, 2023, 11(1): 2069966. |
| [28] |
KAWAKITA E, YANG F, SHI S, et al. Inhibition of dipeptidyl peptidase-4 activates autophagy to promote survival of breast cancer cells via the mTOR/HIF-1α pathway[J]. Cancers, 2023, 15(18): 4529. |
 2025, Vol. 42
2025, Vol. 42