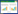文章信息
- 郑婧, 任水明, 高倩, 等.
- ZHENG Jing, REN Shuiming, GAO Qian, et al.
- 白芍总苷对慢性免疫性血小板减少症的作用机制
- The mechanism of total glucosides of paeony on chronic immune thrombocytopenia
- 天津中医药, 2025, 42(1): 84-89
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(1): 84-89
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.01.16
-
文章历史
- 收稿日期: 2024-08-20
免疫性血小板减少症(ITP)是一种以出血及血小板减少的免疫性疾病。流行病数据显示:ITP全球发病率为3.3~8/10万人,亚洲地区高于欧美,女性高于男性[1]。ITP患者临床可表现为牙龈出血、瘀斑等,且随着疾病进展可累及肝脾,导致脾脏肿大及损伤等[2]。现阶段,ITP患者常采用糖皮质激素、免疫调节制剂等,可有效增加血小板数量但停药后复发率较高,不良反应较大,故现阶段临床多推荐传统中医治疗[3]。中医将ITP归属为“血证”“紫癜”的范畴,并认为病机为多种原因所致的气虚、营卫失调之证,故应采用益气固表、调和营卫,标本兼治。白芍总苷(TGP)是主要存在于中药白芍中的天然化合物,主要含芍药苷(PF)、芍药内酯苷(AF)等多种单萜糖苷类化合物[4]。现代药理学表明,TGP具有抗炎、免疫调节、保肝镇痛、抗氧化应激等多种作用。现阶段,已经有学者发现TGP可以用于ITP患者临床治疗,认为其可以对自身免疫多个环节具有调节作用,可以抑制CD4+T细胞计数,增加CD8+T细胞计数,并抑制辅助型T细胞功能进而提高患者临床疗效[5]。但具体研究机制还不清楚,因此,文章通过建立ITP小鼠模型,探讨TGP对其的作用机制,为相关研究提供有力依据。
1 材料与方法 1.1 动物来源无特定病原体(SPF)级BALB/C小鼠60只,体质量24~28 g,购自北京维通利华实验动物技术有限公司,许可证号:(京)2022-0011。于本院动物实验室饲养,温度:23~25 °、湿度:50%~60%自由进食及饮水,所有小鼠适应7 d后进行实验。符合鄂尔多斯市中心医院伦理审批(审批号:2022-0120)。
1.2 药物、主要试剂与仪器白芍总苷胶囊(宁波立华制药有限公司,国药准字H20055058);醋酸泼尼松(天津信谊津津药业有限公司,国药准字H310 20675);戊巴比妥钠(上海新亚药业有限公司,国药准字H31021725);磷酸盐缓冲液(PBS)、0.25%胰酶(HyClone公司,货号:SH30256.01、SH30042.01);苏木精-伊红(HE)试剂盒(北京索莱宝科技有限公司,货号:G1120);白细胞介素(IL)-17,IL-10、转化生长因子(TGF)-β1酶链免疫吸附实验(ELISA)试剂盒(上海酶研生物公司,货号EK-M27857、EKM25932、EK-M29282);FITC-CD4、Percp-CD25、PEFOXP3、Alexa Fluor R 647-IL-17流式抗体(Biolegend公司,货号100405、102027、320014、517006);小鼠抗小鼠CD41单克隆抗体(美国abcam公司,货号:ab33661);淋巴细胞分离液(北京索莱宝科技有限公司,货号:P8370)TDZ4-WS型低速离心机(上海卢湘仪离心机仪器有限公司);DxFLEX流式细胞仪(陕西科仪科技有限公司);Multiskan FC酶标仪(北京旭亚科技有限公司)。
1.3 实验分组、动物模型建立及干预方法60只小鼠按照随机数字方法分为对照组、模型组、TGP低剂量组、TGP中剂量组、TGP高剂量组及西药组,每组10只。将CD41单克隆抗体采用1×PBS稀释成2 μg/200 μL的MWReg30单抗磷酸盐溶液,4 ℃保存。参考文献[6]采用被动免疫法建立ITP动物模型,除对照组外均建立ITP动物模型,具体方法:小鼠腹腔注射含有2 μg的MWReg30单抗的PBS 200 μL,连续注射21 d,对照组同样的方法注射200 μL生理盐水,末次注射后采用全自动五分类血液分析仪(MINDRAY BC-5300Vet)进行血常规检测,当血小板计数降低为正常值的一半以下为建模成功。模型组及TGP中剂量组均有1只小鼠建模失败,其余小鼠均建模成功。建模成功后24 h,TGP低剂量组、TGP中剂量组、TGP高剂量组分别灌胃100 mg/kg、200 g/kg及400 mg/kg的TGP溶液,西药组灌胃5 mg/kg的醋酸泼尼松,对照组及模型组灌胃等体积的生理盐水,每日1次,连续灌胃4周。
1.4 外周血小板计数建模前、干预后1周、干预后2周、干预后3周及干预后4周分别取小鼠尾部静脉血0.5 mL,采用日本东亚Sysmex公司生产的XT-1800i型全自动血细胞计数仪检测血小板计数,按照仪器说明书进行。
1.5 流式细胞仪检测辅助性T细胞17(Th17)、全称调节性T细胞(Teg)各组小鼠尾部取静脉血1 mL,加入0.2%肝素抗凝后采用等体积的PBS稀释,加入淋巴细胞分离液,2 000 r/min离心30 min(离心半径10 cm),取中层经PBS冲洗得到单个核细胞悬液,调整为2×103个/mL,置入离心管中,100 μL/管。每个离心管中加入10 μL FITC-CD4、10 μL Percp-CD25染色20 min洗涤后固定孵育20 min,加入10 μL PE-FOXP3染色20 min,洗涤后上机检测,借助FlowJoV10软件分析Treg;离心管中加入丙二醇甲醚醋酸酯(PMA,100 ng/mL)及Ionomycin(1 μg/mL)孵育60 min,加入布雷菲德菌素A(BFA,10 μg/L)孵育60 min,加入10 μL FITC-CD4染色20 min,洗涤后孵育20 min,加入AlexaFluorR647-IL-17孵育30 min,洗涤后上机检测,借助FlowJoV10软件分析Th17。
1.6 酶联免疫检测仪检测Treg、Th17相关因子取尾部静脉血200 μL,静止2 h,3 500 r/min离心10 min(离心半径12 cm),保留上清液,按照试剂盒说明书进行操作,将酶联免疫吸附法(ELISA)板置于酶标仪中在450 nm波长处检测IL-17、IL-10、TGF-β1吸光度,采用SoftMaxPro软件分析表达水平。
1.7 HE染色及脏器指数各组小鼠按照颈部脱臼方法处死,提取肝组织及脾组织,甲醛固定后进行石蜡包埋后进行5 μm切片,脱蜡后采用95 %的乙醇脱水,切片先放入苏木精染色10 min后小流量自来水冲洗,1 %的盐酸乙醇褪色变红后停止操作,采用碳酸锂浸泡2 min后采用1%伊红复染后,逐级透水。光学显微镜下观察病理形态,并计算脏器指数=脏器质量(mg)/体质量(g)。
1.8 统计学方法采用SPSS.26统计学软件分析,GraphPad Prism 8软件绘图,数据符合正态分布,以均数±标准差(x±s)表示,多组间进行单因素方差分析,组间两两比较采用LSD-t检验,不同时间点组间比较采用重复测量方差分析,P<0.05表示差异具有统计学意义。
2 结果 2.1 各组小鼠不同时间血小板计数比较模型建立前,各组小鼠血小板计数比较,差异无统计学意义(P>0.05);建模24 h及干预1周,与对照组相比,其余各组小鼠血小板计数均降低(P<0.05),但组间比较差异无统计学意义(P>0.05);干预2周、3周及4周时,与对照组相比,模型组血小板计数降低(P<0.05),与模型组相比,TGP低、中、高剂量组及西药组血小板计数升高(P<0.05),TGP低、中、高剂量组及西药组组间比较血小板计数逐渐升高,存在差异(P<0.05)。见表 1。
|
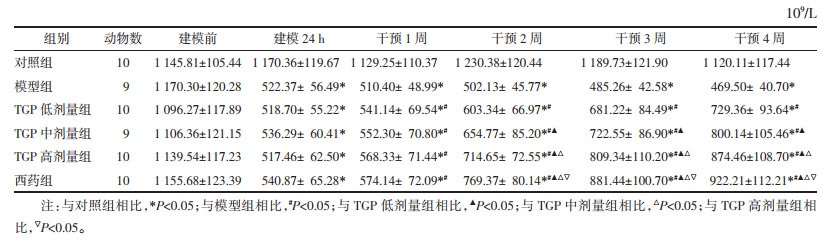
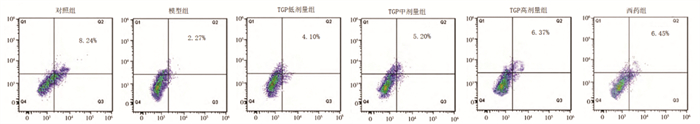
与对照组相比,模型组小鼠外周血Treg百分比降低,Th17百分比升高(P<0.05);与模型组相比,TGP低、中、高剂量组及西药组Treg百分比升高,Th17百分比降低(P<0.05);且TGP低、中、高剂量组组间比较Treg百分比逐渐升高,Th17百分比逐渐降低,比较存在差异(P<0.05),但TGP高剂量组与西药组比较差异无统计学意义(P>0.05)。见表 2,图 1和图 2。

|
|
| 图 1 各组小鼠外周血Treg百分比比较 Fig. 1 Comparison of Treg percentage in peripheral blood of mice in each group |
|
| 图 2 各组小鼠外周血Th17百分比比较 Fig. 2 Comparison of Th17 percentage in peripheral blood of mice in each group |
与对照组相比,模型组小鼠外周血IL-10、TGF-β1降低,IL-17升高(P<0.05);与模型组相比,TGP低、中、高剂量组及西药组IL-10、TGF-β1升高,IL-17降低(P<0.05);IL-17在TGP低、中、高剂量组组间比较差异有统计学意义(P<0.05),TGF-β1在TGP低、中、高剂量组、西药组组间比较无差异(P>0.05),IL-17在TGP高剂量组与西药组比较无差异(P>0.05)。见表 3。
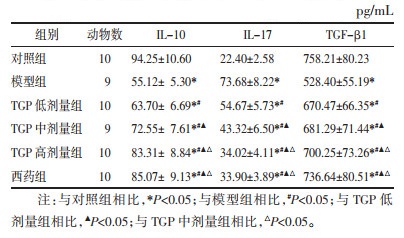
|
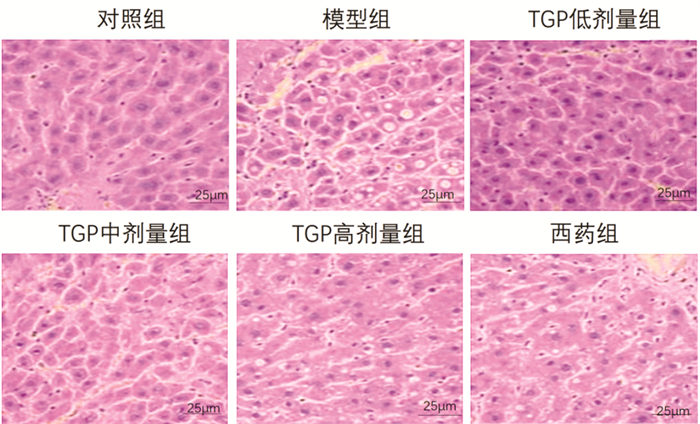
肝组织:对照组肝细胞形态正态,结构清晰无明显病理改变;模型组肝细胞严重空泡化,且细胞核坏死,边界模糊可见明显炎症浸润;TGP低剂量组及TGP中剂量组肝细胞空泡化改善,可见肝细胞具有融合现象;TGP高剂量组肝细胞轻度空泡化,炎症细胞显著减轻,肝细胞形态趋于正常;西药组:肝细胞空泡化不显著,间隙较大,炎症浸润不明显。见图 3。
|
| 图 3 各组小鼠肝组织病理形态比较(HE染色,×400) Fig. 3 Comparison of pathological morphology of liver tissue of mice in each group(HE staining, ×400) |
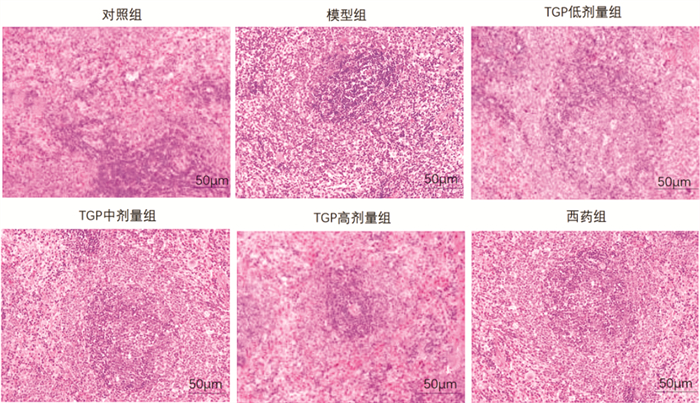
脾组织:对照组红白髓间隙清晰,且动脉结构完好;模型组脾小体形态不规则,红髓显著充血且炎症浸润明显;与模型组相比,TGP低剂量组及TGP中剂量组红白髓边界相对模糊,炎症浸润改善;TGP高剂量组及西药组脾小体数量增多,脾索结构清晰,炎症因子较少分布。见图 4。
|
| 图 4 各组小鼠脾组织病理形态比较(HE染色,×200) Fig. 4 Comparison of pathological morphology of spleen tissue of mice in each group(HE staining, ×200) |
与对照组相比,模型组小鼠肝指数及脾指数升高(P<0.05);与模型组相比,TGP低、中、高剂量组及西药组肝指数及脾指数降低(P<0.05);肝指数及脾指数TGP低、中、高剂量组组间比较差异有统计学意义(P<0.05),但TGP高剂量组与西药组比较无差异(P>0.05)。见表 4。
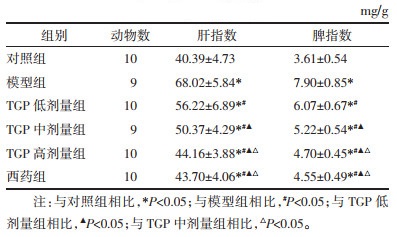
|
ITP是以血小板减少和免疫系统异常为特征的疾病,儿童及中老年女性为发病主体,西医临床疗效较显著,但随着中医的快速发展在其治疗中发挥重要作用。TGP是一种中药成分,被广泛应用于治疗各种免疫性疾病,且已经被证实可用于ITP患者的临床治疗,且效果显著,但具体机制还不清楚,故该研究探讨TGP对ITP的作用机制,以期为该疾病的治疗提供新的思路和方法。
ITP中医发病机制为营卫不和,卫外不固,外邪侵袭肌表,郁于肌肤[7]。故辨证治疗以益气固表、调和营卫,标本兼治。中医认为肝主藏血,脾主统血,而ITP发病多为肝脾虚损,不司藏血、统血之职所致,故临床治疗应寻遵循治肝脾原则[8]。文章研究结果显示:与模型组相比,不同剂量TGP组的小鼠血小板计数升高,同时HE染色发现肝组织及脾组织病理形态均有所改善,而肝指数及脾指数均有所降低,故认为TGP可发挥治疗作用。现代药理研究表明,ITP发病机制主要在于血小板功能障碍,主要体现在血小板破坏增加生成减少,原因在于血小板特异性抗体的产生,这些抗体会结合到血小板表面的受体上,形成免疫复合物,可进一步被巨噬细胞识别并破坏,导致血小板减少[9]。文章认为ITP产生可增加肝指数及脾指数,这是在ITP中脾脏对血小板的清除过程异常增加,降低血小板计数,增加脾脏指数。肝脏主要对血小板的生成、储存和释放地发挥作用,而ITP患者免疫系统异常激活可能导致对肝组织的攻击,引发肝脏炎症和损伤,降低血小板的生成。白芍为毛茛科植物芍药的干燥根,是集养血、益气、通络为一体的中草药,是中医常见的治疗自身免疫疾病的药物[10]。白芍中主要活性成分包含但不限于芍药苷、羟基芍药苷、芍药花苷、芍药内酯苷等,统称为TGP。TGP可用于ITP临床治疗,有研究表明,TGP可恢复Th1/Th2平衡,减少细胞因子IL-1及IL-4表达而增加B淋巴细胞活性降低血小板抗体的功能,进而减少血小板的破坏增加血小板计数[11]。有研究表明,TGP可减少关节炎大鼠炎症的同时可减少胸腺指数及脾脏指数,进一步调节异常免疫功能[12]。文章认为TGP可调理肝脾,改善津液受损、阴血不足,可发挥健脾益气的作用,进而通过调节肝脾而减少ITP血小板减少症状。
笔者研究结果显示:与模型组相比,不同剂量TGP组的小鼠Treg百分比升高,Th17百分比降低,同时检测相关细胞因子水平发现,TGP组小鼠的IL-10、TGF-β1升高,IL-17降低,说明TGP可通过维持机体免疫平衡而改善疾病。ITP发病机制较为复杂,是体液免疫及细胞免疫共同导致的结果,而Th17/Treg失衡已被证实与ITP的发生有关[13-14]。Treg是一类特殊的CD4+T细胞,主要分为自然性Treg及适应性Treg两种,而IL-10及TGF-β1是主要的细胞因子,而当Treg缺乏时可导致多种自身免疫性疾病的发生[15]。Th17是CD+T细胞一种新的类型,其表达异常可参与恶性肿瘤、免疫疾病等的进展,而IL-17是其相关细胞因子,其异常升高参与自身免疫紊乱,进一步促进ITP疾病的发生发展[16]。中医角度认为免疫异常与营卫失调的病理机制相吻合,异常的自身免疫反应是ITP疾病的本质,也是“营卫失调”产生的根源[17]。白芍治营弱,调和营卫,并可以统称人体气血、阴阳、脾胃的协调,进而提高免疫功能,逐步提高患者愈病能力[18]。有研究表明,在ITP小鼠中存在Th17/Treg紊乱,表现为Th17占比升高,而Treg占比降低,并通过降低Th17,升高Treg,实现免疫平衡而实现提高血小板水平[19]。在银屑病血虚证患者采用TGP可调节Th17 /Treg细胞失衡,降低IL-17表达而提高IL-10水平,并对细胞抗原呈递过程进行抑制,减轻炎性反应[20]。故笔者发现TGP可能通过调和营卫益气固表,改善Th17/Treg功能而发挥治疗ITP疾病的作用。
综上所述,TGP可改善慢性ITP小鼠免疫功能,提高血小板计数,减少肝脾损伤。
| [1] |
THALER J, JILMA P, SAMADI N, et al. Long-term follow-up after successful treatment of vaccine-induced prothrombotic immune thrombocytopenia[J]. Thrombosis Research, 2021, 207: 126-130. DOI:10.1016/j.thromres.2021.09.017 |
| [2] |
SANDAL R, MISHRA K, JANDIAL A, et al. Update on diagnosis and treatment of immune thrombocytopenia[J]. Expert Review of Clinical Pharmacology, 2021, 14(5): 553-568. DOI:10.1080/17512433.2021.1903315 |
| [3] |
孙香颖, 胡冬菊, 王永敏, 等. 胡冬菊教授中医辨治免疫性血小板减少症的经验[J]. 世界中西医结合杂志, 2020, 15(11): 2028-2031. |
| [4] |
LIANG C L, JIANG H L, FENG W X, et al. Total glucosides of paeony ameliorate pristane-induced lupus nephritis by inducing PD-1 ligands+ macrophages via activating IL-4/STAT6/PD-L2 signaling[J]. Frontiers in Immunology, 2021, 12: 683249. DOI:10.3389/fimmu.2021.683249 |
| [5] |
吴玉霞, 袁忠, 白玉盛, 等. 白芍总苷联合中药辨证治疗老年慢性原发免疫性血小板减少症的临床观察[J]. 世界中医药, 2015, 10(9): 1340-1343. DOI:10.3969/j.issn.1673-7202.2015.09.012 |
| [6] |
刘晓, 费飞, 秦兰. 补肾活血方对慢性免疫性血小板减少症模型小鼠VEC相关血管因子的影响[J]. 辽宁中医杂志, 2023, 50(2): 191-195. |
| [7] |
杨阳, 施美, 郭子敬, 等. 分期辨治原发免疫性血小板减少症临证撷要[J]. 江苏中医药, 2023, 55(3): 43-46. |
| [8] |
卢诗颖, 陈鹏. 陈志雄从肝脾论治儿童原发性免疫性血小板减少症经验[J]. 广州中医药大学学报, 2022, 39(7): 1658-1663. |
| [9] |
KOHLI R, CHATURVEDI S. Epidemiology and clinical manifestations of immune thrombocytopenia[J]. Hamostaseologie, 2019, 39(3): 238-249. DOI:10.1055/s-0039-1683416 |
| [10] |
余欣然, 陈云志, 牧亚峰, 等. 白芍总苷对自身免疫性甲状腺炎大鼠的免疫调节作用[J]. 中成药, 2023, 45(5): 1666-1669. DOI:10.3969/j.issn.1001-1528.2023.05.049 |
| [11] |
周淑秋. 白芍总苷联合强的松在原发免疫性血小板减少症的疗效[J]. 中国保健食品, 2022(10): 85-87. |
| [12] |
袁君. 芍药苷-6'-O-苯磺酸酯(CP-25)对小鼠胶原性关节炎的治疗作用及初步机制[D]. 合肥: 安徽医科大学, 2013.
|
| [13] |
LI Q Z, LIU Y, WANG X J, et al. Regulation of Th1/Th2 and Th17/Treg by pDC/mDC imbalance in primary immune thrombocytopenia[J]. Experimental Biology and Medicine, 2021, 246(15): 1688-1697. DOI:10.1177/15353702211009787 |
| [14] |
KARGAR M, TORABIZADEH M, PURRAHMAN D, et al. Regulatory factors involved in Th17/Treg cell balance of immune thrombocytopenia[J]. Current Research in Translational Medicine, 2023, 71(2): 103389. DOI:10.1016/j.retram.2023.103389 |
| [15] |
HE Y, JI D X, LU W, et al. Bone marrow mesenchymal stem cell-derived exosomes induce the Th17/Treg imbalance in immune thrombocytopenia through miR-146a-5p/IRAK1 axis[J]. Human Cell, 2021, 34(5): 1360-1374. DOI:10.1007/s13577-021-00547-7 |
| [16] |
TANG M W, CHENG L Y, LI F, et al. Transcription factor IRF4 dysfunction affects the immunosuppressive function of Treg cells in patients with primary immune thrombocytopenia[J]. BioMed Research International, 2019, 2019: 1050285. |
| [17] |
贾钰洁, 何靖, 马萌. 基于营卫和六经病中风理论辨治免疫性血小板减少症[J]. 中医杂志, 2022, 63(18): 1793-1796. |
| [18] |
庞枫韬, 唐晓颇, 徐浩东, 等. 从营卫理论探讨桂枝汤对免疫系统的调节作用[J]. 北京中医药大学学报, 2021, 44(9): 807-811. DOI:10.3969/j.issn.1006-2157.2021.09.007 |
| [19] |
寇少杰, 李欣, 薛敬东, 等. 芍仙萸颗粒通过调节调节性T细胞/辅助性T细胞免疫平衡治疗小鼠原发免疫性血小板减少症的机制研究[J]. 山西医药杂志, 2022, 51(17): 1929-1933. DOI:10.3969/j.issn.0253-9926.2022.17.002 |
| [20] |
蔺莉莉, 任文平, 高宏艳, 等. 白芍总苷胶囊联合阿维A胶囊治疗银屑病血虚证的临床疗效及对辅助性T淋巴细胞17、调节性T淋巴细胞和炎症因子的影响[J]. 河北中医, 2022, 44(9): 1498-1501, 1506. |
 2025, Vol. 42
2025, Vol. 42