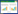文章信息
- 郭金明, 付永涛, 索大伟, 等.
- GUO Jinming, FU Yongtao, SUO Dawei, et al.
- 刺五加注射液通过抑制TLR4/NF-κB信号通路减轻糖尿病肾病小鼠肾损伤的研究
- Study on Acanthopanax senticosus Injection on alleviating renal injury in diabetic kidney disease mice by inhibiting TLR4/NF-κB signaling pathway
- 天津中医药, 2025, 42(1): 100-107
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(1): 100-107
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.01.18
-
文章历史
- 收稿日期: 2024-09-02
糖尿病肾病(DKD)是糖尿病的一种常见且严重的慢性微血管并发症,以持续蛋白尿为主要临床表现。据统计,约35%~40%的糖尿病患者并发不同程度的DKD,已成为终末期肾病的主要触发因素,全球每年因此致死人数超过4万人[1-2]。DKD病理机制非常复杂,涉及炎症、细胞凋亡、组织纤维化等一系列因素[3-4]。多种信号通路参与介导DKD进程,其中Toll样受体4(TLR4)及其下游靶蛋白核因子-κB(NF-κB)等在炎症、细胞凋亡、组织纤维化等病理过程中扮演着关键角色[5-6]。研究证实,通过药物抑制TLR4/NF-κB信号通路可有效减轻DKD大鼠肾损伤[7-9]。
刺五加注射液(ASI)是中药刺五加经水醇法提取精制而成的一种中药注射剂,有效成分包括刺五加苷B、刺五加苷E、刺五加酚、异嗪皮啶、咖啡酸、紫丁香苷等,目前主要用于缺血性脑血管病及冠心病心绞痛等疾病的治疗。随着药理学研究的深入,发现ASI具有较好的抗炎、抗凋亡、抗纤维化等作用[10-11]。有研究报道ASI对糖尿病大鼠血管内皮具有保护作用[12],刺五加提取物对糖尿病小鼠糖脂代谢具有改善作用[13]。并且,ASI对肾缺血再灌注大鼠肾损伤具有抑制作用,其机制与抑制TLR4/NF-κB信号通路而减轻炎症反应有关[10]。该研究通过构建DKD小鼠动物模型,探讨ASI对DKD小鼠肾损伤的影响及其机制,以期为DKD临床治疗提供新的思路。
1 材料与方法 1.1 材料 1.1.1 实验动物通过河北医科大学[实验动物公共服务平台,许可证号:SCXK(冀)2020-001]购买SPF级雄性C57BL/6J品系小鼠55只,体质量15~18 g,饲养于室温23~25 ℃、湿度50%~60%、空气流动性好的动物房,进食饮水不限。该研究获得河北省邯郸市中心医院伦理委员会批准[伦理批号:HDZXLL(K)2023-011]。
1.1.2 主要药品与试剂ASI(批号2201A017)购自黑龙江乌苏里江制药有限公司;瑞沙托维(TAK-242,TLR4抑制剂,货号IR0580)、脂多糖(LPS,TLR4激动剂,货号IL2020)、尿蛋白量(UTP,货号BC5650)、尿酸(UA,BC1360)、血尿素氮(BUN,BC1530)、血清肌酐(Scr,BC4910)试剂盒购自北京索莱宝公司;链脲佐菌素(货号ST1668)、TRIzol试剂(货号R0016)、白细胞介素-1β(IL-1β,货号PI301)、白细胞介素-6(IL-6,货号PI326)、肿瘤坏死因子-α(TNF-α,货号PT512)试剂盒购自上海碧云天公司;苏木精-伊红(HE,货号D006-1-4)、马森(Masson,货号D026-1-3)、末端标记法(TUNEL,货号G001-1-2)染色试剂盒、一步法逆转录实时定量聚合酶链反应(RT-PCR)试剂盒(货号N116)、RIPA裂解液(货号W062-1-1)、二奎磷甲酸(BCA,货号A045-4-2)、增强化学发光试剂(ECL、货号W028-2-1)购自南京建成生物工程研究所;TLR4(货号AF7017)、NF-κB p65(货号AF5006)、B细胞淋巴瘤-2(Bcl-2,货号AF6139)、Bcl-2相关X蛋白(Bax,货号AF0120)、半胱氨酸蛋白酶-3(Caspase-3,货号AF6311)、活化型Caspase-3(Cleaved Caspase-3,货号AF7022)、甘油醛-3-磷酸脱氢酶(GAPDH,货号AF0911)抗体和IgG二抗(货号S0001)购自美国Affinity公司;高脂饲料(60.65%脂肪+21.21%碳水化合物+18.14%蛋白质)购自北京华阜康有限公司。
1.2 方法 1.2.1 分组与模型制备随机取55只实验小鼠中45只,参照Shen等[14]报道的方法构建DKD动物模型:高脂饲料喂养6周后腹腔注射链脲佐菌素50 mg/kg,分别于24 h后和72 h后通过动物血糖仪(Contour TS型,德国拜耳公司)检测空腹血糖(FBG)水平均≥11.1 mmol/L则说明糖尿病模型制备成功(44只成功),继续高脂饲料喂养8周后,按照试剂盒操作说明,通过分光光度计(721型,上海分析仪器厂)测定24 h UTP≥30 mg则说明DKD动物模型制备成功[15](40只成功),将40只成模小鼠随机分为模型组、ASI组、ASI+TAK-242组和ASI+LPS组,每组10只。剩余10只小鼠设为正常对照组。ASI组腹腔注射ASI 75 mg/kg(相当于人临床剂量),ASI+TAK-242组腹腔注射ASI 75 mg/kg和TAK-242 0.5 mg/kg[16],ASI+LPS组腹腔注射ASI 75 mg/kg和LPS 10 mg/kg[17],正常对照组和模型组腹腔注射0.9%氯化钠溶液,各组均1次/d给药,疗程8周。
1.2.2 标本采集与处理持续给药8周后,通过动物血糖仪(Contour TS型,德国拜耳公司)检测FBG水平。收集24 h尿液并2 500 r/min离心(离心半径10 cm)5 min收集上清液,-20 ℃保存。乙醚吸入麻醉后,摘眼球取血,室温静置待血液凝固后1500 r/min离心(离心半径10 cm)10 min收集血清,-20 ℃保存。称量体质量,颈椎脱臼处死小鼠,取双侧肾脏并称质量,肾脏系数=双侧肾质量/体质量。将左侧肾脏置于福尔马林溶液中固定5 d,右侧肾脏-20 ℃保存。
1.2.3 生化指标检测取“1.2.2”尿液上清液和血清标本,按照试剂盒说明,通过分光光度计(721型,上海分析仪器厂)测定肾功能指标(24 h UTP、UA、BUN、Scr)。取1/2右侧肾脏,按质量体积比1∶9(g/mL)加入4 ℃预冷生理盐水后研磨匀浆,3 500 r/min离心(离心半径10 cm)10 min收集上清液,按照试剂盒说明,通过酶标仪(MK3型,芬兰雷勃公司)测定肾组织中炎症因子(IL-1β、IL-6、TNF-α)含量。
1.2.4 肾组织病理学改变、纤维化及细胞凋亡状况检查取左侧肾脏,经脱水浸蜡处理后制备4 μm厚度切片(RM 2264型切片机,德国Leica公司),脱蜡水化处理后,分别按照试剂盒操作说明。1)HE染色,400倍显微镜(BX53型,日本Olympus公司)下观察肾组织病理改变,进行损伤评分[16]:无病变及轻微、轻度、中度、重度病变分别记为0、0.5、1、2、3分;2)Masson染色,400倍显微镜下观察肾组织纤维化状况,通过Image J软件计算胶原容积分数(CVF,蓝色胶原着色面积占视野面积的百分比);3)TUNEL染色,400倍显微镜下观察肾细胞凋亡状况,每张切片随机取5个视野,计数视野内凋亡细胞数和细胞总数,计算凋亡指数(AI,凋亡细胞数占细胞总数的百分比)。
1.2.5 肾组织TLR4、NF-κB p65 mRNA表达检测取100 mg右侧肾脏组织,TRIzol法提取总RNA,逆转录生成cDNA,然后以cDNA作为模板行PCR扩增(ABI7500型RT-PCR仪,美国热电公司):95 ℃预变性5 min,60 ℃退火40 s、72 ℃延伸20 s,共循环40次。PCR引物由北京Servicebio公司合成,序列见表 1。
取100 mg右侧肾脏组织,RIPA法提取总蛋白,BCA法测定总蛋白浓度后沸水浴变性,10%凝胶电泳(28D型电泳仪,北京六一仪器厂)分离蛋白(浓缩胶80 V、30 min,分离胶120 V、60 min)、湿法转膜(Mini Trans-blot型转膜仪,美国Bio-Rad公司,320 mA、120 min)、山羊血清室温封闭60 min后,加一抗TLR4(1∶1 500稀释)、NF-κB p65(1∶1 500稀释)、Bcl-2(1∶1 000稀释)、Bax(1∶1 000稀释)、Caspase-3(1∶1 500稀释)、Cleaved Caspase-3(1∶1 000稀释)、GAPDH(1∶3 000稀释)4 ℃孵育过夜,加二抗(1∶5 000稀释)37 ℃孵育60 min,洗膜后加ECL显色,通过Image J软件计算条带灰度值,与内参GAPDH条带灰度的比值做为目标蛋白半定量结果。
1.3 统计学方法运用SPSS 20.0软件进行数据统计分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验(方差齐)或Dunnett’s T3检验(方差不齐),P<0.05表示差异有统计学意义。
2 结果 2.1 ASI对DKD小鼠FBG水平和肾功能指标的影响与正常对照组相比,模型组小鼠FBG、24 h UTP、UA、BUN、Scr均显著升高(P<0.05)。与模型组相比,ASI组和ASI+TAK-242组FBG、24 h UTP、UA、BUN、Scr显著降低(P<0.05);ASI+LPS组FBG、24 h UTP、Scr显著降低(P<0.05),UA、BUN差异无统计学意义(P>0.05)。与ASI组相比,ASI+TAK-242组FBG、24 h UTP、UA、BUN、Scr显著降低,ASI+LPS组FBG、24 h UTP、UA、BUN、Scr显著升高(P<0.05)。见表 2。
|
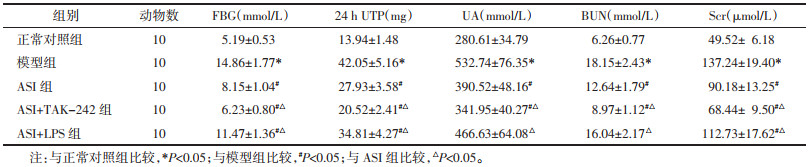
与正常对照组相比,模型组小鼠体质量显著降低,肾脏质量、肾脏系数显著升高(P<0.05)。与模型组相比,ASI组和ASI+TAK-242组体质量显著升高,肾脏质量、肾脏系数显著降低(P<0.05);ASI+LPS组肾脏系数显著降低(P<0.05),体质量、肾脏质量差异无统计学意义(P>0.05)。与ASI组相比,ASI+TAK-242组体质量显著升高,肾脏质量、肾脏系数显著降低(P<0.05);ASI+LPS组体质量显著降低,肾脏质量、肾脏系数显著升高(P<0.05)。见表 3。
|
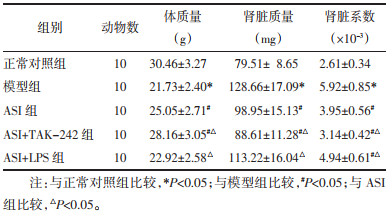
与正常对照组相比,模型组小鼠肾组织IL-1β、IL-6、TNF-α含量显著升高(P<0.05)。与模型组相比,ASI组和ASI+TAK-242组IL-1β、IL-6、TNF-α含量显著降低(P<0.05);ASI+LPS组IL-1β含量显著降低(P<0.05),IL-6、TNF-α含量差异无统计学意义(P>0.05)。与ASI组相比,ASI+TAK-242组IL-1β、IL-6、TNF-α含量显著降低(P<0.05);ASI+LPS组IL-1β、IL-6、TNF-α含量显著升高(P<0.05)。见表 4。
|
正常对照组小鼠肾小球、肾小管等形态正常,结构完整,基底膜和系膜未见增生或扩张。模型组可见肾单元结构紊乱,肾小球肥大,肾小管细胞肿胀或空泡样变,肾间质大量炎性细胞浸润,基底膜增生,系膜扩张等病理改变。与模型组相比,ASI组和ASI+TAK-242组肾组织病变明显改善。与ASI组相比,ASI+TAK-242组肾组织病变明显改善,ASI+LPS组肾组织病变明显加重。肾损伤评分:与正常对照组相比,模型组小鼠损伤评分显著升高(P<0.05);与模型组相比,ASI组和ASI+TAK-242组损伤评分显著降低(P<0.05),ASI+LPS组损伤评分差异无统计学意义(P>0.05);与ASI组相比,ASI+TAK-242组损伤评分显著降低,ASI+LPS组损伤评分显著升高(P<0.05)。见图 1、表 5。
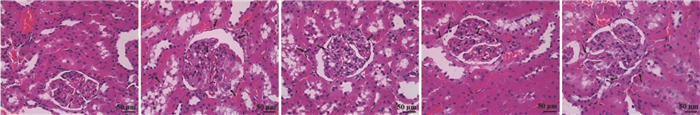
|
| 图 1 ASI对DKD小鼠肾组织病理改变的影响(HE染色,×400) Fig. 1 Effect of ASI on pathological changes of renal tissue in DKD mice(HE staining, ×400) |
|
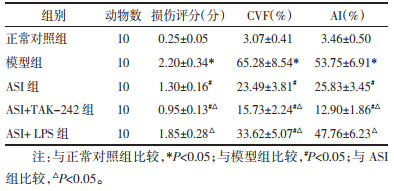
正常对照组小鼠肾间质、肾小球等部位可见少量、丝状、均匀分布的胶原纤维。模型组肾间质区可见大量胶原沉积、呈片状,肾小球和肾小管等部位胶原沉积量也明显增多。与模型组相比,ASI组和ASI+TAK-242组肾纤维化状况明显改善。与ASI组相比,ASI+TAK-242组纤维化状况明显改善,ASI+LPS组纤维化状况明显加重。肾组织CVF结果:与正常对照组相比,模型组CVF显著升高(P<0.05);与模型组相比,ASI组、ASI+TAK-242组和ASI+LPS组CVF显著降低(P<0.05);与ASI组相比,ASI+TAK-242组CVF显著降低,ASI+LPS组CVF显著升高(P<0.05)。见图 2、表 5。

|
| 图 2 ASI对DKD小鼠肾组织肾纤维化的影响(Masson染色,×400) Fig. 2 Effect of ASI on renal fibrosis in renal tissue of DKD mice(Masson staining, ×400) |
与正常对照组相比,模型组肾细胞AI显著升高(P<0.05)。与模型组相比,ASI组和ASI+TAK-242组AI显著降低(P<0.05);ASI+LPS组AI差异无统计学意义(P>0.05)。与ASI组相比,ASI+TAK-242组AI显著降低,ASI+LPS组AI显著升高(P<0.05)。见图 3、表 5。
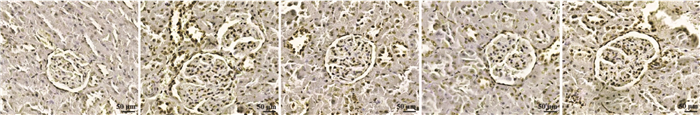
|
| 图 3 ASI对DKD小鼠肾细胞凋亡的影响(TUNEL染色,×400) Fig. 3 Effect of ASI on apoptosis of renal cells in DKD mice(TUNEL staining, ×400) |
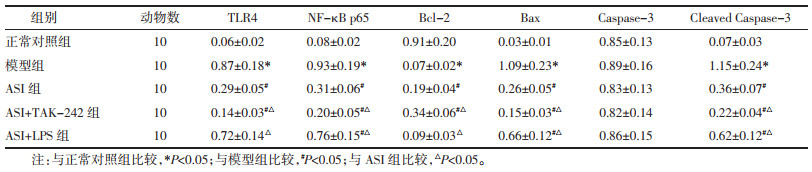
与正常对照组相比,模型组肾组织TLR4、NF-κB p65 mRNA表达显著升高(P<0.05)。与模型组相比,ASI组和ASI+TAK-242组肾组织TLR4、NF-κB p65 mRNA表达显著降低(P<0.05);ASI+LPS组NF-κB p65 mRNA表达显著降低(P<0.05),TLR4 mRNA表达差异无统计学意义(P>0.05)。与ASI组相比,ASI+TAK-242组肾组织TLR4、NF-κB p65 mRNA表达显著降低,ASI+LPS组肾组织TLR4、NF-κB p65 mRNA表达显著升高(P<0.05)。见表 6。
|
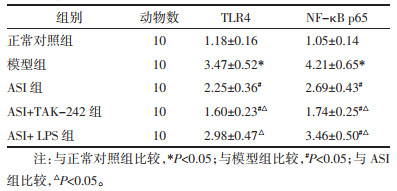
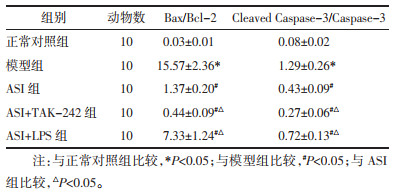
与正常对照组相比,模型组肾组织TLR4、NF-κB p65蛋白表达和Bax/Bcl-2、Cleaved Caspase-3/Caspase-3蛋白表达比值显著升高(P<0.05)。与模型组相比,ASI组和ASI+TAK-242组TLR4、NF-κB p65蛋白表达和Bax/Bcl-2、Cleaved Caspase-3/Caspase-3蛋白表达比值显著降低(P<0.05);ASI+LPS组NF-κB p65蛋白表达和Bax/Bcl-2、Cleaved Caspase-3/Caspase-3蛋白表达比值显著降低(P<0.05),TLR4蛋白表达差异无统计学意义(P>0.05)。与ASI组相比,ASI+TAK-242组TLR4、NF-κB p65蛋白表达和Bax/Bcl-2、Cleaved Caspase-3/Caspase-3蛋白表达比值显著降低,ASI+LPS组TLR4、NF-κB p65蛋白表达和Bax/Bcl-2、Cleaved Caspase-3/Caspase-3蛋白表达比值显著升高(P<0.05)。见图 4、表 7、表 8。
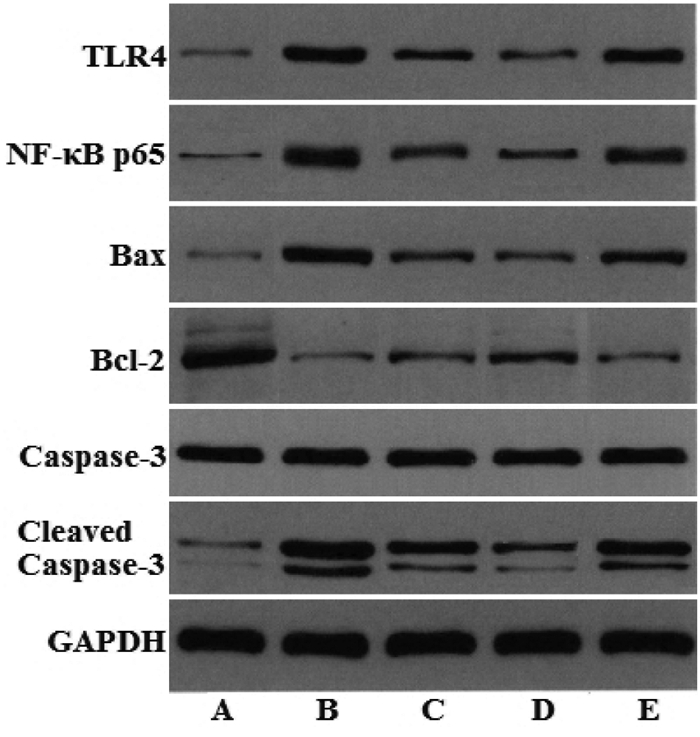
|
| 注:A,正常对照组;B,模型组;C,ASI组;D,ASI+TAK-242组;E,ASI+LPS组。 图 4 ASI对DKD小鼠肾组织TLR4、NF-κB p65、Bcl-2、Bax、Caspase-3、Cleaved Caspase-3蛋白表达的影响 Fig. 4 Effect of ASI on the expression of TLR4, NF-κB p65, Bcl-2, Bax, Caspase-3, Cleaved Caspase-3 proteins in renal tissue of DKD mice |
|
|
中医药具有自己独特的理论体系,以辨证论治、整体调治为基本理念,在慢性病防治方面具有独到的优势。DKD在中医学中没有对应的病名,据中医古籍记载及其症状可归属“肾劳”“下消”“水肿”等范畴,其主要病机在于“脾肾亏虚、气阴两虚、痰湿血瘀”,当以补肾健脾、益气养阴、活血化瘀为基本疗法。刺五加(又名坎拐棒子、老虎潦、一百针)属于五加科灌木植物,取其干燥根茎入药,性温味辛,归脾、肾、心经,具有益气健脾、补肾安神等功效。ASI是以中药刺五加提取物作为有效成分的一种已上市的中药注射剂。本研究发现,DKD小鼠肾功能监测指标24 h UTP、UA、BUN、Scr及肾脏质量、肾脏系数明显升高,肾组织呈现肾单元结构紊乱、肾小球肥大、肾小管细胞肿胀或空泡样变、炎性细胞浸润、基底膜增生、系膜扩张以及肾间质、肾小球纤维化等病理学改变,与任宇晴等[15]和刘五梅等[18]报道一致。但有部分文献[19-21]报道DKD小鼠肾小球萎缩,这可能与造模方法不同以及疾病严重程度存在差异有关。经ASI治疗可改善DKD小鼠肾功能、降低肾脏质量和肾脏系数,减轻肾组织病变及肾纤维化、显著降低肾损伤评分和CVF,说明ASI具有减轻DKD小鼠肾损伤并改善其肾功能的作用。
越来越多的研究表明炎症反应和细胞凋亡是促进DKD进展的关键因素。持续高血糖将破坏肾小管、肾小球上皮细胞结构,刺激巨噬细胞等向肾小管、肾小球上皮聚集并释放IL-1β、IL-6、TNF-α等炎性因子,促进炎症细胞浸润,导致炎症损伤[22]。Rayego-Mateos等[23]报道DKD所致肾脏肥大、滤过率升高等病变与炎症反应密切相关。持续高糖可诱导肾细胞凋亡,可能与脂肪酸聚集、炎症反应、氧化应激等因素有关[24]。Bcl-2家族蛋白通过调节线粒体膜通透性影响细胞凋亡,其中Bax能够改变线粒体膜电位、上调膜孔道通透性而使细胞色素C(Cyt C)异常释放进入细胞质,Cyt C可剪切活化Caspase-3而触发细胞凋亡;Bcl-2蛋白与Bax具有氨基酸同源性,Bcl-2与Bax能够结合形成无活性的异型二聚体,当Bax过表达时可形成同型二聚体而促进细胞凋亡[25]。Yang等[26]报道通过抑制炎症和细胞凋亡可有效减轻DKD大鼠肾损伤。ASI具有良好的抗炎和抗凋亡活性,本研究发现,经ASI治疗可降低DKD小鼠肾组织IL-1β、IL-6、TNF-α含量和肾细胞凋亡率,降低Bax/Bcl-2、Cleaved Caspase-3/Caspase-3蛋白表达比值,说明ASI具有抑制DKD小鼠炎症反应和肾细胞凋亡的作用。
TLR4是高度保守的跨膜分子识别受体TLRs家族成员之一,在机体各类细胞中广泛存在,在先天性免疫应答反应中发挥着关键作用。TLR4由胞外结构域、跨膜结构域和胞内结构域3部分组成,LPS等病原分子可以识别并结合胞外结构域,通过跨膜结构域将信号传递至细胞内,进而促进下游蛋白NF-κB表达与活化,NF-κB核转位后p65亚基与p65亚基N端Rel同源区与DNA特定位点结合,诱导IL-6、TNF-α等促炎因子转录表达,从而加重炎症损伤[27]。并且,NF-κB p65核转位后可上调Bax表达并下调Bcl-2表达,从而表现出促凋亡作用[28]。Qi等[29]报道高糖持续刺激可上调TLR4表达,诱导肾小球上皮细胞NF-κB活化而促进IL-6、TNF-α等炎症因子分泌。Jialal等[30]研究发现,敲除TLR4基因的DKD模型小鼠炎症反应和肾小管、肾小球上皮细胞损伤明显减轻。研究结果显示,经ASI治疗可显著降低DKD小鼠肾组织TLR4、NF-κB p65 mRNA和蛋白表达,显著降低Bax/Bcl-2、Cleaved Caspase-3/Caspase-3蛋白表达比值,说明ASI对DKD小鼠炎症反应和细胞凋亡的抑制作用可能与其下调TLR4/NF-κB信号通路有关。为了进一步阐明上述机制,该实验设置了ASI+TAK-242组和ASI+LPS组,结果显示,TAK-242能够明显增强ASI对DKD小鼠FBG、肾功能、体质量、肾脏系数、肾组织病变、纤维化、肾细胞凋亡及TLR4/NF-κB信号通路相关mRNA和蛋白表达的作用;LPS则明显逆转ASI对DKD小鼠的上述作用。从而进一步明确了ASI对DKD小鼠炎症和肾细胞凋亡的抑制作用与其下调TLR4/NF-κB信号通路有关。
综上所述,ASI具有减轻DKD小鼠肾损伤并改善其肾功能的作用,其机制可能与下调TLR4/NF-κB信号通路,进而抑制炎症、肾纤维化及细胞凋亡有关。肾纤维化是DKD关键病理机制之一,但是ASI对DKD肾纤维化的作用机制尚未明确,需进一步研究。
| [1] |
LIU H H, WANG J, YUE G R, et al. Placenta-derived mesenchymal stem cells protect against diabetic kidney disease by upregulating autophagy-mediated SIRT1/FOXO1 pathway[J]. Renal Failure, 2024, 46(1): 2303396. DOI:10.1080/0886022X.2024.2303396 |
| [2] |
RABIEENIA E, JALALI R, MOHAMMADI M. Prevalence of nephropathy in patients with type 2 diabetes in Iran: A systematic review and meta-analysis based on geographic information system(GIS)[J]. Diabetes & Metabolic Syndrome, 2020, 14(5): 1543-1550. |
| [3] |
SAPIAN S, BUDIN S B, TAIB I S, et al. Role of polyphenol in regulating oxidative stress, inflammation, fibrosis, and apoptosis in diabetic nephropathy[J]. Endocrine, Metabolic & Immune Disorders Drug Targets, 2022, 22(5): 453-470. |
| [4] |
JIANG W J, XU C T, DU C L, et al. Tubular epithelial cell-to-macrophage communication forms a negative feedback loop via extracellular vesicle transfer to promote renal inflammation and apoptosis in diabetic nephropathy[J]. Theranostics, 2022, 12(1): 324-339. DOI:10.7150/thno.63735 |
| [5] |
WANG J X, XU G W, JIN H, et al. Ulinastatin alleviates rhabdomyolysis-induced acute kidney injury by suppressing inflammation and apoptosis via inhibiting TLR4/NF-κB signaling pathway[J]. Inflammation, 2022, 45(5): 2052-2065. DOI:10.1007/s10753-022-01675-4 |
| [6] |
TAO D D, LI Y, TIAN X J, et al. Effect of FoxO1 on cardiomyocyte apoptosis and inflammation in viral myocarditis via modultion of the TLR4/NF-κB signaling pathway[J]. International Heart Journal, 2023, 64(4): 732-740. DOI:10.1536/ihj.22-627 |
| [7] |
ZHU L P, HAN J K, YUAN R R, et al. Berberine ameliorates diabetic nephropathy by inhibiting TLR4/NF-κB pathway[J]. Biological Research, 2018, 51(1): 9. DOI:10.1186/s40659-018-0157-8 |
| [8] |
GUO M F, GAO J R, JIANG L, et al. Astragalus polysaccharide ameliorates renal inflammatory responses in a diabetic nephropathy by suppressing the TLR4/NF-κB pathway[J]. Drug Design, Development and Therapy, 2023, 17: 2107-2118. DOI:10.2147/DDDT.S411211 |
| [9] |
ZHOU Y, MA X Y, HAN J Y, et al. Metformin regulates inflammation and fibrosis in diabetic kidney disease through TNC/TLR4/NF-κB/miR-155-5p inflammatory loop[J]. World Journal of Diabetes, 2021, 12(1): 19-46. DOI:10.4239/wjd.v12.i1.19 |
| [10] |
李强, 靳书滨, 霍韶军. 刺五加注射液通过TLR4/NF-KB通路抑制肾缺血再灌注大鼠炎症反应的研究[J]. 解剖科学进展, 2023, 29(4): 386-390. |
| [11] |
冯玲玲, 陈树杰, 车炜. 刺五加注射液对急性心肌梗死后心力衰竭大鼠心肌保护作用的研究[J]. 天津中医药, 2023, 40(12): 1587-1594. DOI:10.11656/j.issn.1672-1519.2023.12.15 |
| [12] |
李国峰, 陈金秀. 刺五加注射液对糖尿病大鼠血管内皮的保护作用[J]. 中国老年学杂志, 2014, 34(15): 4259-4260. DOI:10.3969/j.issn.1005-9202.2014.15.070 |
| [13] |
常晋霞, 刘文虎, 张建武. 刺五加提取物治疗糖尿病小鼠血清UPLC-MS/MS代谢组学研究[J]. 国际药学研究杂志, 2017, 44(7): 730-737. |
| [14] |
SHEN Q, QI S M, ZHANG J T, et al. Platycodin D inhibits HFD/STZ-induced diabetic nephropathy via inflammatory and apoptotic signaling pathways in C57BL/6 mice[J]. Journal of Ethnopharmacology, 2023, 314: 116596. DOI:10.1016/j.jep.2023.116596 |
| [15] |
任宇晴, 唐堂, 李颖, 等. 降糖丸抑制TGF-β1改善糖尿病肾病小鼠肾损伤及纤维化[J]. 中国药理学通报, 2023, 39(10): 1988-1993. DOI:10.12360/CPB202210026 |
| [16] |
方晶晶, 陶静, 黄钦, 等. 脓毒症中血小板活化对肾小管上皮影响的机制研究[J]. 中国临床药理学与治疗学, 2018, 23(3): 283-289. |
| [17] |
李元耀, 王圣钊, 张靖豪, 等. Sirt1在急性炎症状态下糖尿病小鼠肾损伤中的作用[J]. 临床麻醉学杂志, 2023, 39(12): 1297-1304. DOI:10.12089/jca.2023.12.012 |
| [18] |
刘五梅, 刘永飞, 彭林, 等. 紫丹酸B对糖尿病肾病模型小鼠糖代谢和肾功能的改善作用及机制[J]. 中国药房, 2023, 34(23): 2855-2860. DOI:10.6039/j.issn.1001-0408.2023.23.07 |
| [19] |
陈璟, 杨小艺, 陈静, 等. 银杏叶提取物对糖尿病肾病模型小鼠肾脏炎症的抑制作用及机制[J]. 中国药房, 2024, 35(2): 186-191. |
| [20] |
王江侠, 杨丽霞, 米登海, 等. 当归多糖对糖尿病肾病KK-Ay小鼠肾脏AMPK信号通路及线粒体自噬的影响[J]. 中草药, 2023, 54(10): 3189-3196. |
| [21] |
苏蓓蓓, 杨丽霞, 梁永林, 等. 大黄糖络丸通过AMPK/mTOR/ULK1通路调控糖尿病肾病小鼠足细胞自噬的作用机制研究[J]. 中国临床药理学与治疗学, 2024, 29(3): 260-269. |
| [22] |
RAYEGO-MATEOS S, RODRIGUES-DIEZ R R, FERNANDEZ-FERNANDEZ B, et al. Targeting inflammation to treat diabetic kidney disease: The Road to 2030[J]. Kidney International, 2023, 103(2): 282-296. |
| [23] |
RAYEGO-MATEOS S, MORGADO-PASCUAL J L, OPAZO-RÍOS L, et al. Pathogenic pathways and therapeutic approaches targeting inflammation in diabetic nephropathy[J]. International Journal of Molecular Sciences, 2020, 21(11): 3798. |
| [24] |
GAO J W, LIU P, SHEN Z R, et al. Morroniside promotes PGC-1α-mediated cholesterol efflux in sodium palmitate or high glucose-induced mouse renal tubular epithelial cells[J]. BioMed Research International, 2021, 2021(1): 9942152. |
| [25] |
MOHANY M, AHMED M M, AL-REJAIE S S. The role of NF-κB and bax/bcl-2/caspase-3 signaling pathways in the protective effects of sacubitril/valsartan(entresto) against HFD/STZ-induced diabetic kidney disease[J]. Biomedicines, 2022, 10(11): 2863. |
| [26] |
YANG F, ZHANG Z, ZHANG L. Bisacurone attenuates diabetic nephropathy by ameliorating oxidative stress, inflammation and apoptosis in rats[J]. Human & Experimental Toxicology, 2022, 41: 9603 271221143713. |
| [27] |
闫文, 屈杰, 陈丽名, 等. 中药基于TLR4/NF-κB信号通路干预糖尿病肾病炎症反应的研究进展[J]. 现代中西医结合杂志, 2023, 32(22): 3186-3190. |
| [28] |
ZHANG D, JING B, CHEN Z N, et al. Ferulic acid alleviates sciatica by inhibiting neuroinflammation and promoting nerve repair via the TLR4/NF-κB pathway[J]. CNS Neuroscience & Therapeutics, 2023, 29(4): 1000-1011. |
| [29] |
QI M Y, HE Y H, CHENG Y, et al. Icariin ameliorates streptozocin-induced diabetic nephropathy through suppressing the TLR4/NF-κB signal pathway[J]. Food & Function, 2021, 12(3): 1241-1251. |
| [30] |
JIALAL I, MAJOR A M, DEVARAJ S. Global toll-like receptor 4 knockout results in decreased renal inflammation, fibrosis and podocytopathy[J]. Journal of Diabetes and Its Complications, 2014, 28(6): 755-761. |
 2025, Vol. 42
2025, Vol. 42