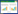文章信息
- 舒容丽, 龚博炀, 李兆栋, 等.
- SHU Rongli, GONG Boyang, LI Zhaodong, et al.
- 基于网络药理学和体外实验验证探讨八子补肾胶囊延缓年龄相关黄斑变性的作用机制
- Exploring the mechanism of Bazi Bushen Capsule in delaying age-related macular degeneration based on network pharmacology and in vitro experimental validation
- 天津中医药, 2025, 42(1): 108-117
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(1): 108-117
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.01.19
-
文章历史
- 收稿日期: 2024-08-28
2. 新疆医科大学第一临床医学院, 乌鲁木齐 830011;
3. 黑龙江中医药大学基础医学院, 哈尔滨 150040;
4. 河北医科大学, 石家庄 050011
年龄相关性黄斑变性(AMD)的主要病理特征是外屏障结构被破坏以及视网膜中黄斑区域的特殊神经上皮细胞丧失,致使视力不可逆下降及视物不直的退行性视网膜病变,是眼科疾病中引起视功能缺陷的主因之一[1]。全球人口中AMD的患病率为6.6%,中国总发病率约7.53%~13.27%,预计至2050年将突破4.98亿[2-3],并且随着人口增长和老龄化,这一数字在未来可能会持续上升。AMD作为一种多因素致盲疾病,其确切的病因目前尚未被完全揭示[4]。视网膜色素上皮(RPE)处于神经视网膜、脉络膜之间,其病变可引起AMD等视网膜病变,通过干预RPE细胞的衰老进程改善AMD的治疗策略已成为当下研究热点[5]。
基础实验及临床实践表明,中医药可显著改善AMD疾病进展,然而,中医药治疗AMD的作用靶点目前尚不明确[6]。八子补肾胶囊(BZBS)作为抗衰老代表性中成药,结合了传统中医理论与现代科学研究,对衰老相关疾病展现出了良好的改善作用[7]。研究团队前期实验初步证实BZBS可以改善衰老小鼠视网膜结构的紊乱[8],然而BZBS治疗AMD的具体作用机制尚不明确。网络药理学基于系统生物学的理论,整合多种数据,将药物、疾病和作用靶点之间的复杂关系进行网络化分析。因此,本研究从网络药理学出发,构建“中药-疾病-关键靶点”网络,预测BZBS治疗AMD的潜在作用靶点及通路;同时通过体外实验验证BZBS改善AMD作用靶点,为明确其作用机制提供实验依据。
1 材料与方法 1.1 网络药理学分析BZBS改善AMD的作用机制 1.1.1 数据库与软件中药系统药理分析平台(TCMSP):https://old.tcmsp-e.com/tcmsp.php、GeneCard数据库:https://www.genecards.org/、TTD数据库:https://db.idrblab.net/ttd/、DRUGBANK数据库:https://GO.drugbank.com/、Venny2.1.0:https://bioinfogp.cnb.csic.es/tools/venny/、Uniprot数据库:https://www.uniprot.org/、STRING平台:https://string-db.org、DAVID数据库:https://david.ncifcrf.GOv/;Cytoscape3.7.2软件、Rx643.6.3软件、PERL软件。
1.1.2 BZBS活性成分及其作用靶点收集运用中药系统药理分析平台数据库(TCMSP)[9]的ADME值作为筛选标准,即口服生物利用度(OB)≥30%,类药性(DL)≥0.18[10],筛选BZBS的活性成分及其作用靶点。
1.1.3 BZBS治疗AMD作用靶点获取与筛选在GeneCards数据库、TTD数据库、Drug-bank数据库以“age-related macular degeneration” “AMD”为关键词进行检索,限定Scroe≥10,去重后得到AMD相关疾病靶点,随后通过Uniprot数据库进行蛋白质靶点信息标准化,并获取BZBS干预AMD的作用靶点(即BZBS成分对应靶点与疾病对应靶点的交集靶点)。
1.1.4 “中药-疾病-关键靶点”网络构建为明确BZBS干预AMD主要活性成分以及作用靶点,通过Cytoscape3.7.2软件,以BZBS的活性成分以及交集靶点为出发点,构建“中药-疾病-关键靶点”可视化网络并进行拓扑分析。网络图由“节点”表示的化合物和靶点以及由“边”表示的相互作用所构成。
1.1.5 蛋白质相互作用(PPI)将BZBS干预AMD的作用靶点导入STRING平台,将物种设定为“Homo sapiens”,以置信度分数score>0.9为条件进行筛选,进行构建PPI可视化网络,分析靶点之间的互作关系。
1.1.6 基因功能注释(GO)和京都基因组百科全书(KEGG)通路分析使用DAVID数据库的“Functional Annotation Tool”板块在线分析,设定阈值为P<0.05,物种为Homo Sapiens作为筛选条件,进行富集分析;以P<0.05和FDR<0.05为标准筛排序筛选,并对富集的通路和GO功能排序,利用R软件将富集结果可视化处理,得出共同靶点的GO和KEGG通路富集分析。
1.2 体外实验验证 1.2.1 药物BZBS由五味子、菟丝子、蛇床子、金樱子、枸杞子、覆盆子、韭菜子、川牛膝、淫羊藿、巴戟天、肉苁蓉、川楝子、地黄、人参、鹿茸、海马组成,并由石家庄以岭药业有限公司(批号:A2102001,中国石家庄)根据国家医药产品管理局批准的标准程序(编号:B20020585)提供。根据文献[11]由天津中医药大学中药学院制备BZBS冻干粉。
1.2.2 细胞、主要试剂与仪器人视网膜色素上皮细胞系(ARPE-19)购买于赛业(广州)生物科技有限公司。细胞周期检测试剂盒(C6078)、Cell Counting Kit-8细胞增殖检测试剂盒(C6005)购自苏州优逸蓝迪生物科技有限公司(中国苏州)。活性氧检测试剂盒(S0033)、细胞衰老β-半乳糖苷酶染色试剂盒(C0602)购自上海碧云天生物技术有限公司(中国上海)。小鼠白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)酶联免疫分析试剂盒购自武汉基因美生物科技有限公司(中国武汉)。兔GAPDH单克隆抗体ab181602和山羊抗兔免疫球蛋白IgG H&Lab150080购自Abcam Co.,Ltd(英国剑桥)。兔LC3Ⅰ/Ⅱ单克隆抗体#12741、兔SQSTM1/p62单克隆抗体#23214购自Cell Signaling Technology(MA,美国)。
台式4 ℃冷冻离心机(ThermoFisher公司)、水浴箱(上海培因实验仪器有限公司)、研究级倒置荧光显微镜(Olympus公司)、-80 ℃超低温冰箱(ThermoFisher公司)、超纯水机(MILLIPORE公司)、移液器(德国Eppendorf)、酶标仪(ThermoFisher公司)、恒温空气摇床(常州兆圣实验设备有限公司)。
1.2.3 细胞培养与分组将ARPE-19细胞用含有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM/F12培养基于37 ℃、5%CO2培养箱中培养,隔天更换1次培养液,2~3 d传代1次。
首先按照文献[12]的诱导方法,采用不同浓度D-gal(2.5、5、10、20、40、80 g/L)处理细胞24 h。通过CCK-8法以及SA-β-gal染色,筛选合适的D-gal浓度进行细胞衰老模型构建。随后根据研究团队前期资料并结合文献报道[11],使用不同浓度BZBS(2.5、5、10、20、40、80、160、320、640 μg/mL)处理细胞24 h和48 h,使用CCK-8检测细胞增殖情况,以选择BZBS合适浓度及处理时间进行后续实验。
将细胞分为Normol组(正常组,正常培养)、D-gal组(D-gal干预培养24 h+正常培基培养48 h)、BZBS组(D-gal干预培养24 h+BZBS培基培养48 h),观察各组细胞衰老情况。
1.2.4 CCK-8法检测细胞活力情况将处于对数期生长期的ARPE-19细胞以2.5×104个/mL接种于96孔板中培养,每孔200 μL。待细胞贴壁后,用不同浓度BZBS与D-gal进行培养24、48 h[在细胞孔周围孔内加入200 μL磷酸盐缓冲溶液(PBS)],培养结束后每孔加入10 μL CCK-8检测细胞活力。
1.2.5 SA-β-gal染色法检测细胞衰老将处于对数期生长期的ARPE-19细胞以2×105个/mL接种于6孔板中培养,待细胞贴壁后,按1.2.3分组进行培养,实验结束后,丢弃培养基,用1mLPBS清洗1~2次,并吸净PBS。每孔加入1 mLSA-β-gal染色固定液,在室温下固定10 min,PBS清洗5次;随后每孔加入1 mL染色工作液,用保鲜膜封住以防止液体挥发,37 ℃避光孵育过夜。次日除去染色工作液,加入1 mL PBS,于显微镜下观察并拍照,使用Image J软件对蓝色染色区域进行定量分析。
1.2.6 DCFH-DA法检测活性氧ROS根据ROS检测试剂盒说明书,将DCFH-DA探针装载至细胞内,使用无血清培基培基按照1∶1 000稀释DCFH-DA,使其终浓度为10 μmol/L。每孔加入1 mL染液,在37 ℃细胞培养箱中孵育20 min后,使用无血清培基洗涤细胞3次,最后用荧光显微镜观察并拍照。
1.2.7 流式细胞仪检测细胞周期胰酶消化后离心收集细胞沉淀,调整密度为1×106个/mL,加入4 ℃预冷乙醇1 mL,于4 ℃冰箱固定过夜。次日以1 000 r/min离心5 min收集细胞,离心半径为11 cm,弃上清,每组加RNaseA 100 μL重悬细胞,并置于37 ℃下水浴30 min,随后加入碘化丙啶400 μL吹打混匀,于4 ℃下避光孵育30 min,最后使用流式细胞仪上机进行细胞周期分析。
1.2.8 酶联免疫吸附实验(ELISA)法检测促炎细胞因子采用ELISA试剂盒检测上清液中IL-6、IL-1β和TNF-α细胞因子的含量,具体操作参照产品说明书。
1.2.9 蛋白免疫印迹法(Western blot)检测P62、LC3收集各组细胞,用预冷的PBS洗涤后加入配制好的裂解液(PMSF:RIPA=1∶100)100 μL,置于冰上充分裂解30 min,随后离心收集蛋白液上清,使用BCA蛋白质定量试剂盒测定样品蛋白质浓度并进行定量;利用SDS-聚丙烯酰胺凝胶电泳分离蛋白,采用湿转1 h的方法将蛋白转移至PVDF膜上,快速封闭液封闭15 min,取出膜,进行一抗孵育,放置于4 ℃冰箱过夜。之后用HRP标记的二抗,室温孵育60 min后TBST清洗。加入化学发光试剂,曝光显影,Image J软件进行灰度值转换。
1.2.10 统计学方法采用SPSS 22.0和GraphPad Prism8.0统计学软件进行分析并作图。对处理后的百分比进行方差分析,实验数据以均数±标准差(x±s)表示,P<0.05为差异具有统计学意义。
2 结果 2.1 网络药理学研究结果 2.1.1 BZBS活性成分及作用靶点筛选运用中药系统药理分析平台数据库ADME筛选,得到BZBS活性成分463个,去重之后得到BZBS潜在作用靶点293个,结果见表 1。
|
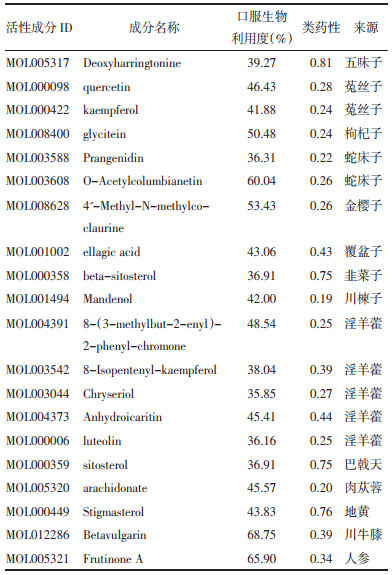
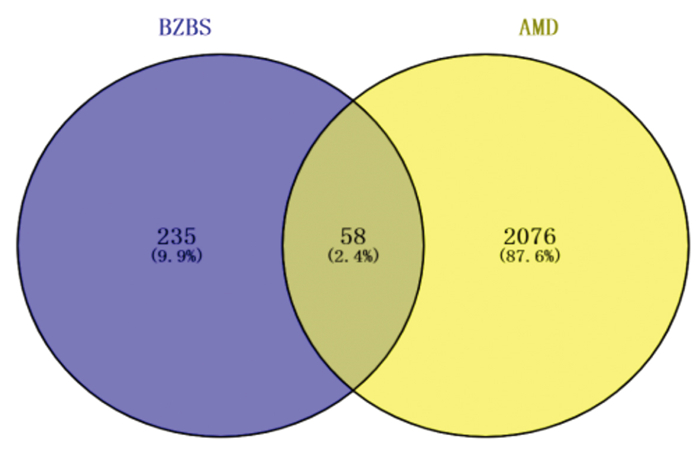
通过GeneCards、TTD、Drug-bank数据库去重后得到AMD的靶点2 134个,与BZBS潜在作用靶点293个取交集,得BZBS治疗AMD的作用靶点58个,见图 1。采用Cytoscape软件构建“中药-疾病-关键靶点”网络,结果见图 2。图中每个成分和靶点都代表一个节点,按度值节点由大到小排列,前3位蛋白靶点为:表皮生长因子受体(EGFR)、IL-6、雌激素受体(ESR1),可能为BZBS干预AMD的关键靶点;BZBS前4位活性成分为槲皮素、远志酮A、豆甾醇、花生四烯酸,见图 2。
|
| 图 1 药物-疾病靶点韦恩图 Fig. 1 Venn diagram of drug-disease target |
|
| 图 2 “中药-疾病-关键靶点”网络图 Fig. 2 Network diagram of"TCM-disease-key targets" |
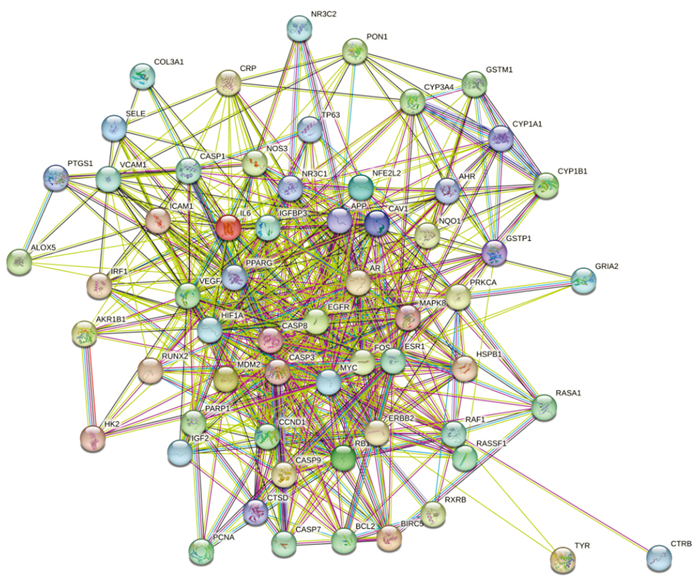
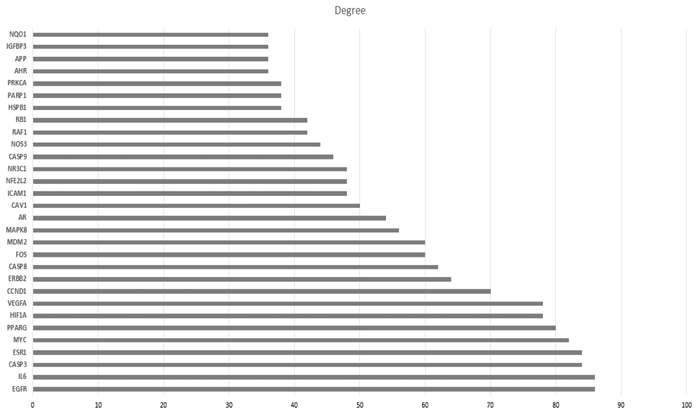
利用STRING数据库中构建BZBS-AMD共同靶点的PPI网络图,将“tsv”文件导入Cytoscape 3.9.2软件中,对所获取的靶蛋白互作数据进行可视化,见图 3。使用R软件统计预测出的BZBS治疗AMD的关键蛋白,见图 4。结果显示,NR3C2、PTGS1、AKR1B1、CTRB1、BCL2、CASP9、CASP3、CASP8度值较高,提示可能是在BZBS治疗AMD中发挥重要作用的核心靶点。
|
| 图 3 BZBS-AMD交集靶点互作网络图 Fig. 3 BZBS-AMD intersection target interaction network diagram |
|
| 图 4 BZBS-AMD关键蛋白统计图 Fig. 4 Statistical chart of BZBS-AMD key proteins |
GO富集分析得到条目共1 211个。其中GO分类确定了849个生物过程、127个细胞成分、23个分子功能。GO功能分析结果预测,关键靶点主要涉及DNA结合转录因子结合、转录协同调节因子结合、氧化还原的调控等,可视化结果见开放科学标识码(OSID)。
KEGG富集到115条相关信号通路,将排名前20的信号通路可视化呈现,主要包括高级糖基化终末产物-受体信号通路、缺氧诱导因子-α(HIF-α)信号通路、自噬信号通路等。提示BZBS可通过多种信号通路对AMD发挥治疗作用,富集分析结果见开放科学标识码(OSID)。
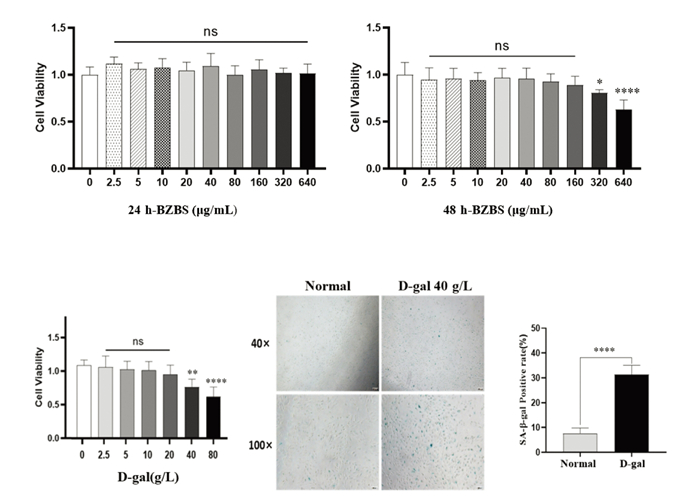
2.2 细胞实验验证 2.2.1 BZBS浓度筛选及D-gal诱导建立衰老模型如图 5A所示,BZBS浓度为2.5、5、10、20、40、80、160、320、640 μg/mL分别干预正常ARPE-19细胞24 h和48 h。实验结果表明BZBS干预24 h后,与正常组相比,不同剂量处理后ARPE-19细胞活性无统计学意义(P>0.05);而BZBS干预48 h后,320 μg/mL和640 μg/mL剂量处理下ARPE-19细胞活力相比于正常组显著下降(P<0.05或P<0.000 1)。实验结果表明BZBS干预ARPE-19细胞48 h且剂量大于160 μg/mL时开始有细胞毒性。考虑药物安全性问题,选择剂量<160 μg/mL的BZBS干预48 h进行后续实验。如图 5B所示,D-gal浓度为2.5、5、10、20、40、80 g/L干预正常ARPE-19细胞24 h。结果发现D-gal干预24 h后,40 g/L和80 g/L剂量组ARPE-19细胞活力显著下降,差异均有统计学意义(P<0.01)。考虑衰老模型稳定性,选择剂量为40 g/L的D-gal干预24 h进行SA-β-gal染色实验,结果显示D-gal组阳性率显著上升(P<0.000 1),提示D-gal诱导的衰老模型建立成功。
|
| 注:图A,不同处理浓度的BZBS对ARPE-19细胞活性的影响(n=6),与BZBS 0剂量组(正常组)相比,*P<0.05,****P<0.000 1;图B,不同处理浓度的D-gal对ARPE-19细胞活性的影响(n=6)及SA-β-gal染色的影响(n=3,×100),与D-gal 0剂量组(正常组)相比,**P<0.01,****P<0.000 1。 图 5 BZBS浓度筛选及D-gal诱导建立衰老模型 Fig. 5 Exploration of BZBS concentration and establishment of D-gal Induced aging model |
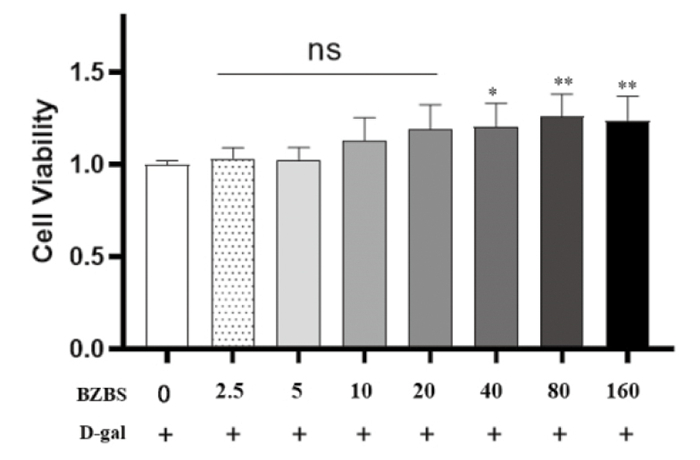
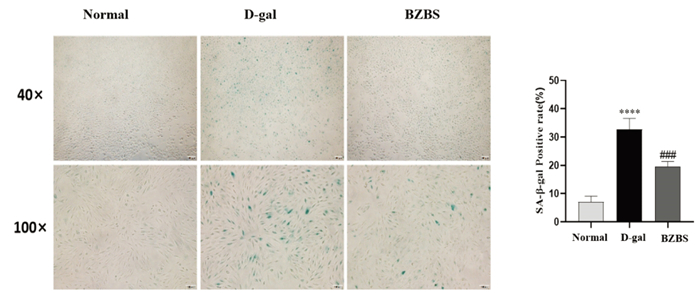
根据2.2.1实验结果,选择不同剂量的7组BZBS干预48 h进行ARPE-19细胞活性比较,实验结果表明剂量为40、80、160 μg/mL的BZBS可提升D-gal诱导的衰老ARPE-19细胞活力,差异具有统计学意义(P<0.05或P<0.01),如图 6。剂量在80 μg/mL时效果最佳,故选择剂量80 μg/mL的BZBS干预48 h进行后续实验。SA-β-gal染色法结果显示,D-gal处理组阳性细胞比例相较于对照组明显增加(P<0.000 1);BZBS组衰老状态相比于D-gal处理组明显改善,衰老细胞比例相对下降(P<0.001)。本部分结果提示BZBS可以抑制D-gal诱导的ARPE-19细胞衰老。见图 7。
|
| 注:与BZBS 0剂量组(正常组)相比,*P<0.05,**P<0.01。 图 6 BZBS对D-gal诱导的衰老ARPE-19细胞活力的影响 Fig. 6 Effect of BZBS on D-gal induced aging ARPE-19 cell viability |
|
| 注:与正常组比较,****P<0.000 1;与D-gal处理组比较,###P<0.001。 图 7 BZBS对D-gal诱导ARPE-19细胞衰老的影响 Fig. 7 Effect of BZBS on D-gal induced aging of ARPE-19 cells |
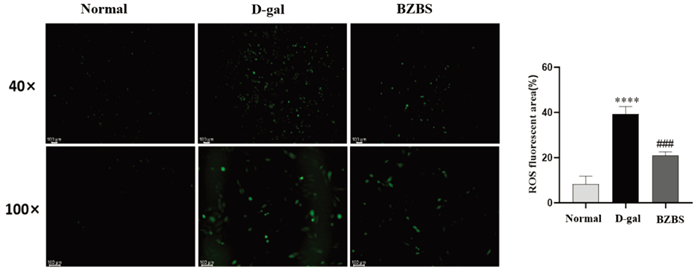
ROS荧光染色显示,与正常组细胞内ROS荧光强度相比,D-gal处理组荧光强度增强,表现为细胞内可见大量较明亮的绿色荧光信号(P<0.000 1);BZBS组绿色荧光强度比D-gal衰老模型组偏弱(P<0.001)。本部分结果提示BZBS可降低衰老ARPE-19细胞中ROS水平。见图 8。
|
| 注:与正常组比较,****P<0.000 1;与D-gal处理组比较,###P<0.001。 图 8 BZBS对D-gal诱导的衰老ARPE-19细胞ROS荧光强度的影响 Fig. 8 Effect of BZBS on ROS fluorescence intensity in D-gal induced aging ARPE-19 cells |
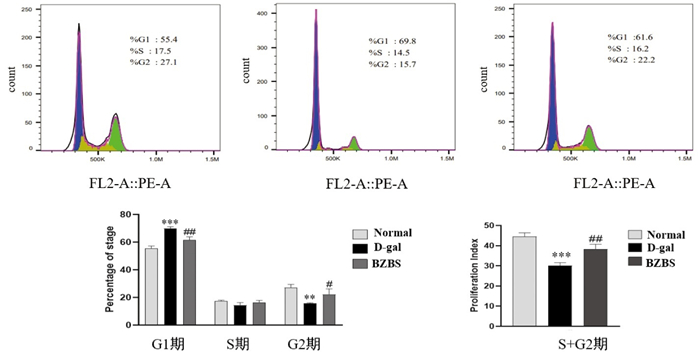
与正常组比较,D-gal诱导的衰老ARPE-19细胞中G1期细胞数量比例增多(P<0.001),S期数量变化不明显(P>0.05),G2期细胞比例减少(P<0.01),S+G2期细胞比例明显减少(P<0.001);与D-gal处理组比较,BZBS组G1期细胞数量比例减少(P<0.01),S期差异无统计学意义(P>0.05),G2期细胞比例增多(P<0.05),S+G2期细胞比例增多(P<0.01)。本部分结果提示,BZBS能够促进衰老ARPE-19细胞的G1/S期进程。见图 9。
|
| 注:与正常组比较,**P<0.01,***P<0.001;与D-gal处理组比较,#P<0.05,##P<0.01。 图 9 BZBS对D-gal诱导的衰老ARPE-19细胞周期的影响 Fig. 9 Effect of BZBS on the cell cycle of D-gal induced aging ARPE-19 |
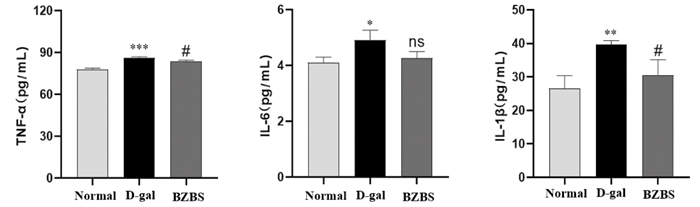
相比于正常组,D-gal诱导的衰老模型中ARPE-19细胞分泌IL-6、IL-1β和TNF-α水平明显增加(P<0.05,P<0.01或P<0.001);与D-gal处理组比较,BZBS干预后IL-6虽然有所下降,但差异无统计学意义(P>0.05),而BZBS干预后显著抑制IL-1β和TNF-α的分泌(P<0.05)。提示BZBS可抑制衰老相关分泌表型(SASP)中促炎细胞因子IL-1β和TNF-α的分泌。见图 10。
|
| 注:与正常组比较,*P<0.05,**P<0.01,***P<0.001;与D-gal处理组比较,#P<0.05。 图 10 BZBS对D-gal诱导衰老ARPE-19细胞分泌促炎细胞因子的影响 Fig. 10 Effect of BZBS on D-gal induced aging of ARPE-19 cells with SASP |
相较于正常组,D-gal处理后自噬相关蛋白P62和LC3表达量明显减少(P<0.01或P<0.001);与D-gal处理组相比,BZBS干预下P62和LC3的蛋白表达量明显增加(P<0.05或P<0.01)。结果提示BZBS能上调衰老ARPE-19细胞自噬水平。见图 11。
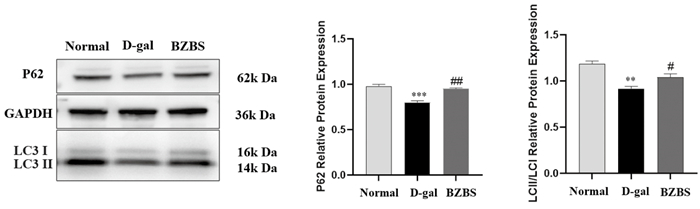
|
| 注:与正常组比较,**P<0.01,***P<0.001;与D-gal处理组比较,#P<0.05,##P<0.01。 图 11 BZBS对D-gal诱导的衰老ARPE-19细胞自噬水平的影响 Fig. 11 Effect of BZBS on D-gal induced autophagy in aging ARPE-19 cells |
中医学认为AMD属于“视瞻昏渺”“云雾移睛”等的范畴,其本质是由脏腑精气不足所致,与元阳不足、精血亏虚有关[13]。BZBS以8种种子药滋填肾精为主,即菟丝子、枸杞子、五味子、蛇床子、金樱子、覆盆子、韭菜子、川楝子。在中药理论中,子类药物常被赋予明目的功效,这是因为它们在形态上与眼睛有相似之处,所谓取像比类的思维方式。在配伍方面,地黄、淫羊藿、巴戟天和肉苁蓉等药物的选择,体现了中医对阴阳平衡的重视,地黄能滋补肾阴,淫羊藿、巴戟天和肉苁蓉则能温扶肾阳,并配伍鹿茸、海马血肉有情之品补肾填精。这种配伍方式旨在燮理阴阳,再佐以人参以温扶元气[14]。与此同时,BZBS中活性成分绿原酸[15]、槲皮素[16]、熊果苷[17]、金圣草素[18]、木犀草素[19]、花生四烯酸[20]等,通过调节氧化应激、自噬等对AMD发挥保护作用。
本研究基于网络药理学数据库初步筛选BZBS治疗AMD的58个相关靶点,并依据PPI网络分析筛选出21个关键靶点。随后KEGG通路富集结果分析显示,BZBS可能通过自噬信号通路发挥改善AMD的作用。并且通过PPI网络分析筛选出关联性较强8个核心靶点中,PTGS1/COX1、CASP9参与调节自噬小体的成熟[21-22];Bcl-2参与调节饥饿诱导的自噬[23];CASP8特异性切割Beclin 1(参与自噬体形成的关键蛋白)调控自噬小体的组装[24];CASP3可特异性切割自噬调控因子ULK1参与调节自噬[25]。此外,相关实验研究表明[26-27],以子类药为基础的中医复方通过自噬信号通路调节氧化应激水平,从而起到对人视网膜色素上皮(RPE)细胞的保护作用。
D-gal是目前公认的致衰剂,已经广泛用于衰老动物模型构建和体外细胞衰老模型复制[28-29],并且在AMD的体内外研究中,D-gal诱导的衰老模型已被广泛运用[30-31]。故实验部分选择D-gal处理ARPE-19细胞构建衰老模型,同时给予BZBS冻干粉干预。细胞衰老表现为细胞活力下降、细胞周期停滞、溶酶体含量增加、SASP分泌增加等[32]。实验结果提示BZBS冻干粉处理后细胞的细胞活力得到改善,SA-β-gal染色阳性细胞数量明显下降、G2期和G2+S期细胞比例增多,SASP中促炎细胞因子分泌减少,提示BZBS冻干粉可改善衰老细胞状态,一定程度上延缓了ARPE-19细胞的衰老进程。
RPE细胞在生理状态下具有一定水平的自噬活动,能够通过更新过氧化物、长寿蛋白和线粒体,帮助清除细胞质中受损的细胞器和代谢物,重建亚细胞水平,从而保护受损细胞[17]。随着年龄的增长,RPE细胞自噬活性的下降可导致异常蛋白质和脂棕素在眼睛内积聚,触发ROS的产生,加速细胞衰老[33]。LC3是目前公认的自噬标记物,在自噬过程中,位于胞浆的LC3-Ⅰ在泛素化作用下,形成LC3-Ⅱ附着于自噬体膜上[34]。P62则作为链接LC3和聚泛素化蛋白之间的桥梁,被选择性地包裹进自噬体,随后被自噬溶酶体中的蛋白水解酶降解[35]。研究结果显示,BZBS下调ROS水平,上调细胞P62和LC3的蛋白表达量,有效促进自噬通量的流通,改善了细胞自身自噬能力。据此本研究推断BZBS通过激活细胞内自噬通路,降低各项衰老相关指标的水平,从而增强ARPE-19细胞的抗衰老能力。但本实验尚有不足之处,未从多方面对自噬展开验证;此外,为了进一步探究BZBS通过调节自噬延缓ARPE-19细胞衰老的分子机制,课题组后续拟通过网络药理学结果进行药物靶点筛选并结合基因敲除实验继续深入研究。
综上所述,本研究明确了BZBS可延缓D-gal诱导的ARPE-19细胞的衰老,减少ROS、降低促炎细胞因子水平,增强细胞活力和改善细胞周期,促进自噬通量的流通,防止视网膜上皮细胞的进一步衰老,为AMD的临床药物开发提供了参考。
| [1] |
LOPEZ P F, GREEN W R. Peripapillary subretinal neovascularization. A re-view[J]. Retina, 1992, 12(2): 147-171. DOI:10.1097/00006982-199212020-00012 |
| [2] |
陈艳玫, 刘子锋, 李贤德, 等. 2015—2050年中国人口老龄化趋势与老年人口预测[J]. 中国社会医学杂志, 2018, 35(5): 480-483. DOI:10.3969/j.issn.1673-5625.2018.05.013 |
| [3] |
EVANS J B, SYED B A. New hope for dry AMD?[J]. Nature Reviews Drug Discovery, 2013, 12(7): 501-502. DOI:10.1038/nrd4038 |
| [4] |
DENG Y H, QIAO L F, DU M Y, et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy[J]. Genes & Diseases, 2021, 9(1): 62-79. |
| [5] |
TANG Z M, HUO M F, JU Y H, et al. Nanoprotection against retinal pigment epi-thelium degeneration via ferroptosis inhibition[J]. Small Methods, 2021, 5(12): e2100848. DOI:10.1002/smtd.202100848 |
| [6] |
陈静香, 仝警安. 中医药治疗年龄相关性黄斑变性的研究进展[J]. 中国中医眼科杂志, 2023, 33(2): 181-184. |
| [7] |
李红蓉, 魏聪, 集川原, 等. 八子补肾胶囊的抗衰老研究进展[J]. 中国实验方剂学杂志, 2022, 28(7): 239-246. |
| [8] |
龚博炀, 徐喆, 李兆栋, 等. 八子补肾胶囊对快速衰老小鼠视网膜的保护作用[J]. 药物评价研究, 2023, 46(9): 1929-1934. |
| [9] |
RU J L, LI P, WANG J N, et al. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [10] |
JIA C Y, LI J Y, HAO G F, et al. A drug-likeness toolbox facilitates ADMET study in drug discovery[J]. Drug Discovery Today, 2020, 25(1): 248-258. |
| [11] |
MAO X, HOU Y, FANG C, et al. Bazi Bushen mitigates epigenetic aging and extends healthspan in naturally aging mice[J]. Biomed Pharmacother, 2023, 16(1): 114-384. |
| [12] |
付雁琳. D-半乳糖通过Aβ蛋白诱导视网膜衰老的研究[D]. 锦州: 锦州医科大学, 2021.
|
| [13] |
陈若冰, 张丽艳. 干性年龄相关黄斑变性中医药研究进展[J]. 中华中医药学刊, 2022, 40(1): 154-156. |
| [14] |
李红蓉, 魏聪, 集川原, 等. 八子补肾胶囊的抗衰老研究进展[J]. 中国实验方剂学杂志, 2022, 28(7): 239-246. |
| [15] |
罗文彬. 绿原酸对视网膜色素上皮细胞氧化损伤保护作用的实验研究[D]. 南昌: 南昌大学, 2014.
|
| [16] |
LI W, CHEN L, GU Z W, et al. Co-delivery of microRNA-150 and quercetin by lipid nanoparticles(LNPs) for the targeted treatment of age-related macular degenera-tion(AMD)[J]. Journal of Controlled Release, 2023, 355: 358-370. |
| [17] |
WANG L, TIAN Y, LI L P, et al. Temporary alleviation of MAPK by arbutin alleviates oxidative damage in the retina and ARPE-19 cells[J]. Heliyon, 2024, 10(12): e32887. |
| [18] |
KIM M H, KWON S Y, WOO S Y, et al. Antioxidative effects of chrysoeriol via activation of the Nrf2 signaling pathway and modulation of mitochondrial function[J]. Molecules, 2021, 26(2): 313. |
| [19] |
ZHANG C Y, ZHANG Y, HU X, et al. Luteolin inhibits subretinal fibrosis and epithelial-mesenchymal transition in laser-induced mouse model via suppression of Smad2/3 and YAP signaling[J]. Phytomedicine, 2023, 116: 154865. |
| [20] |
WANG K, ZHONG Y Y, YANG F K, et al. Causal effects of N-6 polyunsaturated fatty acids on age-related macular degeneration: A Mendelian randomization study[J]. The Journal of Clinical Endocri- nology and Metabolism, 2021, 106(9): e3565-e3572. |
| [21] |
YU Q, LI C, NIU Q H, et al. Hepatic COX1 loss leads to impaired autophagic flux and exacerbates nonalcoholic steatohepatitis[J]. Acta Pharmaceutica Sinica B, 2023, 13(6): 2628-2644. |
| [22] |
AN H K, CHUNG K M, PARK H, et al. CASP9(caspase 9) is essential for autophagosome maturation through regulation of mitochondrial homeostasis[J]. Autophagy, 2020, 16(9): 1598-1617. |
| [23] |
WEI Y J, PATTINGRE S, SINHA S, et al. JNK1-mediated phosphorylation of Bcl-2 regulates starvation-induced autophagy[J]. Molecular Cell, 2008, 30(6): 678-688. |
| [24] |
WIRAWAN E, VANDE WALLE L, KERSSE K, et al. Caspase-mediated cleav-age of Beclin-1 inactivates Beclin-1-induced autophagy and enhances apoptosis by promoting the release of proapoptotic factors from mitochondria[J]. Cell Death & Disease, 2010, 1(1): e18. |
| [25] |
MAN N, TAN Y R, SUN X J, et al. Caspase-3 controls AML1-ETO-driven leukemogenesis via autophagy modulation in a ULK1-dependent manner[J]. Blood, 2017, 129(20): 2782-2792. |
| [26] |
柯玲玲. 基于p62-keap1/Nrf2通路研究驻景丸加减方对干性AMD模型小鼠视网膜保护作用机制[D]. 南京中医药大学, 2020.
|
| [27] |
胡凡, 黄冰林, 梁凌燕, 等. 基于Nrf2/ARE信号通路研究四物五子丸对碘酸钠诱导小鼠视网膜氧化损伤的保护作用及机制[J]. 江西中医药, 2023, 54(8): 68-72. |
| [28] |
LIANG X R, YAN Z J, MA W W, et al. Peroxiredoxin 4 protects against ovarian ageing by ameliorating D-galactose-induced oxidative damage in mice[J]. Cell Death & Disease, 2020, 11(12): 1053. |
| [29] |
ZHANG J J, HU R Y, CHEN K C, et al. 20(S)-protopanaxatriol inhibited D-galactose-induced brain aging in mice via promoting mitochondrial autophagy flow[J]. Phytotherapy Research, 2023, 37(7): 2827-2840. |
| [30] |
CHEN Q Q, XIN G, LI S Y, et al. Berberine-mediated REDD1 down-regulation ameliorates senescence of retinal pigment epithelium by interrupting the ROS-DDR positive feedback loop[J]. Phytomedicine, 2022, 104: 154181. |
| [31] |
TIAN J, ISHIBASHI K, ISHIBASHI K, et al. Advanced glycation endprod-uct-induced aging of the retinal pigment epithelium and choroid: A comprehensive transcriptional response[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(33): 11846-11851. |
| [32] |
GURKAR A U, GERENCSER A A, MORA A L, et al. Spatial mapping of cellular senescence: Emerging challenges and opportunities[J]. Nature Aging, 2023, 3(7): 776-790. |
| [33] |
KAARNIRANTA K, SINHA D, BLASIAK J, et al. Autophagy and heterophagy dysregulation leads to retinal pigment epithelium dysfunction and development of age-related macular degeneration[J]. Autophagy, 2013, 9(7): 973-984. |
| [34] |
FAN S J, YUE L Y, WAN W, et al. Inhibition of autophagy by a small molecule through covalent modification of the LC3 protein[J]. Angewandte Chemie, 2021, 60(50): 26105-26114. |
| [35] |
VARGAS J N S, HAMASAKI M, KAWABATA T, et al. The mechanisms and roles of selective autophagy in mammals[J]. Nature Reviews Molecular Cell Biology, 2023, 24(3): 167-185. |
2. First Clinical Medical College, Xinjiang Medical University, Urumqi 830011, China;
3. Basic Medicine School of Heilongjiang University of Traditional Chinese Medicine, Harbin 150040, China;
4. Hebei Medical University, Shijiazhuang 050011, China
 2025, Vol. 42
2025, Vol. 42