文章信息
- 刘薇, 马宁, 钱文秀, 等.
- LIU Wei, MA Ning, QIAN Wenxiu, et al.
- 基于中药系统毒理学数据库对神经毒性中药的毒性作用及规律研究
- Research on the toxic effects and rules of neurotoxic traditional Chinese medicine based on traditional Chinese medicine system toxicology database
- 天津中医药, 2025, 42(2): 189-196
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(2): 189-196
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.02.10
-
文章历史
- 收稿日期: 2024-08-25
中药神经毒性是指由中药直接或间接引起的神经功能障碍,临床表现为瞳孔放大、意识模糊、精神错乱、烦躁不安、腹痛、呕吐、头晕、抽搐、麻痹、昏迷等[1]。近年来,因中药使用不当而产生不良反应等安全事件时有发生,因此,提高对中药神经毒性的认识,具有重要意义。中药系统毒理学数据库(TCMSTD)将中药信息数据化,根据毒性表现即神经毒性、心脏毒性、肝毒性、肾毒性和生殖毒性,对5个毒性靶点进行了系统的分类、总结和研究,该数据库是国内外第一个关注中药安全性的数据库,为中药信息的挖掘、存储、检索和分析提供了高效、便捷的技术支持。因此笔者研究基于TCMSTD对致神经毒性的中药进行总结,以期进一步阐明中药神经毒性的风险标志、有效促进中药安全性问题的研究,并为神经毒性中药在临床上的应用提供依据。
1 资料与方法 1.1 数据来源TCMSTD网址为(https://www.bic.ac.cn/TCMSTD/)。
1.2 排纳标准从《中华人民共和国药典》(2020版)一部[2]、《中华本草》[3]《现代中药毒理学》[4]《中药毒性理论与安全性评价》[5]等10部权威的中药著作中总结了9 139种中药[6-11],并筛选出有临床中毒报告或通过毒理学实验证明有神经毒性的中药,最终归入具有神经系统毒性的中药。上述数据主要来源于5个文献网站:知网、维普、万方、Pubmed和Web of Science。TCMSTD纳排标准及数据库生成详见已发表文章“TCMSTD 1.0:a systematic analysis of the traditional Chinese medicine system toxicology database”[12]。
1.3 数据提取本研究以TCMSTD为基础,依据毒性表现筛选出的具有神经系统毒性的中药。即进入TCMSTD后,在“药材”界面,选择“毒性表现饼状图—神经系统毒性”进行检索,导出检索结果。
1.4 分析方法将检索到的具有神经系统毒性的中药采用Excel表格进行整理统计,其内容包括序号、名称、相关毒性成分、中药的药性、药味、归经、功效。将统计结果整理为txt形式,借助GenesCloud Tools将结果可视化。
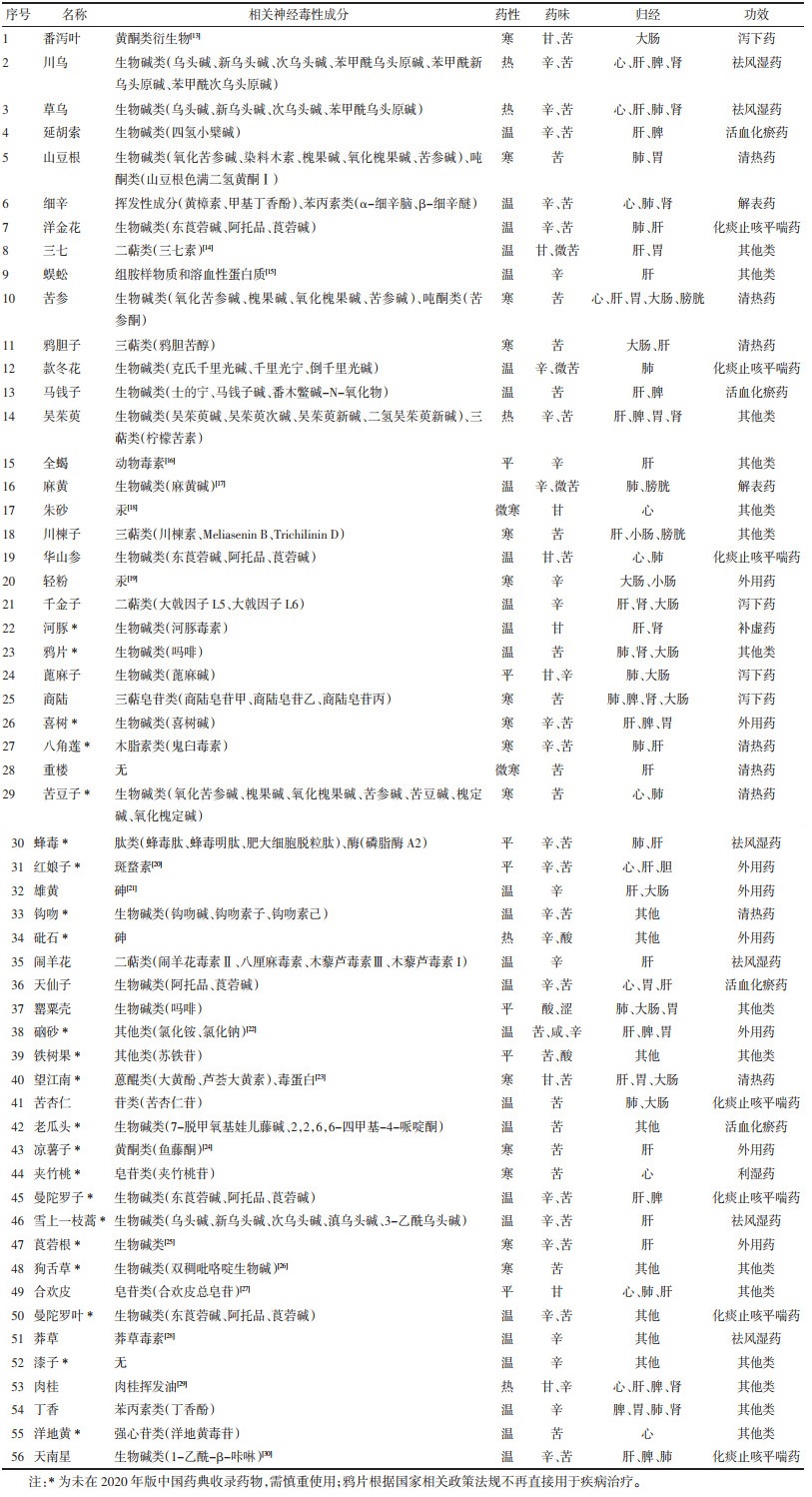
2 结果 2.1 基于TCMSTD的致神经毒性单味中药统计分析TCMSTD共检索到含有神经毒性的药物共有56种[13-30],见表 1,部分药物的相关毒性成分数据库中未检索到,暂列为无。
|
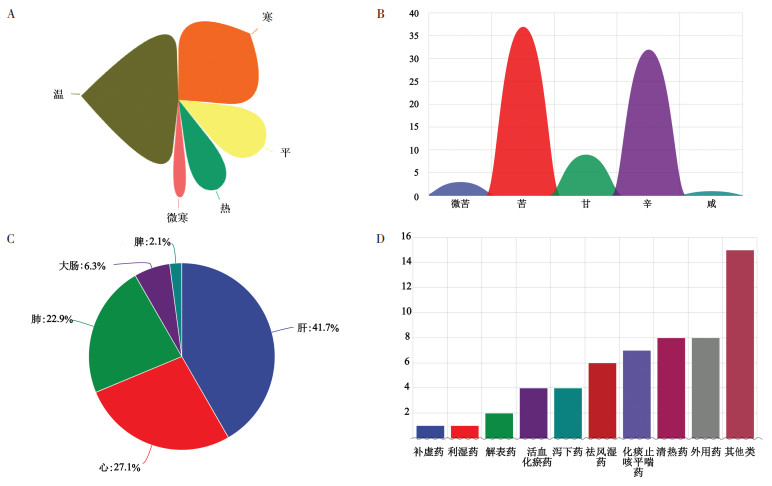
对56种药物的性味归经功效进行分析,结果显示,含有神经毒性的药物药性以温、寒为主,见图 1A;药味以辛、苦为主,见图 1B;药物归经以肝、心二经为主,见图 1C;功效以清热、化痰止咳平喘为主,见图 1D。
|
| 注:图A,具有神经毒性的中药药性分布;图B,具有神经毒性的中药药味分布(纵坐标表示每种药味所对应的中药数量总数);图C,具有神经毒性的中药归经分布;图D,具有神经毒性的中药功效分布(纵坐标表示每种功效所对应的中药数量总数)。 图 1 基于TCMSTD数据库的神经毒性中药性味归经分布规律 Fig. 1 Distribution law of property, flavor and meridian tropism of neurotoxic traditional Chinese medicine based on TCMSTD database |
中药主要毒性成分有:生物碱类,苷类,毒蛋白,萜类和内酯类,金属元素类等[31]。神经毒性中药中含有的有毒物质的种类和含量,在很大程度上都会影响到它们的神经毒性,同时也会影响到它们对人体造成的伤害。比如川乌和附子中含有的乌头碱就是一种毒性很强的成分,服用少量即可中毒[32]。已知其所含生物碱类物质可引起神经损伤,严重时可导致运动中枢和呼吸中枢麻痹,致死[33]。因此,推进具有神经毒性的中药药效物质基础的研究,对全面理解和掌握其毒理作用,客观评价并指导其安全使用有着十分重要的意义。
通过检索TCMSTD,56味中药的相关毒性成分主要为生物碱类。川乌和马钱子等中药中的生物碱具有较好的临床疗效,但也伴有一定程度的神经毒性,可引起中枢亢进、中枢抑制、瞳孔放大、心烦意乱、意识模糊、昏迷眩晕、强直性抽搐、神经麻痹等症状[34]。天仙子中含有莨菪碱和阿托品,临床上多通过外敷治疗皮肤肿块、疼痛、感染、溃烂等[35]。天仙子中毒表现多为阿托品样中毒,比如口干、嘶哑、吞咽困难、皮肤潮红、眼底黏膜发红,然后出现头痛、发烧、心跳过速、瞳孔散大、视力模糊、尿潴留等症状。严重者可出现谵语、狂躁、眩晕,随后就会出现反应迟钝,精神萎靡,昏昏欲睡的症状。最终会因为血压降低、呼吸衰竭而死[35]。
TCMSTD显示,闹羊花和千金子的毒性成分为二萜类,二萜类化合物主要以树脂、内酯或糖苷的形式存在[36-38]。二萜类成分被认为是毒性成分,同时也是药效成分,毒效同源[36]。闹羊花轻度中毒者表现为精神萎靡、步态蹒跚、四肢进行性麻痹,可出现大小便失禁;严重者还会出现抽搐、嗜睡、昏迷、谵妄等症状[37]。千金子中毒表现先有头昏、头痛、恶心、呕吐、心悸、出冷汗、脸色苍白,如中毒较重,可表现为血压降低、大汗淋漓、肢体厥冷、呼吸浅而粗重、脉搏弱欲绝[38]。造成人体中毒的苷类以氰苷类、强心苷类、皂苷类3种有毒物质为主。洋地黄、夹竹桃等中药含有强心苷和皂苷类成分,TCMSTD数据表明苦杏仁中含有氰苷类成分[39]。苦杏仁中毒临床表现为呼吸困难、神志不清、四肢厥冷、紫绀等[40]。此外,蜈蚣、全蝎等动物药因含有动物毒素而具有一定的神经毒性[16]。少数矿物药如雄黄、轻粉因含有重金属元素(雄黄含重金属元素砷,轻粉含重金属元素汞)而具有神经毒性[19, 21]。
2.4 基于TCMSTD的中药致神经毒性的作用机制神经毒性中药可引起精神行为障碍、智力低下、共济失调、言语功能障碍、听觉和视觉障碍、四肢感觉障碍等多种症状,并可引起长期、剧烈和自发的肌肉刺痛或烧灼感[41]。进一步对这56种神经毒性中药的作用机制在TCMSTD进行检索发现,这些中药致神经毒性的机制主要在氧化应激、离子交换、能量代谢、促发炎症等方面。氧化应激与炎症之间的相互作用是通过调节转录水平来实现的,这导致了自由基-氧化应激-炎症-氧化应激-自由基的恶性循环。神经系统中的突触传导和离子通道的作用对于确保神经信息的正常传输以及维持神经系统的正常功能至关重要。突触传递需要消耗大量能量,在突触传递中,神经传递素通过化学途径将信息传递到突触间隙,从而激活或抑制接收信号的神经元。离子通道可调控细胞膜电位,进而调控神经元兴奋性,影响动作电位。由细胞内离子通道的开放与关闭引起的电信号传导构成了神经信息传导的核心基础。钠通道、钾通道与钙通道之间的协同作用确保了神经系统的稳定运作。
2.4.1 诱导氧化应激长期进化过程中,机体形成了一种自我保护机制,即氧化应激,其主要原因在于体内氧化与抗氧化作用的失衡,导致机体适应环境的能力受到影响。氧化应激是机体对外界刺激做出应答反应时,细胞内发生一系列复杂的生化变化及能量转化的综合结果。由于其具有氧化倾向,因此在病理情况下,会引起中性粒细胞的炎性浸润,导致蛋白酶分泌增加,从而产生大量的氧化中间产物。同时还能激活巨噬细胞等免疫细胞,使这些细胞对肿瘤坏死因子具有更高的敏感性。自由基[包括活性氧(ROS)和活性氮(RNS)等]在人体内引发的氧化应激,被认为是导致组织受损、衰老和疾病的一个重要因素[42]。细胞受到外界刺激(如辐射、化学物质、炎症等)或内部代谢紊乱时,ROS的产生会显著增加,超过细胞的抗氧化防御能力,导致氧化应激的发生。谷胱甘肽(GSH)是细胞内主要的还原性谷胱甘肽,具有重要的抗氧化功能。它可以与ROS直接反应,中和自由基,减少氧化损伤。王艳蕾等[43]通过实验发现,在雄黄暴露较低的情况下,砷元素的存在会对海马组织中GSH的合成产生显著的影响;随着暴露浓度的增加,海马组织中GSH的生物合成呈现下降趋势,从而诱发神经毒性反应。TCMSTD数据显示,苦豆子相关毒性成分为氧化苦参碱、槐果碱、氧化槐果碱、苦参碱、苦豆碱、槐定碱和氧化槐定碱。研究表明,苦参碱类生物碱在低浓度下可抑制过多ROS的生成,而超过一定浓度,则可促进ROS的生成,同时,苦参碱、氧化苦参碱、金雀花碱及槐果碱均能引起hiPSC-CMs心肌细胞内ROS及脂质过氧化反应的产物丙二醛(MDA)含量升高,抗氧化活性物质SOD及GSH活性降低,呈量效关系,从而诱发氧化应激,产生神经毒性[44]。
2.4.2 诱导细胞凋亡神经细胞凋亡是神经系统的重要现象。通过检索TCMSTD,雄黄主含二硫化二砷(As2S2)或四硫化四砷(As4S4),雄黄中的砷是其毒性的主要来源。雄黄中砷可以穿透血脑屏障在脑内富集,从而引起中枢神经系统的损伤,产生神经毒性,其毒性机制与MAPK和AKT信号分子介导Nrf2/Keap1/p62信号通路干扰细胞自噬,进而促进细胞凋亡有关[45]。TCMSTD表明苦豆子毒性成分为生物碱,高莉等[46]研究苦豆子总碱对大鼠肾上腺嗜铬细胞瘤PC12细胞的毒性,实验结果表明,苦豆子总碱对神经细胞有显著的毒性作用,毒性作用机制与其引发细胞凋亡有关,在经苦豆子总碱处理后,PC12细胞表现出了不同程度的损伤,随着药物浓度的增加,细胞凋亡率也逐渐增加,其中诱导早期的凋亡率明显增加,而在高质量浓度(2.0 g/L)下,诱导晚期的凋亡率明显提高。TCMSTD数据显示,喜树相关毒性成分为生物碱,万亮琴等[47]经实验推测喜树碱对神经元的细胞毒性与其抑制拓扑异构酶-Ⅰ(Topo-Ⅰ)活性有一定的关系,它有可能是通过抑制神经元DNA转录过程中Topo-Ⅰ的活性,导致DNA发生单链断裂,进而使神经元发生凋亡。
2.4.3 影响离子通道在生物体内,离子通道在调节神经和肌肉细胞功能、维持其正常生理功能方面起着重要作用[44]。报道显示,钠(Na+)通道上有3个独立的神经毒素受体位点,对离子通道的功能进行调控[48],川乌和附子中含有的乌头碱是一种毒性很强的成分,服用少量即可中毒[32]。已知其所含生物碱类物质可引起神经损伤,严重时可导致运动中枢和呼吸中枢麻痹,致死[33]。乌头碱可结合Na+通道第2神经毒素受位点并使其失活,Rao等[49]在全细胞膜片钳技术下,研究了生物碱毒素乌头碱(AC)对中国仓鼠卵巢(CHO)细胞系中异源表达的大鼠脑型IIAα亚单位电生理特性的影响。结果表明AC结合位点位于Na+通道α亚单位的孔区,β亚单位的存在对于AC结合不是必需的。根据TCMSTD显示,蜈蚣、全蝎具有一定神经毒性,Yang等[50]利用转录组测序,cDNA文库等技术从少棘蜈蚣体内分离得到一系列的作用于电压门控的钠通道、钾通道、钙通道的毒素,例如,μ-SLPTX-Sm1a对大鼠背根神经节的敏感性Na+通道有特异性抑制作用;κ-SLPTX-Ssm1a、κ-SLPTX-Ssm2a和κ-SLPTX-Ssm3a能够特异性抑制大鼠背根神经节的钾通道;ω-SLPTX-Ssm1a能够特异性抑制大鼠背根神经节的钙通道,这些神经毒素通过特异性作用于神经系统的离子通道,扰乱神经信号传导和神经细胞功能,从而引发强烈的神经毒性反应。
2.4.4 影响突触传递TCMSTD数据显示,天仙子的致毒机制与其含有的托烷生物碱有关,其致毒机制是通过抑制乙酰胆碱受体,使其产生类似于毒蕈碱的特征,从而起到中枢抗胆碱的作用[51]。另有研究表明,闹羊花中的木藜芦毒素Ⅲ可上调γ-氨基丁酸(GABA)能及谷氨酸能神经元突触后电流频率,促进下丘脑腹内侧核神经元的递质释放,活化下丘脑腹内侧核神经元突触,促进GABA及谷氨酸的释放,从而导致木藜芦毒素Ⅲ中毒[36]。TCMSTD数据显示,蜂毒相关毒性成分主要为肽类,其对神经末梢有高度的选择性作用,它可以阻滞大脑的网状组织,影响大脑皮层的生物电活性。同时,它还可以选择性地阻滞N-胆碱受体,从而对中枢神经系统中突触的兴奋性传导产生影响。此外,蜂毒能抑制周围神经冲动的传导;蜂毒中的非磷脂蛋白能导致脑炎发生[52]。左梦婷等[53]通过钩吻的亚急性与急性毒性实验推测钩吻的毒性机制为有效成分进入机体到达脑部引起机体的低氧反应,引起谷氨酸(Glu)的大量释放,使神经递质γ-氨基丁酸(GABA)/Glu转化失衡,引发强烈兴奋性毒性,并最终造成细胞损伤。
2.4.5 影响能量代谢神经系统对能量非常敏感,能量代谢的紊乱将会对神经系统的调控作用产生很大影响,从而引发神经毒性[54]。通过检索TCMSTD数据,苦杏仁中含有苦杏仁苷,属于氰苷类成分。氰苷在体内水解后会生成氰化氢(氢氰酸),这是一种强效神经毒素。氰化氢通过抑制细胞色素C氧化酶-呼吸链的末端酶,干扰细胞的氧化磷酸化过程,导致细胞内缺氧和ATP生成减少。细胞内能量代谢因此发生紊乱,进而引发一系列神经毒性反应。
2.4.6 促发炎症半夏、掌叶半夏、天南星、白附子是天南星科有毒中药,使用不当会导致强烈的刺激性毒性。4种中药块茎中的“毒针晶”具有较强的穿透力,其主要组分为凝集素蛋白,能随针晶进入到组织中,与组织巨噬细胞膜上的肿瘤坏死因子1(TNFR1)、Toll样受体(TLR4)结合,从而诱发氧化应激反应,同时还会对下游的有丝分裂原活化蛋白激酶(MAPK)、核因子-κB(NF-κB)及核苷酸结合寡聚结构域(NLRP3)信号通路进行激活,造成大量炎症因子的释放,促发炎症级联反应,最终造成强烈的炎症刺激性毒性[55]。神经系统磷脂膜可在磷脂酶A作用下,释放磷脂碱基蛋白和其他抗原,引发一系列的免疫反应,造成脑组织的损伤。蜂毒中含有丰富的组胺、白三烯及促凝血素等血管活性物质,能引起血管收缩,导致脑血管痉挛[52]。
2.5 基于TCMSTD的神经毒性中药的减毒方法 2.5.1 炮制方法研究合理炮制有毒中药是确保其安全有效使用的关键。数千年的中医药实践,让中药炮制的方法多种多样,从中药的采摘到最后呈现在大家面前的炮制成品,在此过程中,要经过一系列的炮制工艺流程,从而降低或消除中药的毒性,使患者在使用时,获得最好的效果并降低毒副作用[56]。对于一些有神经毒性中药,如川乌、附子,因为这类中药中含有生物碱类物质(双酯型乌头碱)可溶解在水中,煮制后剧毒的双酯型乌头碱会被水解为毒性更小的单酯型乌头碱和近乎无毒的乌头原碱,因此,药物的毒性就会大幅度下降。其减毒机制是利用毒性组分的亲水性及在高温条件下易溶出的特性进行减毒[56]。此外,有学者发现运用燀法经过炮制来降低毒性的有毒中药大多是苦杏仁等果实类种子,由于苦杏仁中含有苦杏仁苷、苦杏仁酶、脂肪油等物质,因此可以用这种方法来杀酶保苷[56]。另有研究发现,苦杏仁经过燀法炮制后还残留着能分解苦杏仁苷的苦杏仁酶,所以,可以先用清炒法处理,然后再用燀法炮制,这样就能彻底抑制杏仁酶活性[57]。
2.5.2 配伍减毒研究中药配伍是中医药临床应用的精华所在,中药合理配伍能够减毒增效,是保障其临床用药安全有效的关键[58]。因此,对具有神经毒性的中药,可采用不同的配伍方式来降低其毒性。《本草纲目》记载,甘草有“国老”之号。由此可见甘草在配伍减毒中的重要性。现代研究及古籍资料显示,甘草与吴茱萸、马钱子等神经毒性中药配伍,能降低其毒副作用。栗焕焕等[59]研究发现,当吴茱萸与甘草配伍时,吴茱萸活性成分吴茱萸碱、吴茱萸次碱的含量均有下降的趋势。研究人员据此推测,吴茱萸中的生物碱类物质与甘草的极性基团如羟基等结合,缓解了其毒性,并起到“甘”缓之效,起到了减毒的作用。此外,据报道,甘草可以减少马钱子中马钱子碱和士的宁的含量[60],还可以与马钱子中的有毒成分形成沉淀[61],其中的甘草酸可以诱导血脑屏障上P-糖蛋白(P-gp),加速马钱子碱的外排等[62],从而降低马钱子的毒性。因此,合理的药物配伍不仅可以减轻其毒副作用,甚至有可能提高其临床疗效。
2.5.3 临床合理用药研究有毒中药在临床上能否导致中毒,与其用量密切相关,其中超量用药是导致毒副作用的重要因素之一。古人用药强调“中病即止”,主要为防止与减轻药物对机体的毒性。然而,目前临床上对某些慢性病的治疗,往往需要患者长期服用中药。如果是平淡之药,长时间的服用没有什么问题,但是有毒的药材,长时间的服用,则会导致毒素的积累。所以,在使用有毒的中药时,必须谨慎。如欲采用超常剂量,应先低剂量,逐步递增,并对其效果及毒副作用进行观察。《神农本草经》记载:“若用毒药疗病,先起如黍粟,病去即止,不去倍之,不去十之,取去为度。”同时,正确的服用方法,也能够减少或避免有毒中药的中毒作用。一般情况下,含草乌煎剂在饭后吃,很少会出现中毒的情况,但是药效往往比饭前吃要差一些。在使用时,为了防止中毒,可先在饭后服食,待确认没有明显的毒副作用后,可再改为饭前服食,以增强药效[63]。
3 结论通过检索TCMSTD,对具有神经毒性的中药信息进行挖掘与分析,发现中药的神经毒性与其性味归经及功效关系密切,含有神经毒性的药物药性以温、寒为主,药味以辛、苦为主,药物归经以肝、心二经为主,功效主要是清热、化痰止咳平喘等。同时对含有神经毒性的中药的物质基础与作用机制、减毒方法进行整合分析,发现其毒效成分以生物碱类、苷类、毒蛋白、萜类和内酯类以及金属元素为主;该类中药主要通过诱导氧化应激和细胞凋亡、影响离子通道、突触传递和能量代谢、促进炎症产生神经毒性;其减毒方法主要是炮制减毒、配伍减毒且临床要注意该类中药的用法用量。
4 讨论与展望近年来,随着中药在临床上的广泛应用,研究者们对中药安全性的认识也不断提高。但是,由于中药作用于神经系统的多靶点性、中药成分的复杂性,以及现代研究方法的局限性等因素,导致了大家对中药神经毒性的研究还存在着复杂性和不易监测性的特点。目前对神经毒性中药成分组成、作用机制、毒性等方面的认识还不够深入,严重制约了对其毒性的深入研究及其临床应用。将传统中药与数据库相结合具有重要意义,中药信息数据化将为深入探究致神经毒性中药的毒性作用机制、制定毒性中药的无毒用药方案及质量标准奠定理论基础,为有毒中药的临床用药提供参考,并对中药毒性研究机构或中药安全监管机构起到一定的协助作用。
| [1] |
宋秉智, 高耀宗. 神经系统毒性中药及其与药性和有效成分的关系: 对102种中药神经系统毒性文献资料的分析总结[J]. 中医药研究, 2001(4): 52-53. |
| [2] |
国家药典委员会. 中华人民共和国药典-一部: 2020年版[M]. 北京: 中国医药科技出版社, 2020.
|
| [3] |
国家中医药管理局《中华本草》编委会. 中华本草-9[M]. 上海: 上海科学技术出版社, 1999.
|
| [4] |
夏丽英. 现代中药毒理学[M]. 天津: 天津科技翻译出版公司, 2005.
|
| [5] |
赵军宁, 叶祖光. 中药毒性理论与安全性评价[M]. 北京: 人民卫生出版社, 2012.
|
| [6] |
杜贵友, 方文贤. 有毒中药现代研究与合理应用[M]. 北京: 人民卫生出版社, 2003.
|
| [7] |
沈丕安. 中药不良反应与临床[M]. 上海: 第二军医大学出版社, 2007.
|
| [8] |
苗明三, 朱飞鹏, 朱平生. 实用中药毒理学[M]. 上海: 第二军医大学出版社, 2007.
|
| [9] |
张耕, 马威, 徐宏峰. 常用中药毒性研究进展及应用[M]. 武汉: 湖北科学技术出版社, 2013.
|
| [10] |
苏凤哲. 常用有毒中药的临床研究[M]. 北京: 中国医药科技出版社, 2019.
|
| [11] |
杨军宣, 蒲晓东. 常用有毒中药现代研究与应用[M]. 北京: 科学出版社, 2014.
|
| [12] |
SONG L L, QIAN W X, YIN H Q, et al. TCMSTD 1.0:A systematic analysis of the traditional Chinese medicine system toxicology database[J]. Science China Life Sciences, 2023, 66(9): 2189-2192. DOI:10.1007/s11427-022-2318-4 |
| [13] |
公丕泉. 口服番泻叶致癫痫样发作一例[J]. 山东医药工业, 1998, 17(2): 60-61. |
| [14] |
张玉萍, 余琼. 三七素的止血活性及其神经毒作用实验研究[J]. 山东中医杂志, 2010, 29(1): 43-45. |
| [15] |
吴春红. 少棘蜈蚣最细粉急性毒性和慢性毒性研究[D]. 泸州: 西南医科大学, 2018.
|
| [16] |
王诺琦, 张莉, 杨秀颖, 等. 动物类有毒中药"毒" 的历史认识及现代研究[J]. 医药导报, 2019, 38(11): 1425-1430. DOI:10.3870/j.issn.1004-0781.2019.11.007 |
| [17] |
郑芳昊. 麻黄—桂枝药对配伍对麻黄碱引起的大鼠中枢神经系统毒副作用的保护机制研究[D]. 广州: 南方医科大学, 2015.
|
| [18] |
王陶陶, 董宇, 常生, 等. 朱砂毒性的研究进展[J]. 沈阳药科大学学报, 2018, 35(10): 897-902. |
| [19] |
王晓烨, 林瑞超, 董世芬, 等. 含汞矿物药的毒性研究进展[J]. 中国中药杂志, 2017, 42(7): 1258-1264. |
| [20] |
韦立功, 黄展智. 服红娘子幼虫致急性中毒一例[J]. 中华急诊医学杂志, 2001, 10(3): 175. |
| [21] |
徐文峰, 金鹏飞, 徐硕, 等. 矿物中药雄黄毒性的研究进展[J]. 中南药学, 2019, 17(6): 899-903. |
| [22] |
陆兔林, 毛春芹, 余玖霞, 等. 白硇砂和紫硇砂不同炮制品抗炎作用及急性毒性研究[J]. 中国新药与临床杂志, 2013, 32(9): 734-737. |
| [23] |
郑咏梅. 望江南籽中毒5例报告[J]. 实用医学杂志, 1989, 5(2): 34-35. |
| [24] |
韦元昌. 地瓜米中毒五例[J]. 广西医学, 1991, 13(2): 100-101. |
| [25] |
陈生茂, 肖素萍, 张秀丽. 莨菪根中毒17例报告[J]. 临床儿科杂志, 1997, 15(3): 215. |
| [26] |
司红丽, 王建华, 王跃虎. 狗舌草总黄酮的提取及其毒性试验[J]. 畜牧与兽医, 2003, 35(7): 9-10. |
| [27] |
杨磊, 李棣华. 合欢皮化学成分与药理活性及毒理学研究进展[J]. 中国中西医结合外科杂志, 2019, 25(6): 1061-1064. |
| [28] |
张文静, 高昂, 姚默, 等. 莽草药学研究概况[J]. 安徽农业科学, 2011, 39(33): 20383-20384. |
| [29] |
刘冬恋, 马松涛, 曾仁勇, 等. 肉桂挥发油对小鼠的半数致死量测定[J]. 西南国防医药, 2010, 20(5): 481-482. |
| [30] |
田霖煊, 杨沁媛, 陶俊彦. 基于网络毒理学和分子对接技术探究天南星神经毒性作用机制[J]. 中医药通报, 2023, 22(12): 42-48. |
| [31] |
段亚萍, 骆骄阳, 刘好, 等. 中药中内源性毒性成分分析方法研究进展[J]. 中国中药杂志, 2018, 43(24): 4808-4816. |
| [32] |
胡志祥, 肖金莲. 含毒中药毒理分析[J]. 时珍国医国药, 1999, 10(2): 96. |
| [33] |
王懿, 严军, 黄伟, 等. 基于功效和物质基础的附子毒性研究进展[J]. 中国药物警戒, 2013, 10(3): 155-158. |
| [34] |
孙凤姣, 张译丹, 吴锦, 等. 生川乌醇提物致心、脑毒性的表现及其对血管内皮的影响[J]. 中草药, 2017, 48(6): 1178-1182. |
| [35] |
蒋一帆, 高建超, 田春华, 等. 毒性药材天仙子的文献研究及风险探讨[J]. 中国药物警戒, 2016, 13(3): 165-168, 172. |
| [36] |
郭小红, 冯靖雯, 尤强, 等. 有毒中药闹羊花的现代研究进展[J]. 中国药业, 2020, 29(23): 96-104. |
| [37] |
池锐彬, 刘力新. 血液净化成功救治闹羊花中毒1例[J]. 中国血液净化, 2010, 9(7): 406. |
| [38] |
张家俊, 刘宝屏, 霍渊博, 等. 大戟科千金子毒性、化学成分及药理活性研究进展[J]. 北方药学, 2013, 10(8): 68-68, 69. |
| [39] |
文喜艳, 周鹏发, 魏秀娟, 等. 中药毒性化学成分及解毒方法[J]. 中兽医医药杂志, 2023, 42(2): 34-38. |
| [40] |
张秀梅. 苦杏仁中毒致休克呼吸窘迫一例救治体会[J]. 中国小儿急救医学, 2006, 13(1): 93-94. |
| [41] |
徐新华, 李伟荣, 宓穗卿, 等. 中药神经毒性研究概述[J]. 中国药物警戒, 2011, 8(11): 678-680. |
| [42] |
张尚维, 李明星, 赵蕊, 等. 糖尿病肾病发生的氧化应激机制及抗氧化治疗的研究进展[J]. 中国药理学与毒理学杂志, 2020, 34(8): 634-640. |
| [43] |
王艳蕾, 陈默, 方莹, 等. 雄黄对小鼠海马GSH合成相关因素的影响及机制研究[C]//中国毒理学会. 中国毒理学会第七次全国毒理学大会暨第八届湖北科技论坛论文集, 2015.
|
| [44] |
余登香, 王淑娜, 傅月朦, 等. 山豆根中生物碱类成分的毒性及机制研究进展[J]. 中国实验方剂学杂志, 2022, 28(6): 262-271. |
| [45] |
杨钊. 基于MAPK和AKT介导Nrf2/Keap1/p62信号通路扰动自噬促进海马细胞凋亡的雄黄神经毒性研究[D]. 沈阳: 中国医科大学, 2021.
|
| [46] |
高莉, 彭晓明, 陈长春, 等. 苦豆子总碱对PC12细胞的毒性[J]. 中成药, 2018, 40(11): 2547-2550. |
| [47] |
万亮琴, 李卫红, 叶文国, 等. 从转录环节研究喜树碱诱导神经元凋亡的内在机制[J]. 中医药导报, 2016, 22(1): 22-25. |
| [48] |
汤春红, 肖雪, 段海真, 等. 乌头碱致中枢神经毒性机制的研究进展[J]. 广西医学, 2018, 40(20): 2448-2451. |
| [49] |
RAO S, SIKDAR S K. Modification of alpha subunit of RIIA sodium channels by aconitine[J]. Pflugers Archiv, 2000, 439(3): 349-355. |
| [50] |
YANG S L, LIU Z H, XIAO Y, et al. Chemical punch packed in venoms makes centipedes excellent predators[J]. Molecular & Cellular Proteomics, 2012, 11(9): 640-650. |
| [51] |
李宁, 苗明三, 白莉. 大毒中药临床毒性机制与解救措施[J]. 中华中医药杂志, 2022, 37(2): 659-664. |
| [52] |
张朝晖, 陈玉. 蜂蛰伤导致多器官功能障碍综合征研究进展[J]. 海南医学, 2020, 31(11): 1477-1480. |
| [53] |
左梦婷, 马骁, 黄思娟, 等. 钩吻物质作用基础和毒作用机制研究[C]//中国毒理学会. 中国毒理学会第十次全国毒理学大会论文集, 2023.
|
| [54] |
潘校琦, 彭成. 附子神经毒性研究进展[J]. 世界中医药, 2017, 12(11): 2551-2554, 2562. |
| [55] |
王卫. 天南星科4种有毒中药凝集素蛋白促炎作用机制及炮制的影响[D]. 南京: 南京中医药大学, 2019.
|
| [56] |
曹侃, 荣小雨. 有毒中药炮制减毒的方法研究[J]. 芜湖职业技术学院学报, 2021, 23(2): 44-46. |
| [57] |
那红宇, 鞠成国, 宋巧运, 等. 宋至清代白矾制半夏、天南星炮制历史沿革研究[J]. 亚太传统医药, 2017, 13(18): 51-53. |
| [58] |
郑雁雪, 王圆圆, 王琳, 等. 中药配伍减毒增效的现代研究及思考[J]. 中草药, 2023, 54(2): 386-395. |
| [59] |
栗焕焕, 张国琴, 邱紫莹, 等. 基于指纹图谱结合化学计量学的吴茱萸-甘草配伍减毒化学成分研究[J]. 中草药, 2022, 53(6): 1730-1739. |
| [60] |
郭玉岩, 马文保, 肖洪彬, 等. 基于UPLC-MS技术分析马钱子-甘草药对配伍汤液不同相态中毒效物质的变化规律[J]. 中草药, 2017, 48(23): 4880-4884. |
| [61] |
刘艳文. 甘草酸对中毒剂量下马钱子碱代谢动力学影响及解毒机制研究[D]. 长沙: 中南大学, 2010.
|
| [62] |
张思恒, 刘秋桂. 中草药毒性浅析[J]. 西北药学杂志, 2010, 25(4): 319-320. |
| [63] |
秦晓兵. 浅论中药的毒性及其减毒方法[J]. 北方药学, 2015, 12(3): 159-160. |
 2025, Vol. 42
2025, Vol. 42