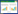文章信息
- 王正雨, 陈青山, 谭新华.
- WANG Zhengyu, CHEN Qingshan, TAN Xinhua.
- 甘草次酸修饰的紫草素脂质体联合光热对肝癌细胞的抗肿瘤疗效研究
- Anti-tumor effect of glycyrrhetinic acid modified shikonin liposomes combined with photothermal therapy on hepatoma carcinoma cells
- 天津中医药, 2025, 42(2): 216-222
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(2): 216-222
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.02.13
-
文章历史
- 收稿日期: 2024-09-24
2. 湖南中医药大学第一附属医院, 长沙 410007
肝癌是一种具有高度致死性的肿瘤,其发病率和病死率在全球范围内都位居前列[1]。根据国家癌症中心的统计数据显示,肝癌在中国的发病率和病死率均高于全球平均水平[2]。目前临床上对于肝癌的治疗方法包括肝切除、射频消融、经肝动脉化疗栓塞等,尽管这些手段可以在一定程度上延长肝癌患者的生存期,但是由于肝癌在早期常无特殊症状,因此往往很难及时发现,大部分肝癌患者被确诊时往往已处于中晚期,治疗效果仍有待提高[3]。因此,研究肝癌的综合治疗是重大的临床需求。
肝癌中医属“胁痛”“肝积”“臌胀”等范畴。大部分医家认为,肝癌多为气血运行不畅,痰热瘀毒等郁结于肝导致[4]。紫草作为中国的传统中药材,距今已有两千多年的历史,中医理论认为,紫草味甘、咸,性寒,归心、肝经,具有活血凉血、清热解毒等功效[5]。现代药理学研究也表明,紫草素(SHK)作为一种从紫草植物中萃取的有效成分,具有显著的抗癌作用[6],其作用途径包括通过抑制癌细胞增殖、诱导细胞凋亡、阻止癌细胞侵袭和转移等多种方式[7],对包括肝癌在内多种肿瘤具备强大的抑制作用[8],但由于SHK水溶性较差,肠道吸收快,“首过”效应明显,导致生物利用度低[9]。
光热疗法(PTT)是一种新型肿瘤治疗策略,目前受到越来越多研究人员的关注,其是通过光热剂吸收光能并有效转化为热能,从而提高肿瘤的局部温度,致使肿瘤细胞的细胞膜破裂或蛋白质变性,从而达到杀灭肿瘤的效果[10]。IR783是一种属于近红外花菁类小分子染料,具有较好的光热性能,使其在肿瘤的光热治疗方面备受关注[11]。目前,单纯的光热转换剂存在在肿瘤中递送效率差等问题,导致肿瘤区域过热而对正常组织造成不必要的损伤[12]。因此,对于此类光热染料,还需要使用能够靶向肿瘤细胞的递送系统以减少热量对健康组织造成的损伤[13]。
纳米递送系统逐渐成为癌症治疗中关注的焦点,目前,多种纳米颗粒已被研究用于癌症的治疗,例如脂质体、磁性、金属等纳米颗粒[14]。纳米颗粒既可以包载各种抗肿瘤药物,又可以在肿瘤血管中内皮细胞间隙运输,可以通过增强渗透性和保留效应(EPR)被动靶向肿瘤组织[15]。甘草次酸(GA)是从甘草根中提取的主要化合物之一,能够抑制肝癌发生和人肝细胞癌HepG2细胞增殖[16]。此外,甘草次酸还能够高效地靶向于肝癌细胞[17]。多项研究表明经过GA修饰的纳米药物递送系统呈现出显著的肝癌细胞主动靶向性[18-19],能够有效提高药物的治疗效果。
该研究创新性地制备一种以脂质体为载体,将SHK的抗肝癌效应和IR783的光热治疗功能相结合,表面修饰GA以利用其抗肝癌作用及肝癌细胞靶向效应,同时修饰聚乙二醇以有效防止颗粒间的聚集,从而维持纳米粒子在循环中的稳定性,增强EPR效应[20]是一种新型多功能脂质体(GSIL),随后对其理化性质和体外抗肿瘤效果进行了深入研究。
1 主要材料与仪器 1.1 材料胆固醇(北京索宝来科技有限公司);卵磷脂(北京索宝来科技有限公司);二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000,西安瑞禧生物技术有限公司,批号:R2A0230324);紫草素(SHK,上海源叶生物科技公司,HPLC > 98%,批号:B21682);红外荧光激发染料IR783(上海源叶生物科技公司,HPLC > 98%,批号:Y21153);DSPE-PEG2000-甘草次酸(DSPE-PEG2000-GA,西安瑞禧生物技术有限公司,批号:R00182215);无水乙醇(昆山金城试剂有限公司,分析纯,货号:10009218);三氯甲烷(昆山金城试剂有限公司,分析纯,货号:10006815);HepG2细胞(普诺赛生命科技有限公司);CCK-8试剂盒(同仁化学研究所);DAPI染色液(赛默飞世尔科技公司);4%多聚甲醛(Biosharp生物科技公司)。
1.2 仪器激光粒度仪(型号:Zetasizer Nano ZS90,英国马尔文公司);低电压透射电镜-TEM(型号:JEM1200EX,日本JEOL公司);紫外分光光度计(型号:UV1800,日本岛津公司);电子天平(型号:PX224ZH,奥豪斯仪器有限公司);旋转蒸发仪(型号:R-300 EL,瑞士BUCHI公司);超声波清洗仪(型号:SK5200H,上海科导超声仪器有限公司);超纯水机(型号:CCH-E100-VF,湖南创纯水处理有限公司);高低速台式冷冻离心机(型号:TGD-22MC,长沙湘锐离心机有限公司);LWIRPD-808-8F激光器(北京镭志威光电技术有限公司);FLuke TiS20+红外热成像仪(美国FLuke电子仪器仪表公司);Enspire多功能酶标仪(珀金埃尔默企业管理有限公司);HeroceLL 180二氧化碳培养箱(上海润度生物科技有限公司);Merk手持式细胞计数仪(美国MiLLipore Sigma公司);ZEISS LSM900激光共聚焦显微镜[卡尔蔡司(上海)管理有限公司]。
2 方法 2.1 脂质体的制备采用旋转蒸发法制备目标脂质体。将胆固醇、卵磷脂、DSPE-PEG2000、SHK、DSPE-PEG2000-GA、IR783(质量比=28∶4∶4∶2∶1∶1),加入10 mL无水乙醇:三氯甲烷(体积比=9∶1)混匀,在超声波清洗仪中超声10 min充分溶解,再将所得混合溶液转移至500 mL圆底烧瓶并置于旋转蒸发仪上,在60 ℃条件下负压真空旋转40 min除去有机溶剂,得到均匀的GSIL薄膜,加入10 mL超纯水在40 ℃条件下水化5 min,取出混合溶液超声分散30 min,最后得到GSIL,GSIL结构模型如图 1。按照相同实验流程,去掉DSPE-PEG2000-GA制备无靶头的SIL。
|
| 注:SHK,紫草素;IR783,近红外荧光染料IR783;DSPE-PEG2000,二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000;DSPE-PEG2000-GA,DSPE-PEG2000-甘草次酸。 图 1 GSIL模型图 Fig. 1 GSIL model |
室温条件下,在玻璃片上将封口膜平铺,使用镊子将铜网放置于封口膜上,采用液枪向铜网上滴加10 μL GSIL,10 min后使用小片滤纸将多余液体吸去,再用移液枪吸取10 μL 3%醋酸双氧铀滴在铜网上,3 min后,再次使用小片滤纸将多余的染色液体吸掉,待铜网自然晾干10 min后,使用低电压透射电镜拍摄脂质体的电镜形貌。选取1 mL GSIL溶液,逐渐注入样品池中。在25 ℃条件下,借助马尔文激光粒度仪ZS90进行检测,检测GSIL的粒径大小及分布、多分散指数(PDI)和电位,且对每个样本均进行3次平行测定。同时利用紫外分光光度计分别将游离SHK、游离IR-783、GSIL在200~1 200 nm范围内对其吸收光谱进行检测。
2.3 稳定性研究按前文2.1实验方法制备GSIL,所得GSIL混悬液置于4 ℃环境下保存,然后按前文2.2所述实验方法分别于1、3、5、7、9、11、13、15 d时测定GSIL的粒径大小,评估其稳定性。此外,将所制备的GSIL混悬液与MEM培养基(含10%胎牛血清)等体积混合,于37 ℃恒温水浴中孵育,同样的方法分别于0、2、4、6、8、10、12 h时测定GSIL的粒径大小,评估其血清稳定性。
2.4 GSIL的药物包封率取适量SHK溶于无水乙醇,定容后得到SHK溶液,以无水乙醇为空白,使用紫外分光光度计在200~800 nm波长范围内扫描,确定SHK的最大吸收波长为516 nm。然后取1 mg SHK,加入10 mL无水乙醇,超声分散10 min将其充分溶解,得到浓度为100 μg/mL的SHK溶液备用,再用无水乙醇稀释成浓度为5、10、20、30、40、50 μg/mL的不同溶液,采用紫外分光光度计测定相同条件下样品在SHK吸收峰的吸收值,代入坐标轴中获得SHK回归方程曲线。
取1 mL GSIL溶液,采用低速离心法在高速冷冻离心机中以5 500 r/min离心10 min(离心半径为17.5 cm),取0.5 mL上清液,加入2.5 mL无水乙醇并超声分散10 min充分破乳,所得溶液用紫外分光光度计在516 nm处测定吸光度,带入SHK回归方程曲线,得到M包。取0.5 mL GSIL溶液混悬液,加入2.5 mL无水乙醇并超声分散10 min充分破乳,所得溶液用紫外分光光度计在516 nm处测定吸光度,带入SHK吸收曲线方程曲线,得到M总。根据方程式计算SHK的包封率,包封率(%)=(M包/M总)×100%。
2.5 GSIL的光热性能研究取1 mL不同浓度的GSIL溶液(5、10、25、50 μg/mL),采用808 nm激光器在1.1 W/cm2条件下分别照射3 min,使用热成像仪观察GSIL溶液的温度变化,每间隔30 s记录1次。再取1 mL相同浓度(50 μg/mL)的GSIL溶液,采用808激光器分别在不同能量下(0.1,0.6,1.1,1.7 W/cm2)照射3 min,采用相同方法记录溶液的温度变化。
使用808 nm激光器在能量为1.1 W/cm2条件下分别照射浓度为50 μg/mL的GSIL和SIL溶液3 min,之后在室温条件下自然冷却,使用热成像仪每30 s记录一次温度,获得升温和冷却曲线。
2.6 细胞培养将HepG2细胞用10%胎牛血清、1%青-链霉素及MEM培养基配成的完全培养基在37 ℃、5%CO2条件下的培养箱中培养及传代。
2.7 细胞摄取实验将处于对数生长期的HepG2细胞接种于6孔板(2×105个/孔),然后将孔板置37 ℃、5% CO2条件下继续培养24 h,使细胞贴壁。然后分别加入SHK浓度为2 μg/mL的游离SHK、SIL和GSIL,每组设置3个复孔,然后继续培养12 h后弃去培养基,用磷酸盐缓冲溶液(PBS)清洗2~3遍,加入4 %多聚甲醛1 mL固定15 min,再次用PBS清洗2~3遍。随后在避光条件下每孔加入DAPI染色液100 μL,避光染色25 min后,弃掉染液,用PBS溶液冲洗3遍。避光条件下在激光共聚焦显微镜下观察并采集图像(IR783在633 nm激发波长下激发,DAPI在465 nm激发波长下激发)。
2.8 体外细胞毒性实验以人肝癌细胞HepG2为细胞模型,采用CCK-8法进行细胞毒性实验,测定不同浓度游离SHK、SIL、GSIL、GSIL+Laser对细胞生长的影响。将处于对数生长期的HepG2细胞接种于96孔板(8×103个/孔),用PBS填充孔板四周防止蒸发,然后将96孔板放置培养箱中继续培养24 h使细胞贴壁,再以换液的形式分别加入SHK浓度为3、4、5、6 μg/mL的上述不同含药培养基100 μL培养24 h,每种设6个复孔,GSIL+Laser组在终止培养4 h前,用808激光(2.5 W/cm2)照射3 min继续培养,最后再次以换液的形式向每孔加入含10 %CCK-8溶液的培养基100 μL,放入培养箱中避光孵育适当时间后取出,用酶标仪测定450 nm处的吸光度A。同时设置空白组、对照组,每组设6个复孔。最后计算细胞存活率,细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100%(As为实验孔吸光度,Ab为空白孔吸光度,Ac为对照孔吸光度)。
2.9 统计学方法实验数据采用均数±标准差(x±s)表示,应用SPSS 27.0.1软件进行统计学分析。采用单因素方差分析(one-way ANOVA analysis)确定多组间均数比较,并用LSD-t检验进行两两组间比较。P < 0.05为差异有统计学意义。
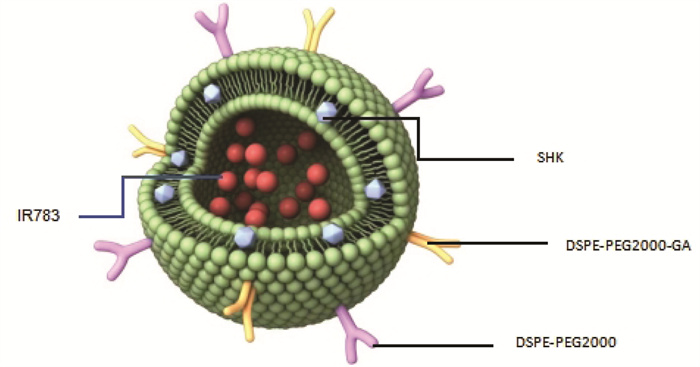
3 结果 3.1 GSIL的表征GSIL的透射电镜观察(图 2a)可见所制备的脂质体呈大小均一,形态规整的圆形,颗粒分散良好,无聚集现象。采用粒度仪测得脂质体的平均粒径大小为(209.67±2.88)nm(图 2b),粒径分布集中。Zeta电位为(-40.83±0.68)mV(图 2c),PDI值是0.20±0.01。因电镜观察的GSIL为干燥状态下的粒径大小,而激光粒度仪测得的粒径大小为水化状态下的粒径大小,因此电镜观察到的粒径小于粒度仪测得的粒径。
|
| 注:图a,GSIL的透射电镜图;图b,粒径分布图;图c,电位图;图d,SHK、IR-783及GSIL的紫外光谱。 图 2 GSIL的表征 Fig. 2 Characterization of GSIL |
通过紫外分光光度计测量,SHK在516 nm处有特征吸收峰,IR783在700~800 nm处有特征吸收峰。SHK/ IR-783负载的GSIL在紫外-可见光谱中在788 nm处有明显的吸收(图 2d),这表明GSIL具有IR783的光学性质,可以用于光热治疗。
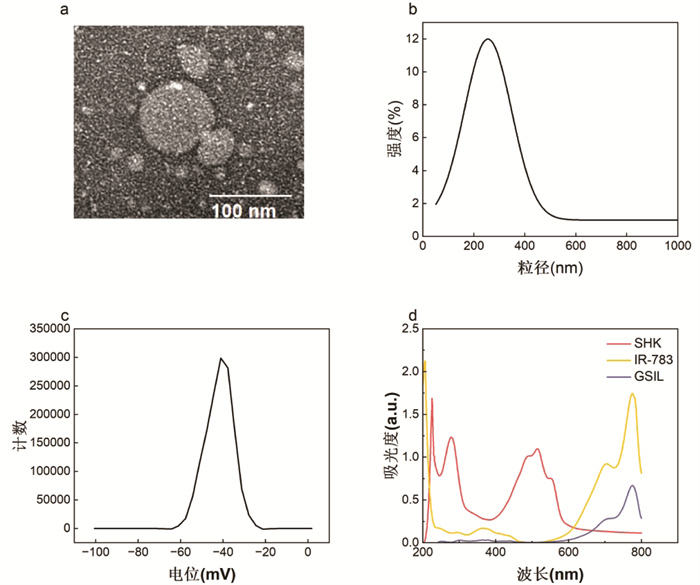
3.3 稳定性评价如上文所述测定GSIL稳定性,可以观察到(图 3a)GSIL的粒径大小在15 d内波动较小,在含血清培养基中孵育12 h粒径也无明显波动(图 3b),表明GSIL制备方法合适,稳定性及血清稳定性良好。
|
| 图 3 GSIL的稳定性(a)和血清稳定性(b) Fig. 3 Stability(a) and serum stability(b) of GSIL |
用紫外分光光度计得出IR783吸收曲线方程曲线为Y=0.021 02X-0.008 42(R2=0.999 6),图 4a表明SHK在5~50 μg/mL浓度范围具有良好的线性关系。通过代入包封率公式,测得SHK包封率(53.65±4.43)%,证明所制备的GSIL成功搭载SHK。
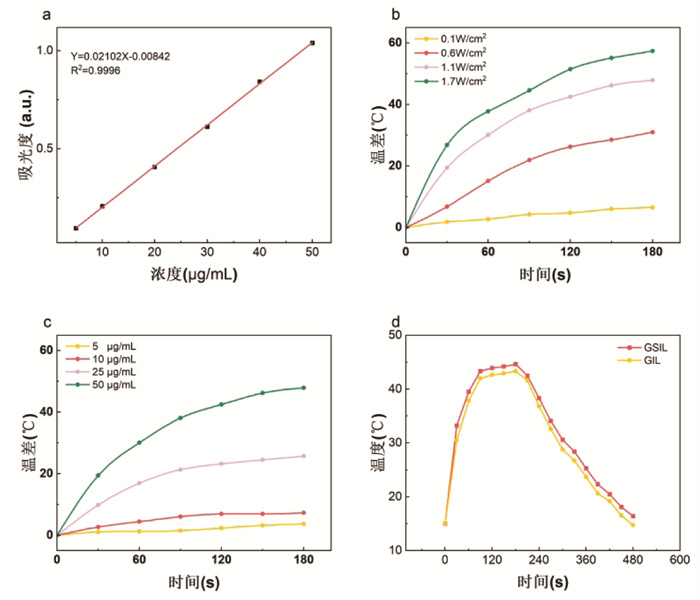
|
| 注:图a,SHK在5~50 μg/mL浓度范围吸收曲线方程;图b,50 μg/mL的GSIL在不同能量激光照射后的升温曲线;图c,1.1 W/cm2激光照射下不同浓度的GSIL的升温曲线;图d,GSIL和SIL的升温冷却曲线。 图 4 紫草素吸收曲线及GSIL体外光热实验 Fig. 4 Absorption curves of SHK and photothermal experiment of GSIL in vitro |
图 4b显示,同一浓度(50 μg/mL)的GSIL,经过808激光器照射后,温度明显上升,且照射相同的时间,激光能量越大,温度越高。图 4c同样可以看出,采用808激光器在同一能量(1.1 W/cm2)下照射3 min,照射相同时间时GSIL浓度越大温度越高。这些结果表明SIL具有良好的光热性能,并且GSIL升温温度与激光能量、GSIL浓度呈正相关。
3.6 GSIL和SIL冷热曲线GSIL和SIL的冷热曲线如图 4d,可以明显地观察到,在大部分的时间点,GSIL的温度都略高于SIL,GSIL混悬液的最高温度为46.2 ℃,SIL混悬液的最高温为42.0 ℃,GSIL是SIL的1.1倍,这可能是因为SHK的有效共包封导致GSIL激发热量的储存和抑制热能扩散,从而减少了热损失。
3.7 细胞摄取实验为了证明采用脂质体共同包封紫草素/IR783能够有效提高HepG2细胞的摄取,并证明采用甘草次酸修饰脂质体能够提高对HepG2细胞靶向性,笔者通过使用激光共聚焦显微镜来观察蓝色荧光与红色荧光重叠部分,从图 5可以明显的看到HepG2细胞对游离IR783基本无明显摄取,而SIL、GSIL红蓝荧光重叠部分明显,GSIL红蓝荧光重叠部分荧光相较于SIL也更强。此外,可以看出SIL、GSIL组细胞数明显少于游离IR783组,这可能是由于药物摄取增加而导致细胞死亡脱落。这说明脂质体的包封、甘草次酸的修饰显著增加了HepG2细胞对药物的摄取,提高了对HepG2细胞的杀伤抑制作用(蓝色荧光:Dapi,红色荧光:IR783)。
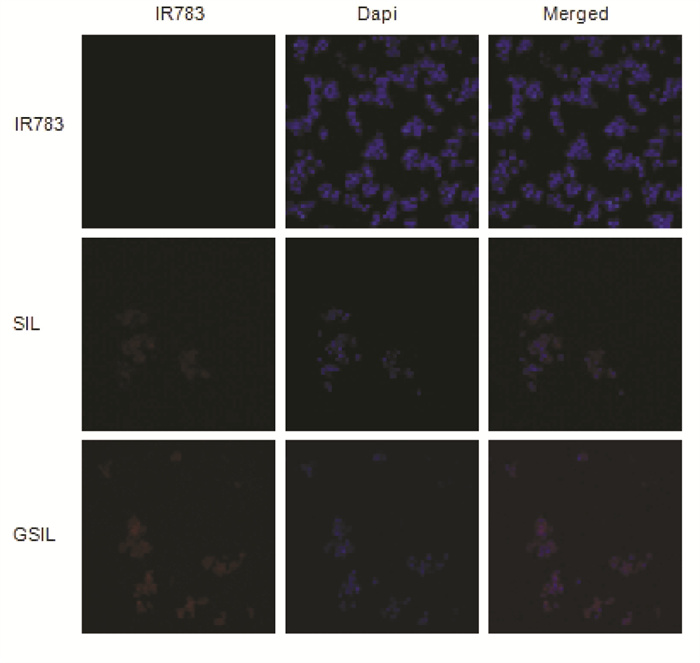
|
| 注:SIL,紫草素/IR783脂质体;GSIL,甘草次酸修饰的紫草素/IR783脂质体;IR783,游离红外荧光激发染料IR783;DAPI,DAPI染色液;Megerd,合并图。 图 5 HepG2细胞摄取实验 Fig. 5 HepG2 cellular uptake experiment |
通过在体外比较游离SHK、SIL、GSIL、GSIL+Laser对人肝癌HepG2细胞的细胞毒性,如图 6所示。当药物浓度为3 μg/mL时,SIL、GSIL、GSIL+Laser对比游离SHK组,细胞活性均有明显下降,差异具有统计学意义(P < 0.001),但其中SIL、GSIL组细胞活性无明显差异,差异无统计学意义(P>0.05)。当药物浓度为4、5、6 μg/mL时,细胞存活率均表现为游离SHK>SIL>GSIL>GSIL+Laser组,表明多功能GSIL结合光热治疗能显著降低HepG2细胞存活率,提高药物的抑癌效果,差异具有统计学意义(P < 0.001)。IL、GSIL组细胞活性无明显差异,差异无统计学意义(P>0.05)。当药物浓度为4、5、6 μg/mL时,细胞存活率均表现为游离SHK>SIL>GSIL>GSIL+Laser组,表明多功能GSIL结合光热治疗能显著降低HepG2细胞存活率,提高药物的抑癌效果,差异具有统计学意义(P < 0.001)。
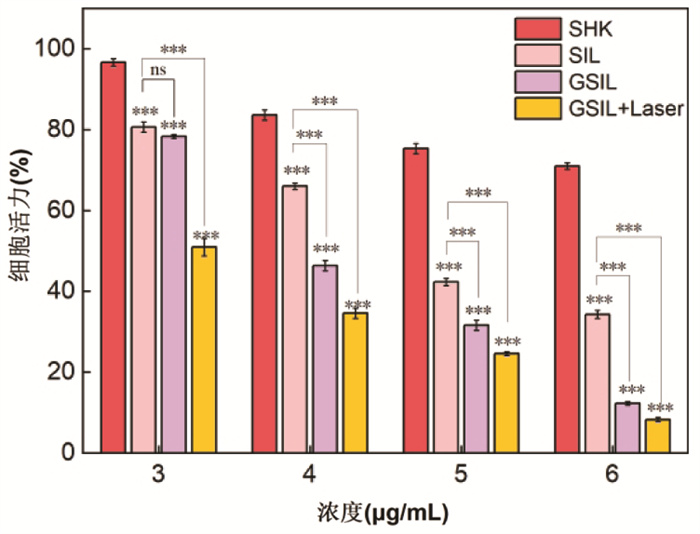
|
| 注:SHK,游离紫草素;SIL,紫草素/IR783脂质体;GSIL,甘草次酸修饰的紫草素/IR783脂质体;GSIL+Laser,甘草次酸修饰的紫草素/IR783脂质体+激光照射;同一浓度的不同药物间两两比较,nsP>0.05,***P<0.001。 图 6 细胞毒性实验 Fig. 6 Cytotoxicity test |
光热治疗是一种新兴的癌症治疗技术,其机制主要是利用光热剂产生的局部热效应对肿瘤细胞进行消融[21]。目前,这一技术受到越来越多研究人员的广泛关注。IR783具有优异的光疗性能,使其在光热治疗方面受到了越来越多研究人员的关注[22]。IR783本身稳定性较差,代谢迅速等性质也给其高效应用带来了一定的限制[23]。由于光热剂在肿瘤上的热量分布不均匀,很难实现肿瘤完全消退,甚至还可能会对正常组织造成严重损害[24]。SHK是一种天然的生物碱,展现出非常显著的抗肿瘤、抗炎、抑菌作用,但由于其结构的特殊性以及水溶性较差等问题,其生物利用度较低,不易被人体吸收,限制了其进一步应用[25]。因此,如何提高SHK、IR783的生物利用度,促进其在抗肿瘤领域的广泛应用,是当前需要解决的核心问题之一。
该研究采用旋转蒸发法成功制备了一种多功能GSIL。GSIL是以光热材料IR783和抗肿瘤药物SHK为主要组成部分,两者共同作用实现对肿瘤的光热化联合治疗。实验证明,所制备的GSIL电镜形态呈规则的圆形,测得平均粒径(209.67±2.88)nm、平均电位为(-40.83±0.68)mV、PDI为0.20±0.01,GSIL具有极小的粒径和较高的光热能力,且稳定性好,在近红外光照射下可以成功升温达到杀灭肿瘤细胞的适宜温度。GSIL拥有良好的包封率和光热作用,能够更高效地将抗肿瘤药物SHK递送至HepG2细胞,并联合光热消融进一步提高抑癌作用。表征和体外实验表明,GSIL展现出较好的多模式治疗效果,在光热治疗联合中药抗肿瘤中起到了积极的作用。该研究创新性地制备一种新型的GSIL,其具备良好的光热/抗肿瘤协同疗效,为纳米中药联合光热消融治疗肝癌提供了新视角。
| [1] |
BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA-A Cancer Journal for Clinicians, 2024, 74(3): 229-263. DOI:10.3322/caac.21834 |
| [2] |
陈建国, 张永辉, 陆建华, 等. 中国肝癌预防与筛检工作实践及防控挑战[J]. 中国肿瘤, 2023, 32(11): 836-847. |
| [3] |
WEN N Y, CAI Y L, LI F Y, et al. The clinical management of hepatocellular carcinoma worldwide: A concise review and comparison of current guidelines: 2022 update[J]. Bioscience Trends, 2022, 16(1): 20-30. DOI:10.5582/bst.2022.01061 |
| [4] |
黄婉婷, 郭涛, 张晶, 等. 原发性肝癌气滞血瘀证的研究进展[J]. 世界科学技术-中医药现代化, 2023, 25(11): 3724-3727. |
| [5] |
国家药典委员会. 中华人民共和国药典-三部: 2020年版[M]. 北京: 中国医药科技出版社, 2020: 340.
|
| [6] |
YAN C M, LI Q X, SUN Q, et al. Promising nanomedicines of shikonin for cancer therapy[J]. International Journal of Nanomedicine, 2023, 18: 1195-1218. DOI:10.2147/IJN.S401570 |
| [7] |
GUO C J, HE J L, SONG X, et al. Pharmacological properties and derivatives of shikonin-a review in recent years[J]. Pharmacological Research, 2019, 149: 104463. DOI:10.1016/j.phrs.2019.104463 |
| [8] |
王俊玲, 李宏伟, 杨春菊, 等. 紫草素的抗癌作用机制研究进展[J]. 安徽医药, 2022, 26(6): 1061-1067, 1273. |
| [9] |
SUN Q, GONG T, LIU M L, et al. Shikonin, a naphthalene ingredient: Therapeutic actions, pharmacokinetics, toxicology, clinical trials and pharmaceutical researches[J]. Phytomedicine, 2022, 94: 153805. DOI:10.1016/j.phymed.2021.153805 |
| [10] |
LI C W, CHENG Y, LI D W, et al. Antitumor applications of photothermal agents and photothermal synergistic therapies[J]. International Journal of Molecular Sciences, 2022, 23(14): 7909. DOI:10.3390/ijms23147909 |
| [11] |
PLASKO D P, JORDAN C J, CIESA B E, et al. Visible light-promoted alkylation of imines using potassium organotrifluoroborates[J]. Photochemical & Photobiological Sciences, 2018, 17(5): 534-538. |
| [12] |
OVERCHUK M, WEERSINK R A, WILSON B C, et al. Photodynamic and photothermal therapies: Synergy opportunities for nanome- dicine[J]. ACS Nano, 2023, 17(9): 7979-8003. DOI:10.1021/acsnano.3c00891 |
| [13] |
REN Y T, YAN Y Y, QI H. Photothermal conversion and transfer in photothermal therapy: From macroscale to nanoscale[J]. Advances in Colloid and Interface Science, 2022, 308: 102753. DOI:10.1016/j.cis.2022.102753 |
| [14] |
邓文瑞, 陈琨, 何洁, 等. 纳米颗粒在前列腺癌治疗中的应用[J]. 重庆医科大学学报, 2024, 49(6): 687-693. |
| [15] |
KALYANE D, RAVAL N, MAHESHWARI R, et al. Employment of enhanced permeability and retention effect(EPR): Nanoparticle-based precision tools for targeting of therapeutic and diagnostic agent in cancer[J]. Materials Science and Engineering: C, 2019, 98: 1252-1276. |
| [16] |
HE Z Y, ZHENG X, WU X H, et al. Development of glycyrrhetinic acid-modified stealth cationic liposomes for gene delivery[J]. International Journal of Pharmaceutics, 2010, 397(1/2): 147-154. |
| [17] |
闫付晴, 梁菊, 林阳, 等. 基于甘草次酸的肝癌靶向纳米递送系统研究进展[J]. 中国药学杂志, 2024, 59(12): 1065-1073. |
| [18] |
CHANG M X, WU M M, LI H M. Antitumor activities of novel glycyrrhetinic acid-modified curcumin-loaded cationic liposomes in vitro and in H22 tumor-bearing mice[J]. Drug Delivery, 2018, 25(1): 1984-1995. |
| [19] |
JIANG H, LI Z P, TIAN G X, et al. Liver-targeted liposomes for codelivery of curcumin and combretastatin A4 phosphate: Preparation, characterization, and antitumor effects[J]. International Journal of Nanomedicine, 2019, 14: 1789-1804. |
| [20] |
MOZAR F S, CHOWDHURY E H. Impact of PEGylated nanoparticles on tumor targeted drug delivery[J]. Current Pharmaceutical Design, 2018, 24(28): 3283-3296. |
| [21] |
LI X S, LOVELL J F, YOON J, et al. Clinical development and potential of photothermal and photodynamic therapies for cancer[J]. Nature Reviews Clinical Oncology, 2020, 17(11): 657-674. |
| [22] |
GENG S N, GUO M Q, ZHAN G T, et al. NIR-triggered ligand-presenting nanocarriers for enhancing synergistic photothermal-chemotherapy[J]. Journal of Controlled Release, 2023, 353: 229-240. |
| [23] |
WU Y M, ZENG C H, LV J J, et al. Tumor-targeted cRGD-coated liposomes encapsulating optimized synergistic cepharanthine and IR783 for chemotherapy and photothermal therapy[J]. International Journal of Nanomedicine, 2024, 19: 6145-6160. |
| [24] |
ZHAO L P, ZHANG X, WANG X X, et al. Recent advances in selective photothermal therapy of tumor[J]. Journal of Nanobiotechnology, 2021, 19(1): 335. |
| [25] |
王昕怡, 陈佳佳, 谢祎帆, 等. 紫草素纳米结构脂质载体的制备与评价[J]. 中南药学, 2024, 22(5): 1256-1263. |
2. The First Clinical Chinese Medicine College of Hunan University of Chinese Medicine, Changsha 410007, China
 2025, Vol. 42
2025, Vol. 42