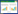文章信息
- 刘燕, 陈晓阳, 张理, 等.
- LIU Yan, CHEN Xiaoyan, ZHANG Li, et al.
- 基于网络药理学和实验验证探讨参兰颗粒治疗主动脉弓缩窄的心力衰竭机制研究
- Exploration of effect and mechanism of Shenlan Granule on transverse aortic constriction-induced heart failure in mice based on network pharmacology and experimental verification
- 天津中医药, 2025, 42(2): 223-232
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(2): 223-232
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.02.14
-
文章历史
- 收稿日期: 2024-09-11
2. 郑州市中医院, 郑州 450046;
3. 广州中医药大学-郑州市中医院方证研究联合实验室, 郑州 450046;
4. 广州中医药大学基础医学院, 广州 510405;
5. 河南省中医药心血管病重点实验室, 郑州 450046;
6. 河南省慢性病中医药转化工程技术研究中心, 郑州 450046
心力衰竭是心室充盈或射血障碍导致全身体循环或肺循环瘀血,引起胸闷、气促、肢体水肿的复杂临床综合征。该病具有高发病率和高病死率以及难以治愈的特点,是多种心脏病的最终归宿[1-2]。目前针对心力衰竭的药物治疗以“新四联”为主,尽管这些药物可降低患者的住院率及病死率,仍有停药反应、血管性水肿、高钾血症的风险[2]。因此探索心力衰竭的发病机制及防治具有重要的意义。
中医药治疗心力衰竭已有两千多年历史,在改善临床症状、提高生活质量、增加活动耐量等方面具有一定优势[3]。中医认为本虚标实为心力衰竭的基本病机,益气活血是心力衰竭的基本治法[4]。课题组结合心力衰竭的4个发展阶段及传统中医理论,认为心力衰竭终末期瘀痰久不化成毒,单用益气活血化痰法并不完全符合终末期病机,毒邪在其中发挥重要作用,因此结合心力衰竭治法化裁为参兰颗粒(SLG)。该方具有益气活血化痰解毒之功效,在临床上有良好的治疗效果,但是其治疗机制尚不明确。本研究拟通过网络药理学及实验验证探讨SLG干预心力衰竭的作用机制。
1 材料与方法 1.1 网络药理学 1.1.1 SLG的活性成分收集及靶点预测使用TCMSP数据库(https://tcmsp-e.com/)检索红参、丹参、羊红膻、泽兰、绞股蓝的所有活性成分及靶点。以口服生物利用度(OB)≥30%、类药性(DL)≥0.18来筛选SLG的活性成分。通过登录BATMAN-TCM数据库(http://bionet.ncpsb.org.cn/batman-tcm/)获得羊红膻可信度高的蛋白作为候选基因,删除无效重复靶点。通过Uniprot(https://www.uniprot.org/)校准靶点得到标准化的基因名。
1.1.2 获取心力衰竭的相关靶点使用关键词“heart failure”在Gene Cards、OMIM数据库中获取疾病相关靶点,excel剔除重复基因,Uniprot数据库校正心力衰竭的靶点基因。
1.1.3 药物-疾病靶点分析通过Venney2.1.0软件制作Venn图,获得药物成分靶点与疾病靶点的交集基因,并用Cytoscape3.7.2软件构建成分靶点网络图。
1.1.4 构建蛋白互作网络(PPI)将心力衰竭和SLG的靶点导入String数据库,物种类型设为“Homo sapiens”,交互作用评分设为0.7,将获得的PPI数据导入Cytoscape3.7.2构建PPI图,通过颜色和节点大小评估Degree的大小,节点大小和Degree值成正比,边的粗细与Combine score值成正比。
1.1.5 GO功能和KEGG通路分析使用Rstudio将交集基因转化为Entrez IDs,用cluster Profiler软件进行GO功能和KEGG富集分析,设置物种为人,筛选标准为P < 0.05,用Rstudio将数据进行可视化分析。
1.2 动物实验材料 1.2.1 动物60只6~8周龄的雄性C57BL/6小鼠,体质量(24.24±1.70)g,实验动物由广州锐格生物科技有限公司提供,许可证号SCXK(粤)2021-0059,质量合格证号No.4482720000540,饲养于广州中医药大学中药学院动物实验中心[许可证号:SYXK(粤)2019-0202],所有动物均在SPF级环境下自由喂养普通饲料、饮用清洁水,实验环境温度21~26 ℃,相对湿度40%~70%,12/12 h明暗交替。实验方案已通过广州中医药大学中药学院实验动物伦理审查(伦理审批号:ZYD-2023-119),实验程序严格遵守3R动物伦理学。
1.2.2 药物与试剂SLG由红参20 g,丹参20 g,羊红膻10 g,泽兰10 g,绞股蓝20 g组成,由郑州市中医院统一提供,并经主任药师陶继阳鉴定为合格。卡托普利片(批号:221005)购自国药集团汕头金石制药有限公司;前体脑钠肽(NT-proBNP,批号:SEKM-0298)、白细胞介素-6(IL-6),批号:SEKM-0007)、IL-1β(批号:SEKM-0002)、肿瘤坏死因子(TNF-α,批号:SEKM-0034)酶联免疫试剂盒均购自北京索莱宝科技有限公司;苏木精-伊红(HE)染液(批号:GP1031)、马松(Masson)染色(批号:GP1032)、WGA试剂(批号:GDP1020)均购自赛维尔生物科技有限公司;胞内磷脂酰肌醇激酶(PI3K)蛋白抗体(批号:AF6242)、p-PI3K蛋白抗体(批号:AF3242)、丝氨酸/苏氨酸蛋白激酶(AKT)蛋白抗体(批号:AF6261)、p-AKT蛋白抗体(批号:AF63262)、核因子(NF-κB)蛋白抗体(批号:AF5006)、p-NF-κB蛋白抗体(批号:AF2006)、二抗(批号:S0001)均购自江苏亲科生物有限公司;逆转录试剂盒(批号:11142ES10)购自翌圣生物科技有限公司。
1.2.3 仪器超声机(飞依诺科技股份有限公司,主机VINNO6 LAB,探头X10-23L);核酸蛋白定量仪(赛默飞世尔科技公司,NANODROP 2000);实时荧光定量PCR仪(赛默飞世尔科技公司,QuantStudioTM 1 Plus);多功能酶标仪(帝肯公司,TECAN SPARK);低温组织研磨仪(武汉赛维尔有限公司,KZ-Ⅲ-FP);正置显微镜(奥林巴斯科技有限公司,VS200);负压旋蒸仪(上海爱朗仪器有限公司,EYBL4);微量高速冷冻离心机(广州吉迪仪器有限公司,JIDI-17R)。
1.3 动物实验方法 1.3.1 主动脉弓缩窄模型(TAC)的构建小鼠腹腔注射0.3%戊巴比妥纳溶液(0.1 mL/10 g)麻醉小鼠后仰卧位固定于鼠板上,脱去颈、胸部毛发并消毒,剪开近胸骨处皮肤,沿胸骨正中剪开至第二肋骨上缘,分离胸腺暴露主动脉弓,用直径0.4 mm垫针(27 G)置于左颈总动脉及头臂干之间的主动脉弓处,用6-0不可吸收缝线穿线并结扎,观察右颈总动脉较左颈总动脉明显增粗为造模成功,抽出垫针并用6-0可吸收缝线逐层关胸缝合。
1.3.2 药品制备SLG经水煎、过滤后置于负压旋蒸仪(50 ℃)浓缩为冻干粉,依据等效剂量系数折算法[5](成人70 kg,小鼠与成人等效剂量比值9.1 mg/kg换算)将每剂冻干粉分别稀释至含生药0.052 g/mL(终体积38.5 mL)和0.208 g/mL(终体积153.8 mL)两种浓度,在-20 ℃冰箱保存备用,卡托普利片25 mg粉碎后溶解至76.9 mL的生理盐水中,配置成0.325 g/mL浓度的溶液。
1.3.3 分组与给药小鼠适应性喂养1周后,对小鼠行主动脉弓缩窄手术,假手术组仅穿线不缩窄,将缩窄后存活的小鼠随机分为4组,SLG低剂量组、SLG高剂量组和卡托普利组每天给药剂量分别为5.2、20.8和3.25 mg/kg。模型组每天灌胃0.01 mL/g生理盐水。
1.3.4 小动物彩超手术后4周将小鼠麻醉后,在持续麻醉状态下行经胸超声心动图检测,采集左室长轴切面和左室短轴切面的M模式图像,测量射血分数(EF)、短袖缩窄分数(FS)、左心室收缩末期内径(LVIDs)和左心室舒张末期内径(LVIDd)。
1.3.5 动物取材小鼠超声检测后行眼球取血,离心后的血清放-80 ℃冰箱冷冻用于血清学检测,迅速剪下心脏,去除多余组织后在冰上用磷酸盐缓冲溶液(PBS)清洗,用吸水纸吸干水分后称质量拍照,一部分心脏置于4%多聚甲醛中用于病理染色,一部分心脏剪成小块分装后置于液氮中速冻,并放-80 ℃冰箱中冷冻用于后续检测。
1.3.6 酶联免疫吸附法(ELISA)检测小鼠血清中NT-proBNP、IL-6的水平用ELISA检测血清中NT-proBNP、IL-6、IL-1β、TNF-α的含量,操作严格按照试剂盒说明。
1.3.7 HE染色观察心肌组织病理损伤情况将心脏石蜡切片用二甲苯及梯度无水乙醇中脱蜡至水,加入苏木素染液染色5 min,流水浸洗后用分化液分化数秒,浸洗后苏木素返蓝液返蓝,用伊红染液染色5 min,加入梯度无水乙醇和脱蜡透明液脱水透明,风干后用中性树胶封片在显微镜下观察。
1.3.8 Masson染色观察心肌胶原纤维沉积心脏石蜡切片脱蜡至水后,加入重铬酸钾过夜,按照使用说明书分别用铁苏木素、丽春红酸性品红、磷酸钼、苯胺蓝溶液染色,脱水封片并在显微镜下观察,用Image J软件测量心肌胶原纤维沉积比例。
1.3.9 WGA染色观察心肌细胞肥大情况心脏石蜡切片脱蜡至水,用EDTA抗原修复缓冲液加热修复,PBS洗涤5 min,圈出组织,滴加WGA染液避光染色30 min,DAPI染液避光染色10 min,自发荧光淬灭剂5 min,每次染色后均用PBS洗涤,洗涤后抗荧光淬灭封片剂封片并镜下观察,用Image J软件测量心肌细胞平均横截面面积。
1.3.10 qPCR检测心肌中的IL-1β、AKT、NF-κB基因表达取小鼠部分心肌组织加入TrIzol裂解液,匀浆提取总RNA,测量RNA的纯度使OD260/OD280为1.8~2.0,按照Hifair Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR说明书进行逆转录,按照Hieff UNICON Universal Blue qPCR SYBR Green Master Mix说明书进行扩增,反应条件:预变性95 ℃ 2 min 1个循环,变性95 ℃ 10 s,退火60 ℃ 30 s,40个循环,用GAPDH为RNA内参基因,采用2-ΔΔCt计算RNA的相对含量,引物由上海生工生物工程有限公司提供。引物序列见表 1。
取各组心肌组织,加入RIPA裂解液,组织匀浆超声。根据BCA蛋白定量的结果,加入loading buffer、pbs配平蛋白,98 ℃变性5 min。制备10%聚丙烯酰胺凝胶,将样本加入凝胶孔中,电泳后半干转置聚偏氟乙烯(PVDF)膜上,用5%脱脂奶粉室温封闭2 h 30 min,分别加入稀释的抗体p-PI3K(1∶1 000)、PI3K(1∶1 000)、p-AKT(1∶1 000)、AKT(1∶1 000)、NF-κB(1∶1 000)、GAPDH(1∶2 000),1 h室温后4 ℃封闭过夜并复温1 h,TBST洗膜3次,每次10 min,加入HRP标记的山羊抗兔IgG抗体(1∶2 000)室温孵育2 h,TBST洗膜后在显微成像仪器中曝光用ECL发光液浸泡的条带,采用Image J软件测定灰度值分析各组蛋白的表达水平。
1.3.12 统计学方法采用SPSS 26统计分析,两两比较采用t检验,多组间比较采用单因素方差分析,计量数据以均数±标准差(x±s)表示,采用GraphPad Prism 9.0绘制统计图,P < 0.05为差异有统计学意义。
2 结果 2.1 SLG的有效成分通过TCMSP检索,以OB≥30%,DL≥0.18并剔除无效成分后,筛选收集到红参4个成分、丹参60个成分、泽兰2个成分、绞股蓝15个成分。羊红膻通过BATMAN-TCM数据库,在Score cutoff>0.84(LR=80.88)、P<0.05条件下,得到6个成分。所有药物成分中去重后共得到84个成分。
2.2 心力衰竭相关靶点以Relevance score>5为靶点纳入标准,分别从GeneCards及OMIM数据库中获得3 675个、620个靶点,去重后得到心力衰竭相关靶点4 112个,通过Uniprot数据库校正并取交集,获得154个SLG治疗心力衰竭的交互靶点基因,见图 1。

|
| 图 1 SLG治疗心力衰竭交集靶基因韦恩图 Fig. 1 Venn diagram of intersection targets of SLG and heart failure |
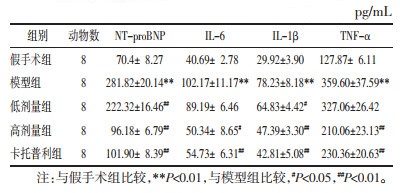
将药物-成分-靶点数据用Cytoscape3.7.2作图,图中包括241个节点和781条边,度值排名前5的核心成分分别是:槲皮素(Quercetin)、β-谷甾醇(Beta-sitosterol)、木犀草素(Luteolin)、丹参酮IIA(Tanshinone IIA)、隐丹参酮(Cryptotan shinone),见图 2。
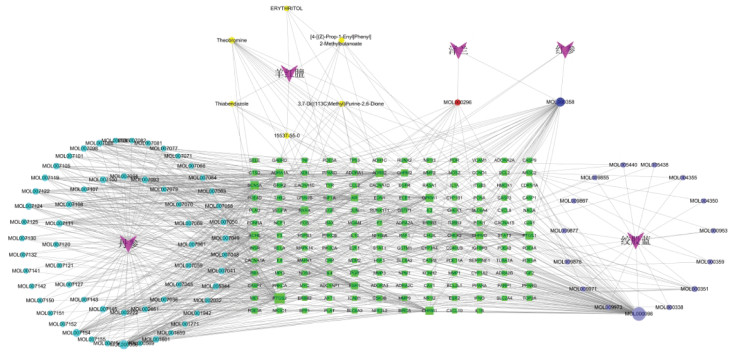
|
| 注:菱形代表SLG,圆形代表有效成分,矩形代表作用靶点。 图 2 SLG有效成分-作用靶点-疾病网络 Fig. 2 Network diagram of ingredient of SLG-targets-disease |
将得到的154个交互靶点基因导入String数据库,得到的PPI数据用Cytoscape3.7.2软件绘制PPI网络图。选择得到度(Degree)>5的靶点,拓扑分析显示有98个节点和2 152条边。其中排名前10的关键靶点为IL-6、肿瘤蛋白p53(TP53)、AKT1、信号传导及转录激活蛋白3(STAT3)、表皮生长因子受体(EGFR)、TNF、IL-1β、原癌基因(JUN)、半胱天冬酶3(CASP3)、髓细胞组织增生病毒癌基因同源物(MYC),SLG与心力衰竭的PPI网络图见开放科学标识码(OSID)。
2.5 GO功能分析GO分析共筛选出2 841个条目,其中生物过程(BP)、细胞成分(CC)及分子功能(MF)分别为2 499条、108条和234条。分别筛选其中排名前10的作图,见图 3。SLG的BP主要参与脂多糖和活性氧的反应等,CC主要涉及薄膜筏、突触前膜、突触后膜等,MF主要涉及转录因子和核受体活性等。
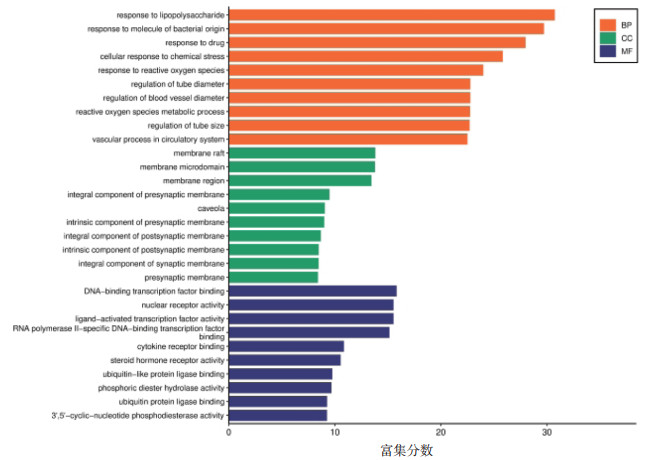
|
| 图 3 GO功能注释条形图 Fig. 3 Bar diagram of GO functional enrichment analysis |
KEGG通路分析共得到183条药物治疗心力衰竭的通路,根据P值筛选其中排名前20的通路,见图 4。主要涉及的通路有PI3K-AKT通路、MAPK通路、AGE-RAGE通路、cAMP通路、NF-κB通路等。提示SLG可能通过上述多条通路调节干预心力衰竭,而PI3K/AKT信号通路可能是其中最关键的通路。
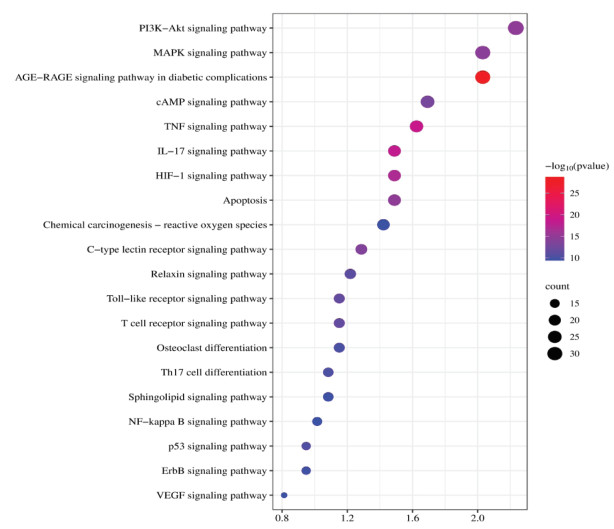
|
| 注:横坐标为富集到通路上的基因数目,富集到通路上的基因越多气泡越大,颜色越红,P值越小,显著性越高。 图 4 KEGG富集分析气泡图(top20) Fig. 4 Bubble diagram of KEGG functional enrichment analysis(top20) |
假手术组状态良好,动作敏捷、饮食与饮水正常,模型组小鼠精神欠佳、气喘、呼吸急促,动作迟缓。给药组小鼠状态较模型组改善。彩超结果显示,与假手术组相比,模型组小鼠EF、FS降低,差异有统计学意义(P < 0.01),LVIDs、LVIDd值增加,差异有统计学意义(P < 0.01),提示模型组小鼠出现心腔扩大、心脏收缩功能障碍等心力衰竭结构改变。SLG低剂量组、高剂量组与卡托普利组的EF、FS较模型组升高,差异有统计学意义(P < 0.01),LVIDs、LVIDd值缩小,差异有统计学意义(P < 0.05或P < 0.01),提示心室收缩功能明显改善,心功能增强,见图 5。
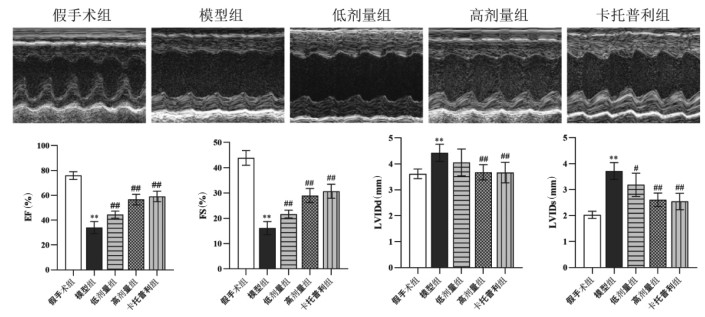
|
| 注:与假手术组比较,**P<0.01,与模型组比较,#P<0.05,##P<0.01。 图 5 SLG对小鼠心功能的影响 Fig. 5 Effects of SLG on cardiac function of mice |
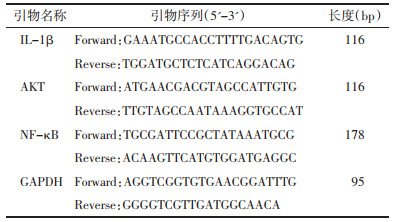
ELISA结果显示,与假手术组比较,模型组小鼠血清中的NT-proBNP、IL-6、IL-1β、TNF-α水平升高,差异有统计学意义(P < 0.01)。与模型组比较,SLG高剂量组、卡托普利组小鼠的NT-proBNP、IL-6、IL-1β、TNF-α降低,差异有统计学意义(P < 0.05或P < 0.01);SLG低剂量组的血清IL-6、TNF-α水平降低差异无统计学意义(P>0.05);血清IL-1β水平降低,差异有统计学意义(P < 0.05),血清NT-proBNP水平降低,差异有统计学意义(P < 0.01),见表 2。提示SLG可改善模型小鼠的血清心力衰竭标志物NT-proBNP及炎症水平。
HE染色结果显示,假手术组小鼠心肌细胞形态正常、排列整齐,无明显的炎症细胞浸润;模型组心肌细胞结构异常、排列紊乱,组织内有明显的炎症细胞浸润,以血管周围居多;与模型组相比,SLG低剂量、高剂量组及卡托普利组心肌细胞排列较为规则,炎症细胞浸润减少,心肌细胞损伤明显改善,见图 6。
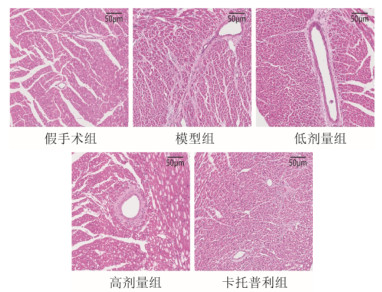
|
| 图 6 各组小鼠心肌组织HE染色(×200,刻度尺:50 μm) Fig. 6 HE staining of myocardial tissue of mice in each group(×200, scale: 50 μm) |
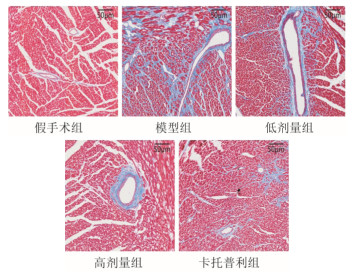
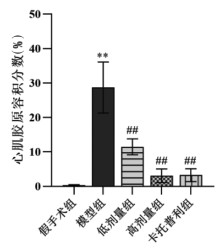
Masson染色结果显示,模型组小鼠较假手术组小鼠心肌组织的胶原纤维沉积明显增多,差异有统计学意义(P < 0.01);SLG低剂量组、高剂量组、卡托普利组心肌胶原纤维沉积程度相较模型组均降低,差异有统计学意义(P < 0.01),见图 7、图 8。提示SLG可减轻心力衰竭小鼠的心肌纤维化水平。
|
| 图 7 各组小鼠心肌组织Masson染色(×200,刻度尺:50 μm) Fig. 7 Masson staining of myocardial tissue of mice in each group(×200, scale: 50 μm) |
|
| 注:与假手术组比较,**P<0.01,与模型组比较,##P<0.01。 图 8 各组小鼠心肌胶原容积分数 Fig. 8 Collagen volume fraction of myocardial tissue of mice in each group |
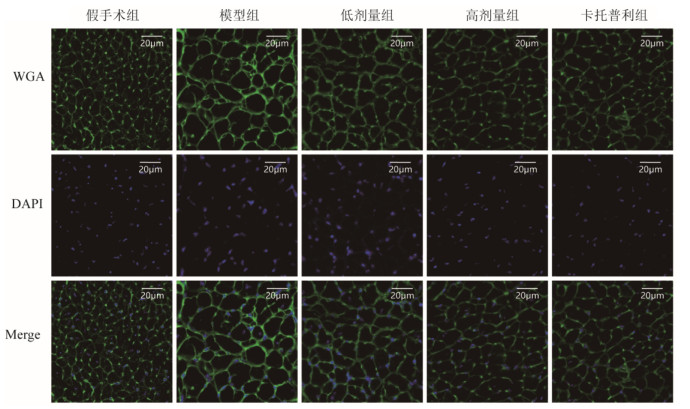
WGA染色结果显示,与模型组小鼠比较,假手术组心肌心肌细胞明显增大,差异有统计学意义(P < 0.01);SLG低剂量组较模型组心肌细胞平均横截面面积减小,差异有统计学意义(P < 0.05);与模型组相比,SLG高剂量组、卡托普利组心肌细胞平均横截面面积减小,差异有统计学意义(P < 0.01)。见图 9、图 10,提示SLG可减小压力后负荷引起的心力衰竭小鼠的心肌细胞肥大。
|
| 图 9 各组小鼠心肌细胞WGA染色(×200,刻度尺:20μm) Fig. 9 WGA staining of myocardial cells of mice in each group(×200, scale: 50μm) |

|
| 注:与假手术组比较,**P<0.01,与模型组比较,#P<0.05,##P<0.01。 图 10 各组小鼠心肌细胞平均横截面面积 Fig. 10 The average cross-sectional area of myocardial cells in each group |
qPCR结果显示,与假手术组相比,模型组小鼠心肌组织的IL-1β、AKT、NF-κB mRNA的表达水平升高,差异有统计学意义(P < 0.01);SLG高剂量组、卡托普利组相较模型组心肌组织的IL-1β、AKT、NF-κB mRNA的表达水平均降低,差异有统计学意义(P < 0.01);SLG低剂量组较模型组IL-1β、AKT mRNA的表达水平均降低,差异有统计学意义(P < 0.05);低剂量组NF-κB mRNA的表达水平与模型组比较,差异无统计学意义(P>0.05),见表 3。
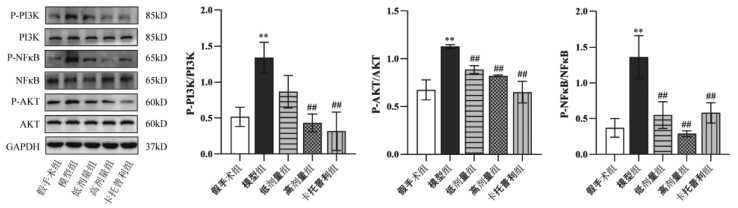
Western blot结果显示,与假手术组相比,模型组小鼠的p-PI3K/PI3K、p-AKT/AKT、p-NF-κB/NF-κB的蛋白比值升高,差异有统计学意义(P < 0.01);SLG高剂量组、卡托普利组较模型组小鼠的心肌组织中的p-PI3K/PI3K、p-AKT/AKT、p-NF-κB/NF-κB的蛋白比值降低,差异有统计学意义(P < 0.01);SLG低剂量组的p-PI3K/PI3K的蛋白比值较模型组无显著变化,差异无统计学意义(P>0.05),SLG低剂量组的p-AKT/AKT、p-NF-κB /NF-κB的蛋白比值较模型组降低,差异有统计学意义(P < 0.01),见图 11。
|
| 注:与假手术组比较,**P<0.01,与模型组比较,##P<0.01。 图 11 SLG对PI3K/AKT/NF-κB通路相关蛋白表达的影响 Fig. 11 Effects of SLG on the related proteins expression of PI3K/AKT/NF-κB pathway |
心力衰竭是所有心血管疾病发展的终末期,严重威胁患者的生命健康,因此探索心力衰竭的有效防治方法成为亟待解决的问题。中医对心力衰竭的认识最早可以追溯到《黄帝内经》,其对心力衰竭的描述“喘呼”“胕肿”“心下鼓”,这与心脏泵血功能受损导致的呼吸困难、下肢水肿为表现的心力衰竭相吻合。中医认为心力衰竭的病机以气虚血瘀为基础,兼夹痰饮。将益气活血化痰作为治疗心力衰竭的基本方法。徐学功教授对心力衰竭临床治疗和理论认识积累了多年的经验,对心力衰竭的病机和治则做了进一步的拓展和延伸,以中医病机理论阐述心力衰竭的4个阶段:前心力衰竭阶段心力衰竭以气为本,气虚及阳,关联五脏;前临床阶段心力衰竭生血乏源,行血无力,血脉瘀阻;临床心力衰竭阶段瘀血蕴蓄,继而生热,热毒灼心;心力衰竭终末期瘀毒不化,心肾阳虚,水凌心肺。受《黄帝内经》“治之以兰,除陈气也”理论启发,徐学功教授认为心力衰竭后期久郁所化之痰毒皆为陈气,当以除之,首次提出了“除陈气”理论。在该理论的指导下,化裁国医大师陈绍宏的益气活血散[6]为SLG,在益气活血的基础上增加了化痰解毒的绞股蓝和泽兰,清香解毒,除体内郁积陈腐秽浊之气,又以人参为君药,大补元气、复脉固脱,丹参活血祛瘀、通经止痛,使心血不瘀,痹痛得止,羊红膻补阴助阳,养心益肾。红参、丹参、羊红膻、泽兰、绞股蓝5味药合用则血运得健,陈气得除,共奏益气活血化痰解毒之功效,符合心力衰竭虚瘀毒的病机演变规律,临床疗效显著,但是其治疗的机制尚不明确。该研究主要是基于网络药理学探讨SLG治疗心力衰竭的可能作用靶点和通路,并且进行实验验证。
网络药理学通过分析药物与机体之间的相互作用,从中药多成分多靶点的复杂作用中找到药物调节的关键靶点和作用机制,在中医药研究中被广泛应用。通过网络药理学筛选后获得复方有效成分84个,相关靶点与4 112个心力衰竭疾病靶点取交集后得到154个交集靶点。通过PPI网络筛选出排名前10的关键靶点,其中以IL-6、IL-1β、肿瘤坏死因子(TNF)等炎症相关靶点居多,通过GO和KEGG筛选出SLG治疗心力衰竭的最关键的途径是PI3K/AKT通路。研究报道,心力衰竭发生后,心肌细胞受到缺血缺氧等多方面刺激,引起不良失代偿:线粒体功能障碍、焦亡、坏死、纤维化等,细胞启动程序性死亡发生坏死肿胀、质膜破裂,细胞内容物及碎片进入组织,在半胱天冬酶(Caspase)的刺激下释放炎症因子IL-18及IL-1β等,引发机体的炎症反应[7-8]。促炎细胞因子IL-1、IL-6、TNF等可增加转化生长因子-β(TGF-β)的表达,TGF-β可通过与受体的结合引起小母亲抗去分化蛋白同源物(3Smad)磷酸化和激活,进而促进成纤维细胞生长因子的转化,使胶原蛋白的含量增加,心脏的顺应性降低又可导致心力衰竭的加重[9-10]。有研究表明,PI3K/AKT在心脏纤维化中起关键作用[11],PI3K激酶被受体酪氨酸激酶(RTKs)激活后,使细胞膜的重要信号转导分子磷脂酰肌醇肌醇磷酸化,促进磷酸肌醇依赖型激酶-1(PDK1)与AKT结合,PDK1在T308位点将AKT彻底磷酸化,磷酸化后的AKT可介导多种重要的细胞过程,长期激活可诱导心肌肥大和心力衰竭[12]。研究发现,PI3K/AKT信号通路下游包括mTOR、GSK3、一氧化氮合酶、IKK等[11],AKT磷酸化后可激活κB抑制因子激酶(IKK),IκB抑制蛋白(IκB)被IKK抑制并降解,这种降解可刺激NF-κB的激活[13],NF-κB是激活炎症的基本转录因子,NF-κB长时间被激活时,会导致大量促炎细胞因子和趋化因子的释放以及心肌细胞凋亡的加剧。Tuo等[14]发现,NF-κB及PI3K/AKT通路在Ang Ⅱ构建的心力衰竭小鼠中的蛋白明显升高,而石蒜碱的应用逆转了这种升高,从而降低了心脏的炎症及纤维化程度。因此,PI3K/AKT通路、NF-κB通路和白介素在心力衰竭发展过程中起重要作用,通过PI3K/AKT信号通路抑制NF-κB和白介素可能是治疗心力衰竭的有效策略。
该研究采用主动脉弓缩窄诱导心力衰竭小鼠模型,发现SLG可以有效改善心功能、降低心力衰竭标志物NT-proBNP的水平。病理染色显示其可以明显改善心肌炎症浸润、纤维化、细胞肥大,验证了其临床有效性。ELISA实验表明模型组血清炎症水平相较假手术组明显升高,应用SLG可明显逆转这种升高。Western blot实验显示,与假手术组相比模型组心脏组织中p-PI3K/PI3K、p-AKT/AKT、p-NF-κB/NF-κB蛋白相对表达水平比值明显升高,而经过SLG干预后p-PI3K、p-AKT、p-NF-κB蛋白表达含量相对降低。qPCR验证实验显示SLG高剂量组可显著降低模型小鼠心肌组织中的AKT、NF-κB、IL-1β的基因表达水平。由此可见,TAC构建的心力衰竭模型会出现PI3K/AKT通路和炎症水平的改变,SLG可能是通过PI3K/AKT/NF-κB信号通路抑制白细胞介素的释放发挥治疗心力衰竭的作用。
该研究有一定的局限性,通路的方向不够明确,如SLG是否通过直接影响PI3K/AKT激活NF-κB作用于炎症或直接激活NF-κB通路尚未可知,同时炎症反应可能涉及多条通路的调节,未来需要进一步地研究。
综上所述,该研究表明SLG可能通过抑制PI3K/AKT/NF-κB通路诱导的炎症反应来改善压力负荷引起的心力衰竭,为SLG应用于心力衰竭治疗提供了依据。
| [1] |
中国心血管健康与疾病编写委员会. 《中国心血管健康与疾病报告2022》要点解读[J]. 中国心血管杂志, 2023, 28(4): 297-312. |
| [2] |
Writing Committee Members, ACC/AHA Joint Committee Members. 2022 AHA/ACC/HFSA guideline for the management of heart failure[J]. Journal of Cardiac Failure, 2022, 28(5): e1-e167. DOI:10.1016/j.cardfail.2022.02.010 |
| [3] |
《中成药治疗优势病种临床应用指南》标准化项目组. 中成药治疗心力衰竭临床应用指南(2021年)[J]. 中国中西医结合杂志, 2022, 42(3): 261-275. |
| [4] |
中国中医协会慢性心力衰竭中医诊疗指南项目组. 慢性心力衰竭中医诊疗指南(2022年)[J]. 中医杂志, 2023, 64(7): 743-756. |
| [5] |
徐叔云. 药理实验方法学[M]. 北京: 人民卫生出版社, 1982: 1207.
|
| [6] |
王筠, 庄锦莉, 黎江, 等. 益气活血法治疗脑梗死患者颈动脉粥样硬化的临床观察[J]. 中国中医急症, 2017, 26(5): 848-851. |
| [7] |
ZENG Z L, LI G H, WU S Y, et al. Role of pyroptosis in cardiovascular disease[J]. Cell Proliferation, 2019, 52(2): e12563. DOI:10.1111/cpr.12563 |
| [8] |
NAKAMURA M, SADOSHIMA J. Mechanisms of physiological and pathological cardiac hypertrophy[J]. Nature Reviews Cardiology, 2018, 15(7): 387-407. DOI:10.1038/s41569-018-0007-y |
| [9] |
DUTKA M, BOBIŃSKI R, ULMAN-WŁODARZ I, et al. Various aspects of inflammation in heart failure[J]. Heart Failure Reviews, 2020, 25(3): 537-548. DOI:10.1007/s10741-019-09875-1 |
| [10] |
MATSUYAMA D, KAWAHARA K. Oxidative stress-induced formation of a positive-feedback loop for the sustained activation of p38 MAPK leading to the loss of cell division in cardiomyocytes soon after birth[J]. Basic Research in Cardiology, 2011, 106(5): 815-828. DOI:10.1007/s00395-011-0178-8 |
| [11] |
QIN W M, CAO L H, MASSEY I Y. Role of PI3K/Akt signaling pathway in cardiac fibrosis[J]. Molecular and Cellular Biochemistry, 2021, 476(11): 4045-4059. |
| [12] |
WALKOWSKI B, KLEIBERT M, MAJKA M, et al. Insight into the role of the PI3K/Akt pathway in ischemic injury and post-infarct left ventricular remodeling in normal and diabetic heart[J]. Cells, 2022, 11(9): 1553. |
| [13] |
YU H, LIN L B, ZHANG Z Q, et al. Targeting NF-κB pathway for the therapy of diseases: Mechanism and clinical study[J]. Signal Transduction and Targeted Therapy, 2020, 5(1): 209. |
| [14] |
TUO P P, ZHAO R S, LI N, et al. Lycorine inhibits Ang Ⅱ-induced heart remodeling and inflammation by suppressing the PI3K-AKT/NF-κB pathway[J]. Phytomedicine, 2024, 128: 155464. |
2. Zhengzhou Hospital of Chinese Medicine, Zhengzhou 450046, China;
3. Joint Formula and Syndrome Research Laboratory, Guangzhou University of Chinese Medicine & Zhengzhou Hospital of Chinese Medicine, Zhengzhou 450046, China;
4. School of Basic Medical Sciences, Guangzhou University of Chinese Medicine, Guangzhou 510405, China;
5. Henan Provincial Key Cardiovascular Disease Laboratory of Chinese Medicine, Zhengzhou 450046, China;
6. Henan Provincial Transformation Engineering Research Center of Chinese Medicine for Chronic Diseases, Zhengzhou 450046, China
 2025, Vol. 42
2025, Vol. 42