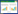文章信息
- 平佳宜, 刘静生, 任志广.
- PING Jiayi, LIU Jingsheng, REN Zhiguang.
- 基于TGF-β1/Smads信号通路探究强肝软坚丸对肝纤维化大鼠肝脏的保护作用
- Exploring the protective effect of Qianggan Ruanjian pill on liver fibrosis in rats based on TGF-β1/Smads signaling pathway
- 天津中医药, 2025, 42(2): 233-238
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(2): 233-238
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.02.15
-
文章历史
- 收稿日期: 2024-10-20
2. 河南大学中医药研究院, 开封 475004
肝纤维化(HF)是由各种致病因素引起的肝脏结缔组织的异常增殖,如果不进行干预和治疗,肝纤维化可能发展为肝硬化甚至肝癌[1-2]。迄今为止,肝纤维化还没有标准的治疗方法。合成药物治疗肝纤维化的疗效并不令人满意,价格也相对较高。此外,合成药物也会产生副作用,在治疗过程中可能会带来其他的健康问题[3-4]。随着医学研究的不断发展,中药逐渐成为最受关注的研究领域之一,尤其是在开发包括肝纤维化在内的慢性病治疗策略方面。强肝软坚丸主要由黄芪、鳖甲、三七、姜黄、沉香等药组成的中药制剂,已有研究报道,强肝软坚丸能够抑制大鼠肝脏纤维化病理改变,具有明显的抗肝纤维化作用[5-6],但具体机制尚不完全明确。相关研究显示,转化生长因子-β1(TGF-β1)/Smads通路的抑制可改善大鼠肝纤维化[7]。但强肝软坚丸改善大鼠肝纤维化是否与调控TGF-β1)/Smads通路有关尚不可知。基于此,本研究旨在探究强肝软坚丸对大鼠肝纤维化的影响以及其作用机制。
1 材料与方法 1.1 实验动物78只,SPF级雄性Wistar大鼠(8周龄,体质量290~300 g)购自上海泰楚生物技术有限公司,生产许可证号SCXK(沪)2023-0001。所有动物实验均获得医院伦理委员会的批准。
1.2 主要试剂强肝软坚丸由开封市中医院药学部制剂室提供,其组成为鳖甲、沉香、三棱、莪术、青皮、豆蔻、王不留行、三七、黄芪、虎杖、姜黄。四氯化碳(CCl4)购自南京化学试剂股份有限公司;秋水仙碱购自青岛克斯特生物科技有限公司;TGF-β1激活剂SRI-011381购自美国MCE公司;大鼠Ⅳ型胶原蛋白(CIV)、Ⅲ型前胶原蛋白(PC-Ⅲ)、层粘连蛋白(LN)、透明质酸(HA)酶联免疫吸定法(ELISA)试剂盒购自上海润裕生物科技有限公司;兔源一抗α-平滑肌肌动蛋白(α-SMA)、TGF-β1、p-Smad2/3、Smad2/3、甘油醛-3-磷酸脱氢酶(GAPDH)及辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自英国Abcam公司。
1.3 HF大鼠模型的构建及分组处理通过连续8周,每周腹腔注射1.5 mL/kg 50% CCl4橄榄油溶液2次的方式构建HF大鼠模型[8](63只),对照组(15只)大鼠仅腹腔注射等量的橄榄油溶液,随机抽取对照组、造模组大鼠各3只,处死大鼠收集肝脏组织做病理检测,当造模组大鼠显示肝实质损伤、炎性细胞浸润、脂肪变性、肝细胞排列紊乱,且有大量呈蓝染的胶原沉积时,表明模型构建成功,造模成功率为100%。将造模成功的剩余60只大鼠随机分为HF组、强肝软坚丸组、秋水仙碱组、SRI-011381组、强肝软坚丸+SRI-011381组,每组12只。强肝软坚丸组[9]、秋水仙碱组[10]大鼠分别需灌胃2 g/kg强肝软坚丸、0.2 mg/kg秋水仙碱,且均需腹腔注射等量的生理盐水;SRI-011381组[11]大鼠需腹腔注射30 mg/kg SRI-011381,且还需灌胃等量的生理盐水;强肝软坚丸+SRI-011381组大鼠需灌胃2 g/kg强肝软坚丸且还需腹腔注射30 mg/kg SRI-011381;对照组(剩余的12只)、HF组大鼠需灌胃且腹腔注射等量的生理盐水,给药每日1次,持续6周。
1.4 样本收集末次处理24 h后,腹腔注射2%戊巴比妥钠麻醉所有大鼠,腹主动脉取血用于谷丙转氨酶(ALT)、谷草转氨酶(AST)、CIV、PC-Ⅲ、LN、HA的检测;血液收集后,处死大鼠,收集大鼠肝脏组织,分为两部分,一部分用于苏木精-伊红(HE)、马松(Masson)染色及免疫组化实验,另一部分用于蛋白免疫印迹法(Western blot)实验。
1.5 大鼠血清中ALT、AST活性及CIV、PC-Ⅲ、LN、HA含量的检测全自动生化分析仪测定各组大鼠血清中AST、ALT活性,按照试剂盒说明书检测大鼠血清中CIV、PC-Ⅲ、LN、HA含量。
1.6 肝脏组织的HE和Masson染色肝脏组织固定在4%多聚甲醛中,经石蜡包埋后,将组织标本切成5 mm厚的组织切片并安装在载玻片上,这些载玻片上的切片分别用于HE染色、Masson染色,以评估肝组织病理变化及肝纤维情况。
1.7 免疫组化检测肝组织中α-SMA阳性细胞数取1.6中肝组织病理切片采用烤片、脱蜡和抗原修复后,用山羊血清封闭溶液封闭组织切片,加入一抗α-SMA(1∶3 000)在4 ℃下培养过夜。洗涤后,添加二抗(1∶5 000)并在37 ℃下孵育1 h。洗涤后加入DAB染料显色。最后,用苏木精复染并用乙醇脱水后,在显微镜下观察和评估肝组织中α-SMA阳性细胞数。
1.8 Western blot检测肝脏组织中TGF-β1、p-Smad2/3蛋白表达RIPA缓冲液提取肝脏组织蛋白,蛋白定量后,通过SDS-PAGE电泳分离总蛋白,并将其转移到聚偏氟乙烯膜上。在室温下使用5%脱脂牛奶将其封闭1 h。然后,将一抗TGF-β1(1∶3 000)、p-Smad2/3(1∶5 000)、Smad2/3(1∶4 000)、GAPDH(1∶4 000)与膜在4 ℃下孵育过夜,再用二抗(1∶5 000)在37 ℃下孵育1 h。最后,加入ECL试剂显色蛋白印迹,Image J软件用于评估蛋白灰度值。
1.9 统计学方法采用SPSS 24.0进行统计分析,实验数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间比较采用SNK-q检验,P<0.05表示差异有统计学意义。
2 结果 2.1 强肝软坚丸对大鼠肝功能变化的影响与对照组相比,HF组大鼠血清中ALT、AST活性升高(P<0.05);与HF组相比,强肝软坚丸组、秋水仙碱组大鼠血清中ALT、AST活性降低,SRI-011381组大鼠血清中ALT、AST活性升高(P<0.05);与强肝软坚丸组相比,强肝软坚丸+SRI-011381组大鼠血清中ALT、AST活性升高(P<0.05),见表 1。
|
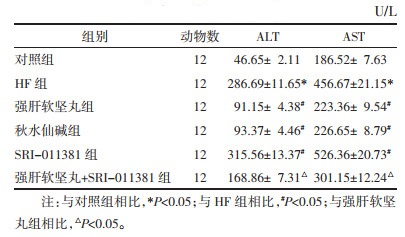
与对照组相比,HF组大鼠血清中CIV、PC-Ⅲ、LN、HA含量升高(P<0.05);与HF组相比,强肝软坚丸组、秋水仙碱组大鼠血清中CIV、PC-Ⅲ、LN、HA含量降低,SRI-011381组大鼠血清中CIV、PC-Ⅲ、LN、HA含量升高(P<0.05);与强肝软坚丸组相比,强肝软坚丸+SRI-011381组大鼠血清中CIV、PC-Ⅲ、LN、HA含量升高(P<0.05),见表 2。
|
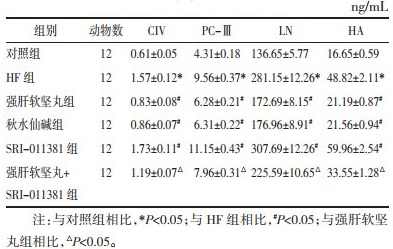
HE染色显示,对照组大鼠肝实质无变化;HF组大鼠肝组织显示肝实质损伤、炎性细胞浸润、脂肪变性、肝细胞排列紊乱;与HF组相比,强肝软坚丸组、秋水仙碱组大鼠肝组织病理损伤减轻,SRI-011381组大鼠肝组织病理损伤严重;与强肝软坚丸组相比,强肝软坚丸+SRI-011381组大鼠肝组织病理损伤加剧,见图 1。
|
| 图 1 大鼠肝组织病理变化的HE染色结果(×200,n=6) Fig. 1 HE staining results of pathological changes of liver tissue of rats(×200, n=6) |
Masson染色显示,与对照组相比,HF组大鼠肝组织中有大量呈蓝染的胶原沉积;与HF组相比,强肝软坚丸组、秋水仙碱组大鼠肝组织中胶原沉积减少,SRI-011381组大鼠肝组织中胶原沉积增多;与强肝软坚丸组相比,强肝软坚丸+SRI-011381组大鼠肝组织中胶原沉积变多,见图 2。
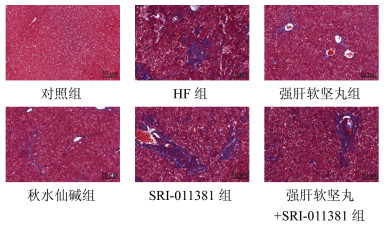
|
| 图 2 大鼠肝组织纤维化的Masson染色结果(×200,n=6) Fig. 2 Masson staining results of liver fibrosis of rats (×200, n=6) |
与对照组相比,HF组大鼠肝组织中α-SMA阳性细胞数升高(P<0.05);与HF组相比,强肝软坚丸组、秋水仙碱组大鼠肝组织中α-SMA阳性细胞数降低,SRI-011381组大鼠肝组织中α-SMA阳性细胞数升高(P<0.05);与强肝软坚丸组相比,强肝软坚丸+SRI-011381组大鼠肝组织中α-SMA阳性细胞数升高(P<0.05),见图 3和表 3。
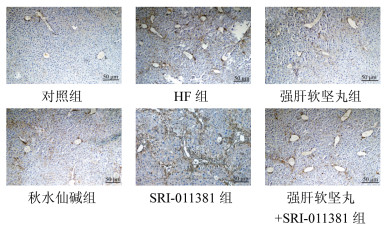
|
| 图 3 大鼠肝星状细胞活化标记物α-SMA阳性细胞数变化的免疫组化染色结果(×200) Fig. 3 Immunohistochemical staining results of changes in the number of α-SMA positive cells of hepatic stellate cell activation marker of rats(×200) |
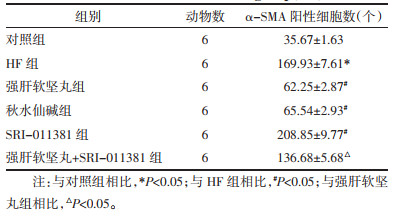
|
与对照组相比,HF组大鼠肝组织中TGF-β1、p-Smad2/3蛋白表达升高(P<0.05);与HF组相比,强肝软坚丸组、秋水仙碱组大鼠肝组织中TGF-β1、p-Smad2/3蛋白表达降低,SRI-011381组大鼠肝组织中TGF-β1、p-Smad2/3蛋白表达升高(P<0.05);与强肝软坚丸组相比,强肝软坚丸+SRI-011381组大鼠肝组织中TGF-β1、p-Smad2/3蛋白表达升高(P<0.05),见图 4和表 4。

|
| 注:A,对照组;B,HF组;C,强肝软坚丸组;D,秋水仙碱组;E,SRI-011381组;F,强肝软坚丸+SRI-011381组。 图 4 Western blot检测大鼠肝组织中TGF-β1、p-Smad2/3蛋白表达 Fig. 4 TGF-β1 and p-Smad2/3 protein expression in liver tissue of rats detected by Western blot |
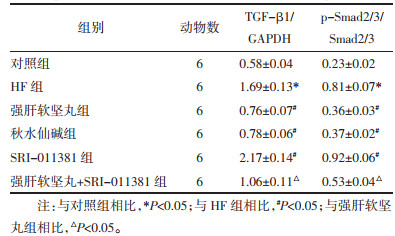
|
CCl4是一种典型的肝脏毒素,可破坏肝细胞功能,诱导脂质过氧化破坏膜结构,损伤肝细胞[12]。用CCl4建立的肝纤维化模型简单、廉价、具有典型的病变,应用广泛[13]。有研究表明,CCl4破坏肝细胞膜,从而导致细胞内ALT和AST进入到血液中;血清中ALT和AST的活性表明肝损伤的程度,这是肝细胞损伤的敏感指标[14]。在该研究中,CCl4给药后,血清ALT、AST水平显著升高,表明HF大鼠肝功能异常,存在肝损伤。CIV、PC-Ⅲ、LN、HA是临床上常用于反映肝纤维化程度的指标[15],本研究显示,与对照组相比,HF组大鼠肝组织中有大量呈蓝染的胶原沉积,肝组织病理损伤严重,血清中CIV、PC-Ⅲ、LN、HA含量升高,提示HF大鼠肝纤维化程度高。此外,肝星状细胞在正常肝组织中下调[16]。激活肝星状细胞被认为是肝纤维化发生的关键事件[17]。一旦被损伤信号触发,肝星状细胞从正常的“静止状态”转变为“活化状态”,这可能表现为α-SMA的产生增加,最终促进肝组织中胶原纤维的逐渐积累[18]。本研究检测了肝组织中肝星状细胞活化标记物α-SMA阳性细胞数变化情况,结果显示,与对照组相比,HF组大鼠肝组织中α-SMA阳性细胞数升高,表明HF大鼠肝星状细胞活化增多。因此,改善肝功能、抑制肝星状细胞活化可能是改善大鼠HF的有效策略之一。
强肝软坚丸具有滋阴益气,化瘀散结的功效,已有研究报道,强肝软坚丸能明显改善肝纤维化大鼠肝纤维化程度,抑制肝纤维化的形成和发展[19]。本研究结果与其是一致的,该研究显示,强肝软坚丸能改善HF大鼠肝功能、抑制肝星状细胞活化、减轻肝纤维化。秋水仙碱是常用于改善HF的药物[20],本研究以该药物作为阳性药物,结果显示,秋水仙碱与强肝软坚丸对HF大鼠肝功能的改善作用,肝星状细胞活化的抑制作用以及肝纤维化的减轻作用差异无统计学意义,提示强肝软坚丸可能成为治疗HF的潜在有效药物之一。
TGF-β1是一种多功能细胞因子,其可激活TGF-β受体,TGF-β受体介导下游分子Smad2、Smad3参与纤维化过程[21]。已有研究表明,激活TGF-β1/Smads信号通路诱导小鼠肝纤维化[22];抑制TGF-β1/Smads信号通路可抑制小鼠肝纤维化[23]。该研究显示,与HF组相比,SRI-011381组大鼠肝组织中TGF-β1、p-Smad2/3蛋白表达升高,肝功能异常,肝星状细胞活化增多,肝纤维化严重,且SRI-011381为TGF-β1激活剂,表明TGF-β1/Smads信号通路确实参与了大鼠HF过程。此外,强肝软坚丸可抑制HF大鼠肝组织中TGF-β1、p-Smad2/3蛋白表达,猜想强肝软坚丸可能通过抑制TGF-β1/Smads信号通路改善大鼠HF。为了验证该猜想的正确性,本研究在强肝软坚丸作用的基础上再加上SRI-011381干预HF大鼠,结果显示,SRI-011381逆转了强肝软坚丸对大鼠HF的改善作用,证实了猜测的合理性。
综上所述,强肝软坚丸可能通过抑制TGF-β1/Smads信号通路改善大鼠HF。该研究首次证实了强肝软坚丸改善HF的机制与抑制TGF-β1/Smads信号通路有关,可为HF的治疗提供新的靶点。但强肝软坚丸改善大鼠HF涉及的机制较为复杂,具体通过TGF-β1/Smads信号通路下游的哪些蛋白来发挥作用,有待后续实验进一步深入探究。
| [1] |
CAI Q, WANG Z Q, ZHANG R, et al. Huangjia Ruangan Granule inhibits inflammation in a rat model with liver fibrosis by regulating TNF/MAPK and NF-κB signaling pathways[J]. Evidence-Based Complementary and Alternative Medicine, 2022, 2022(7): 8105306. |
| [2] |
MOON A M, SINGAL A G, TAPPER E B. Contemporary epidemiology of chronic liver disease and cirrhosis[J]. Clinical Gastroenterology and Hepatology, 2020, 18(12): 2650-2666. DOI:10.1016/j.cgh.2019.07.060 |
| [3] |
BAOGUI X U, ZHENG J W, TIAN X X, et al. Antihepatofibrotic effect of Guizhifuling pill on carbon tetrachloride-induced liver fibrosis in mice[J]. Journal of Traditional Chinese Medicine, 2022, 42(5): 715-722. DOI:10.3969/j.issn.1674-070X.2022.05.004 |
| [4] |
LIU Z G, ZHOU S, ZHANG Y, et al. Rat bone marrow mesenchymal stem cells(BMSCs) inhibit liver fibrosis by activating GSK3β and inhibiting the Wnt3a/β-catenin pathway[J]. Infectious Agents and Cancer, 2022, 17(1): 17. DOI:10.1186/s13027-022-00432-4 |
| [5] |
王正. 强肝软坚丸对肝纤维化大鼠肝组织MMP-1、TIMP-1表达的影响[D]. 郑州: 河南中医学院, 2015.
|
| [6] |
王正, 史海立, 赵庆华. 强肝软坚丸对肝纤维化大鼠肝组织HGF表达的影响[J]. 中医临床研究, 2014, 6(35): 7-8. DOI:10.3969/j.issn.1674-7860.2014.35.003 |
| [7] |
王珑, 刘小军, 苗倩倩, 等. 连夏保肝颗粒对肝纤维化大鼠TGF-β1/Smads通路的影响[J]. 陕西中医药大学学报, 2023, 46(5): 88-93. |
| [8] |
张畦, 安祯祥, 何远利. 异甘草素对大鼠肝纤维化的治疗作用及其机制[J]. 安徽医科大学学报, 2023, 58(4): 649-654. |
| [9] |
赵庆华, 史海立, 刘静生, 等. 强肝软坚丸对肝纤维化大鼠肝组织中MMP、TIMP表达的影响[J]. 中医学报, 2017, 32(2): 260-264. |
| [10] |
牛媛媛, 汪龙德, 毛兰芳, 等. 基于网络药理学探讨化瘀软肝胶囊对肝纤维化大鼠的肝脏保护作用[J]. 中成药, 2023, 45(9): 3104-3109. DOI:10.3969/j.issn.1001-1528.2023.09.050 |
| [11] |
YAO C L, ZHOU X J, WENG W D, et al. Aligned nanofiber nerve conduits inhibit alpha smooth muscle actin expression and collagen proliferation by suppressing TGF-β1/SMAD signaling in traumatic neuromas[J]. Experimental and Therapeutic Medicine, 2021, 22(6): 1414. DOI:10.3892/etm.2021.10850 |
| [12] |
LV Y, WU S, WANG Z, et al. Research progress of modeling methods for animal models of liver fibrosis[J]. Guangxi Medicine Journal, 2020, 42(1): 875-878. |
| [13] |
阙任烨, 戴彦成, 李勇, 等. 白藜芦醇通过调控肝脏生物钟改善CCl4诱导的小鼠肝纤维化[J]. 天津中医药, 2022, 39(12): 1604-1610. DOI:10.11656/j.issn.1672-1519.2022.12.18 |
| [14] |
WU Z G, WU Y C, ZHONG W C, et al. The hepatoprotective effect of aspirin on carbon tetrachloride-induced hepatic fibrosis via inhibition of TGFβ-1 pathway and pro-inflammatory cytokines IL-1β and COX-2 in rats[J]. Experimental and Therapeutic Medicine, 2023, 25(5): 232. DOI:10.3892/etm.2023.11931 |
| [15] |
周林华, 陈晓. 栀子苷通过TGF-β1/Smad信号通路抑制肝纤维化和肝星状细胞活化[J]. 生理学报, 2022, 74(2): 217-224. |
| [16] |
XIA Y J, LI J J, CHEN K, et al. Bergenin attenuates hepatic fibrosis by regulating autophagy mediated by the PPAR-γ/TGF-β pathway[J]. PPAR Research, 2020, 2020(12): 6694214. |
| [17] |
YIN F, WANG W Y, MAO L C, et al. Effect of human umbilical cord mesenchymal stem cells transfected with HGF on TGF-β1/smad signaling pathway in carbon tetrachloride-induced liver fibrosis rats[J]. Stem Cells and Development, 2020, 29(21): 1395-1406. DOI:10.1089/scd.2020.0060 |
| [18] |
ZHANG Y Q, HUA L P, LIN C F, et al. Pien-Tze-Huang alleviates CCl4-induced liver fibrosis through the inhibition of HSC autophagy and the TGF-β1/Smad2 pathway[J]. Frontiers in Pharmacology, 2022, 13(9): 937484. |
| [19] |
李元元. 强肝软坚丸对肝纤维化大鼠肝组织中MMP-2、TIMP-2表达的影响[D]. 郑州: 河南中医学院, 2015.
|
| [20] |
卢芬萍, 胡世平, 唐颖慧, 等. 丹桃养肝丸对四氯化碳致肝纤维化大鼠的保护作用研究[J]. 现代中西医结合杂志, 2023, 32(14): 1940-1944, 1950. DOI:10.3969/j.issn.1008-8849.2023.14.007 |
| [21] |
YANG H X, SUN J H, YAO T T, et al. Bellidifolin ameliorates isoprenaline-induced myocardial fibrosis by regulating TGF-β1/smads and p38 signaling and preventing NR4A1 cytoplasmic localization[J]. Frontiers in Pharmacology, 2021, 12(4): 644886. |
| [22] |
LIU F, SUN C F, CHEN Y F, et al. Indole-3-propionic acid-aggravated CCl4-induced liver fibrosis via the TGF-β1/smads signaling pathway[J]. Journal of Clinical and Translational Hepatology, 2021, 9(6): 917-930. |
| [23] |
LIU X L, LIU W C, DING C B, et al. Taxifolin, extracted from waste Larix olgensis roots, attenuates CCl4-induced liver fibrosis by regulating the PI3K/AKT/mTOR and TGF-β1/smads signaling pathways[J]. Drug Design, Development and Therapy, 2021, 15(2): 871-887. |
2. Institute of Traditional Chinese Medicine, Henan University, Kaifeng 475004, China
 2025, Vol. 42
2025, Vol. 42