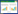文章信息
- 史月欣, 姚志, 李莉, 等.
- SHI Yuexin, YAO Zhi, LI Li, et al.
- 基于TLR4/MyD88/NF-κB信号通路探讨芪黄解毒化瘀饮治疗脓毒症急性肾损伤的作用机制
- Exploring the mechanism of Qihuang Jiedu Huayu Yin in treating acute kidney injury in sepsis based on TLR4/MyD88/NF-κB signal pathway
- 天津中医药, 2025, 42(2): 239-245
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(2): 239-245
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.02.16
-
文章历史
- 收稿日期: 2024-08-29
2. 北京中医药大学, 北京 100029
脓毒症是由宿主对感染反应失调而引起的器官功能障碍,是一种危及生命的临床综合征[1]。脓毒症最严重的危害是引起多器官功能障碍,肾功能损伤是其中最常见的器官功能障碍之一。脓毒症急性肾损伤(AKI)的发生是脓毒症患者最常见的并发症之一,它增加了患者死亡的风险,脓毒症AKI在重症监护室中发病率高达50%以上,住院病死率40%~60%,其早已成为备受关注的公共健康问题[2]。
脓毒症AKI的发病具有复杂而独特的病理生理学机制,影响脓毒症AKI发生和发展的因素众多,这使得脓毒症AKI成为一种不同于任何其他AKI表型的综合征[3]。目前研究发现微循环障碍、炎症反应、氧化应激、细胞凋亡和内皮功能障碍参与了脓毒症AKI的发病机制[4],另有大量研究表明炎症反应失调在脓毒AKI的病理生理学中起着关键作用[5]。Toll样受体4(TLR4)/髓样分化因子88(MyD88)/核转录因子-κB(NF-κB)信号通路与炎症反应密切相关。TLR4的激活可以使炎症细胞大量募集和增殖,从而启动炎症反应,通过MyD88依赖性通路启动下游信号传导并激活NF-κB,从而释放许多炎症分子并增强局部炎症反应[6]。因此,抑制TLR4/MyD88/NF-κB通路的激活可能成为防治脓毒症AKI的有效策略。
北京中医药大学东直门医院急诊科、重症监护病房(ICU)以名老中医姜良铎教授学术思想为指导,擅长运用中西医结合方法治疗脓毒症及相关脏器损伤。团队前期通过对近十年治疗脓毒症AKI的有效方剂进行挖掘分析,得到了中医药治疗脓毒症AKI的核心处方,命名为芪黄解毒化瘀饮。该方符合学术界提出的理、法、方、药理念,临床研究显示其可以显著改善脓毒症AKI患者的炎症指标,延缓肾功能恶化,促进肾功能恢复。现代药理学研究发现该方中黄芪、大黄、丹参等所包含的多种药物活性成分具有明显的抗炎功效[7-9]。因此,该研究基于TLR4/MyD88/NF-κB信号通路观察芪黄解毒化瘀饮治疗脓毒症AKI的作用机制,进一步阐明本方的科学内涵,同时为中医药防治脓毒症AKI提供新的切入点。
1 实验材料 1.1 动物6~7周龄雄性SD大鼠,体质量(200±20)g,购自北京维通利华实验动物技术有限公司[编号:SCXK(京)2016-0006]。所有动物饲养于SPF级实验动物屏障环境[许可证编号:SYXK(京)2020-0013]中,动物房保持恒温(22±2)℃、恒湿(50±10)%,光照12 h明暗交替,动物自由进食饮水。该实验已通过北京中医药大学动物实验伦理委员会的批准(批件号:BUCM-2023092907-220),所有操作均严格按照实验动物伦理的相关规定进行。
1.2 药物及制备芪黄解毒化瘀饮:生黄芪30 g,熟大黄9 g,生地黄15 g,赤芍15 g,丹参30 g,金银花15 g,炙甘草6 g。中药饮片均由北京中医药大学东直门医院中药库统一提供,常规煎煮,水浴浓缩成2 g/mL药液。
1.3 主要试剂与仪器采用全自动生化仪检测大鼠血清肌酐(Scr)、尿素氮(BUN);ELISA试剂盒检测中性粒细胞明胶酶相关脂质释放素(NGAL)、肾损伤分子(KIM)-1、白细胞介素(IL)-1β、白细胞介素-6、白细胞介素-10、肿瘤坏死因子(TNF)-α、过氧化氢酶(CAT)、还原性谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)购自南京建成科技有限公司(批号分别为H392-1-1、H436-1-1、H002-1-1、H007-1-1、H009-1-1、H052-1-1、A007-1、A005、A003-1、A001-3);RIPA裂解液、蛋白酶抑制剂混合物、BCA定量试剂盒(北京普利莱科技有限公司,批号分别为C1053、P1265、02912E);苏木素染色液、伊红染色液(珠海贝索生物技术有限公司,批号分别为C210704、BA2024);TLR4(美国Proteitech公司,货号为19811-1-AP)、MyD88、NF-κB p65(美国CST公司,货号分别为:4283、8242)。
ST5020型全自动酶标仪(美国Thermo公司);HH.W21.420型低温高速离心机(德国Eppendorf公司);HistoCore型石蜡切片机(德国Leica公司);BX60型光学显微镜(日本Olympus公司);731BR03474型电泳仪(美国Bio-Rad公司)。
2 实验方法 2.1 造模方法造模前所有实验大鼠禁食12 h,以1%戊巴比妥钠(用量为40 mg/kg)进行麻醉,置于无菌操作台,腹部备皮并常规碘伏消毒,在大鼠下腹部中央消毒区域作纵向切口2 cm左右,暴露腹腔,假手术组大鼠仅开腹暴露盲肠后关闭腹腔,造模组大鼠采用盲肠结扎穿刺法建模,暴露腹腔后继续分离盲肠,使用不可吸收的3.0丝线结扎盲肠(距盲肠尖端1.5 cm或盲肠的50%)。用18 G针穿刺盲肠远端,2个穿孔应穿过盲肠,穿刺后从穿孔两侧挤出少许肠内容物,回纳盲肠至腹腔并关腹缝合。手术后使用37 ℃预热的0.9%的生理盐水1.5 mL腹腔注射对大鼠进行液体复苏。造模成功的表现:造模后6 h内未发生死亡,大鼠出现腹泻、竖毛、精神萎靡、少尿等脓毒症表现,Scr升高至对照组的2倍时,脓毒症AKI模型成功建立。
2.2 动物分组及给药SD大鼠适应性饲养1周后,随机分为假手术组大鼠10只及造模组大鼠40只。将模型构建成功的大鼠随机分为模型组、芪黄解毒化瘀饮低剂量组、中剂量组及高剂量组。按照人与大鼠的等效剂量换算,芪黄解毒化瘀饮低、中、高剂量组分别予以2、4、8 g/kg剂量灌喂。假手术组、模型组大鼠灌胃等量生理盐水。造模前每12 h给药1次,连续给药3 d,造模成功后每12 h给药1次,共给药2次,造模后24 h即末次给药后麻醉大鼠从腹主动脉采血。分离血清-80 ℃冰箱冻存备测,解剖分离大鼠肾组织,部分固定于4%甲醛溶液留作病理染色,剩余肾组织置于液氮罐备用。大鼠存活情况:假手术组全部存活,模型组死亡2只,芪黄解毒化瘀饮剂量组各死亡2只。
2.3 检测指标 2.3.1 一般情况观察并记录各组大鼠精神状态、活动情况、毛发色泽、进食和饮水量、体质量及尿量的变化情况、死亡情况及其他不良反应。
2.3.2 酶联免疫吸附法(ELISA)检测大鼠血液样本室温静置2 h后,1 500×g离心15 min(离心半径7 cm)得到血清。根据ELISA试剂盒说明,设定标准孔、空白孔及样本孔,酶标仪450 nm波长测量各孔吸光度A,利用Origin软件计算各样本Scr、BUN、NGAL、KIM-1、IL-1β、IL-6、IL-10、TNF-α、CAT、GSH-PX、MDA及T-SOD因子的实际水平。
2.3.3 苏木素-伊红(HE)染色大鼠肾脏组织用10%多聚甲醛固定,脱水后石蜡包埋,制作厚度为4 μm切片。经二甲苯脱蜡和梯度乙醇脱蜡,苏木素染细胞核、伊红染细胞质,再用梯度乙醇和二甲苯脱水透明,最后用中性树胶封片。采用光学显微镜观察肾脏组织形态变化。
2.3.4 蛋白免疫印迹法(Western blot)检测将肾组织剪碎,加入裂解液(磷酸酶抑制剂∶蛋白酶抑制剂∶RIPA=1∶1∶100)在研磨仪中匀浆,离心取上清后,使用BCA蛋白浓度测定试剂盒测定总蛋白浓度。随后,将蛋白样品与蛋白上样缓冲液(含β-巯基乙醇)混合,100 ℃加热10 min。采用SDS-PAGE凝胶电泳分离蛋白组分,转移到PVDF膜上,快速封闭液封闭15 min,分别孵育一抗TLR4(1∶1 000)、MyD88(1∶500)、NF-κB p65(1∶1 000),4 ℃过夜。次日室温孵育二抗(1∶10 000),飞克特敏ECL液显影,使用Image J软件分析各蛋白条带的灰度值,以ACTIN为内参,计算目的蛋白的相对表达量。
2.4 统计分析方法采用SPSS22.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,方差齐用LSD法,方差不齐用Tamhane’s T2检验。P < 0.05为差异有统计学意义。
3 实验结果 3.1 芪黄解毒化瘀饮对脓毒症AKI大鼠一般状态的影响假手术组大鼠的精神状态良好,双眼分泌物少,毛发呈白色有光泽,反应灵敏,活动自如,大小便正常;模型组大鼠手术后出现精神萎靡,静止状态和活动量减少或迟缓;眼角分泌物明显增多,眼睛未完全睁开和眼睛浑浊不清;毛色晦暗颜色深,背部出现立毛,状态憔悴;大鼠进食减少,尿量减少明显,有腹泻症状;大鼠呼吸不均匀,伴有呼吸喘憋困难表现。芪黄解毒化瘀饮低、中、高剂量组大鼠的各方面状态较模型组均有所改善。
3.2 芪黄解毒化瘀饮对脓毒症AKI大鼠肾功能及对肾损伤标志物的影响与假手术组相比,模型组大鼠的Scr、BUN水平明显升高(P < 0.05,P < 0.01);使用芪黄解毒化瘀饮高剂量干预后Scr、BUN水平均较模型组明显降低(P < 0.05);与假手术组相比,模型组大鼠的NGAL和KIM-1水平明显升高(P < 0.05,P < 0.01);使用芪黄解毒化瘀饮中剂量和高剂量组NGAL和KIM-1水平均较模型组明显降低(P < 0.05,P < 0.01)。芪黄解毒化瘀饮各剂量组间比较未见明显差异。上述结果表明芪黄解毒化瘀饮可以显著改善脓毒症AKI大鼠的肾功能,减轻肾脏损伤,且高剂量组效果更佳。见表 1。
|
与假手术组相比,模型组大鼠肾组织结构重度异常,具体表现为视野内大量肾小管水肿,上皮细胞胞质淡染,如绿色箭头所示;部分肾小管刷状缘损伤,如红色箭头所示;部分肾小管管腔可见细胞,如紫色箭头所示;部分肾小管上皮细胞坏死,胞核碎裂,固缩深染,如橙色箭头所示;组织轻度出血,间质可见少量红细胞,如黑色箭头所示。
与模型组比较,芪黄解毒化瘀饮低剂量组肾组织结构异常减轻,视野内肾小球结构完整,轮廓清晰,系膜细胞数量正常,囊腔未见扩张;部分肾小管刷状缘损伤,如红色箭头所示;部分肾小管水肿,上皮细胞胞质淡染,如绿色箭头所示;间质未见明显炎症细胞浸润。芪黄解毒化瘀饮中剂量组肾组织结构轻度异常,视野内肾小球结构完整,轮廓清晰,系膜细胞数量正常,囊腔未见扩张;部分肾小管刷状缘损伤,如红色箭头所示;少量肾小管管腔可见细胞,如紫色箭头所示;间质未见明显炎症细胞浸润。芪黄解毒化瘀饮高剂量组肾组织结构轻度异常,视野内肾小球结构完整,轮廓清晰,系膜细胞数量正常,囊腔未见扩张;部分肾小管上皮细胞变性,胞质可见小空泡,如黄色箭头所示;间质未见明显炎症细胞浸润。病理结果提示,芪黄解毒化瘀饮治疗可减轻脓毒症AKI大鼠肾小管损伤,减轻肾间质炎症反应,减轻肾脏病理改变,起到有效保护肾小球和肾小管的作用。见图 1。

|
| 图 1 各组大鼠肾脏病理图(HE染色,×200) Fig. 1 Pathological images of kidneys of rats in each group (HE staining, × 200) |
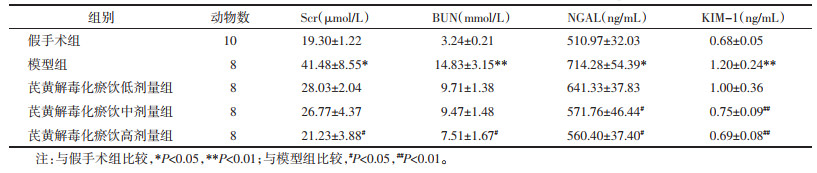
与假手术组相比,模型组IL-1β、IL-6、TNF-α的水平明显升高,IL-10水平明显降低,差异有统计学意义(P < 0.01,P < 0.05);与模型组相比,芪黄解毒化瘀饮低剂量组、中剂量组和高剂量组IL-1β、IL-6、TNF-α的水平均有明显降低,差异有统计学意义(P < 0.01,P < 0.05);芪黄解毒化瘀饮高剂量组IL-10水平显著升高,差异有统计学意义(P < 0.01)。芪黄解毒化瘀饮各剂量组间比较未见明显差异。这表明芪黄解毒化瘀饮可以一定程度上减轻脓毒症AKI大鼠的炎症水平,且高剂量组效果更佳。见表 2。
|
与假手术组相比,模型组的MDA水平显著升高,而CAT、GSH-PX、T-SOD水平显著降低,差异有统计学意义(P < 0.01);与模型组相比,芪黄解毒化瘀饮低剂量组、中剂量组和高剂量组MDA的水平均有显著降低,差异有统计学意义(P < 0.01);与模型组相比,芪黄解毒化瘀饮低剂量组、中剂量组和高剂量组CAT水平均有明显升高,差异有统计学意义(P < 0.05,P < 0.01);与模型组相比,芪黄解毒化瘀饮中剂量组和高剂量组GSH-PX水平明显升高,差异有统计学意义(P < 0.05);与模型组相比,芪黄解毒化瘀饮高剂量组T-SOD水平明显升高,差异有统计学意义(P < 0.05)。芪黄解毒化瘀饮各剂量组间比较未见明显差异。这表明芪黄解毒化瘀饮可以一定程度上减轻脓毒症AKI大鼠氧化应激损伤,发挥抗氧化应激作用,且高剂量组效果更佳。见表 3。

|
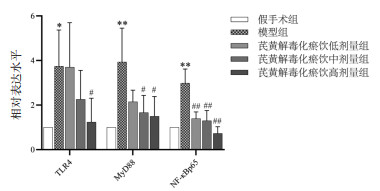
与假手术组相比,模型组TLR4、MyD88、NF-κBp65蛋白的表达水平呈升高趋势(P < 0.01,P < 0.05),使用芪黄解毒化瘀饮干预后TLR4、MyD88、NF-κBp65蛋白表达水平较模型组明显降低(P < 0.01,P < 0.05)。芪黄解毒化瘀饮各剂量组间比较未见明显差异。结果提示:芪黄解毒化瘀饮可以对TLR4/MyD88/NF-κB信号转导通路起到调控作用,进而降低脓毒症AKI的损伤程度,且高剂量组效果更佳。见图 2和图 3。
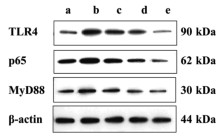
|
| 注:a,假手术组;b,模型组;c,芪黄解毒化瘀饮低剂量组;d,芪黄解毒化瘀饮中剂量组;e,芪黄解毒化瘀饮高剂量组。 图 2 芪黄解毒化瘀饮对TLR4/MyD88/NF-κB信号通路蛋白表达的影响 Fig. 2 The effect of Qihuang Jiedu Huayu Yin on the protein expression of TLR4/MyD88/NF-κB signaling pathway |
|
| 注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 3 芪黄解毒化瘀饮对TLR4/MyD88/NF-κB信号通路蛋白表达的影响 Fig. 3 The effect of Qihuang Jiedu Huayu Yin on the protein expression of TLR4/MyD88/NF-κB signaling pathway |
AKI是脓毒症的一种极其常见的并发症,与不良预后密切相关,包括增加慢性肾病、心血管事件和死亡的风险,严重影响患者的预后和生存质量[10]。脓毒症AKI的病理生理过程复杂,其发病机制尚未完全阐明,至今仍然缺乏有效的治疗措施,进一步明确脓毒症AKI的发病机制,探索针对性的治疗手段,仍是研究工作中的重点和难点[11]。中医药已广泛应用于脓毒症AKI的治疗且取得了良好的临床效果[12-14]。中医药复方以其多功效、多靶点、个体化治疗、毒副作用小等特点在改善脓毒症AKI患者临床症状,延缓肾功能损伤方面均显示了较明显的优势。
古代医书典籍中无“脓毒症急性肾损伤”的历史记载,根据其临床症状和体征特点,“脓毒症”大致可归属于中医“伤寒”“温病”的范畴,急性肾损伤与中医的“水肿”“癃闭”和“关格”相类似,尤其与“关格”最为相似[15]。脓毒症AKI的发病是正虚和邪实的混杂交争的结果,其病因病机尚无统一的结论,学界普遍认为与“毒、瘀、虚、浊”密切相关[16]。内外因素导致机体正气亏虚,毒邪入络,络脉受损,血行不畅,产生瘀血,毒瘀互结耗伤人之正气,进一步加重脏腑功能失调,毒瘀互结深入肾络,肾脏功能受损,代谢水液的功能下降,机体水液内聚,运行不畅,则浊气内生,毒瘀浊3种病理产物相互交织,使得邪气更胜,正气更虚[17]。芪黄解毒化瘀饮中黄芪补益正气,益气固表,抵御外邪,利水消肿;熟大黄泻火通腑,清热解毒,凉血活血,两者为方中君药;金银花清热解毒和疏散外邪;丹参活血化瘀,清热除烦,凉血,两者为臣药;生地黄清热凉血,养阴生津;赤芍清热凉血,活血化瘀,两者为佐药;炙甘草益气复脉,解毒,调和药性为使药,全方共奏固本扶正,解毒化瘀之功效。
脓毒症的本质是全身炎症反应,瀑布式的炎症反应是导致多器官功能障碍综合征的主要因素之一,促炎细胞因子的过量产生被认为是脓毒症AKI的重要致病因素[18]。由TNF-α和IL-1β等早期促炎细胞因子引发并由晚期介质HMGB1维持的炎症反应失调,可能是导致脓毒症晚期组织损伤和器官功能障碍发生的重要原因[11]。笔者研究发现,经芪黄解毒化瘀饮治疗后,TNF-α、IL-1β、IL-6等促炎细胞因子显著减少,抗炎细胞因子IL-10显著增加,并且呈现剂量依赖性趋势。提示芪黄解毒化瘀饮对脓毒症AKI的炎症反应具有抑制作用。有研究发现,脓毒症患者的自由基反应在病理上加剧,氧化和抗氧化之间的平衡明显受到干扰[19]。笔者研究结果表明,芪黄解毒化瘀饮治疗后可以减弱脓毒症AKI的氧化物MDA的过度产生,使抗氧化系统中CAT、T-SOD和GSH-PX水平提高,表明芪黄解毒化瘀饮可以抑制脓毒症AKI的氧化应激反应,避免肾脏受到损伤。
由革兰氏阴性菌产生的脂多糖(LPS)是诱导脓毒症AKI的最常见分子之一,TLR4是LPS最重要的受体,其功能是LPS传感器,并负责脓毒症中的炎症级联反应,是炎症反应开启的钥匙,其激活会招募炎症因子并导致肾损伤[20]。此外,TLR4通过募集MyD88,随后介导IKK复合物磷酸化,诱导核NF-κB异位和激活。NF-κB通路的激活,上调促炎细胞因子分泌,同时诱导一氧化氮合酶和环加氧酶表达增加,导致肾血流量减少,细胞膜损伤,线粒体功能受到抑制,从而启动肾小管细胞凋亡过程,因此,NF-κB活化被认为是脓毒症AKI炎症和氧化应激的关键因素。NF-κB介导的炎症和氧化应激反应可以相互放大,导致不受控制的促炎信号传导的恶性循环[21]。NF-κB在S-AKI疾病进展中的核心作用使其成为药物干预的有吸引力的靶标。通过抑制NF-κB信号通路,可以减少炎症细胞活化和浸润,减少活性氧的产生,改善线粒体功能,从而发挥抗炎抗氧化失衡以保护肾脏免受脓毒性损伤[22]。在该研究中,笔者发现脓毒症AKI大鼠肾脏中TLR4和MyD88表达显著上调,NF-κB信号通路被激活,大鼠血清炎症因子水平和氧化应激相关指标明显升高。而芪黄解毒化瘀饮干预治疗后显著降低了大鼠肾组织中TLR4和MyD88的表达,抑制了NF-κB信号通路的活性,同时大鼠血清炎症因子水平下降和氧化应激减轻,这表明芪黄解毒化瘀饮可以通过TLR4/MyD88/NF-κB途径发挥抗炎和减轻氧化应激损伤而起到肾保护作用。
综上所述,芪黄解毒化瘀饮可以改善脓毒症AKI大鼠的一般状态,可以改善脓毒症AKI大鼠的肾功能障碍和肾脏病理损伤,减轻炎症水平和氧化应激反应,其作用机制可能与抑制TLR4/MyD88/NF-κB信号转导通路相关。
| [1] |
STEVENS P E, LEVIN A, Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: Synopsis of the kidney disease: Improving global outcomes 2012 clinical practice guideline[J]. Annals of Internal Medicine, 2013, 158(11): 825-830. DOI:10.7326/0003-4819-158-11-201306040-00007 |
| [2] |
SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for sepsis and septic shock(sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [3] |
CECCONI M, EVANS L, LEVY M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/S0140-6736(18)30696-2 |
| [4] |
PEERAPORNRATANA S, MANRIQUE-CABALLERO C L, GÓMEZ H, et al. Acute kidney injury from sepsis: Current concepts, epidemiology, pathophysiology, prevention and treatment[J]. Kidney International, 2019, 96(5): 1083-1099. DOI:10.1016/j.kint.2019.05.026 |
| [5] |
CHANG Y M, CHOU Y T, KAN W C, et al. Sepsis and acute kidney injury: A review focusing on the bidirectional interplay[J]. International Journal of Molecular Sciences, 2022, 23(16): 9159. DOI:10.3390/ijms23169159 |
| [6] |
HU X Q, ZHOU W Q, WU S, et al. Tacrolimus alleviates LPS-induced AKI by inhibiting TLR4/MyD88/NF-κB signalling in mice[J]. Journal of Cellular and Molecular Medicine, 2022, 26(2): 507-514. DOI:10.1111/jcmm.17108 |
| [7] |
陈曦, 施京红, 吴守振. 黄芪多糖在支气管哮喘中的免疫调节作用和相关机制的研究进展[J]. 中国医药导报, 2023, 20(31): 56-59. |
| [8] |
余应嘉, 叶淑芳, 邓燕芳, 等. 大黄素甲醚对脂多糖诱导肠上皮细胞损伤自噬与缝隙连接蛋白的作用影响[J]. 中国医院药学杂志, 2023, 43(18): 2032-2036. |
| [9] |
陈智阳, 黄江山, 徐燕军, 等. 丹参酮ⅡA减轻脓毒症大鼠急性肝肾损伤[J]. 中国免疫学杂志, 2020, 36(13): 1578-1582. DOI:10.3969/j.issn.1000-484X.2020.13.008 |
| [10] |
ZARBOCK A, NADIM M K, PICKKERS P, et al. Sepsis-associated acute kidney injury: Consensus report of the 28th acute disease quality initiative workgroup[J]. Nature Reviews Nephrology, 2023, 19(6): 401-417. DOI:10.1038/s41581-023-00683-3 |
| [11] |
KUWABARA S, GOGGINS E, OKUSA M D. The pathophysiology of sepsis-associated AKI[J]. Clinical Journal of the American Society of Nephrology, 2022, 17(7): 1050-1069. DOI:10.2215/CJN.00850122 |
| [12] |
何爱凤, 蔡志慧, 肖建鹏, 等. 二至丸对脓毒症急性肾损伤的保护作用及机制[J]. 中华中医药杂志, 2022, 37(8): 4309-4314. |
| [13] |
狄浩然, 王晓鹏, 梁立新, 等. 芪归银颗粒治疗脓毒症急性肾损伤患者的临床研究[J]. 中国中医急症, 2021, 30(9): 1583-1585, 1606. DOI:10.3969/j.issn.1004-745X.2021.09.019 |
| [14] |
彭志允, 彭环庆, 林辉文, 等. 补气养阴活血法治疗脓毒症患者急性肾损伤的临床观察[J]. 辽宁中医杂志, 2015, 42(2): 326-328. |
| [15] |
张瑞娟, 郭铭嘉, 任红艳. "关格" 之秦汉溯源[J]. 浙江中医杂志, 2023, 58(5): 323-325. DOI:10.3969/j.issn.0411-8421.2023.05.004 |
| [16] |
梅漫雪, 吴志光, 冯劲立, 等. 脓毒症多脏器功能障碍的中药辨治概况[J]. 广州中医药大学学报, 2019, 36(8): 1287-1291. |
| [17] |
倪清颖, 何振洋, 方雅萱, 等. 中医药治疗急性肾损伤研究概述[J]. 中医药学报, 2022, 50(10): 93-96. |
| [18] |
KEIR I, KELLUM J A. Acute kidney injury in severe sepsis: Pathophysiology, diagnosis, and treatment recommendations[J]. Journal of Veterinary Emergency and Critical Care, 2015, 25(2): 200-209. DOI:10.1111/vec.12297 |
| [19] |
LI J M, WANG L Y, WANG B, et al. NOX4 is a potential therapeutic target in septic acute kidney injury by inhibiting mitochondrial dysfunction and inflammation[J]. Theranostics, 2023, 13(9): 2863-2878. DOI:10.7150/thno.81240 |
| [20] |
WANG B, XU J, REN Q, et al. Fatty acid-binding protein 4 is a therapeutic target for septic acute kidney injury by regulating inflammatory response and cell apoptosis[J]. Cell Death & Disease, 2022, 13(4): 333. |
| [21] |
SHI M, ZENG X X, GUO F, et al. Anti-inflammatory pyranochalcone derivative attenuates LPS-induced acute kidney injury via inhibiting TLR4/NF-κB pathway[J]. Molecules, 2017, 22(10): 1683. DOI:10.3390/molecules22101683 |
| [22] |
BATCIK Ş, TUMKAYA L, MERCANTEPE T, et al. The nephroprotective effect of amifostine in a cecal ligation-induced sepsis model in terms of oxidative stress and inflammation[J]. European Review for Medical and Pharmacological Sciences, 2022, 26(24): 9144-9156. |
2. Beijing University of Chinese Medicine, Beijing 100029, China
 2025, Vol. 42
2025, Vol. 42