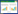文章信息
- 郑琳, 赵元, 吴锦如, 等.
- ZHENG Lin, ZHAO Yuan, WU Jinru, et al.
- 黄芪桂枝五物汤改善环磷酰胺致生精障碍小鼠的肠道菌群紊乱
- Study on the effects of Huangqi Guizhi Wuwu Decoction on the gut microbiota dysbiosis in mice with oligoasthenospermia induced by cyclophosphamide
- 天津中医药, 2025, 42(2): 246-252
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(2): 246-252
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.02.17
-
文章历史
- 收稿日期: 2024-08-02
根据中国人口协会和国家卫生健康委员会2016年发布的《中国不孕不育现状调研报告》显示,中国不孕不育患病率为12.5%~15%;以此推算,中国不孕不育的患者人数在5 000万左右;预计到2025年,中国不孕症患病率将增加到18%,患者人数将达到6 000万左右,给社会带来严重的疾病负担[1]。在临床不孕不育事件中男性精子问题占比超过50%,大量关于男性生殖健康的研究表明,男性精子质量正在大幅下降,对各大洲男性精子质量统计发现从1973年到2018年精子质量下降了51.6%,且下降幅度每年都在增加[2]。对深圳地区男性不育患者精液常规参数统计分析也显示,精子活力下降情况异常严重,是深圳地区男性不育首要原因[3]。积极检查及尽早有效地治疗少精子症是缓解不孕不育现状、提高人口出生率的1项重要措施。
少精子症的发病机制目前仍不清楚,主要原因可能与感染、内分泌激素水平异常、精索静脉曲张、免疫因素、遗传以及先天发育不足等有关。在临床中还没有很好的特效药,多为补充激素、抗氧化剂、改善能量代谢和微循环药物,虽能有限地改善某些症状,但临床疗效并不尽如人意。近期研究证明精子的生长发育与肠道菌群有密切关系。肠道菌群失调与胆汁酸水平降低影响了脂溶性维生素A在肠-睾轴的运输,睾丸中维生素A缺乏导致睾丸发育和精子发生的异常[4]。青少年2型糖尿病是潜在男性不育高风险人群,益生元海藻酸寡糖能改善其精子生成环境,增加其精子浓度和活力[5]。白消安处理可破坏肠道菌群并降低小鼠的精子质量及精子形成。将喂食褐藻寡糖后的小鼠粪菌移植给白消安处理后的小鼠,可通过调节肠道菌群组成、改善血液及睾丸代谢组,以提升后者的精子质量并恢复精子形成[6-7]。这些研究通过揭示机体在肠道菌群、代谢产物和睾丸发育等方面的密切联系,解析了代谢紊乱诱发的雄性生殖力下降的肠-睾丸轴存在的新机制,为代谢紊乱引发的生殖疾病的预防和治疗提供了新的思路。
中医认为少精子症证候病因主要为肾阳亏虚,肾阴阳两虚,脾虚精亏,湿热内蕴,气滞血瘀。少精子症中医辨证治疗主要以补肾益精为治疗原则,辅以滋阴补肾,补脾益气,补肾壮阳,清热利湿等[8]。黄芪桂枝五物汤出自张仲景《金匮要略·血痹虚劳病脉证治篇》,具有益气温经,祛风散邪,补气通阳和血通痹之功效。该配方组成为黄芪、桂枝、芍药、生姜、大枣等5味药,方中以黄芪为君,黄芪专以补气,气旺则血行,血行则瘀自通,肾子得养则化气血而生精;桂枝为臣,桂枝散风寒而温经通痹。生姜辛温,疏散风邪,以助桂枝之力;大枣甘温,养血益气,助黄芪益气以活血,故姜枣为佐药。芍药柔血养阴,引诸药入血分,助血得行,在方中为使药。临床上多应用于类风湿性关节炎[9]、糖尿病周围神经病变[10]、神经性疼痛[11]、IgA肾病[12]的治疗,笔者先前的实验结果发现,黄芪桂枝五物汤能有效地改善生精障碍C57BL/6J小鼠精子各种相关指标,提高雄激素表达水平[13],但其对肠道菌群方面的影响尚无研究。因此,该研究通过生精障碍小鼠模型,探讨黄芪桂枝五物汤对生精障碍小鼠在肠道菌群方面的干预作用,为其临床广泛应用提供可靠的实验依据。
1 材料与方法 1.1 黄芪桂枝五物汤的制备黄芪桂枝五物汤的制备方法参考《金匮要略》原文记载,剂量依据国家中医药管理局和国家药品监督管理局联合发布《古代经典名方关键信息表(7首方剂)》,黄芪(批号:201201551)∶赤芍(批号:210101011)∶桂枝(批号:201101901)∶生姜(批号:210300841)∶大枣(批号:210100051)剂量比例为23∶23∶23∶46∶20,5味药均购自康美(深圳)智慧药房。具体煎煮过程为浸泡30 min,大火煮沸后,小火煎煮30 min,煎煮2次,合并两次水煎液,浓缩至浓度分别为0.75、1.5、3.1 g生药/mL,储存于-80 ℃冰箱中备用。
1.2 仪器荧光倒置显微镜购自德国蔡司公司;16srDNA测序是基于Illumina测序平台进行的PE250双端测序系统来自美国Illumina公司;精子分析(CASA)软件采用BEION医学图像软件V4.20(上海北昂医药科技股份有限公司)。
1.3 动物体质量20~26 g雄性昆明小鼠由浙江维通利华实验动物技术有限公司提供,合格证号:SCXK(浙)2019-0001;适应性饲养1周后开始实验。实验动物的使用过程中按3R原则给予动物人道的关怀,并经深圳市拓普生物科技有限公司实验动物管理伦理委员会批准(TOP-IACUC-2021-0092)。
1.4 生精障碍小鼠模型建立、分组及给药随机选取10只雄性昆明小鼠为正常组,其余小鼠连续7 d腹腔注射环磷酰胺[60 mg/(kg·d)]制备小鼠生精障碍模型,而后随机分为模型组、黄芪桂枝五物汤低、中、高剂量组(8、16、32 g/kg),每组10只,分别灌胃黄芪桂枝五物汤浓缩液;正常组、模型组予以等剂量的生理盐水进行灌胃,连续给药35 d[13-14]。
1.5 睾丸、附睾脏器指数检测药物干预结束后,称取各组小鼠的体质量,然后处死小鼠,摘取小鼠睾丸、附睾,并称质量,计算睾丸和附睾的脏器指数。睾丸(附睾)指数=睾丸(附睾)质量/体质量。
1.6 精子参数检测分别摘取小鼠单侧附睾,剪碎后置于磷酸盐缓冲溶液(PBS)溶液中,孵育10 min,并制成精子悬液。显微镜观察精子浓度和活力,采用计算机辅助精子分析(CASA)系统检测附睾中精子质量[15-16]。
1.7 小鼠睾丸组织病理学观察取小鼠的睾丸组织,常规固定24 h,切片,每个标本选取8个不同视野,然后在显微镜下观察记录睾丸组织的病理改变。苏木素-伊红(HE)染色观察睾丸组织病理学变化[17]。
1.8 粪便16s rDNA测序收集小鼠粪便,MOBIO PowerSoil?誖DNA提取试剂盒抽提其中微生物总基因组DNA,采用Ⅱ代基因测序技术对粪便样品16S rDNA V4高变区进行扩增测序,扩增引物序列为(515F-806R),测序采用Illumina MiniSeq platform(2×250 bp);然后划分可操作分类单元OTU,使用USEARCH(Version 10.0)分析平台对所有OTU(Operational Taxonomic Units)进行物种注释、多样性分析、主坐标分析及PCoA运用方差分解;以观察不同组别间微生物群落多样性的分类学差异[18]。最后根据鉴别出的两组间差异菌群,采用PICRUST方法预测其潜在的肠道微生物基因功能,Willcom检验确定黄芪桂枝五物汤处理组肠道菌群功能的改变。
1.9 统计学分析所有数据以均数±标准差(x±s)表示,采用SPSS 20.0统计软件进行单因素方差分析(ANOVA),以P < 0.05为差异有统计学意义,运用R软件(version 3.6.0)和Python软件(version 3.5)软件对数据进行统计学分析。
2 结果 2.1 黄芪桂枝五物汤对睾丸指数、附睾指数、精子密度和精子活力的影响造模后,与正常组比较,模型组小鼠睾丸指数、附睾指数明显偏低;给药黄芪桂枝五物汤后,两者均得到显著改善,见图 1;8、16、32 g/kg黄芪桂枝五物汤的睾丸指数约为模型组的1.2、1.3、1.4倍,差异有统计学意义(P<0.05或P < 0.001);8、16、32 g/kg 3个不同剂量黄芪桂枝五物汤给药后附睾系数也得到显著改善(P<0.01或P < 0.001),以32 g/kg黄芪桂枝五物汤组改善最为显著。
|
| 注: 8 g/kg为低剂量组, 8 g生药/kg小鼠体质量黄芪桂枝五物汤水煎液; 16 g/kg为中剂量组, 16 g生药/kg小鼠体质量黄芪桂枝五物汤水煎液; 32 g/kg为高剂量组, 32 g生药/kg小鼠体质量黄芪桂枝五物汤水煎液。睾丸指数=小鼠睾丸质量/体质量; 附睾指数: 小鼠附睾质量/体质量。与对照组相比, ###P<0.001;与模型组相比, *P<0.05, **P<0.01, ***P<0.001。 图 1 黄芪桂枝五物汤对睾丸指数、附睾指数、精子浓度、精子活力的影响 Fig. 1 Effects of Huangqi Guizhi Wuwu Decoction on the testis index, epididymis index, sperm quality and viability |
造模后,与正常组比较,模型组小鼠精子浓度(106/mL)、精子活力(%)明显偏低;给药黄芪桂枝五物汤后,精子浓度显著升高;8、16、32 g/kg黄芪桂枝五物汤的精子密度分别为模型组的2.32、3.00、3.33倍,差异有统计学意义(P < 0.001);精子活力分别为模型组的1.7、2.1、2.9倍,差异具有显著性(P<0.05或P < 0.001)。说明黄芪桂枝五物汤可显著改善环磷酰胺造成的精子损伤。
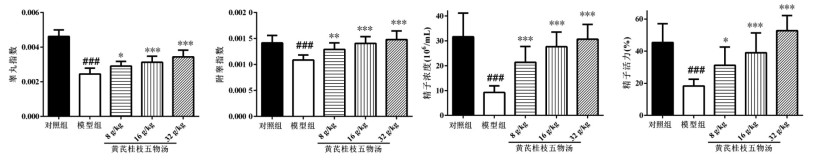
2.2 黄芪桂枝五物汤对睾丸组织切片的结构的影响HE结果显示,模型组小鼠睾丸的生精细胞数目及层数明显减少,大面积脱落、消失,间质内细胞数目明显减少,间质变大。给药后,间质内细胞增多,基本可以分辨出各级生精细胞,生精小管内细胞排列逐渐紧密、有序,排列较规则,层次分明,且呈剂量依赖性。见图 2。
|
| 图 2 黄芪桂枝五物汤对睾丸组织切片结构的影响(×200) Fig. 2 Effects of Huangqi Guizhi Wuwu Decoction on the pathological lesions of testicular tissue(×200) |
从粪便及肠道内容物中提取总DNA进行16S rRNA扩增子测序。结果显示,黄芪桂枝五物汤给药后各组内基于Shannon指数和evenness指数的Alpha多样性(图 3A、3B)以及不同组之间各门细菌的丰度(图 3E)没有显著性差异;但是微生物beta多样性PCoA分析显示,空白对照组与模型组以及给药组之间beta多样性存在显著性差异,证明不同组之间肠道菌群的组成发生了明显改变(图 3C、3D)。

|
| 注: 图A, 微生物alpha多样性evenness指数; 图B, 微生物alpha多样性shannon指数; 图C, 基于Unweight_UniFrac距离的PCoA分析; 图D, 基于Bray Curtis距离的PCoA分析; 图E, 各门微生物的丰度组成。其中Model为少精子症模型组, Sham为空白对照组, HGW为黄芪桂枝五物汤给药组。 图 3 给药后肠道菌群多样性及菌群丰度组成 Fig. 3 The diversity and composition of gut microbiota after administration |
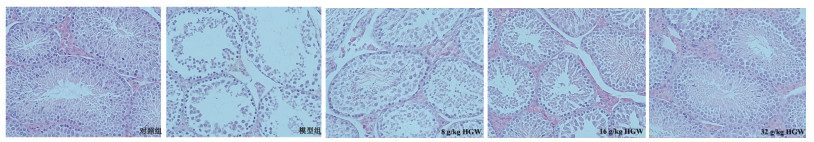
通过线性判别分析(LEfSe)得出各组间存在显著标志性特有物种,默认LDA>3且P < 0.05的肠道菌群作为差异菌种。结果显示空白对照组以罗氏菌属(Roseburia)、丹毒丝菌科(Erysipelotrichaceae)和布劳特氏菌属(Blautia)为优势菌群;少精子症模型组则以脱铁杆菌科(Deferribacteraceae)和毛螺菌科(Lachnospiraceae)为特征菌;黄芪桂枝五物汤给药组中瘤胃球菌属(Ruminococcaceae、Desulfovibrionaceae)、副拟杆菌属(Parabacteroides)和丁酸弧菌属(Butyrivibrio)为特征性菌群(图 4)。
|
| 注:图A,进化分支图;图B,分布柱状图(LDA>3,P < 0.05)。其中Model为少精子症模型组,Sham为空白对照组,HGW为黄芪桂枝五物汤给药组。 图 4 给药后各组肠道菌群LEfSe分析 Fig. 4 LEfSe analysis of the gut microbiota in different groups after administration |
不同组之间差异肠道菌属的丰度分布显示黄芪桂枝五物汤非显著性地提高了拟普雷沃氏菌属(Alloprevotella),瘤胃球菌科UCG-014(Ruminococcaceae UCG-014)和拟杆菌属(Bacteoides)的丰度;使得罗氏菌属(Roseburia)丰度比空白对照组明显减少(图 5D)。而各组间差异肠道菌群的火山分布图显示黄芪桂枝五物汤给药会使得生精障碍小鼠肠道菌群中副拟杆菌属(Parabacteroides)和丁酸弧菌属(Butyrivibrio)丰度增加(图 5A-C)。
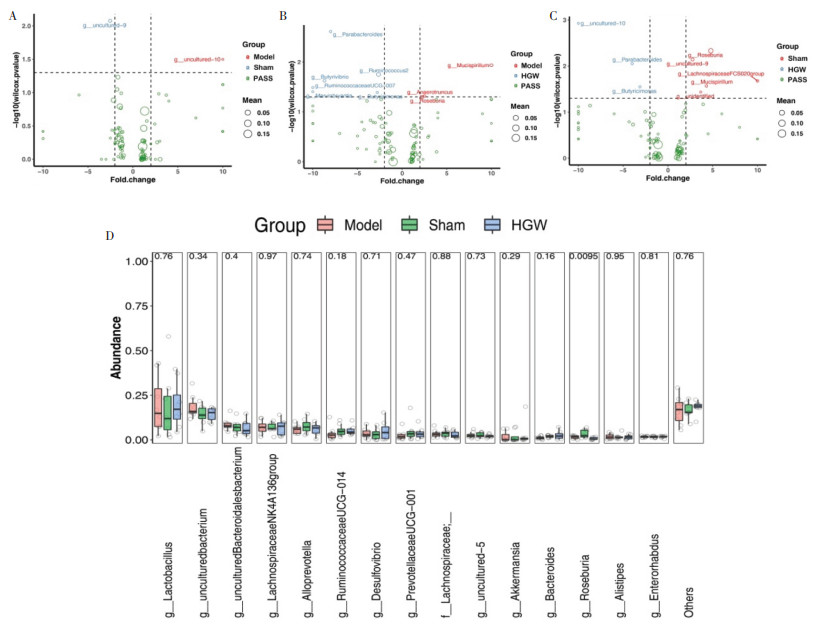
|
| 注:图A,空白对照组与模型组比较;图B,模型组与中药给药组比较;图C,空白对照组与中药给药组比较;图D,不同组之间差异肠道菌的丰度分布。其中Model为少精子症模型组,Sham为空白对照组,HGW为黄芪桂枝五物汤给药组。P<0.05,|log2FC|>1。 图 5 给药后各组间差异肠道菌群的火山分布图 Fig. 5 Volcano plot of gut microbiota in different groups after administration |
少、弱精子症是当前生殖男科门诊常见的病症。由少、弱精子症,尤其是特发性少精子症等精液质量异常所致的男性不育症发病率逐年升高,因其病理机制尚未完全阐明,导致临床上缺乏有效的治疗措施。中医药在治疗男性不育症方面疗效显著。研究表明黄芪桂枝五物汤中的中药具有生精障碍治疗作用:黄芪能有效缓解环磷酰胺引发的精子数量和存活率,以及睾丸重量的减少,显著提高环磷酸腺苷反应元件调节蛋白的表达,调控减数分裂后生殖细胞分化的重要转录因子[19]。黄芪甲素除了能改善环磷酰胺诱导的少精子症小鼠生殖器官损伤和精子各项参数,修复精子发生中各种基因的表达,同时还能提高睾酮水平和其生成的相关蛋白表达,提高抗凋亡蛋白,降低凋亡蛋白的表达[20]。姜黄素纳米混悬液能有效缓解环磷酰胺引起的生殖器毒性,生精小管构造和睾丸细胞凋亡,有效修复精子的DNA损伤[21]。黄芪多糖能通过改善肠道菌群来有效激活环磷酰胺诱导的免疫抑制小鼠肠道中的免疫应答反应[22]。
肠道菌群被证实与精子的生长发育有着密切关系[23]。肠道菌代谢物,如3-羟基苯乙酸,可直接通过调控铁死亡改善衰老导致的生精障碍[24];肠道菌能通过调节营养物质代谢(如维生素A)间接调控精子的发育[4]。共生菌Roseburia作为一种高产丁酸菌,可能对控制炎症过程具有重要作用。研究发现其可通过在小鼠体内产生丁酸盐抑制细菌易位从而缓减肠道菌群失调引起的乳腺炎[25]。该研究中空白对照组中Roseburia丰度比模型组高,可能环磷酰胺破坏该肠道菌导致睾丸炎症升高、生精障碍,中药给药也没有使其恢复。Ruminococcaceae_ UCG-014 sp.是一种可以降解纤维素产生短链脂肪酸丁酸盐的益生菌,丁酸盐是结肠细胞的重要能量来源,可通过促进肽YY分泌,抑制下丘脑弓状核中的神经肽Y和激活前阿黑皮素原神经元来影响食欲和饱腹感,控制体质量增长[26]。研究还表明青春期男性中睾酮含量与Ruminococcus和Parabacteroides相关[27]。该研究用环磷酰胺造模后该肠道菌在模型组中丰度显著降低,中药给药后其丰度在给药组略有升高,同时导致Parabacteroides的富集。可见黄芪桂枝五物汤可能是通过改变肠道菌群来调节精子生成功能,相关的分析需要进一步研究。
环磷酰胺作为免疫抑制剂,用于各种自身免疫性疾病,特别是肾病综合征。它在身体内主要通过肝脏P450酶水解成醛磷酰胺再运转到组织中形成磷酰胺氮芥而发挥作用。环磷酰胺属于烷化剂,是双功能烷化剂及细胞周期非特异性药物,可与DNA发生交叉联结从而抑制DNA合成,干扰DNA及RNA功能,对S期作用最明显,对T淋巴细胞和B淋巴细胞均有抑制作用。在临床上作为抗肿瘤药属于广谱抗肿瘤药使用,对白血病和实体瘤都有效。研究表明环磷酰胺可引起生殖细胞损害,在动物实验模型中,环磷酰胺可导致小鼠体质量降低,附睾质量减轻,精子计数减少,精子存活率降低,生精小管数量减少,生精细胞减少、空泡化[28]。其所致生殖损伤机制目前尚未明确,对精子的影响主要表现在对精子线粒体的损伤上,会造成精子活性降低、线粒体畸形率增加,使精子DNA碎片率增加。30例早期环磷酰胺治疗的儿童,有43.3%患者在后续12年间发展成为少精子症患者,精子浓度与环磷酰胺治疗的剂量和时间呈显著负相关。结果提示睾丸代偿性间质细胞衰竭,出现该情况的患者需进行睾丸功能的长期评估[29]。环磷酰胺能增加BALB/c小鼠硬壁菌门和变形杆菌门的丰度,降低拟杆菌门的丰度[30]。这些门上的变化在笔者研究的昆明小鼠模型上并不显著,只有拟杆菌属有显著下降,可能是因为不同种类老鼠对环磷酰胺反应程度不一样,昆明小鼠属于远交系封闭群小鼠,相比较近交系的BALB/c小鼠,个体差异性大且免疫力强。而且该研究中药给药时间较长,小鼠后期可能菌群自行恢复,造成给药后各组之间肠道菌群差异度下降。因此,生精障碍小鼠模型中小鼠种类对肠道菌群影响的差异还需要进一步实验探索。
| [1] |
刘淳, 孙惠昕, 马玉琨, 等. 1990-2019年中国不孕不育患者的疾病负担研究[J]. 中华生殖与避孕杂志, 2023, 43(6): 627-631. |
| [2] |
LEVINE H, JØRGENSEN N, MARTINO-ANDRADE A, et al. Temporal trends in sperm count: A systematic review and meta-regression analysis of samples collected globally in the 20th and 21st centuries[J]. Human Reproduction, 2023, 29(2): 157-176. |
| [3] |
魏玉娥, 魏荣兴, 刘苑欢, 等. 深圳特区2791例男性不育患者精液常规结果分析及病因探讨[J]. 中国优生与遗传杂志, 2016, 24(5): 141-142, 66. |
| [4] |
ZHANG T, SUN P, GENG Q, et al. Disrupted spermatogenesis in a metabolic syndrome model: The role of vitamin A metabolism in the gut-testis axis[J]. Gut, 2022, 71(1): 78-87. DOI:10.1136/gutjnl-2020-323347 |
| [5] |
YAN X W, FENG Y N, HAO Y N, et al. Gut-testis axis: Microbiota prime metabolome to increase sperm quality in young type 2 diabetes[J]. Microbiology Spectrum, 2022, 10(5): e0142322. DOI:10.1128/spectrum.01423-22 |
| [6] |
ZHANG P F, FENG Y N, LI L, et al. Improvement in sperm quality and spermatogenesis following faecal microbiota transplantation from alginate oligosaccharide dosed mice[J]. Gut, 2021, 70(1): 222-225. DOI:10.1136/gutjnl-2020-320992 |
| [7] |
DING N, ZHANG X, ZHANG X D, et al. Impairment of spermatogenesis and sperm motility by the high-fat diet-induced dysbiosis of gut microbes[J]. Gut, 2020, 69(9): 1608-1619. DOI:10.1136/gutjnl-2019-319127 |
| [8] |
郭军, 耿强. 少弱精子症的中医药治疗[J]. 江西中医药, 2008, 39(9): 19-20. |
| [9] |
WANG Y, CHEN T, YANG C, et al. Huangqi Guizhi Wuwu Decoction improves arthritis and pathological damage of heart and lung in TNF-tg mice[J]. Frontiers in Pharmacology, 2022, 13: 871481. DOI:10.3389/fphar.2022.871481 |
| [10] |
ZHENG Y J, YANG F, HAN L, et al. Efficacy of Chinese herbal medicine in the treatment of moderate-severe painful diabetic peripheral neuropathy: A retrospective study[J]. Journal of Diabetes Research, 2019, 2019: 4035861. |
| [11] |
LI M Z, LI Z, MA X D, et al. Huangqi Guizhi Wuwu Decoction can prevent and treat oxaliplatin-induced neuropathic pain by TNFα/IL-1β/IL-6/MAPK/NF-kB pathway[J]. Aging, 2022, 14(12): 5013-5022. DOI:10.18632/aging.203794 |
| [12] |
LIU W W, SHI L Q, WAN Q, et al. Huangqi Guizhi Wuwu Decoction attenuates Podocyte cytoskeletal protein damage in IgA nephropathy rats by regulating AT1R/Nephrin/c-Abl pathway[J]. Biomedecine & Pharmacotherapie, 2021, 142: 111907. |
| [13] |
ZHAO Y, WU J R, LI X B, et al. Protective effect of Huangqi-Guizhi-Wuwutang against cyclophosphamide-induced spermatogenesis dysfunction in mice by promoting steroid hormone biosynthesis[J]. Journal of Ethnopharmacology, 2024, 319(Pt 2): 117260. |
| [14] |
YUAN D, WANG H W, HE H B, et al. Protective effects of total flavonoids from Epimedium on the male mouse reproductive system against cyclophosphamide-induced oxidative injury by up-regulating the expressions of SOD3 and GPX1[J]. Phytotherapy Research, 2014, 28(1): 88-97. DOI:10.1002/ptr.4956 |
| [15] |
LU W P, MEI X T, WANG Y, et al. Zn(Ⅱ)-curcumin protects against oxidative stress, deleterious changes in sperm parameters and histological alterations in a male mouse model of cyclophosphamide-induced reproductive damage[J]. Environmental Toxicology and Pharmacology, 2015, 39(2): 515-524. DOI:10.1016/j.etap.2014.12.014 |
| [16] |
FUSCO R, SALINARO A T, SIRACUSA R, et al. Hidrox®counteracts cyclophosphamide-induced male infertility through NRF2 pathways in a mouse model[J]. Antioxidants, 2021, 10(5): 778. DOI:10.3390/antiox10050778 |
| [17] |
王梦梦, 克迎迎, 李亚格, 等. 杜仲补天素胶囊改善环磷酰胺诱导的小鼠生精障碍研究[J]. 中草药, 2019, 50(11): 2625-2631. |
| [18] |
ZHENG L, CHEN S, WANG F C, et al. Distinct responses of gut microbiota to Jianpi Yishen Decoction are associated with improved clinical outcomes in 5/6 nephrectomized rats[J]. Frontiers in Pharmacology, 2020, 11: 604. DOI:10.3389/fphar.2020.00604 |
| [19] |
KIM W, KIM S H, PARK S K, et al. Astragalus membranaceus ameliorates reproductive toxicity induced by cyclophosphamide in male mice[J]. Phytotherapy Research, 2012, 26(9): 1418-1421. DOI:10.1002/ptr.4756 |
| [20] |
FAN Q G, ZHAO Z Y, MENG Q, et al. Improvement of astragalin on spermatogenesis in oligoasthenozoospermia mouse induced by cyclophosphamide[J]. Reproductive Sciences, 2022, 29(6): 1738-1748. DOI:10.1007/s43032-021-00808-8 |
| [21] |
POOJARY K K, NAYAK G, VASANI A, et al. Curcumin nanocrystals attenuate cyclophosphamide-induced testicular toxicity in mice[J]. Toxicology and Applied Pharmacology, 2021, 433: 115772. DOI:10.1016/j.taap.2021.115772 |
| [22] |
LI Y N, ZHENG J P, WANG Y, et al. Immuno-stimulatory activity of Astragalus polysaccharides in cyclophosphamide-induced immunosuppressed mice by regulating gut microbiota[J]. International Journal of Biological Macromolecules, 2023, 242(Pt 2): 124789. |
| [23] |
CAI H, CAO X H, QIN D Z, et al. Gut microbiota supports male reproduction via nutrition, immunity, and signaling[J]. Frontiers in Microbiology, 2022, 13: 977574. DOI:10.3389/fmicb.2022.977574 |
| [24] |
JIN Z R, YANG Y Z, CAO Y L, et al. The gut metabolite 3-hydroxyphenylacetic acid rejuvenates spermatogenic dysfunction in aged mice through GPX4-mediated ferroptosis[J]. Microbiome, 2023, 11(1): 212. |
| [25] |
ZHAO C J, BAO L J, QIU M, et al. Commensal cow Roseburia reduces gut-dysbiosis-induced mastitis through inhibiting bacterial translocation by producing butyrate in mice[J]. Cell Reports, 2022, 41(8): 111681. |
| [26] |
CANFORA E E, JOCKEN J W, BLAAK E E. Short-chain fatty acids in control of body weight and insulin sensitivity[J]. Nature Reviews Endocrinology, 2015, 11(10): 577-591. |
| [27] |
YUAN X, CHEN R M, ZHANG Y, et al. Gut microbiota: Effect of pubertal status[J]. BMC Microbiology, 2020, 20(1): 334. |
| [28] |
沈国球, 鲁功成, 潘铁军, 等. 环磷酰胺诱导少精子/无精子症大鼠模型所致睾丸、附睾bFGF的变化[J]. 中国男科学杂志, 2010, 24(2): 28-30. |
| [29] |
WATSON AR, RANCE CP, BAIN J. 环磷酰胺对睾丸功能的长期影响[J]. 英国医学杂志中文版, 2022, 25(7): 1. |
| [30] |
KONG X H, DUAN W W, LI D J, et al. Effects of polysaccharides from Auricularia auricula on the immuno-stimulatory activity and gut microbiota in immunosuppressed mice induced by cyclophosphamide[J]. Frontiers in Immunology, 2020, 11: 595700. |
 2025, Vol. 42
2025, Vol. 42