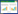文章信息
- 吴尚, 赵璐, 张玲, 等.
- WU Shang, ZHAO Lu, ZHANG Ling, et al.
- 基于网络药理学和实验验证探讨八宝丹胶囊治疗肝细胞癌的作用机制
- Study on the mechanism of Babaodan Capsules in the treatment of hepatocellular carcinoma based on network pharmacology and experimental validation
- 天津中医药, 2025, 42(3): 362-371
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(3): 362-371
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.03.15
-
文章历史
- 收稿日期: 2024-10-31
2. 浙江大学药学院, 杭州 310058;
3. 浙江中医药大学生命科学学院, 杭州 310053
八宝丹胶囊是一种由牛黄、蛇胆、羚羊角、珍珠、三七、麝香等8种名贵药材配伍组成的中药配方制剂, 是国家保密技术配方。临床资料记载, 八宝丹在抗炎、抗肿瘤等方面具有显著的辅助治疗作用, 主要包括治疗原发性肝癌[1]、病毒性肝炎[2]、重症肝炎[3]、胰腺癌[4]、胃癌[5]等疾病, 其中原发性肝癌最为常见。而肝细胞癌(HCC)在原发性肝癌中占比最多[6]。目前大量研究表明, 患者使用八宝丹胶囊-西药联合治疗的策略, 不仅对患者肝癌化疗栓塞的术后综合征有良好疗效, 而且能显著改善患者的肝功能[7]。八宝丹胶囊虽在临床使用多年, 但其成分资料和作用机制研究尚不完善。网络药理学具有"疾病-表型-基因-药物"多层次、整体性、系统性的优点[8], 以复方网络药理学为背景, 筛选中药单体进行网络连接验证, 再结合分子对接预测药物靶标, 最后使用生物实验验证的三重验证方法, 可探究药物机制并助力新型药物研发。因此, 本研究采用多种生物信息学分析并结合实验验证的方法, 系统探究八宝丹胶囊的活性成分及其治疗HCC潜在靶点和作用机制, 为八宝丹胶囊临床治疗HCC提供理论基础。
1 资料与方法 1.1 体外细胞实验 1.1.1 材料与试剂人肝癌HepG2细胞由中国科学院干细胞库提供; mRNA提取试剂盒(RN001, 奕杉生物), cDNA试剂盒(AT311-03, 北京全式金生物), 实时荧光定量聚合酶链反应(PCR)试剂盒(TB Green®Premix Ex TaqTM; No. RR420Q;TAKARA); 高糖DMEM培养基(Corning; CA公司, 美国); 磷酸盐缓冲液(PBS; PB2004Y;天津灏洋华科生物); 胎牛血清(FBS; 04-001-1ACS; Israel Beit Haemek LTD); 胰蛋白酶(Gibco公司; 美国); 葡萄糖(L2128240;阿拉丁试剂); 噻唑蓝(MTT; Sigma-Aldrich; Merk KGaA公司, 德国); 二甲亚砜(DMSO; 30072418;沪试)。八宝丹胶囊由厦门中药厂有限公司提供(批号: 221003091)。人信号转导和转录激活因子3(STAT3)、肿瘤蛋白p53(TP53)、连环蛋白1(CTNNB1)、表皮生长因子受体(EGFR)、丝裂原活化蛋白激酶10(MAPK10)、甘油醛-3-磷酸脱氢酶(GAPDH)引物(批号: 20230425-207, 浙江尚亚)。
1.1.2 八宝丹胶囊溶液配制取八宝丹胶囊中粉末, 使用超纯水溶解超声12 h后经0.22 μm滤膜过滤, 制备100 mg/mL的八宝丹原始母液。然后用含10% FBS和1% 双抗的DMEM培养基(完全培养基)进一步稀释至10 mg/mL, 并经0.22 μm滤膜再次除菌。
1.1.3 细胞培养HepG2细胞用完全培养基于37℃、5% CO2环境的细胞培养箱中培养, 待细胞增殖至表面80%~90%时进行传代, 每48 h更换培养液。选择稳定生长、状态良好的细胞用于后续实验。
1.1.4 细胞活力检测取对数生长期的HepG2细胞, 胰酶消化、离心重悬后以3 000每孔的密度接种于96孔板中, 完全培养基培养24 h, 设置不同程度(0、5、12.5、25、50、100、200 μg/mL)的八宝丹给药, 每组设6个复孔。八宝丹胶囊作用24 h后MTT法测定各组细胞活力。
1.1.5 Realtime qPCR取对数生长期的HepG2细胞, 以50万每孔的密度接种至6孔板, 完全培养基培养至细胞贴壁约90%, 随即分为3组。1)空白组(Con组): 完全培养基。2)低剂量给药组(Low组): 完全培养基添加八宝丹胶囊浓度为100 μg/mL。3)高剂量给药组(High组): 完全培养基添加八宝丹胶囊浓度为200 μg/mL。设3复孔, 于37℃、5% CO2环境的细胞培养箱中培养。培养24 h后收集细胞提取细胞总RNA, 并使用逆转录酶试剂盒制备cDNA。随后, 在20 μL反应体系中扩增, 该体系由10 μL TB Green®Premix Ex Taq Mix、1 μL cDNA模板、7 μL dd water和1μL正/反向引物组成。引物序列见表 1。PCR反应的热反应循环为: 在95℃下初始变性1 min; 在95℃下变性15 s, 在59℃下退火20 s, 在60℃下延伸40 s的40个循环。GAPDH用作内参基因, 并使用2-ΔΔCt方法计算相对表达。
运用中药系统药理学数据库(TCMSP, https://tcmsp-e.com/)、PubChem(https://pubchem.ncbi.nlm.nih.gov/)等数据库以及文献报道收集八宝丹胶囊主要成分。以三七、牛黄、麝香、珍珠、羚羊角、蛇胆为关键词在TCMSP数据库中进行检索, 以生物利用度(OB)和类药性(DL)作为筛选条件, 保留OB ≥ 30%或DL ≥ 0.18的化学成分。此外, 综合文献检索汇总麝香、蛇胆、珍珠、羚羊角等所含化合物, 并在Chemical Book(https://www.chemicalbook.com/)、PubChem等平台获取可供补充的化合物成分。
以三七、牛黄等药材为关键词, 在TCMSP、PharmMapper数据库(http://www.lilab-ecust.cn/)预测活性成分作用靶点。其余靶点通过中医药整合药理学研究平台(TCMIP)、中医药综合数据库(TCMID)等数据库进行以化合物为源头的靶点检索。最后将获得的靶点信息通过Uniprot蛋白质数据库(https://www.uniprot.org/)进行标准化, 结果作为八宝丹胶囊活性成分靶点。
1.2.2 HCC核心成分的数据库构建与筛选以"Hepatocellular Carcinomas"或"HCC"为关键词在GeneCards、人类在线孟德尔遗传(OMIM)、遗传药理学与药物基因组学数据库(PGKB)等数据库进行搜索, 获取HCC相关的疾病靶点。将3个数据库平台搜索所得结果取并集, 此为所需的疾病靶点。
1.2.3 "中药复方-化学成分-疾病靶点"网络图的构建将八宝丹胶囊治疗HCC的交集靶点导入Cytoscape 3.9.0软件, 构建八宝丹胶囊化学成分疾病靶点的"药物-成分-靶点"可视化网络图, 并将各组分按照Degree筛选核心中药单体。
1.2.4 蛋白质互作(PPI)网络图构建将筛选得到的八宝丹胶囊干预HCC的靶点基因录入String数据库(https://string-db.org), 选择"Multiple proteins"-"Homo sapiens", 其他参数设置为默认, 将可视化图以文本和图片的格式导出, 使用R 4.0.2对上述数据进行分析, 并按照Degree值排序, 选取排名前10的靶点为核心靶标, 用于后续分析。
1.2.5 作用靶点通路富集分析基因本体论(GO)数据库和京都基因与基因组百科全书(KEGG)数据库是目前世界上最常用的基因组和通路类数据库, 用于为目标基因分配系统功能注释并揭示基因组分配功能。在R 4.0.2的环境中运行org.Hs.eg.db数据库, 将基因名称转换为Entrez ID后使用cluster-Profiler富集分析基因, 并在pathview和enrichplot相关组件协助下绘制并导出气泡图和路径图。
1.3 分子对接验证从PubChem(https://pubchem.ncbi.nlm.nih.gov)数据库下载八宝丹胶囊关键化合物的3D结构, 经ChemBio3D Ultra 14.0优化能量。从PDB(https://www.rcsb.org/)数据库下载STAT3、TP53、CTNNB1、MAPK10、ESR1的蛋白结构。利用AutoDock Tools 1.5.6软件对蛋白质进行去水加氢以及去除蛋白质原有配体等操作, 并将蛋白受体和分子配体均转化为PDBqt格式。最后使用AutoDock Vina进行分子对接, 选取最合适的构象, 使用PyMOL 2.4.0和Discovery Studio 4.5软件将对接模型进行可视化分析。
1.4 统计分析所有数据均采用GraphPad Prism 9.0软件与Excel(Office 2021)进行处理与分析, 组间比较通过单因素方差分析或非配对t检验进行。以P < 0.05为差异有统计学意义。
2 实验结果 2.1 网络药理学实验结果 2.1.1 八宝丹胶囊活性成分与靶点的筛选TCMSP数据库中共获取72种三七主要成分, 包括三七皂苷、人参皂苷类等, 牛黄的18种成分主要为牛磺酸、胆汁酸类。其余为非植物类药材, 在数据库中暂无查询结果。李洋等[9]利用液相色谱技术从八宝丹胶囊中鉴别分离到72种化合物, 其中皂苷类有34种, 多源于三七; 胆酸类有10种, 多源于牛黄和蛇胆; 氨基酸类有15种, 多源于羚羊角和珍珠; 含氮杂环以及其他甾体类源于麝香。此外, 综合了曹妍等[10]、夏静芬等[11]的研究结果, 筛选去重后得出可查询的化合物共115个, 对应药物靶点393个, 见表 2。
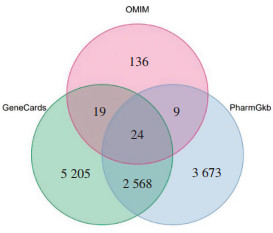
在PGKB、GeneCards和OMIM数据库中检索与HCC相关的基因。对搜索到的3个数据库基因进行筛选, 得出3个数据库中基因分布状况。为全面挖掘靶点, 选择疾病靶点的并集, 以上搜索得到的疾病靶点数目为11 634个, 见图 1。将药物靶点和疾病靶点再次建立Venn图联系, 同时可以得到药物和疾病靶点交集靶点346个, 见图 2。
|
| 图 1 疾病靶点数目及分布 Fig. 1 Number and distribution of disease targets |
|
| 图 2 药物靶点-疾病靶点Veen图 Fig. 2 Venn diagram of drug target-disease target |
将346个Venn图交集靶点导入Cytoscape 3.9.0软件, Strawberry Perl(5.30.0.1-64bit)构建交叉药物靶标、分子和中药的交互关系, 并将输出数据表导入Cytoscape 3.9.0软件中, 绘制出八宝丹胶囊与HCC的"化学成分-疾病靶点"网络图, 见图 3。其中, 靶点的大小与节点的连接度(Degree值)成正相关; 中间蓝色方形部分为疾病靶点; 左部紫色菱形代表三七化学成分; 左上绿色菱形代表蛇胆化学成分; 左下红色菱形代表珍珠化学成分; 右部红色菱形代表羚羊角化学成分; 右上绿色菱形代表麝香化学成分; 右下黄色菱形代表牛黄化学成分。

|
| 注:节点大小反映Degree值大小变化,节点越大Degree值越大。 图 3 “化学成分-疾病靶点”网络图 Fig. 3 Network diagram of"chemical composition-disease target" |
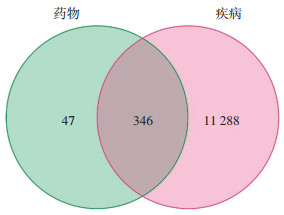
依据前述步骤将346个互作基因导入String数据库后, 设置中等置信度(0.400)并将数据导出到Cytoscape 3.9.0软件并编辑优化, 根据Degree可以得出排序, 其中Degree数值最高的靶点基因为STAT3, 其次为TP53、CTNNB1、EGFR等。STAT3编码控制细胞生长或凋亡的STAT蛋白质家族, 正常情况下在癌细胞中高度表达以完成癌细胞的增殖[12]; 此外, 还分析了蛋白互作情况: 与STAT3进行了互作链接, PPI连接度筛选 > 10, STAT蛋白家族互作分析图。见图 4、图 5。
|
| 注:每个气泡代表一个靶点蛋白,中间的区域节点较多,反映其互作性较强,起主导作用。 图 4 PPI网络图 Fig. 4 PPI network diagram |
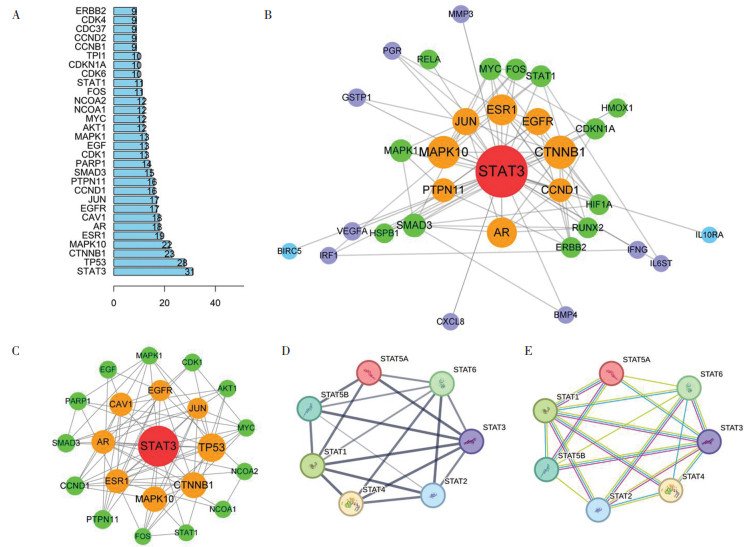
|
| 注:图A,连接度Degree排序图;图B,仅与STAT3相关联的潜在蛋白靶点预测;图C,互作Degree > 10的潜在蛋白靶点预测;图D和图E,STAT 蛋白家族互作分析图 图 5 蛋白互作情况 Fig. 5 Protein interaction |
将筛选所得346个交集靶点基因进行GO功能富集分析, 得出相关结果共3 175条。将结果划分3类, 其中生物过程(BP)2 781条、细胞组分(CC)119条、分子功能(MF)275条。使用R 4.0.2软件将3类的前10项进行可视化操作, 生成条形图和气泡图。见图 6。
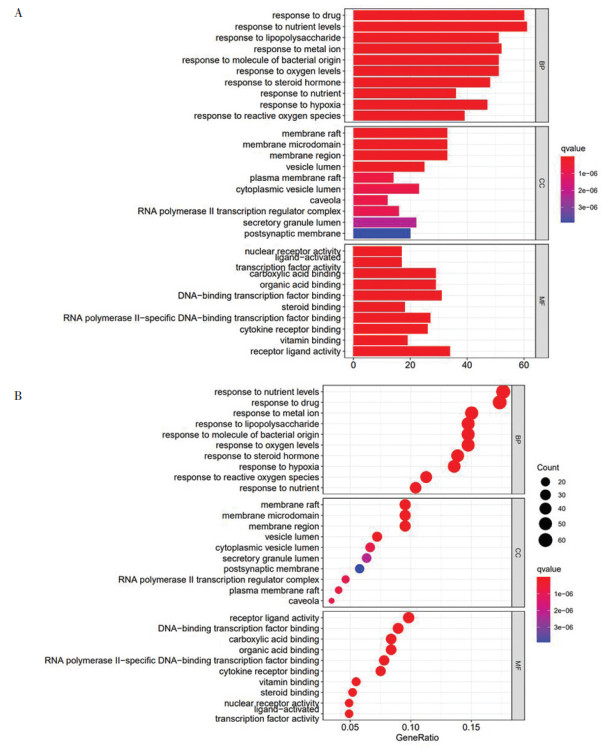
|
| 图 6 GO分析条形图与气泡图 Fig. 6 Bar chart and bubble diagram of GO analysis |
同样, 对346个交集靶点进行KEGG富集分析, 共计得到KEGG通路187条, 使用R 4.0.2软件对前30条通路进行可视化分析, 生成条形图和气泡图。见图 7。
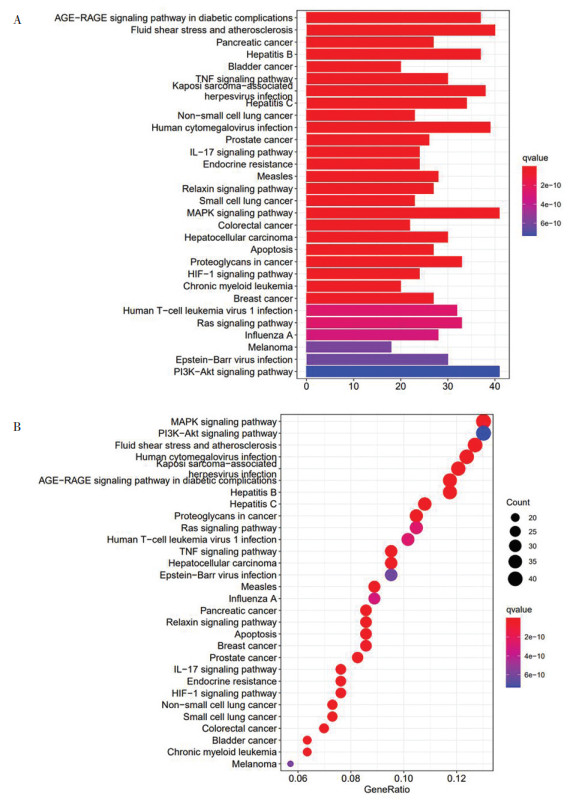
|
| 图 7 KEGG分析条形图与气泡图 Fig. 7 Bar chart and bubble diagram of KEGG analysis |
通过分子对接分析, 可评价八宝丹胶囊中关键化合物与蛋白配体的结合亲和力。一般认为对接分数越小, 配体与受体对接的结合能越低, 亲和力越高, 发生作用的可能性越大[13]。配体(雌二醇、槲皮素、熊果酸、甘草素、鹅去氧胆酸)和蛋白之间的对接得分均在-6.8至-8.8之间, 提示有效或活性成分与关键靶点具有较高亲和活力, 见表 3。根据PPI选取了3个关键靶点与前3个活性成分雌二醇、槲皮素和熊果酸做3D模型结合图, 见图 8。配体-蛋白对接图显示配体和靶蛋白间存在着氢键、疏水作用力等。
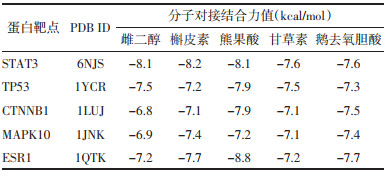
|
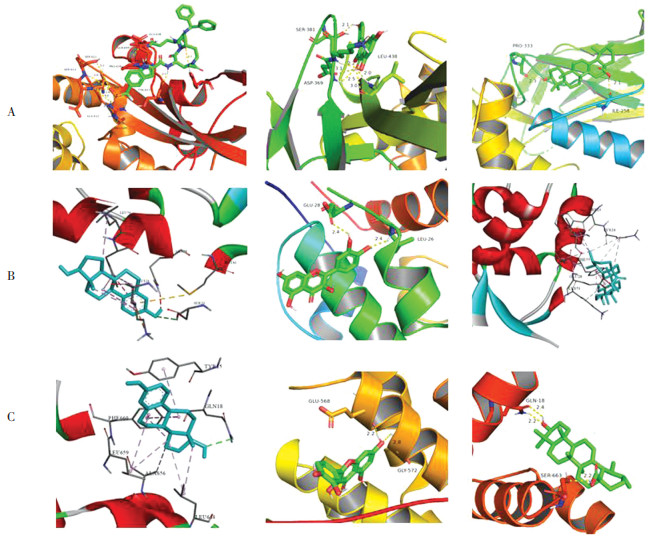
|
| 图 8 A.STAT3蛋白与雌二醇、槲皮素和熊果酸的对接图;B.TP53蛋白与雌二醇、槲皮素和熊果酸的对接图;C.CTNNB1蛋白与雌二醇、槲皮素和熊果酸的对接图 Fig. 8 A.Docking diagrams of STAT3 with 17-beta-estradiol, quercetin, ursolic acid B.Docking diagrams of TP53 with 17- beta-estradiol, quercetin, ursolic acid C.Docking diagrams of CTNNB1 with 17-beta-estradiol, quercetin, ursolic acid |
使用不同浓度(0、5、12.5、25、50、100、200 μg/mL)的八宝丹胶囊处理HepG2细胞, 经MTT法处理后得出八宝丹胶囊在100 μg/mL浓度条件对HepG2细胞活力具有显著的抑制作用, 因此选用100和200 μg/mL的浓度作为后续实验浓度。与Con组相比, 八宝丹胶囊100 μg/mL组(Low)处理后, 与癌细胞生长、增殖相关的STAT3、TP53、CTNNB1等基因表达水平均显著降低, 结合分子对接结果, 说明八宝丹胶囊通过作用于上述基因对肝癌细胞起到杀伤作用(P < 0.05)。见图 9。
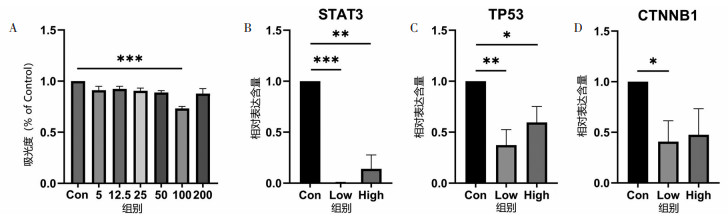
|
| 注:与Con组比较;*P<0.05,**P<0.01,***P<0.001。 图 9 A.细胞活力数据;B-D.各基因表达情况 Fig. 9 A. Cell viability; B-D. Expression of test genes |
HCC作为一种难治愈、易复发、生存率低的恶性癌症, 是全球第六大常见癌症类型, 肿瘤致死性仅次于胰腺癌[14], 占原发性肝癌的九成之多[15]。八宝丹胶囊作为一种治疗肝胆类疾病的良药, 包含三七、天然牛黄、天然麝香、羚羊角等成分, 在临床治疗中起到重要作用[16]。但八宝丹胶囊治疗肝细胞癌的有效成分及其作用机制尚未十分明确。
本研究通过构建"药物-成分-靶点"网络, 找到八宝丹胶囊治疗HCC的潜在核心分子, 包括雌二醇、槲皮素、熊果酸、甘草素、鹅去氧胆酸、甘氨酸等。槲皮素主要来自三七, 能通过上调p53和p21的表达, 下调Cyclin D1、细胞周期蛋白依赖性激酶2(CDK2)以及CDK7的表达, 从而发挥G2/M期的延迟滞后, 加快活性氧(ROS)的合成的作用[17], 并在其他药物治疗HCC的记载中也被印证[18]。熊果酸也来自于三七, 可促使人肝癌HepG2细胞凋亡[19], 二者的调控方式都能进一步减少肝癌细胞, 从源头上杜绝了肝癌细胞的产生。甘草素能辅助三七中其他药物活性分子, 通过ROS介导的MAPK/STAT3/NF-κB信号通路以诱导肝癌细胞周期的延滞和细胞的凋亡[20]。鹅去氧胆酸源自牛黄、蛇胆, 能联合奥贝胆酸辅助增加人肝细胞牛磺胆酸(TCA)的外流, 调节机体胆汁酸的稳态, 避免肝胆疾病的产生[21]。甘氨酸从珍珠、羚羊角均分离得到, 可降低HCC患者甘氨酸受体(GlyR)依赖的、血管内皮生长因子(VEGF)介导的血管生成信号, 具有潜在的抗血管生成作用[22], 在肝癌治疗中起到不可或缺的作用。
通过PPI分析得到八宝丹胶囊调控的一些核心靶点, 包括STAT3、TP53、CTNNB1等。STAT3是一种转录因子, 其参与细胞的增殖分化和血管生成等多种生物学过程, 但在大多数癌症细胞中被过度激活。作为一个转录因子, STAT3调控一系列与癌细胞过度增殖、侵袭转移和免疫逃避等生物过程有关的基因[23]; 相关的AG490[24]是一种STAT3抑制剂, 可通过降低上游激酶Janus激酶Ⅱ(JAK2)阻断STAT3的激活, 从而减少肿瘤的发生。TP53是肝癌中最常见的突变基因, Huang等[25]证实了ROS产生和苏氨酸激酶(AKT)的激活介导了线粒体分裂的促生存作用, 并促进了TP53降解; 此外, TP53突变易下调HCC免疫应答、导致肿瘤产生。CTNNB1是HCC中一个突变较为频繁的基因, 其突变可能影响CD96来调节自然杀伤(NK)细胞, 进而影响肝细胞的癌变[26], 表明这些核心靶点与HCC的发生是密切相关的。
分子对接结果显示, 在活性成分和关键靶标中存在配体和蛋白之间的良好结合, 提示活性分子在与关键靶点的结合过程中具有较高亲和活力。此外, 细胞实验表明, 在肝癌细胞接触八宝丹胶囊活性成分干预的过程中, STAT3等基因发生了显著下调, 说明抑制STAT3的表达即可导致细胞周期停滞和凋亡, 进而降低HepG2细胞活力[27]。Shi等[28]采用动物实验验证了HCC的发生与TNF-α/NF-κB信号通路相关, 与本研究分析结果一致。白细胞介素(IL)-17A是IL-17信号通路中促肿瘤发生的细胞因子, 可以调节肝脂肪变性、纤维化和HCC, 可能是HCC患者的潜在治疗靶点[29]。因此, 得出八宝丹胶囊通过TNF-α/NF-κB信号通路、MAPK信号通路; 通过调控癌细胞的STAT3等生长转录因子基因、TP53等癌系基因多途径介导细胞凋亡, 进而发挥治疗HCC的作用。
综上所述, 本研究采用网络药理学、分子对接、蛋白验证等方法初步研究了八宝丹胶囊治疗HCC的潜在机制, 发现其治疗作用的核心化合物与核心靶点, 分析了相关的治疗生物过程、作用方式和信号通路, 并结合实验及已有文献进行验证讨论。研究在分析中还存在珍珠等天然成分的微量元素未被收集导致数据库不完整等不足, 后续将对八宝丹胶囊展开质谱成分分析, 揭示其所有化学成分和核心靶点, 并开展深入研究和动物实验验证, 尝试发现更有效的治疗靶点和作用途径。
| [1] |
董智刚, 马丽丽, 张占红, 等. 经导管肝动脉化疗栓塞术联合鸦胆子油乳液静脉滴注对原发性肝癌的疗效及VEGF水平的影响[J]. 中国现代医学杂志, 2018, 28(18): 88-92. |
| [2] |
中华中医药学会肝胆病学分会. 八宝丹胶囊治疗病毒性肝炎临床应用专家共识[J]. 中西医结合肝病杂志, 2020, 30(6): 579-580. |
| [3] |
陈欣, 秦莉. 还原型谷胱甘肽联合八宝丹胶囊治疗慢性重症肝炎临床观察[J]. 吉林医学, 2011, 32(29): 6122-6123. |
| [4] |
SONG L B, GAO S, ZHANG A Q, et al. Babaodan Capsule combined with Qingyi Huaji Formula in advanced pancreatic cancer-a feasibility study[J]. Chinese Journal of Integrative Medicine, 2017, 23(12): 937-942. DOI:10.1007/s11655-017-2279-1 |
| [5] |
兰炜兰, 赵锦燕, 彭军, 等. 八宝丹调控TGF-β/Smad信号通路抑制胃癌耐药细胞生长和转移的作用机制[J]. 现代中药研究与实践, 2021, 35(2): 34-38. |
| [6] |
WALLACE M C, PREEN D, JEFFREY G P, et al. The evolving epidemiology of hepatocellular carcinoma: A global perspective[J]. Expert Review of Gastroenterology & Hepatology, 2015, 9(6): 765-779. |
| [7] |
徐意, 李伟, 楼妙姿, 等. 八宝丹胶囊治疗原发性肝癌化疗栓塞术后综合征临床研究[J]. 新中医, 2020, 52(16): 104-106. |
| [8] |
HOPKINS A L. Network pharmacology[J]. Nature Biotechnology, 2007, 25(10): 1110-1111. DOI:10.1038/nbt1007-1110 |
| [9] |
李洋, 余静, 赵亚红, 等. 中药复方制剂八宝丹中化学成分的UHPLC-Q-TOF/MS分析[J]. 第二军医大学学报, 2016, 37(12): 1548-1554. |
| [10] |
曹妍, 李婷, 常安琪, 等. 蛇胆中胆汁酸类化学成分分析[J]. 中国中药杂志, 2021, 46(1): 130-138. |
| [11] |
夏静芬, 钱国英, 陈亮, 等. 珍珠粉和贝壳粉的化学成分和结构特征分析[J]. 化学研究与应用, 2010, 22(11): 1467-1471. |
| [12] |
MAKINO Y, HIKITA H, KATO S, et al. STAT3 is activated by CTGF-mediated tumor-stroma cross talk to promote HCC progression[J]. Cellular and Molecular Gastroenterology and Hepatology, 2023, 15(1): 99-119. DOI:10.1016/j.jcmgh.2022.09.006 |
| [13] |
TANG Y J, SHI C Y, QIN Y Y, et al. Network pharmacology-based investigation and experimental exploration of the antiapoptotic mechanism of colchicine on myocardial ischemia reperfusion injury[J]. Frontiers in Pharmacology, 2021, 12: 804030. DOI:10.3389/fphar.2021.804030 |
| [14] |
VILLANUEVA A. Hepatocellular carcinoma[J]. New England Journal of Medicine, 2019, 380(15): 1450-1462. DOI:10.1056/NEJMra1713263 |
| [15] |
LLOVET J M, ZUCMAN-ROSSI J, PIKARSKY E, et al. Hepatocellular carcinoma[J]. Nature Reviews Disease Primers, 2016, 2(1): 16018. DOI:10.1038/nrdp.2016.18 |
| [16] |
蒲月华, 何锦锋, 高振声, 等. 珍珠粉与珍珠层粉微量元素的对比研究[J]. 食品研究与开发, 2016, 37(16): 125-128. |
| [17] |
LI Y Y, DUAN S Z, JIA H Y, et al. Flavonoids from Tartary buckwheat induce G2/M cell cycle arrest and apoptosis in human hepatoma HepG2 cells[J]. Acta Biochimica et Biophysica Sinica, 2014, 46(6): 460-470. DOI:10.1093/abbs/gmu023 |
| [18] |
李索咪, 徐辉辉, 朱均晶, 等. 基于网络药理学探讨白花蛇舌草—半枝莲抗肝细胞癌的作用机制[J]. 浙江中医药大学学报, 2020, 44(11): 1113-1123. |
| [19] |
宗彦红, 霍丽静, 常胜. 熊果酸对人肝癌HepG2细胞凋亡及PI3K/Akt信号通路的影响[J]. 医学研究杂志, 2020, 49(9): 107-111, 115. |
| [20] |
WANG J R, LUO Y H, PIAO X J, et al. Mechanisms underlying isoliquiritigenin-induced apoptosis and cell cycle arrest via ROS-mediated MAPK/STAT3/NF-κB pathways in human hepatocellular carcinoma cells[J]. Drug Development Research, 2019, 80(4): 461-470. DOI:10.1002/ddr.21518 |
| [21] |
GUO C, LACERTE C, EDWARDS J E, et al. Farnesoid X receptor agonists obeticholic acid and chenodeoxycholic acid increase bile acid efflux in sandwich-cultured human hepatocytes: Functional evidence and mechanisms[J]. The Journal of Pharmacology and Experimental Therapeutics, 2018, 365(2): 413-421. DOI:10.1124/jpet.117.246033 |
| [22] |
BRUNS H, PETRULIONIS M, SCHULTZE D, et al. Glycine inhibits angiogenic signaling in human hepatocellular carcinoma cells[J]. Amino Acids, 2014, 46(4): 969-976. DOI:10.1007/s00726-013-1662-2 |
| [23] |
SONG L X, RAWAL B, NEMETH J A, et al. JAK1 activates STAT3 activity in non-small-cell lung cancer cells and IL-6 neutralizing antibodies can suppress JAK1-STAT3 signaling[J]. Molecular Cancer Therapeutics, 2011, 10(3): 481-494. DOI:10.1158/1535-7163.MCT-10-0502 |
| [24] |
MEYDAN N, GRUNBERGER T, DADI H, et al. Inhibition of acute lymphoblastic leukaemia by a Jak-2 inhibitor[J]. Nature, 1996, 379(6566): 645-648. DOI:10.1038/379645a0 |
| [25] |
HUANG Q C, ZHAN L, CAO H Y, et al. Increased mitochondrial fission promotes autophagy and hepatocellular carcinoma cell survival through the ROS-modulated coordinated regulation of the NFKB and TP53 pathways[J]. Autophagy, 2016, 12(6): 999-1014. DOI:10.1080/15548627.2016.1166318 |
| [26] |
MO Z M, WANG Y D, CAO Z R, et al. An integrative analysis reveals the underlying association between CTNNB1 mutation and immunotherapy in hepatocellular carcinoma[J]. Frontiers in Oncology, 2020, 10: 853. DOI:10.3389/fonc.2020.00853 |
| [27] |
AI H H, ZHOU Z L, SUN L G, et al. 20(S)-25-methoxyl-dammarane-3β, 12β, 20-triol negatively regulates activation of STAT3 and ERK pathways and exhibits anti-cancer effects in HepG2 cells[J]. Apoptosis, 2017, 22(11): 1404-1418. DOI:10.1007/s10495-017-1416-9 |
| [28] |
SHI J N, SONG S P, LI S X, et al. TNF-α/NF-κB signaling epigenetically represses PSD4 transcription to promote alcohol-related hepatocellular carcinoma progression[J]. Cancer Medicine, 2021, 10(10): 3346-3357. DOI:10.1002/cam4.3832 |
| [29] |
MA H Y, YAMAMOTO G, XU J, et al. IL-17 signaling in steatotic hepatocytes and macrophages promotes hepatocellular carcinoma in alcohol-related liver disease[J]. Journal of Hepatology, 2020, 72(5): 946-959. DOI:10.1016/j.jhep.2019.12.016 |
2. College of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058, China;
3. College of Life Science, Zhejiang Chinese Medical University, Hangzhou 310053, China
 2025, Vol. 42
2025, Vol. 42