文章信息
- 王德旺, 蒙天琛, 李鑫.
- WANG Dewang, MENG Tianchen, LI Xin.
- 白桦脂醇纳米乳处方筛选及制备工艺优化研究
- Formulation screening and preparation process optimization of betulin nanoemulsion
- 天津中医药, 2025, 42(4): 486-495
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(4): 486-495
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.04.13
-
文章历史
- 收稿日期: 2024-11-01
白桦脂醇是羽扇豆烷型五环三萜类化合物,分子式为C30H50O2,相对分子质量为442.72,呈白色针状结晶,不溶于水,微溶于乙酸乙酯、乙醇、甲醇等中等极性溶剂,易溶于氯仿等低极性溶剂[1]。其广泛存在于白桦树皮、酸枣仁、石榴树皮等物质中[2],其中在干燥的白桦树树皮中含量较高[3]。研究表明白桦脂醇具有抗肿瘤、机体免疫调节、抗炎及护肝等药理作用[4-8],特别是在抗肿瘤和抗人类免疫缺陷病毒(HIV)等方面展现出巨大的潜能[9-11],而有关肿瘤的靶向治疗更是医学领域的研究热点。
但因白桦脂醇水溶性差、在体内的稳定性低以致生物利用度低,限制了在临床的应用。而纳米乳作为一种优秀的药物载体,是为临床和治疗应用而设计的重要工具。与传统剂型相比,纳米乳具有颗粒小、表面积大的特性,可以显著增加难溶药物的溶解度、提高其生物利用度以提升抗肿瘤效果[12]。同时纳米乳表面还具有活性中心多、反应活性高、吸附性强和催化率高的特性,使得药物更容易进入肿瘤细胞实现靶向性[13-15]。
本课题组实验研究表明经腹腔注射途径给药的白桦脂醇纳米乳对S180荷瘤小鼠模型有显著的抑瘤活性和靶向性[16]。将白桦脂醇做成纳米乳,不仅解决了白桦脂醇水溶性差的问题,还进一步提高了抗肿瘤的有效性。因此课题组决定对白桦脂醇纳米乳的处方和工艺进一步优化,以全面提升白桦脂醇对肿瘤的治疗效果,同时拓展了白桦脂醇剂型,对白桦脂醇的应用具有现实意义。
1 实验材料 1.1 仪器AS3120A超声波清洗器(天津奥特赛恩斯仪器有限公司);LE204E/02电子天平[梅特勒-托利多(上海)有限公司];TGL-16G台式离心机(上海安亭科学仪器厂制造);高效液相色谱仪、Chromeleon色谱工作站、UltiMate3000紫外检测器、P680A四元泵(美国Dionex公司);Welchrom C18色谱柱(上海月旭科技有限公司);DF-101S集热恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);HH-2数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);LitesizerTM500纳米粒度电位仪(奥地利Anton Paar公司);QL-861涡旋器(海门市其林贝尔仪器制造有限公司);SHA-CA水浴恒温振荡器(金坛市城东新瑞仪器厂)。
1.2 试剂与药物白桦脂醇标准品(纯度≥99.5%)(天津市天力化学试剂有限公司20200319);白桦脂醇(含量>98%,西安西海生物科技有限公司XH20201101);甲醇(色谱纯,德国,Merck公司);甲酸(色谱纯,天津市科密欧化学试剂有限公司);娃哈哈纯净水(娃哈哈集团有限公司);肉豆蔻酸异丙酯(IPM)、蓖麻油、氢化蓖麻油聚氧乙烯醚(RH-40)、二乙二醇乙醚(上海阿拉丁试剂有限公司);吐温80(Tween-80,天津百伦斯生物技术有限公司);蓖麻油聚氧乙烯醚(EL-40,山东优索化工科技有限公司);1,2-丙二醇(天津市巴斯夫化工有限公司);丙三醇(天津市天力化学试剂有限公司);双蒸水(自制)。
2 方法与结果 2.1 白桦脂醇纳米乳的制备方法在油相和表面活性剂中加入过量的白桦脂醇后密封。涡旋混合后,以37 ℃、100 r/min在恒温振荡器中震荡48 h。取出后离心5 min(5 000 r/min,离心半径5.96 cm),吸取上清液,作为载药油相和表面活性剂。精密量取载药表面活性剂与助表面活性剂混合,作为混合表面活性剂。精密量取载药油相,与混合表面活性剂混匀,在25 ℃、1 000 r/min的转速下进行磁力搅拌,逐滴加入蒸馏水,至溶液由浑浊变得透明时即得白桦脂醇纳米乳。
2.2 粒径、多分散指数(PDI)、Zeta电位的测定方法取适量白桦脂醇纳米乳,蒸馏水稀释100倍后超声震荡处理10 min,使其分散完全,取1 mL于比色皿中,在25 ℃,用激光粒度仪测定白桦脂醇纳米乳的平均粒径、PDI值和Zeta电位。
2.3 白桦脂醇纳米乳液结构类型的鉴别方法采用染色法对白桦脂醇纳米乳液的结构类型进行鉴别。取同一批次相同体积的两份白桦脂醇纳米乳液置于样本瓶中,同时分别滴加苏丹红Ⅲ及亚甲基蓝染料溶液各1滴,静止放置,观察红色和蓝色两种染料在纳米乳液中扩散速度及外观的变化。
2.4 载药量的测定方法 2.4.1 色谱条件色谱柱:Welchrom C18色谱柱(4.6 mm×250 mm,5 μL);流动相:甲醇:0.2%甲酸(80∶20);流速:1 mL/min;检测波长:210 nm;柱温:30 ℃;进样量:20 μL。
2.4.2 对照品溶液储备液的配制精密称取适量白桦脂醇标准品于25 mL容量瓶中,加入甲醇定容,超声波震荡5 min,即得浓度为400 μg/mL的标准储备液。用封口膜密封后,保存在4 ℃冰箱中,备用。
2.4.3 供试品溶液的配制制备3批白桦脂醇纳米乳,加入100 mL甲醇破乳,精密称定质量后超声1 h,充分溶解后用甲醇补足放冷后的损失,混匀后过滤,取续滤液经0.45 μm滤膜过滤后用封口膜密封,保存在4 ℃冰箱中,备用。
2.4.4 专属性实验量取一定量的空白纳米乳,记溶液A;量取一定量对照品储备液得溶液B;称取供试品液,稀释成一定浓度得溶液C。过0.45 μm微孔滤膜后,依照“2.4.1”项下色谱条件进样,比较色谱峰,结果表明空白纳米乳在210 nm处无吸收,供试品与对照品在相应位置上存在相同峰,对白桦脂醇的测定无干扰,该方法专属性强。
2.4.5 标准曲线的建立精密吸取白桦脂醇对照品的储备液1.0、1.5、2.5、3.0、4.0、5.0 mL于10 mL容量瓶中,加甲醇至容量瓶刻度线,超声5 min溶解,配制成40、60、100、120、160、200 μg/mL系列浓度的对照液。按“2.4.1”项下色谱条件进样,以色谱峰峰面积平均值Y为纵坐标,白桦脂醇标准溶液浓度X(mg/mL)为横坐标进行线性回归,得到白桦脂醇对照品回归方程Y=0.096 4X-1.296 3,R2=0.999 9。实验结果表明,说明白桦脂醇的浓度在40~200 μg/mL范围内标准曲线线性关系良好,可以用于白桦脂醇样品的测定。
2.4.6 精密度实验分别精密量取对照品储备液,用甲醇配成浓度为100、120、160 μg/mL的溶液。按“2.4.1”项下色谱条件进样,分别在1 d内进行重复测量3次,重复测量3 d,计算日内和日间精密度,根据实验数据结果,不同浓度对照品储备液的日内和日间精密度的峰面积(RSD)值分别为0.20、0.41、1.79和1.52、1.33、0.70均小于2%,精密度良好。
2.4.7 重复性实验精密量取白桦脂醇纳米乳,按供试品溶液制备方法制备6份。按“2.4.1”项下色谱条件进样记录峰面积并计算浓度和RSD值。RSD值为0.21%,表明重复性良好。
2.4.8 稳定性实验精密量取白桦脂醇纳米乳,按供试品溶液制备方法制备。按“2.4.1”项下色谱条件进样,根据峰面积计算RSD值。记录样品静置0、1、2、4、6、8 h的峰面积,计算RSD值为0.93%,表明供试品稳定性良好。
2.4.9 加样回收率实验精密量取白桦脂醇纳米乳1.0 mL 9份,分别精密加入低、中、高浓度的对照品溶液1.0 mL,按供试品溶液制备方法制备。再分别按“2.4.1”项下色谱条件进样,记录峰面积,代入标准曲线,计算回收率和RSD值。平均回收率分别为97.04、102.56、100.89,均在95%~105%,RSD值分别为1.41、1.22、1.47均小于2%,表明白桦脂醇对照品的回收率良好,符合方法学要求。
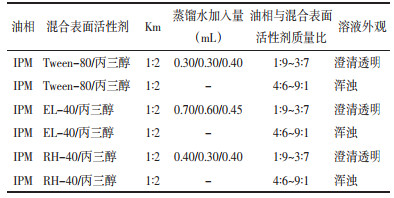
2.5 白桦脂醇纳米乳的处方筛选 2.5.1 油相的筛选分别精密量取表面活性剂(Tween-80、RH-40、EL-40)和助表面活性剂丙三醇,以质量比Km=1∶2混合,作为混合表面活性剂。精密量取油相(IPM、蓖麻油),分别与混合表面活性剂按质量比(1∶9~9∶1)混合,总质量1 g。在25 ℃,1 000 r/min转速下进行磁力搅拌,逐滴加入蒸馏水,当溶液由浑浊变得透明时制成纳米乳。记录各组溶液外观形态,见表 1。当油相为IPM时,可以与3种表面活性剂混合得到溶液外观澄清透明,流动性强且静置后不分层。处方最终选择IPM作为纳米乳的油相。
分别将表面活性剂(Tween-80、EL-40、RH-40)与助表面活性剂丙三醇以质量比Km=1∶2混合,作为混合表面活性剂,备用。精密称取IPM,分别与混合表面活性剂以质量比(1∶9~9∶1)混合,总质量1 g。在25 ℃,1 000 r/min转速下进行磁力搅拌,逐滴加入蒸馏水,当溶液由浑浊变得透明时制成纳米乳。记录各组溶液外观形态。根据油相、水相、混合表面活性剂比例绘制伪三元相图,见表 2、图 1。表面活性剂为Tween-80时形成的伪三元相图O/W纳米乳的区域面积最大。最终制备白桦脂醇纳米乳的表面活性剂为Tween-80。

|
| 图 1 不同表面活性剂制备纳米乳的伪三元相图 Fig. 1 Pseudo-ternary phase diagrams of nanoemulsions prepared with different surfactants |
将筛选出的表面活性剂分别与助表面活性剂(1,2-丙二醇、丙三醇和二乙二醇乙醚)以质量比Km=1∶2混合,作为混合表面活性剂,备用。精密称取IPM,分别与混合表面活性剂质量比(1∶9~9∶1)混合,总质量1 g。在25 ℃,1 000 r/min转速下进行磁力搅拌,逐滴加入蒸馏水,当溶液由浑浊变得透明时制成纳米乳。根据油相、水相、混合表面活性剂比例绘制伪三元相图,见表 3、图 2。助表面活性剂为丙三醇时形成的伪三元相图O/W纳米乳的区域面积最大。最终制备白桦脂醇纳米乳的助表面活性剂为丙三醇。

|
| 图 2 不同助表面活性剂制备纳米乳的伪三元相图 Fig. 2 Pseudo-ternary phase diagram of nanoemulsions prepared with different co-surfactants |
将筛选出的表面活性剂Tween-80与助表面活性剂丙三醇以质量比(Km=1∶2、1∶1、2∶1、3∶1)混合,作为混合表面活性剂。精密称取IPM,分别与混合表面活性剂以(1∶9~9∶1)质量比混合,总质量1 g。在25 ℃,1 000 r/min转速下进行磁力搅拌,逐滴加入蒸馏水,当溶液由浑浊变得透明时制成纳米乳。根据油相、水相、混合表面活性剂比例绘制伪三元相图,见表 4、图 3。当Km值为1∶2时,伪三元相图形成O/W纳米乳的区域面积最大。最终制备白桦脂醇纳米乳的Km值选择1∶2。

|
| 图 3 不同Km值制备纳米乳的伪三元相图 Fig. 3 Pseudo-ternary phase diagrams for the preparation of nanoemulsions with different Km values |
比较3组伪三元相图形成O/W纳米乳的区域面积。最优的处方组成为∶油相为IPM,表面活性剂为Tween-80、助表面活性剂为丙三醇,Km=1∶2。为保证空白纳米乳的载药量和稳定性,选择油相的中间比例点为作为最终处方。空白纳米乳的最终处方为:m(IPM)∶m(Tween-80)∶m(丙三醇)∶m(蒸馏水)=15.38%∶20.51%∶41.03%∶23.08%。
2.6 单因素筛选白桦脂醇纳米乳的制备工艺筛选 2.6.1 搅拌速度的考察按照实验筛选的最佳处方,以搅拌温度50 ℃,搅拌时间5 min进行磁力搅拌,分别考察500、1 000、1 500 r/min的搅拌速度对纳米乳制备的影响,以纳米乳的粒径、PDI、Zeta电位、载药量作为评价指标,测定结果见表 5。结果显示,搅拌速度对纳米乳的影响显著,当搅拌速度较慢时,水相和混合溶液不能充分混合,形成的纳米乳大小不一,故载药量较低,分散指数也较大;当搅拌速度过快时,初步形成的纳米乳不够稳定会被破坏,所以载药量也比较低,粒径也较大。因此综合纳米乳的粒径、PDI、Zeta电位、载药量测定结果,确定搅拌速度为1 000 r/min。

|
按照实验筛选的最佳处方,以搅拌速度1 000 r/min,搅拌时间5 min进行磁力搅拌,分别考察20、35、50、65 ℃的搅拌温度对纳米乳制备的影响,以纳米乳的粒径、PDI、Zeta电位、载药量作为评价指标,测定结果见表 6。根据实验结果可知,搅拌温度对粒径的影响较大。搅拌温度的升高,会加速分子的热运动,溶液能与水相及时充分反应混合,使得粒径逐渐变小;但当搅拌温度过高,颗粒易发生聚集,粒径变大。因此综合纳米乳的粒径、PDI、Zeta电位、载药量测定结果,确定搅拌温度为50 ℃。

|
按照实验筛选的最佳处方,以搅拌速度1 000 r/min,搅拌温度50 ℃进行磁力搅拌,分别考察1、5、20、35、50 min的搅拌时间对纳米乳制备的影响,以纳米乳的粒径、PDI、Zeta电位、载药量作为评价指标,测定结果见表 7。实验发现,搅拌时间较短,溶液没有充分混合,纳米乳形成不完全,所以载药量较小;搅拌时间较长时,体系容易被破坏,易发生聚集,且随着搅拌时间的逐渐加长,对纳米乳的粒径、PDI、Zeta电位、载药量的影响较小,为缩短实验时间,确定搅拌时间为5 min。

|
以单因素实验选择出的搅拌速度、温度和时间,作进一步筛选。因此,以搅拌速度(A)、搅拌温度(B)和搅拌时间(C)为影响因素,每个因素3个水平,以载药量(Y1)和粒径(Y2)为响应值进行最优工艺筛选。每个自变量的低、中、高水平设定为-1、0、+1,见表 8,实验设计及结果见表 9。
以Design-Export 12统计软件分析,以载药量(Y1)为响应值,对搅拌速度、搅拌温度、搅拌时间3个因素进行二项式拟合,Y1=5.14+0.226 2A+0.525 0B+0.323 7C-0.400AB-0.202 5AC+0.205 0BC-1.83A2-1.01B2-0.781 3C2(R2=0.984 9)。回归模型P<0.000 1,响应值拟合良好,失拟项P>0.05,无失拟因素存在,见表 10。方程一次项A、B、C和平方项A2、B2、C2的P<0.05,说明对载药量均有显著性影响;各因素对载药量的影响从大到小依次为∶B(搅拌温度,℃)>C(搅拌时间,min)>A(搅拌速度,r/min)。残差正态分布图见图 4。残差分布趋向一条直线,表明模型的拟合效果好。

|
| 图 4 残差正态分布图(Y1) Fig. 4 Distribution map of diaconal(Y1) |
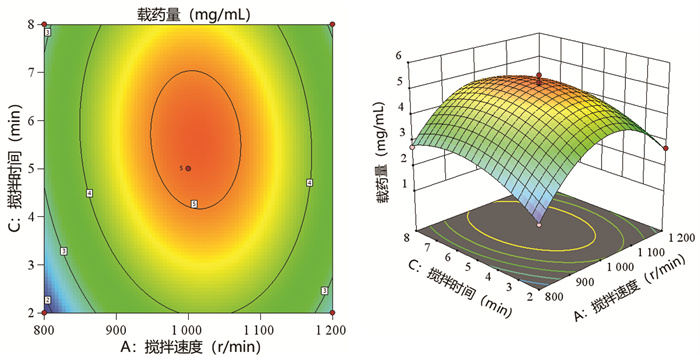
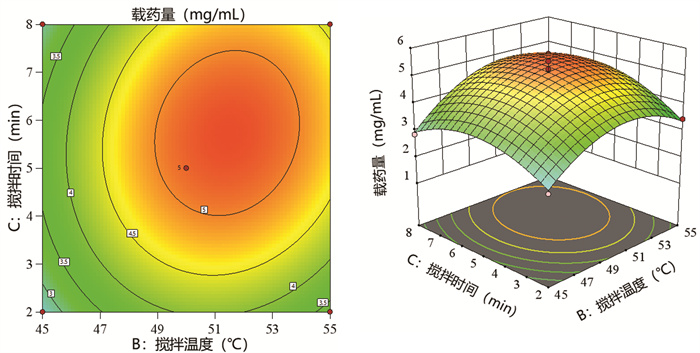
搅拌速度(A)、搅拌温度(B)和搅拌时间(C)的交互作用对载药量Y的影响的效应面影响结果见图 5-图 7。每当控制一个工艺参数不变,随着另外两个工艺参数变化时,白桦脂醇纳米乳的载药量都呈现先增加后降低的趋势,响应面曲面都很陡峭,越陡峭表明两种因素的交互作用越明显。等高线图皆为闭合曲线,表明3个因素两两之间交互作用明显并且存在最大值,说明模型拟合准确可靠。

|
| 图 5 搅拌速度和搅拌温度对载药量的等高线及3D响应面图 Fig. 5 Contour line and 3D response surface diagram of stirring speed and stirring temperature to drug loading |
|
| 图 6 搅拌速度和搅拌时间对载药量的等高线及3D响应面图 Fig. 6 Contour lines and 3D response surface diagram of stirring speed and stirring time to drug loading |
|
| 图 7 搅拌温度和搅拌时间对载药量的等高线及3D响应面图 Fig. 7 Contour lines and 3D response surface diagram of stirring temperature and stirring time on drug loading |
以Design-Export 12统计软件分析,以粒径(Y2)为响应值,分别对搅拌速度、搅拌温度、搅拌时间3个因素进行二项式拟合,Y2=34.83-1.28A-1.000 0B+2.19C-0.825 0AB-0.387 5AC+0.985 0BC+5.76A2+4.97B2+4.33C2(R2=0.981 6)。回归模型P<0.000 1,响应值拟合良好,失拟项P>0.05,无失拟因素存在,说明方程拟合性良好,见表 11。方程一次项A、B、C和平方项A2、B2、C2的P<0.05,说明对粒径均有显著性影响;各因素对粒径的影响从大到小依次为:C(搅拌时间,min)>A(搅拌速度,r/min)>B(搅拌温度,℃)。残差正态分布图见图 8。残差分布趋向一条直线,表明模型的拟合效果好。

|
| 图 8 残差正态分布图(Y2) Fig. 8 Distribution map of diaconal(Y2) |
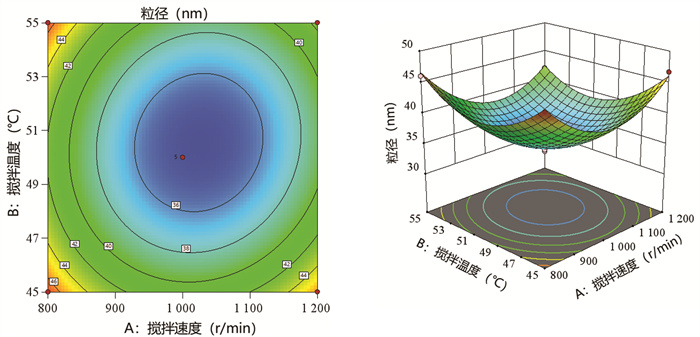
搅拌速度(A)、搅拌温度(B)和搅拌时间(C)的交互作用对粒径Y2的影响的效应面影响结果见图 9-图 11。每当控制一个工艺参数不变,随着另外两个工艺参数变化时,白桦脂醇纳米乳的粒径都呈现先降低后增加的趋势,响应面曲面都很陡峭,越陡峭表明两种因素的交互作用越明显。等高线图皆为闭合曲线,表明3个因素两两之间交互作用明显并且存在最大值,说明模型拟合准确可靠。
|
| 图 9 搅拌速度和搅拌温度对粒径的等高线及3D响应面图 Fig. 9 Contour line and 3D response surface diagram of stirring speed and stirring temperature to particle size |

|
| 图 10 搅拌速度和搅拌时间对粒径的等高线及3D响应面图 Fig. 10 Contour lines and 3D response surface diagram of stirring speed and stirring time to particle size |

|
| 图 11 搅拌温度和搅拌时间对粒径的等高线及3D响应面图 Fig. 11 Contour lines and 3D response surface diagram of stirring temperature and stirring time on particle size |
以载药量和粒径为响应值,考察搅拌速度、搅拌温度、搅拌时间之间交互作用对载药量的影响,确定白桦脂醇纳米乳的最佳制备工艺为:搅拌速度1 050 r/min,搅拌温度53 ℃,搅拌时间6.2 min,响应面法所得最佳处方的载药量为5.26 mg/mL,最佳粒径为34.41 nm。对该工艺进行验证实验结果见表 12。预测值与实测值RSD<2%,说明建立的制备工艺准确可靠。
最佳处方及工艺制备的白桦脂醇纳米乳呈淡黄色,外观均一、半透明且有淡蓝色乳光,此特征是纳米乳制备成功的标志之一,符合实验方案设计要求。
白桦脂醇纳米乳液的结构类型鉴别结果如图 12所示。苏丹红Ⅲ染料为油溶性染料,易在油相中扩散;亚甲基蓝染料为水溶性染料,易在水溶液中扩散。如果红色的扩散速度大于蓝色的扩散速度,则为W/O型纳米乳,相反则为O/W型纳米乳。两种染色剂同时滴入样品后扩散情况不同,其中蓝色的扩散速度大于红色的扩散速度,表明所制备的白桦脂醇纳米乳液的结构类型为O/W型纳米乳。

|
| 图 12 亚甲基蓝(左)与苏丹红Ⅲ(右)在白桦脂醇纳米乳液中的扩散 Fig. 12 Diffusion of methylene blue(left) and Sudan Red Ⅲ (right) in betulin nanoemulsions |
笔者课题组查阅大量文献未发现国内外有关白桦脂醇纳米乳的报道,没有前研究可进行比较优化,因此参考已成功制备纳米乳的文献[17-18]进行白桦脂醇纳米乳的研究。
本研究在预实验中通过溶解度实验和配伍实验对油相、表面活性剂、助表面活性剂进行了初步确定。通常油相选择短链(碳链<8)或中长链(碳链为8~14)的试剂,表面活性剂选用HLB值在8~18范围的非离子型表面活性剂,助表面活性剂选择具有增溶效果、可以改善表面活性剂HLB值的试剂。基于以上条件,本实验油相选择油酸乙酯、IPM、辛酸/癸酸三酰甘油(GTCC)、三乙酸甘油酯、蓖麻油,表面活性剂选择司盘20(Span-20)、Tween-80、RH-40、EL-40,助表面活性剂选择聚乙二醇400(PEG-400)、二乙二醇乙醚、1,2-丙二醇、丙三醇进行实验。
溶解度实验结果显示油相中的三乙酸甘油酯和表面活性剂中的司盘20在室温下黏度高,离心后无法与白桦脂醇分离,不利于含量测定和纳米乳的制备。因此油相初步确定为IPM、GTCC、蓖麻油。表面活性剂初步确定为Tween-80、RH-40、EL-40。助表面活性剂初步确定为1,2-丙二醇、丙三醇和二乙二醇乙醚。最后油相和表面活性剂的配伍实验结果显示,IPM与三种表面活性剂混合都无分层,蓖麻油与EL-40混合无分层,能够配伍。GTCC与3种表面活性剂都配伍失败,混合后静置溶液分层。最终根据溶液外观情况,选择IPM与3种表面活性剂、蓖麻油与EL-40的组合进一步筛选。
综上,本实验确定的白桦脂醇纳米乳处方工艺稳定简便,重复性好,制得的纳米乳载药量较高,届时可根据具体治疗需求,制备为口服、注射和外用等不同的给药方式或凝胶、喷雾剂型等不同剂型,为白桦脂醇纳米乳制剂的开发和应用提供理论依据和技术支持。
| [1] |
张彦南, 张欣, 邹梓萱, 等. 白桦脂醇酯类衍生物合成及体外抗氧化活性评价[J]. 中药新药与临床药理, 2024, 35(4): 563-569. |
| [2] |
李影, 李林夕, 张玉琦, 等. 一种高效的白桦树皮中白桦脂醇分离、纯化方法[J]. 植物研究, 2020, 40(3): 468-475. |
| [3] |
马博玉, 于涛. 白桦脂醇的连续提取工艺研究[J]. 科学技术创新, 2020, 20(2): 150-153. |
| [4] |
SO H M, EOM H J, LEE D, et al. Bioactivity evaluations of betulin identified from the bark of Betula platyphylla var. japonica for cancer therapy[J]. Archives of Pharmacal Research, 2018, 41(8): 815-822. DOI:10.1007/s12272-018-1064-9 |
| [5] |
傅增辉, 姜岩, 刘晶, 等. 白桦脂醇对脂多糖诱导小胶质细胞炎症反应的抑制作用[J]. 免疫学杂志, 2021, 37(2): 128-133. |
| [6] |
张玉, 李延玲, 李书印, 等. 白桦脂醇对人胃癌MGC-803细胞增殖的抑制作用和凋亡诱导作用[J]. 中国免疫学杂志, 2020, 36(17): 2115-2119. |
| [7] |
罗芳, 高琴, 费志医. 白桦脂醇对宫颈癌小鼠自然杀伤细胞杀伤力及淋巴细胞增殖活性的影响[J]. 中国现代医学杂志, 2022, 32(6): 6-11. |
| [8] |
黎舒心, 金成浩. 白桦脂醇的药理作用研究进展[J]. 园艺与种苗, 2023, 43(4): 105-107. |
| [9] |
徐耿. 新型羽扇豆烷型三萜衍生物的设计合成及抗肿瘤活性研究[D]. 广州: 广东工业大学, 2021.
|
| [10] |
TULI H S, SAK K, GUPTA D S, et al. Anti-inflammatory and anticancer properties of birch bark-derived betulin: Recent developments[J]. Plants, 2021, 10(12): 2663. DOI:10.3390/plants10122663 |
| [11] |
JOHN R, DALAL B, SHANKARKUMAR A, et al. Innovative Betulin Nanosuspension exhibits enhanced anticancer activity in a Triple Negative Breast Cancer Cell line and Zebrafish angiogenesis model[J]. International Journal of Pharmaceutics, 2021, 600: 120511. DOI:10.1016/j.ijpharm.2021.120511 |
| [12] |
YIN F, FENG F, WANG L, et al. SREBP-1 inhibitor Betulin enhances the antitumor effect of Sorafenib on hepatocellular carcinoma via restricting cellular glycolytic activity[J]. Cell Death & Disease, 2019, 10(9): 672. |
| [13] |
姜悦垚. 乳铁蛋白修饰的石杉碱甲纳米乳构建及其经鼻脑靶向机制研究[D]. 长春: 吉林大学, 2020.
|
| [14] |
邹灵辉, 丁文雅, 黄秋艳, 等. 纳米乳在中药制剂领域的应用优势及其研究进展[J]. 中国实验方剂学杂志, 2021, 27(18): 217-226. |
| [15] |
范容晖, 阳志强, 李勃深, 等. 中药纳米技术靶向治疗脑部疾病研究进展[J]. 中国比较医学杂志, 2023, 33(6): 128-140. |
| [16] |
王立鑫, 李鑫, 蒙天琛, 等. 白桦脂醇纳米乳的制备及其在S180荷瘤小鼠体内分布研究[J]. 湖南中医药大学学报, 2024, 44(4): 587-591. |
| [17] |
陈光宇, 瞿昊宇, 谢梦洲, 等. 基于伪三元相图法探索湿疹纳米乳处方[J]. 中国药学杂志, 2023, 58(12): 1110-1116. |
| [18] |
黄益穗, 钟文嘉, 刘灼波. 伪三元相图联合星点设计—响应面法优选鸦胆子油微乳处方[J]. 中国药业, 2023, 32(12): 45-50. |
 2025, Vol. 42
2025, Vol. 42