文章信息
- 李琳琳, 郭晶, 朱朝军, 等.
- LI Linlin, GUO Jing, ZHU Zhaojun, et al.
- 化腐再生法调控创面自噬促进糖尿病皮肤溃疡愈合的作用机制研究
- The mechanism of putridity-resolving and regeneration therapy for promoting the healing of diabetes skin ulcers by regulating wound autophagy
- 天津中医药, 2025, 42(4): 496-503
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(4): 496-503
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.04.14
-
文章历史
- 收稿日期: 2024-11-01
2. 浙江中医药大学附属第一医院皮肤科, 杭州 310006
糖尿病皮肤溃疡是一种常见的糖尿病并发症,是由于糖尿病患者血糖控制不佳,导致神经、血管病变,进而引起皮肤损伤和溃疡,可能导致感染、坏疽甚至截肢等严重后果[1]。大约34%的糖尿病患者会发生下肢溃疡,尤其是糖尿病足溃疡[2]。糖尿病皮肤溃疡因其复杂的发病机制导致临床愈合时间延长甚至难以治愈,严重影响患者生活质量,因此深入研究皮肤创面的愈合机制对于促进创面愈合以及研发新的治疗药物具有重要意义。已有研究证实皮肤溃疡创面的细胞自噬能够参与创面炎症反应、细胞能量代谢、创面上皮再生、新生血管形成以及组织结构重塑等病理过程[3]。化腐再生法是天津中医药大学第二附属医院中医外科应用菠萝蛋白酶液化坏死的肌腱和筋膜以化腐配合传统的中药橡皮生肌膏以生新的治疗方法,该治法是针对糖尿病足肌腱坏死而提出的内治法、外治法结合,局部与整体兼顾的治疗方法,前期研究证实化腐再生法能够促使创面在特定时期产生微酸环境,刺激成纤维细胞增殖,毛细血管胚芽生长及再上皮化过程,参与筋之血化过程的早中期时抑制精氨酸酶-1(Arg-1)、CD206、C型相关性植物血凝素-1(Dectin-1)表达,在创面修复过程中有效调控Arg-1、CD206、Dectin-1表达,从而促进糖尿病足筋之血化从而加速糖尿病足溃疡创面愈合[4-6]。但化腐再生法是否能够通过调控糖尿病皮肤溃疡创面自噬以促进糖尿病皮肤溃疡创面愈合仍不明确,因此本研究通过动物实验以探索化腐再生法调控创面自噬促进糖尿病皮肤溃疡愈合的潜在机制,以期为化腐再生法治疗糖尿病皮肤溃疡的临床疗效提供分子学证据。
1 研究材料与方法 1.1 实验动物实验动物为SPF级雄性SD大鼠,6周龄,60只,体质量180~200 g,适应性喂养1周后开始造模。实验动物购买于:北京华阜康生物科技股份有限公司,实验动物质量合格证书编号:110322220101040632,实验动物使用许可证编号:SYXK(津):2019-0002。动物购入后在中国医学科学研究院放射医学研究所动物中心饲养,饲养于温度:20~25 ℃,湿度:50%~65%,12 h光照、12 h黑暗的环境中,饲料为全价营养颗粒料、经高压消毒灭菌的新鲜卫生饮水。本研究按照中华人民共和国科技部颁布的《关于善待动物的指导性意见》,在实验过程及动物处理遵循动物实验伦理要求,实验方案通过中国医学科学研究院放射医学研究所伦理审核(伦理编号:IRM-DWLL-2022127)。
1.2 实验试剂、仪器及耗材链脲佐菌素(STZ,美国Sigma公司,货号:S0130-1G);醋酸氢化可的松(上海通用药业股份有限公司,货号:H31021290);血糖试纸(鱼跃公司,货号:586);无菌脱脂棉纱布(曹县华鲁卫生材料有限公司,货号:7063771445);医用碘伏消毒剂(仁和医疗有限公司,货号:20211202);SDS-PAGE蛋白上样缓冲液(2×,武汉博士德生物工程有限公司,货号:AR0131)BCA蛋白测定试剂盒(兰杰柯科技有限公司,货号:Biosharp BL521A);PageRulerTM预染蛋白分子量标准品(10-180 kDa,美国Thermo Fisher Scientific公司,货号:Thermo 26616);Skim Milk脱脂奶粉(美国BD Difco公司,货号:232100);QuickBlockTM Western一抗、二抗稀释液(碧云天生物技术有限公司,货号:P0239);SDS-PAGE凝胶制备试剂盒(武汉博士德生物工程有限公司,货号:AR0138);SDS-PAGE快速电泳液(Tris-Gly Powder,南京金斯瑞生物科技有限公司,货号:P0562-1L);蛋白免疫印迹(Western blot)快速转膜液(Powder)(南京金斯瑞生物科技有限公司,货号:P0575-1L);1×TBST缓冲液(北京索莱宝科技有限公司,货号:232100);GAPDH Rabbit Polyclonal Antibody(武汉Proteintech公司,货号:10494-1-AP);Beclin1抗体(Affinity Biosciences,货号:AF5128);LC3抗体(Affinity Biosciences,货号:AF5402);P62抗体(Affinity Biosciences,货号:AF6478);RNApur Tissue&Cell Kit(北京康为世纪公司,货号:CW0584S);HiFiScript cDNA Synthesis Kit(北京康为世纪公司,货号:CW2569);2×μLtraSYBR Mixture(北京康为世纪公司,货号:CW2601S);2~8 ℃医用冷藏箱(中科美菱低温科技股份有限公司,型号:YC-968L);-80 ℃超低温冰箱(中科美菱低温科技股份有限公司,型号:DW-HL388);电泳仪(美国BIO-RAD公司);转印槽(美国BIO-RAD公司);灰度分析软件(美国UVP公司)。
1.3 药物制备及来源橡皮生肌膏(天津达仁堂京万红药业有限公司(生产批号:206624)。复方菠萝蛋白酶(汕头市橄榄制药有限公司,国药准字H44024825)。
1.4 糖尿病大鼠模型的制备SPF级雄性SD大鼠适应性喂养7 d,造模前禁食不禁水12 h。造模当日称质量,尾静脉采血并使用便携式血糖仪测定大鼠血糖情况并记录,连续2 d按照40 mg/kg腹腔注射1% STZ溶液制备糖尿病大鼠模型,注射72 h后测定随机血糖,当大鼠血糖≥16.7 mmol/L,并出现多饮、多食、多尿,体形消瘦,精神萎靡,毛色油腻无光泽等表现,则糖尿病大鼠模型制备成功。
1.5 糖尿病大鼠慢性创面模型的制备在糖尿病大鼠造模成功14 d后,进行糖尿病大鼠全层皮肤缺损开放性创面模型制备,并连续3 d肌肉注射醋酸氢化可的松(80 mg/kg)延缓创面愈合。造模前大鼠禁食不禁水12 h,于当日造模前称质量并记录,进行麻醉。将麻醉满意的大鼠背部朝上放置于固定板上,固定四肢,使用剃毛器将大鼠背部毛发剔除,面积约为4 cm×4 cm。沿大鼠背部脊柱正中线,两侧旁开1 cm分别做直径为2 cm的圆形标记,在无菌条件下使用外科手术方法切除标记处全层皮肤和皮下结缔组织,深至筋膜。用灭菌纱布止血,生理盐水冲洗,即成糖尿病大鼠全层皮肤缺损开放性创面模型,造模后的大鼠术后注意保温,自由饮水、摄食,最终各组大鼠成模率为89.3%~94.5%。
1.6 分组及换药模型制备成功后将大鼠分为4组,模型组(MX组),化腐组(HF组),再生组(ZS组),化腐再生组(HFZS组)。换药前,碘伏常规消毒创面。模型组应用凡士林油纱换药,化腐组应用菠萝蛋白酶纱布换药,再生组应用橡皮生肌膏外涂换药,化腐再生组应用橡皮生肌膏外涂联合菠萝蛋白酶纱布换药。每日换药1次。
1.7 观察创面愈合情况于造模成功换药治疗后第0、3、7、14天4个时点随机选取各组大鼠在固定焦距的情况下对创面拍照,同时以透明薄膜描印创面。采用NIH ImageJ图像分析软件测量创面面积,计算创面愈合率。公式:创面愈合率(%)=(初始创面面积-观察日创面面积)/初始创面面积×100%。
1.8 疮面肉芽组织标本的采集方法分别在创面换药治疗的第0、3、7、14天进行糖尿病大鼠慢性创面标本的采集,大鼠麻醉满意后,腹面朝下放在固定板上,固定四肢,切取包含整个疮面组织(创面外缘、疮面肉芽组织)且深于创面深度的立体长方块,一部分取材后立即固定于4%的福尔马林固定液中,另一部分将组织分成创面外缘和创面肉芽组织两部分,先储存于液氮中,随后保存在-80 ℃冰箱中,统一进行后续自噬相关蛋白表达情况。
1.9 组织形态观察留取创面组织后,磷酸盐缓冲液(PBS)冲洗,然后按照以下步骤进行苏木精-伊红(HE)染色:1)固定:取材后将肾组织置于4%多聚甲醛中固定2 d以上。2)脱水:采用梯度浓度乙醇依次浸泡,75%乙醇脱水1 h-80%乙醇脱水1 h-90%乙醇脱水1 h-95%乙醇脱水30 min-无水乙醇脱水30 min-无水乙醇再次脱水30 min。3)透明:二甲苯Ⅰ透明10 min,二甲苯Ⅱ透明10 min。4)浸蜡:软蜡Ⅰ 1 h-软蜡Ⅱ 1 h-硬蜡2 h。5)组织包埋:将浸好蜡的组织肾脏组织平放于模具底部,切面朝下,将熔蜡倒入模具中,并平放在冰冻台上,冷却凝固后取出。6)切片:切片厚度4 μmol/L,50℃恒温水浴锅中展平切片,后迅速贴于防脱片上,置于烘片机上烘烤1 h。7)脱蜡复水:二甲苯Ⅰ 10 min-二甲苯Ⅱ 10 min-无水乙醇5 min-无水乙醇5 min-95%乙醇5 min-85%乙醇5 min-70%乙醇5 min-纯水5 min。8)苏木精染色:苏木精染色5 min-蒸馏水冲洗2 min-1%盐酸乙醇分化10 s-蒸馏水冲洗2 min-0.6%氨水返蓝-蒸馏水冲洗2 min。9)伊红染色:伊红染色1 min。染色完成后,依次放入无水乙醇和二甲苯中脱水透化,并用中性树脂封片,光学显微镜下观察拍照观察各组创面肉芽组织生长以及炎性细胞浸润的差异。
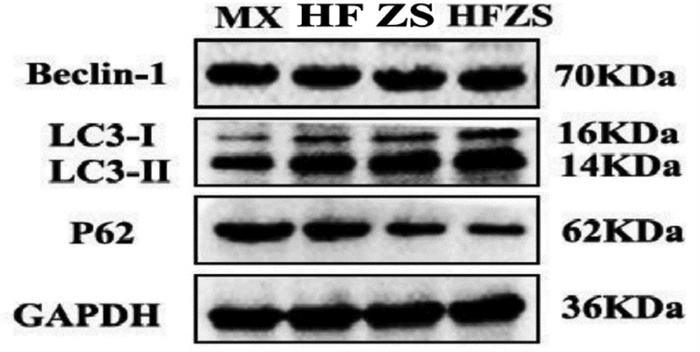
1.10 创面组织自噬相关蛋白检测选取各组治疗至第7天创面组织样本进行自噬相关蛋白Beclin-1、微管相关蛋白1轻链3 Ⅰ/Ⅱ(LC3-Ⅰ/Ⅱ)、泛素结合蛋白(P62)检测,实验步骤如下:取80~100 mg创面组织放置于冰上的灭菌铝箔纸上迅速剪碎,PBS反复冲洗,然后将组织充分研磨,用RIPA快速裂解液裂解组织,离心提取蛋白,随后进行蛋白变性,电泳仪电泳,转膜,转膜后加入Western blot快速封闭液,将盒置于摇床上匀速慢摇封闭20 min,随后一抗(1∶1 000)孵育,4 ℃冰箱冷藏过夜,二抗(1∶5 000)孵育,回收二抗后,用1×TBST漂洗3次,每次10 min;检测:依此将各组PVDF膜泡入特超敏ECL发光液中1 min左右,之后放入电子成相机器中进行蛋白条带显影成像,保存图像数据;分析灰度值:用ImageJ软件分析蛋白条带灰度值。
1.11 创面组织自噬相关蛋白mRNA检测选取各组治疗至第7天创面组织样本用逆转录-聚合酶链反应(RT-PCR)方法检测创面组织自噬相关蛋白mRNA表达,具体方法如下:根据RNA提取试剂盒说明书配制Buffer RL提取组织RNA并检测浓度,采用逆转录试剂盒将RNA反转录为cDNA,配置反应体系后加入PCR仪进行扩增,采用2-ΔΔCt法计算目的基因的相对表达量。以GAPDH为内参基因得出各组目的基因的mRNA相对表达水平。计算方法:ΔΔCt=ΔCt实验组(目的基因Ct值-内参基因Ct值)-ΔCt对照组(目的基因Ct值-内参基因Ct值)。引物由上海生工生物工程公司设计合成,引物序列见表 1。
所有数据采用采用SPSS 20.0软件数据包进行统计,计量资料以均数±标准差(x±s)表示,组间比较采用One-way ANOVA检验方法,以P<0.05为差异有统计学意义。
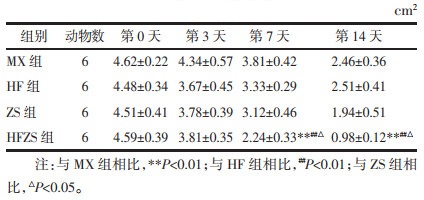
2 研究结果 2.1 各组皮肤溃疡创面愈合情况及愈合率各组在治疗过程中的创面图片见图 1。造模成功后各组创面均出现溃烂,可见肌层组织,创面上覆盖脓性分泌物,肉芽组织水肿,颜色晦暗。随着治疗时间的延长,MX组在第3天变化不大,其他3组分泌物较前稍减少,肉芽组织仍轻度水肿,在第7天时,MX组创面颜色逐渐转红,创面周边可见分泌物,其余3组创面干燥,基底部可见较多新鲜肉芽组织,无明显分泌物,周边可见上皮化。至第14天时,MX组可见少量分泌物,基底部可见肉芽组织增生,其他3组创面新鲜,肉芽组织红润,周边可见上皮化皮缘,创面面积缩小,化腐再生组最为明显。在治疗前各组创面面积相比差异无统计学意义,在治疗第3天时,HF组、ZS组创面面积小于MX组,创面愈合率高于MX组,但差异无统计学意义,在治疗第7天和第14天时,HFZS组的创面面积明显小于其他3组,差异有统计学意义(P<0.01或P<0.05),创面愈合率高于其他3组,差异有统计学意义(P<0.01或P<0.05)。见表 2,表 3。
|
| 注:MX组,模型组;HF组,化腐组;ZS组,再生组;HFZS组,化腐再生组。D0,治疗第0天;D3,治疗第3天;D7,治疗第7天;D14,治疗第14天。 图 1 治疗过程中各组大鼠创面图片 Fig. 1 Wound photos of rats in each group during treatment |
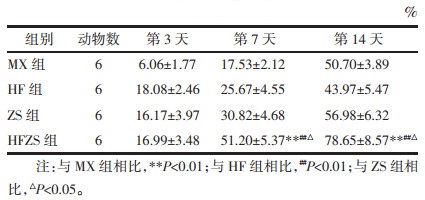
各组大鼠在治疗过程中分别取第0、3、7,14天组织做HE染色,观察各组创面组织病理变化,结果见图 2。在治疗前可以看到各组创面均出现水肿,伴较多炎性细胞浸润,如中性粒细胞,单核细胞等。随着药物的治疗,在治疗后第3天和第7天,各组创面组织炎性细胞浸润逐渐减少,水肿逐渐消退,其中HFZS组效果最好,到第14天,模型组仍有较多炎性细胞浸润,伴轻度肉芽水肿,HF组和ZS组浸润炎性细胞少于MX组,而HFZS组炎性细胞明显少于其他3组,肉芽基本无水肿,并可见较多成纤维细胞和胶原组织沉积。
|
| 注:MX组:模型组;HF组:化腐组,ZS组:再生组;HFZS组:化腐再生组。D0:治疗第0天;D3:治疗第3天;D7:治疗第7天;D14:治疗第14天,n=3。 图 2 各组创面组织HE染色结果(×40) Fig. 2 HE staining results of wound tissue in each group(×40) |
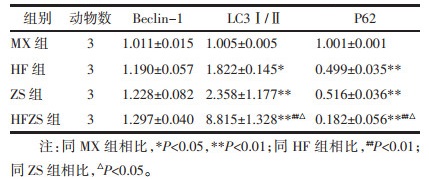
治疗至第7天时,检测各组创面组织自噬相关蛋白,结果发现,与MX组相比,HF组Beclin-1差异无统计学意义(P>0.01);LC3Ⅰ/Ⅱ升高,P62蛋白降低,差异有统计学意义(P<0.01或0.05);与HF组相比,HSZS组LC3Ⅰ/Ⅱ升高,P62蛋白降低,差异有统计学意义(P<0.01);与ZS组相比,HSZS组LC3Ⅰ/Ⅱ升高,P62蛋白降低,差异有统计学意义(P<0.05)。见图 3和图 4。
|
| 注:MX,模型组;HF,化腐组;ZS,再生组;HFZS:化腐再生组。 图 3 各组自噬相关蛋白Western blot条带图 Fig. 3 Western blot bands of autophagy-associated proteins in each group |

|
| 注:MX,模型组;HF,化腐组;ZS,再生组;HFZS,化腐再生组。同MX相比,*P<0.01,**P<0.05;同HF组相比,##P<0.01;同ZS组相比,&P<0.05。 图 4 各组自噬相关蛋白定量比较 Fig. 4 Comparison of autophagy-related proteins in each group |
治疗至第7天时,检测各组创面组织自噬相关蛋白PCR相对定量,结果发现,与MX组相比,HF组Beclin-1 mRNA统计结果差异无统计学意义(P>0.05);LC3Ⅰ/Ⅱ mRNA升高,P62 mRNA降低,差异有统计学意义(P<0.01或0.05);与HF组相比,HSZS组LC3Ⅰ/Ⅱ mRNA升高,P62mRNA降低,差异有统计学意义(P<0.01);与ZS组相比,HSZS组LC3Ⅰ/Ⅱ mRNA升高,P62 mRNA降低,差异有统计学意义(P<0.05)。见表 4。
|
糖尿病皮肤溃疡是糖尿病的严重并发症之一,据统计糖尿病患者一生中发生足部溃疡的风险达25%,其中有14%~24%的足溃疡患者需要截肢。在许多国家糖尿病足是截肢的首位原因,全球每20 s就有一个人因糖尿病足截肢。糖尿病皮肤溃疡的发病机制复杂,但缺血、神经病变和感染是导致组织坏死和溃疡形成的3个主要因素[7]。皮肤创面愈合是由多细胞、多细胞因子、多机制参与的连续动态复杂过程,深入研究皮肤创面的愈合机制对于促进创面愈合以及研发新的治疗药物具有重要意义。
细胞自噬作为维持细胞稳态、实现细胞更新再生的重要生理过程,其具有清除细胞质内受损或衰老细胞器、有害分泌蛋白的作用。已有研究证实皮肤溃疡创面的细胞自噬能够参与创面炎症反应、细胞能量代谢、创面上皮再生、新生血管形成以及组织结构重塑等病理过程[8-9]。中医药治疗皮肤创面历史悠久,经验丰富,并且在临床上取得了较好的临床疗效,特别是在一些慢性难愈性皮肤创面的治疗方面具有独特的优势。近年来在临床疗效的基础上,众多学者对于中医药治疗皮肤创面的作用机制展开了一系列研究[10-13]。其中,自噬也逐渐成为研究者的切入点,化腐再生法是针对糖尿病足肌腱坏死而提出的内治法与外治法结合,局部与整体兼顾的治疗方法。它可以使药物直接作用于创面,采用化腐结合蚕食清创,使腐败组织加速液化清除,减少毒邪旁窜、侵骨及内陷的发生,加速伤口的愈合。本科运用外用菠萝蛋白酶液化坏死的肌腱和筋膜以化腐与传统的中药橡皮生肌膏以生新的化腐再生法,能靶向性祛除坏死的肌腱,实现组织的原位修复,在治疗糖尿病皮肤溃疡疗效方面疗效显著[14-15],但其促进糖尿病皮肤溃疡创面愈合的作用机制仍不甚明确。
本研究主要依据化腐再生法治疗糖尿病皮肤溃疡的临床疗效,进一步探索其治疗糖尿病足溃疡愈合的分子机制。首先本研究在大鼠后背建立糖尿病大鼠皮肤溃疡模型,通过将大鼠随机分为MX组、HF组、ZS组、HFZS组,观察治疗过程中观察创面颜色、肉芽组织生长情况,并通过Western blot及RT-PCR方法检测创面自噬相关蛋白的表达,以阐述化腐再生法是否是通过调控糖尿病皮肤溃疡创面自噬而促进创面愈合的。研究结果表明化腐再生组大鼠创面面积和创面愈合率明显优于其他3组,提示化腐再生法具有明显的促进糖尿病皮肤溃疡愈合效果,并且效果优于单独化腐法和再生法。病理切片显示随着治疗时间的延长,化腐再生组炎性细胞浸润明显减少,促进创面上皮修复,加速糖尿病皮肤溃疡愈合。化腐再生法是本科在继承中国著名疮疡病学家李竞教授之“腐去肌生”学术思想,局部整体相参,提出的促进筋之血化的独特治疗方法,是针对糖尿病足肌腱坏死而提出的内治法、外治法结合,局部与整体兼顾的治疗方法,它可以使药物直接作用于创面,采用化腐结合蚕食清创,使腐败组织加速液化清除,减少毒邪旁窜、侵骨及内陷的发生,加速伤口的愈合[16-18]。
创面愈合是涉及一系列复杂生物学行为的动态过程,分为4个伴随和重叠的阶段:炎症、血管再生、再上皮化与胶原蛋白沉积[19]。既往研究[20-21]表明,多种细胞及细胞因子在创面愈合中起着重要作用,目前已有研究证实自噬参与调控间充质干细胞(MSCs)治疗创面修复相关[22]。但事实上,自噬除了参与调控MSCs功能之外,也在调控创面愈合各个阶段相关细胞的功能中发挥重要作用。目前普遍认为自噬主要以3种形式存在:伴侣介导的自噬、微自噬和巨自噬,其主要区别在于它们的生理功能和向溶酶体的传递方式不同[23],其中巨自噬是自噬中研究最广泛的形式。Beclin-1是第1个[24]被发现的在哺乳动物细胞内参与自噬的特异基因,与酵母自噬基因Atg6同源,是自噬发生的始动因子[25],能介导其他自噬蛋白定位于前自噬小体的关键因子LC3-Ⅰ和LC3-Ⅱ。LC3蛋白在合成后其C端即被Atg4蛋白酶切割变成LC3-Ⅰ,分布于细胞浆内。当自噬体形成后,LC3-Ⅰ和磷脂酰乙醇胺(PE)偶联形成LC3-Ⅱ并定位于自噬体内膜和外膜,并稳定地保留在自噬体膜上直到与溶酶体融合。因此,LC3-Ⅱ被用来作为自噬体的标记,其表达水平在某种程度上反映了自噬体的数量。基于上述自噬调控通路,本研究进一步检测创面组织自噬相关蛋白结果显示,3组Beclin-1蛋白及mRNA在统计结果比较,差异无统计学意义,而化腐再生组LC3Ⅰ/Ⅱ升高,P62蛋白及mRNA降低,差异有统计学意义,提示化腐再生法能够调控自噬通路,但是其并未改变Beclin-1蛋白的变化,提示其可能是通过干预其他自噬蛋白如ULK1蛋白而发挥其调控作用,今后可以进一步继续深入研究探索其干预靶点。
总之本研究结果发现化腐再生法能够促进糖尿病大鼠皮肤溃疡愈合,减轻皮肤溃疡创面组织炎症反应,促进新鲜肉芽组织再生和创面上皮化,其作用机制可能与其促进创面自噬通路激活有关,但是其具体促进的自噬通路始动因子仍不明确,今后将在现有基础上继续开展深入研究。
| [1] |
LAITEERAPONG N, HAM S A, GAO Y, et al. The legacy effect in type 2 diabetes: Impact of early glycemic control on future complications(diabetes & aging study)[J]. Diabetes Care, 2019, 42(3): 416-426. DOI:10.2337/dc17-1144 |
| [2] |
WONG AYW, ONG BSY, LEE ARYB, et al. Topical biological agents as adjuncts to improve wound healing in chronic diabetic wounds: A systematic review of clinical evidence and future directions[J]. Cureus, 2022, 14(7): e27180. |
| [3] |
高海霞, 刘宏伟. 自噬在糖尿病血管损害发病中的作用及与创面难愈关联性的研究[J]. 感染、炎症、修复, 2016, 17(4): 243-247. DOI:10.3969/j.issn.1672-8521.2016.04.015 |
| [4] |
孙旭, 孙瀚驰, 徐强, 等. 基于筋之血化现象探讨化腐再生法对糖尿病大鼠溃疡Arg-1、CD206、DECTIN-1表达的影响[J]. 时珍国医国药, 2020, 31(12): 2861-2865. DOI:10.3969/j.issn.1008-0805.2020.12.012 |
| [5] |
徐强, 张朝晖, 马静, 等. 筋之血化与化腐再生法治疗糖尿病足初探[J]. 南京中医药大学学报, 2014, 30(1): 8-10. |
| [6] |
徐强, 张朝晖, 朱朝军. 基于筋之血化现象分段探索糖尿病足肌腱坏死创面修复的要点[J]. 天津中医药大学学报, 2014, 33(4): 193-195. DOI:10.11656/j.issn.1673-9043.2014.03.01 |
| [7] |
中华医学会糖尿病学分会糖尿病足与周围血管病学组. 中国糖尿病足诊治临床路径(2023版)[J]. 中华内分泌代谢杂志, 2023, 39(2): 93-102. |
| [8] |
LINGFEI L, JUNHUI Z, QIONG Z, et al. High glucose suppresses keratinocyte migration through the inhibition of the p38 MAPK/Autophagy pathway[J]. 2019, 10: 24.
|
| [9] |
JIN H, ZHANG Z, WANG C, et al. Melatonin protects endothelial progenitor cells against AGE-induced apoptosis via autophagy flux stimulation and promotes wound healing in diabetic mice[J]. Experimental & Molecular Medicine, 2018, 50(11): 1-15. DOI:10.1038/s12276-018-0177-z |
| [10] |
麻华胆, 郑爱甜, 刘贤彬, 等. MEBT/MEBO对糖尿病大鼠创面组织中ULK1表达的影响[J]. 中国烧伤创疡杂志, 2020, 32(1): 1-11. DOI:10.3969/j.issn.1001-0726.2020.01.001 |
| [11] |
胡啸明, 黄仁燕, 韩强, 等. 紫朱软膏对急性创面愈合过程中自噬蛋白LC3和Becin1的影响[J]. 海南医学院学报, 2020, 26(4): 251-256, 261. |
| [12] |
廖明娟, 蒉纲, 王永灵, 等. 长皮膏治疗下肢静脉性溃疡的疗效观察及对LC3-Ⅱ和Beclin-1的影响[J]. 组织工程与重建外科杂志, 2019, 15(4): 252-255. |
| [13] |
李金凤, 王永萍. 油桐花水提取物干预烧伤大鼠Bcl-2、Bax表达的研究[J]. 中国民族民间医药, 2018, 27(14): 14-18. |
| [14] |
张朝晖, 徐强, 马静, 等. 化腐再生法治疗糖尿病肌腱坏死模型大鼠的实验研究[J]. 时珍国医国药, 2011, 22(11): 2787-2790. |
| [15] |
张朝晖, 徐强, 马静, 等. 化腐再生法促进糖尿病创面愈合的初步机制[J]. 中国中医基础医学杂志, 2012, 18(4): 378-379, 391. |
| [16] |
朱朝军, 张朝晖, 马静, 等. 生肌象皮膏治疗慢性难愈性溃疡临床疗效及初步机制[J]. 中国中医药信息杂志, 2013, 20(11): 11-12, 27. |
| [17] |
卢旭亚, 李品川, 张朝晖. 止痛生肌散联合生肌象皮膏对小腿静脉痛性溃疡治疗前后伤口渗出物中NGF、SP及S100A8/A9的影响[J]. 中华中医药杂志, 2019, 34(9): 4423-4425. |
| [18] |
卢旭亚, 李品川, 张朝晖. 止痛生肌散联合生肌象皮膏治疗慢性小腿疼痛性皮肤溃疡12例临床观察[J]. 中国皮肤性病学杂志, 2015, 29(4): 407-409. |
| [19] |
PULLAR J M, CARR A C, VISSERS M C M, et al. The roles of vitamin C in skin health[J]. Nutrients, 2017, 9(8): 866. |
| [20] |
王宏宇, 刘玲英, 巴特. 间充质干细胞源性外泌体在创面修复中的研究进展[J/OL]. 中华损伤与修复杂志(电子版), 2020, 15(1): 67-69.
|
| [21] |
佟长贵, 赵文志, 楚同彬, 等. 同种异体骨髓间充质干细胞局部多点注射联合特有中药膏剂外敷治疗糖尿病溃疡创面实验研究[J]. 中华中医药学刊, 2014, 32(3): 477-479. |
| [22] |
米向斌, 赖宽, 魏姗姗. 间充质干细胞调控细胞自噬机制的研究进展[J]. 实用医学杂志, 2019, 35(15): 2495-2498. |
| [23] |
LEVINE B, KROEMER G. Autophagy in the pathogenesis of the disease[J]. Cell, 2008, 132(1): 27-42. |
| [24] |
黄河清, 周祥, 陈建昌, 等. 吸烟对大鼠心肌组织自噬相关基因及蛋白表达的影响[J]. 临床心血管病杂志, 2013, 29(9): 702-704. |
| [25] |
KANG R, ZEH H J, LOTZE M T, et al. The Beclin 1 network regulates autophagy and apoptosis[J]. Cell Death and Differentiation, 2011, 18(4): 571-580. |
2. Department of Dermatology, The First Affiliated Hospital of Zhejiang University of Traditional Chinese Medicine, Hangzhou 310006, China
 2025, Vol. 42
2025, Vol. 42