文章信息
- 肖宁, 段欢欢, 王云.
- XIAO Ning, DUAN Huanhuan, WANG Yun.
- 黄连解毒汤治疗金黄色葡萄球菌肺炎的机制研究
- Mechanism study of Huanglian Jiedu Decoction in the treatment of Staphylococcus aureus pneumonia
- 天津中医药, 2025, 42(4): 511-518
- Tianjin Journal of Traditional Chinese Medicine, 2025, 42(4): 511-518
- http://dx.doi.org/10.11656/j.issn.1672-1519.2025.04.16
-
文章历史
- 收稿日期: 2024-10-25
金黄色葡萄球菌肺炎是革兰氏阳性医院获得性肺炎和呼吸机相关性肺炎的最常见原因[1]。虽然抗生素用于治疗金黄色葡萄球菌感染,但耐甲氧西林金黄色葡萄球菌等耐抗生素物种的出现导致肺炎的广泛复发,对公共卫生构成了严峻的挑战[2]。因此,迫切需要新的有效药物来对抗耐药细菌。中医药在预防和改善肺炎的临床症状和严重程度方面具有重要意义,可多靶点作用,对病机复杂的肺炎具有综合优势[3]。现代药理学研究发现,中药可以通过调节细胞因子的产生和免疫细胞的活性来调节免疫反应,从而起到治疗作用[4]。
黄连解毒汤是晋代著名医学家葛洪所创,源于《肘后备急方》,由黄连、黄芩、黄柏、栀子组成,具有清热解毒的功效,主治各种热毒及三焦热证,目前临床上主要用于炎症性疾病的治疗[5],但对于黄连解毒汤治疗金黄色葡萄球菌所致肺部感染的作用机制研究较少。分子对接是一种基于计算机模拟结构的成熟方法,它有助于预测分子与生物靶点之间的相互作用[6]。通过分子对接,可以验证活性化合物与关键靶点的结合能力,提高靶点网络的准确性。
1 资料与方法 1.1 网络药理学及分子对接探讨黄连解毒汤的作用机制 1.1.1 黄连解毒汤有效化学成分的收集与筛选通过中国天然产物化学成分库(http://pharmdata.ncmi.cn/cnpc/)以及SymMap(http://symmap.org//),以类药性≥10%和口服利用度≥30%为标准,筛选出黄连、黄芩、黄柏、栀子的靶点,并与Uniprot数据库进行匹配。
1.1.2 金黄色葡萄球菌肺炎靶基因的获取在Gene Cards数据库(https://www.genecards.org/)中,以“金黄色葡萄球菌肺炎”为关键词对金黄色葡萄球菌肺炎靶基因进行检索,筛选得分≥1.0相关性高的基因靶点。
1.1.3 黄连解毒汤和金黄色葡萄球菌肺炎共同靶点网络绘制应用R4.0.2软件对黄连解毒汤和金黄色葡萄球菌肺炎的相同靶点进行整合,并结合上述关键靶点,依托Cytoscape3.7.0软件构建黄连解毒汤和金黄色葡萄球菌肺炎共同靶点网络信息图。
1.1.4 京都基因与基因组百科全书(KEGG)信号通路将STRING处理后的常见靶点导入metscape数据库进行KEGG分析,选取P值最小的前10个KEGG路径导入生物信息学制图网站(http://www.bioinformatics.com.cn/),绘制气泡图和信号通路图。
1.1.5 黄连解毒汤和金黄色葡萄球菌肺炎共同靶点蛋白质-蛋白质相互作用(PPI)网络的构建利用STING(http://sting-db.org/)数据平台建立PPI网络图,将黄连解毒汤和金黄色葡萄球菌肺炎共有的关键靶点导入,将最小交互作用要求得分设置为最高置信度(0.900),应用cytospace3.7绘制共同靶点PPI网络图。
1.1.6 黄连解毒汤和金黄色葡萄球菌肺炎共同靶点分子对接验证从RCSB PDB(https://www.rcsb.org/)数据库中下载目标体三维结构的PDB格式文件,从TCMSP数据库中下载核心活性部件的mol2格式的三维结构文件,利用PyMoL 2.3.0和AutoDock Vina18对主要活性成分和核心靶蛋白进行分子对接,并计算主要成分与核心靶蛋白对接的结合能,结合能越低可以认为结合效果越好。
1.2 实验验证 1.2.1 药物黄连解毒汤由邯郸市中心医院中药房制备,黄连10 g,黄芩10 g,黄柏10 g,栀子10 g组成,万古霉素(浙江医药股份有限公司,国药准字H20033366),金黄色葡萄球菌标准菌株ATCC25923购自广东环凯微生物科技有限公司。
1.2.2 动物选取90只SPF级SD大鼠,雄性,3个月月龄,体质量(180±20)g,由河北省实验动物中心提供。本研究通过邯郸市中心医院伦理委员会审查(编号为:2024090948)。常规适应性饲养1周后开始实验。
1.2.3 动物分组及模型制备将SPF级SD大鼠按随机数字表法分为正常组、模型组、万古霉素组、黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组,每组15只。除正常组外,其余各组参考文献[7]方法制备金黄色葡萄球菌肺炎的大鼠模型。异氟烷气体麻醉大鼠,将麻醉后的大鼠仰卧固定于操作台上,除正常组外均使用移液枪吸取金黄色葡萄球菌菌液50 μL(含有5×108 CFU),从口腔滴入咽后壁,捏住鼻孔,维持大鼠头向下倾斜的姿势30 s,使液体全部吸入鼻腔,每日1次,连续3 d,以大鼠出现呼吸急促、活动量减少及肺组织病理改变提示造模成功。
1.2.4 给药模型组、万古霉素组和黄连解毒汤组造模结束后,参照《药理实验方法学》(第4版)[8],按人-大鼠体表面积折算系数进行给药剂量换算,正常组和模型组大鼠予0.9%氯化钠注射液,每次2 mL,每日1次灌胃;万古霉素组予0.2 g/mL浓度的万古霉素溶液,每次2 mL,每日1次灌胃;黄连解毒汤低、中、高剂量组分别予0.5、1.0、2.0 g/mL黄连解毒汤浓缩液,每次2 mL,每日1次灌胃;所有大鼠均连续灌胃治疗4 d。
1.2.5 标本收集给药结束后,大鼠禁食不禁水24 h,腹腔注射3%戊巴比妥钠麻醉,腹主动脉取血,静置2 h后,以3 500 r/min离心(离心半径13 cm)10 min,取上清液置于-80 ℃冰箱保存,随后取部分肺组织置于-80 ℃冰箱备用。
1.2.6 肺组织菌落计数将肺组织放入无菌研磨器,加入1 mL冷生理盐水匀浆,加入生理盐水稀释至106倍,吸取0.1 mL均匀平涂于平板上,37 ℃恒温培养24 h,对平板上的细菌计数。
1.2.7 炎症因子相关指标检测药物治疗后,取2 mL腹主动脉血,以3 500 r/min离心(离心半径13 cm)10 min,采用ELISA测定白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)的水平。
1.2.8 蛋白免疫印迹法(Western blot)检测取约10 mg肺组织,加入组织裂解液,匀浆后以12 000 r/min离心(离心半径13 cm)10 min,取上清液,采用BCA法测定蛋白浓度,蛋白变性,上样,行SDS-PAGE电泳,转膜,5%脱脂牛奶封闭1 h,加入雌激素受体1(ESR1)、糖原合成酶激酶3β(GSK3B)、大鼠β连接素(CTNNB)、低聚果糖(FOS)、Jun原癌基因(JUN)和过氧化物酶体增生激活受体γ(PPARG)抗体(1∶1 000)4 ℃孵育过夜,次日加入二抗(1∶2 000)室温孵育1 h,ECL显影,曝光。使用Image J软件分析蛋白条目灰度值。
1.2.9 统计学方法采用R4.0.2软件及SPSS 22.0软件进行数据分析。计量资料先予以正态性检验,符合正态分布的资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
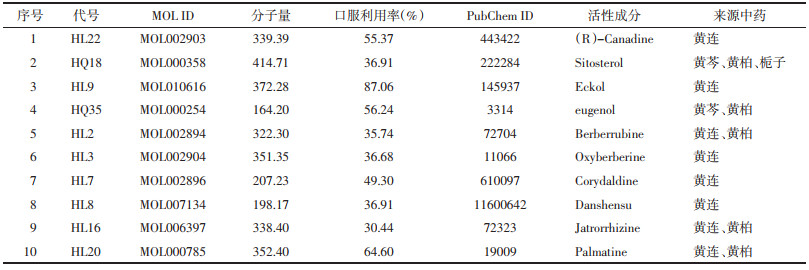
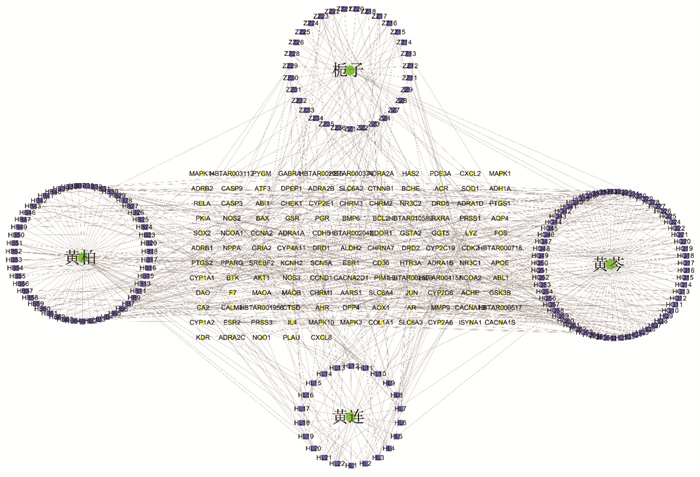
2 结果 2.1 黄连解毒汤活性成分及其靶点通过SymMap数据库获得活性成分167个,其中,黄连22个,黄芩66个,黄柏65个,栀子36个。获得活性成分作用靶点125个。应用R4.0.2软件构建“中药-活性成分-靶点”网络。见表 1、图 1。
|
|
| 图 1 黄连解毒汤药物-有效成分-靶点网络 Fig. 1 Drug-active ingredient-target network of Huanglian Jiedu Decoction |
通过数据库检索,共收集到1 668个金黄色葡萄球菌肺炎相关靶点。将黄连解毒汤有效成分靶点和金黄色葡萄球菌肺炎相关基因进行匹配后得到50个靶点基因。
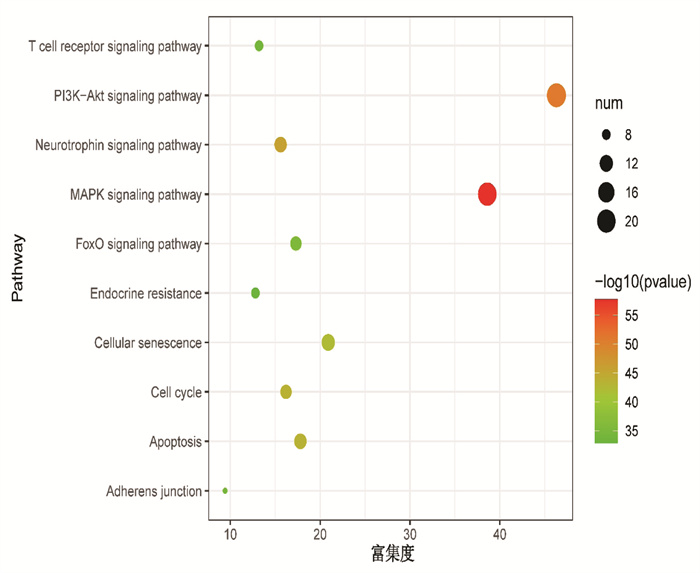
2.3 黄连解毒汤有效成分治疗金黄色葡萄球菌肺炎核心靶点的KEGG信号通路KEGG富集得到10条通路,主要包括T细胞受体信号通路、PI3K-Akt信号通路、神经营养因子信号通路、MAPK信号通路、FoxO信号通路、内分泌的阻力、细胞衰老、细胞周期、细胞凋亡、粘合连接等。见图 2。
|
| 图 2 黄连解毒汤主要成分治疗金黄色葡萄球菌肺炎核心靶点的KEGG分析气泡图 Fig. 2 KEGG bubble diagram of the core target of the treatment of Staphylococcus aureus pneumonia by the main components of Huanglian Jiedu Decoction |
使用Cytoscape3.7软件对PPI网络进行拓扑分析,ESR1、GSK3B、CTNNB、FOS、JUN和PPARG等6个核心靶点。见图 3。
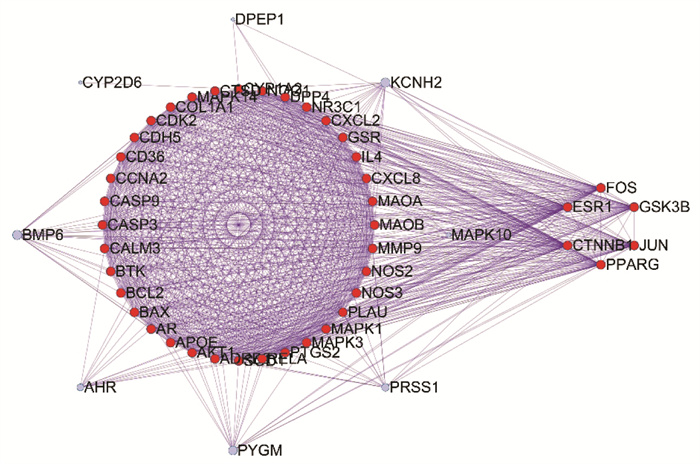
|
| 图 3 黄连解毒汤治疗金黄色葡萄球菌肺炎核心靶点PPI网络 Fig. 3 PPI network of the core target of Staphylococcus aureus pneumonia treated by Huanglian Jiedu Decoction |
选取黄连解毒汤活性成分(R)-氢化小檗碱、谷甾醇、丁香酚、药根碱、巴马汀及靶点ESR1、GSK3B、CTNNB、FOS、JUN、PPARG进行分子对接,对接总分表明成分靶点结合的稳定性较好,碰撞参数均小于0 kcal/moL,表明小分子配体与蛋白结合的构象稳定。见表 2、图 4。
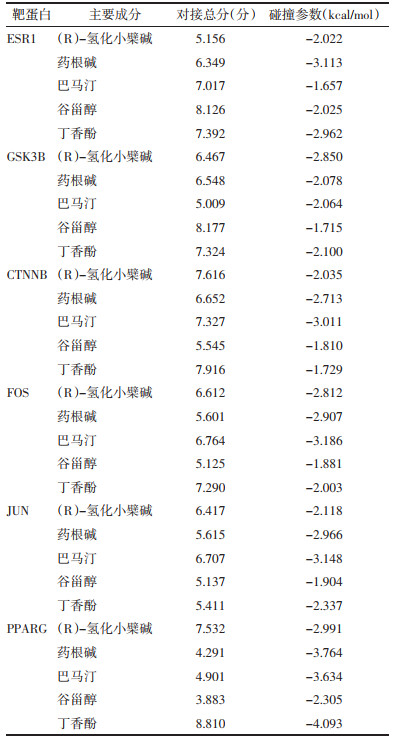
|

|
| 图 4 分子对接结果 Fig. 4 Molecular docking results |
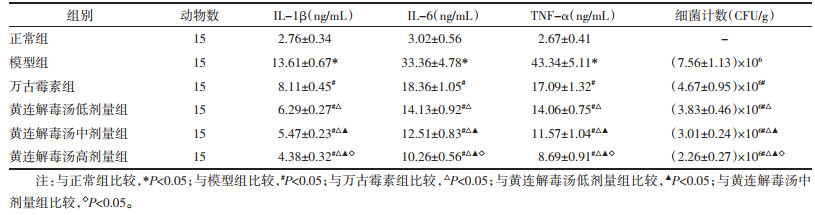
与正常组比较,模型组大鼠IL-1β、IL-6、TNF-α水平升高(P<0.05)。与模型组比较,万古霉素组、黄连解毒汤低、中、高剂量组大鼠肺组织细菌计数和IL-1β、IL-6、TNF-α水平降低(P<0.05);与万古霉素组比较,黄连解毒汤低、中、高剂量组大鼠肺组织细菌计数和IL-1β、IL-6、TNF-α水平降低(P<0.05),与黄连解毒汤低剂量组比较,黄连解毒汤中、高剂量组大鼠肺组织细菌计数和IL-1β、IL-6、TNF-α水平降低(P<0.05),与黄连解毒汤中剂量组比较,黄连解毒汤高剂量组大鼠肺组织细菌计数和IL-1β、IL-6、TNF-α水平降低(P<0.05)。见图 5、表 3。

|
| 图 5 各组大鼠肺组织细菌计数 Fig. 5 Comparison of bacterial count in lung tissues of rats in each group |
与正常组比较,模型组大鼠ESR1、GSK3B、PPARG降低(P<0.05),CTNNB、FOS、JUN升高(P<0.05)。与模型组比较,万古霉素组、黄连解毒汤低、中、高剂量组大鼠ESR1、GSK3B、PPARG升高(P<0.05),CTNNB、FOS、JUN降低(P<0.05)。与万古霉素组比较,黄连解毒汤低、中、高剂量组大鼠ESR1、GSK3B、PPARG升高(P<0.05),CTNNB、FOS、JUN降低(P<0.05)。与黄连解毒汤低剂量组比较,黄连解毒汤中、高剂量组大鼠ESR1、GSK3B、PPARG升高(P<0.05),CTNNB、FOS、JUN降低(P<0.05)。与黄连解毒汤中剂量组比较,黄连解毒汤高剂量组大鼠ESR1、GSK3B、PPARG升高(P<0.05),CTNNB、FOS、JUN降低(P<0.05)。见图 6、表 4。

|
| 图 6 各组大鼠肺组织ESR1、GSK3B、CTNNB、FOS、JUN、PPARG蛋白免疫印迹图 Fig. 6 Western blot of ESR1, GSK3B, CTNNB, FOS, JUN, and PPARG in lung tissue of rats in each group |
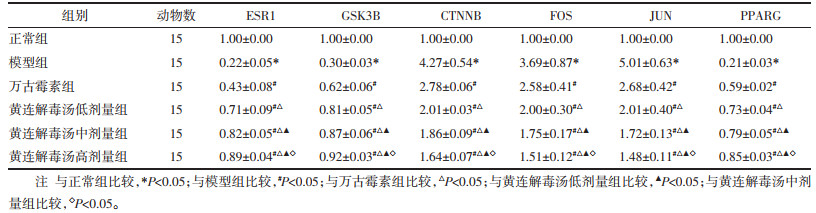
|
金黄色葡萄球菌是导致医院和社区获得性肺炎的主要细菌。近年来,从感染性肺炎患者中分离出抗药性金黄色葡萄珠菌(MRSA)的比例逐渐增加,发病率和病死率都很高[9]。目前临床治疗较为局限,多为单靶点的抗感染治疗,治疗效率较低[10]。因此,迫切需要开发新型抗生素来控制MRSA感染,但新抗生素的开发是困难的、缓慢的,而且远远落后于耐药菌株的开发。故须确定多途径的替代治疗策略来对抗不断进化的细菌。本研究通过构建金黄色葡萄球菌肺炎大鼠模型,观察黄连解毒汤对金黄色葡萄球菌肺炎的影响。实验结果表明,黄连解毒汤可通过调节ESR1、GSK3B、CTNNB、FOS、JUN和PPARG蛋白表达,抑制炎症因子释放,从而起到治疗作用。
分子对接分析表明黄连解毒汤的有效成分主要作用于ESR1、GSK3B、CTNNB、FOS、JUN和PPARG多个核心靶点。最新研究[11]发现ESR1/NLRP3/Caspase-1信号通路可激活中性粒细胞和T细胞释放IL-1β、IL-6等多种炎症介质,导致局部出现炎症反应,最终加重金黄色葡萄球菌肺炎。Zhang等[12]发现谷甾醇可通过调节肺组织内ESR1/NLRP3/Caspase-1的信号通路,抑制了肺组织内炎症因子的释放,减轻炎症反应。与此同时,相关的实验研究发现,丁香酚[13]、巴马汀[14]均通过调节ESR1/NLRP3/Caspase-1/GSDMD的信号通路,上调了肺细胞的增殖能力,抑制了肺细胞的凋亡。另外,先前的研究[15]发现,GSK3B/Nrf2/HO-1信号通路在金黄色葡萄球菌肺炎诱导的肺组织炎症和凋亡中具有重要作用。与此同时,相关研究[16]发现GSK3B可通过激活Nrf2/ARE通路,促进HO-1等蛋白表达,减少自由基和脂质过氧化的产生,进而抑制氧化应激和炎症反应,从而起到保护肺组织的作用。Cao等[17]发现谷甾醇可调节组织内GSK3B蛋白的表达,抑制肺组织的炎症反应,从而延缓疾病进程。除此之外,有学者研究发现,丁香酚[18]、R-氢化小檗碱[19]均可通过调节GSK3B/Nrf2轴,增强抗氧化靶基因的转录,从而保护肺组织免受氧化损伤。此外,既往的研究表明,CTNNB[20]、FOS[21]、JUN[21]、PPARG[22]在肺炎中的重要作用,洪玉书等研究[23]表明谷甾醇可作用于CTNNB介导的β-catenin/Wnt信号通路,阻断了上皮细胞效应,延缓了金黄色葡萄球菌肺炎患者肺组织损害的进程。钟思凡等[24]证明丹参素可作用于JNK转录因子,可以调节AP-1基因的表达,减轻金黄色葡萄球菌诱导的炎症反应。Wu等[25]发现药根碱可激活PPARG会导致特定DNA元件的结合和转录级联的诱导,减轻内皮细胞的氧化损伤,从而改善患者的症状。由上述研究可知,ESR1、GSK3B、CTNNB、FOS、JUN和PPARG可能是黄连解毒汤治疗金黄色葡萄球菌肺炎的关键靶点。
为了验证网络药理学结果,动物实验发现金黄色葡萄球菌肺炎大鼠肺组织菌落计数、IL-1β、IL-6、TNF-α、CTNNB、FOS、JUN较正常组升高,ESR1、GSK3B、PPARG蛋白表达降低,经黄连解毒汤治疗后,大鼠肺组织中ESR1、GSK3B、PPARG蛋白表达升高,肺组织菌落计数、IL-1β、IL-6、TNF-α、CTNNB、FOS、JUN降低,表明黄连解毒汤可通过调节ESR1、GSK3B、CTNNB、FOS、JUN和PPARG核心靶点,抑制IL-1β、IL-6、TNF-α等炎症因子的释放,从而发挥治疗金黄色葡萄球菌肺炎的作用。本研究仍存在不足之处,由于时间和经费限制,本研究仅采用网络药理学、分子对接与体外实验相结合的方法,初步探讨了黄连解毒汤治疗金黄色葡萄球菌肺炎相关机制,后续将在此基础上开展更深入的研究。
综上所述,黄连解毒汤具有清热解毒的功效,其对金黄色葡萄球菌肺炎的治疗或许具有积极作用,作用机制可能与调节ESR1/NLRP3/Caspase-1信号通路、GSK3B/Nrf2信号通路、CTNNB信号通路、FOS信号通路、JUN信号通路和PPARG信号通路有关,后期有待于进一步实验和临床验证。
| [1] |
PICKENS C I, WUNDERINK R G. Methicillin-resistant Staphylococcus aureus hospital-acquired pneumonia/ventilator-associated pneumonia[J]. Seminars in Respiratory and Critical Care Medicine, 2022, 43(2): 304-309. DOI:10.1055/s-0041-1740583 |
| [2] |
PICHON M, MICAELO M, RASOANANDRASANA S, et al. Molecular characterization of Staphylococcus aureus isolates derived from severe pneumonia: A retrospective monocentre study[J]. Infectious Diseases, 2021, 53(11): 811-819. DOI:10.1080/23744235.2021.1963472 |
| [3] |
WANG S X, WANG Y, LU Y B, et al. Diagnosis and treatment of novel coronavirus pneumonia based on the theory of traditional Chinese medicine[J]. Journal of Integrative Medicine, 2020, 18(4): 275-283. DOI:10.1016/j.joim.2020.04.001 |
| [4] |
DU H Z, HOU X Y, GUO Y J, et al. Classic mechanisms and experimental models for the anti-inflammatory effect of traditional Chinese medicine[J]. Animal Models and Experimental Medicine, 2022, 5(2): 108-119. DOI:10.1002/ame2.12224 |
| [5] |
CHEN Y, JIANG L Y, LI M, et al. Huanglian Jiedu decoction alleviates neurobehavioral damage in mice with chronic alcohol exposure through the RAS-RAF-MEK-ERK pathway[J]. Heliyon, 2024, 10(8): e2955. |
| [6] |
VIDAL-LIMON A, AGUILAR-TOALÈJ E, LICEAGA A M. Integration of molecular docking analysis and molecular dynamics simulations for studying food proteins and bioactive peptides[J]. Journal of Agricultural and Food Chemistry, 2022, 70(4): 934-943. DOI:10.1021/acs.jafc.1c06110 |
| [7] |
李建成, 冯斌. 丹酚酸B对金黄色葡萄球菌肺炎幼年小鼠肺组织修复及脑神经保护作用的观察[J]. 郑州大学学报(医学版), 2021, 56(1): 102-108. |
| [8] |
魏伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010: 70.
|
| [9] |
WANG M Q, LIU X, TIAN Z X. A 600 mg of fixed-dose linezolid in renally impaired patients versus 15 mg/kg intermittent dose-optimized vancomycin in renally non-impaired patients: A single centre retrospective analysis for adult patients with hospital -acquired pneumonia due to methicillin-resistant Staphylococcus aureus[J]. Tropical Medicine & International Health, 2023, 28(4): 315-323. |
| [10] |
LEE L N, CHOU W R, WANG J Y, et al. Characteristics and local risk factors of community-acquired and health-care-associated Staphylococcus aureus pneumonia[J]. Scientific Reports, 2022, 12(1): 18670. DOI:10.1038/s41598-022-23246-1 |
| [11] |
ZHANG L, WU Q, HUANG Y Y, et al. Formononetin ameliorates airway inflammation by suppressing ESR1/NLRP3/Caspase-1 signaling in asthma[J]. Biomedicine & Pharmacotherapy, 2023, 168: 115799. |
| [12] |
ZHANG D, GE F, JI J, et al. β-sitosterol alleviates dextran sulfate sodium-induced experimental colitis via inhibition of NLRP3/Caspase-1/GSDMD-mediated pyroptosis[J]. Frontiers in Pharmacology, 2023, 14: 1218477. DOI:10.3389/fphar.2023.1218477 |
| [13] |
GOJANI E G, WANG B, LI D P, et al. Anti-inflammatory properties of eugenol in lipopolysaccharide-induced macrophages and its role in preventing β-cell dedifferentiation and loss induced by high glucose-high lipid conditions[J]. Molecules, 2023, 28(22): 7619. DOI:10.3390/molecules28227619 |
| [14] |
CHENG J J, MA X D, AI G X, et al. Palmatine protects against MSU-induced gouty arthritis via regulating the NF-κB/NLRP3 and Nrf2 pathways[J]. Drug Design, Development and Therapy, 2022, 16: 2119-2132. DOI:10.2147/DDDT.S356307 |
| [15] |
HUANG H, WANG J, HUSSAIN S A, et al. Gossypin exert lipopolysaccharide induced lung inflammation via alteration of Nrf2/HO-1 and NF-κB signaling pathway[J]. Environmental Toxicology, 2023, 38(8): 1786-1799. DOI:10.1002/tox.23806 |
| [16] |
SUN Y Y, ZHU H J, ZHAO R Y, et al. Remote ischemic conditioning attenuates oxidative stress and inflammation via the Nrf2/HO-1 pathway in MCAO mice[J]. Redox Biology, 2023, 66: 102852. DOI:10.1016/j.redox.2023.102852 |
| [17] |
CAO Z Q, WANG X X, LU L, et al. β-sitosterol and gemcitabine exhibit synergistic anti-pancreatic cancer activity by modulating apoptosis and inhibiting epithelial-mesenchymal transition by deactivating Akt/GSK-3β signaling[J]. Frontiers in Pharmacology, 2019, 9: 1525. DOI:10.3389/fphar.2018.01525 |
| [18] |
KUANG B C, WANG Z H, HOU S H, et al. Methyl eugenol protects the kidney from oxidative damage in mice by blocking the Nrf2 nuclear export signal through activation of the AMPK/GSK3β axis[J]. Acta Pharmacologica Sinica, 2023, 44(2): 367-380. DOI:10.1038/s41401-022-00942-2 |
| [19] |
CHLEBEK J, DE SIMONE A, HOĆĆÈLKOVÈ A, et al. Application of BACE1 immobilized enzyme reactor for the characterization of multifunctional alkaloids from Corydalis cava(Fumariaceae) as Alzheimer's disease targets[J]. Fitoterapia, 2016, 109: 241-247. DOI:10.1016/j.fitote.2016.01.008 |
| [20] |
MIGGIOLARO A F R S, DA SILVA F P G, WIEDMER D B, et al. COVID-19 and pulmonary angiogenesis: The possible role of hypoxia and hyperinflammation in the overexpression of proteins involved in alveolar vascular dysfunction[J]. Viruses, 2023, 15(3): 706. DOI:10.3390/v15030706 |
| [21] |
陈阳西, 余幼微, 杨帆, 等. 转染DPP-4 siRNA或(和)加入SP600125的小鼠肺泡巨噬细胞极化及JNK/AP-1信号通路激活情况观察[J]. 山东医药, 2024, 64(12): 10-14. |
| [22] |
GARG M, JOHRI S, SAGAR S, et al. Cardiolipin-mediated PPARγ S112 phosphorylation impairs IL-10 production and inflammation resolution during bacterial pneumonia[J]. Cell Reports, 2021, 34(6): 108736. DOI:10.1016/j.celrep.2021.108736 |
| [23] |
洪玉书, 张晶, 李玉梅, 等. 基于网络药理学和实验验证探讨补阳还五汤含药血清对高糖损伤血管内皮细胞的影响[J]. 中药药理与临床, 2024, 40(4): 34-41. |
| [24] |
钟思凡, 陶源, 兰松博, 等. 天麻-丹参药对治疗高血压作用机制的网络药理学分析及实验验证[J]. 中药新药与临床药理, 2024, 35(3): 384-393. |
| [25] |
WU G J, MU T, ZHANG L H, et al. Jatrorrhizine hydrochloride alleviates tert-butyl hydroperoxide-induced endothelial cell injury through its anti-inflammatory activity and PPAR-γ activation[J]. Cellular and Molecular Biology, 2020, 66(2): 125-129. DOI:10.14715/cmb/2020.66.2.20 |
 2025, Vol. 42
2025, Vol. 42