文章信息
- 李杰, 王林洋, 程涓, 吴珺, 邱泽计, 罗慧
- LI Jie, WANG Lin-yang, CHENG Juan, WU Jun, QIU Ze-ji, LUO Hui
- 清热化痰法对AECOPD痰热证大鼠模型病理肺组织的影响
- The influence of clearing heat and dispersing phlegm method on the pathological lung tissue of AECOPD rat model (syndrome of phlegm and heat)
- 天津中医药大学学报, 2016, 35(1): 31-35
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(1): 31-35
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.01.09
-
文章历史
- 收稿日期: 2015-09-12
2. 北京中医药大学基础医学院, 北京 100029
2. School of Basic Medical Sciences, Beijing University of Chinese Medicine, Beijing 100029, China
基于前期研究清热化痰方可以提高青霉素在慢性阻塞性肺疾病急性加重期(AECOPD)大鼠模型肺组织中的转运能力[1, 2],即提高抗生素在肺组织中的浓度,以合理的剂量达到良好的疗效。本研究初步探究清热化痰法指导下的蒌芩止嗽煎提高抗生素的肺内转运作用的机制,是否通过对病理肺组织的影响,不同程度的改善受损肺组织形态学定量指标、减轻肺泡受损程度、保护弹力纤维等因素达到改善肺组织受损的形态结构来利于抗生素在肺组织中的正相扩散,提高其在肺组织中的药物浓度。
1 材料与方法 1.1 动物Wistar雄性大鼠50只,体质量(200±20) g,合格证号SCXK(京)2009-0007,由北京华阜康生物科技股份有限公司提供。
1.2 材料与试剂内毒素(L2880,由美国 Sigma-Aldrich 公司提供),青霉素(华北制药有限公司生产,批号F3056114),金黄色葡萄球菌(北京中医药大学医学病原学与免疫实验室提供,菌号ATCC25923),哈德门香烟(焦油含量12 mg,烟碱含量1.2 mg,由上海卷烟厂生产),氨溴索(上海勃林格殷格翰药业有限公司,批号227521)。二陈汤和蒌芩止嗽煎制备成免煎颗粒,由北京康仁堂药业有限公司提供。
1.3 造模、分组及用药大鼠按随机数字表法随机分成5组,即正常组、模型组、氨溴索组、二陈汤组和蒌芩止嗽煎组,每组各10只。除正常组外,其余4组用熏吸香烟加气管内注射内毒素的方法[3]建立大鼠慢性阻塞性肺疾病(COPD)模型,分别于实验第7、14、28天向气管内注入溶于注射用生理盐水的内毒素200 μL(1 g/L)。第1~28天(第7、14、28天除外)上午将大鼠置入自制密闭的有机玻璃仓(30 cm×45 cm×50 cm)内,注入浓度约5%(V/V)哈德门香烟烟雾每日30 min,制备COPD大鼠模型。在COPD模型基础上,参照李建生[4]AECOPD痰热证模型建立方法,于第29天开始连续9 d置于温度(38±1) ℃、相对湿度50%、风速0.7 m/s的鼓风干燥箱中进行风热刺激,每日2次,每次30 min,建立痰热证模型,并于第38天经鼻腔注入金黄色葡萄球菌2.4×109 cfu/mL [5],每日2次,每次0.3 mL,连续滴注细菌3 d,制备AECOPD大鼠模型。每组分别予股四头肌肌内注射青霉素16万U/(kg·d)(与人体肌注量等效),连续7 d。同时模型组予蒸馏水10 mL/(kg·d)灌胃,氨溴索组腹腔内注射氨溴索6 mg/(kg·d),二陈汤组予二陈汤10 mL/(kg·d)(制备成免煎颗粒,每克生药配成3 mL混悬液)灌胃,蒌芩止嗽煎组予蒌芩止嗽煎剂10 mL/(kg·d)(制备成免煎颗粒,每克生药配成3 mL混悬液)灌胃。上述给药均每日2次。
1.4 采集生物标本从造模后开始用药起计算,分别于第8天肌肉注射青霉素后15 min,每组随机处置动物各10只,留取肺组织。处死大鼠后,迅速开胸分离支气管与肺脏,夹闭右主支气管,取大鼠右肺下叶,用4%多聚甲醛溶液固定48 h后,取肺组织常规脱水、透明、浸蜡、包埋,切成4 μm厚的切片,苏木精-伊红(HE)染色及Weigert弹力纤维染色,光镜下观察其病理形态学改变。
1.4.1 HE染色肺组织常规包埋切片后用二甲苯分别脱蜡2次,每次10 min,再用无水乙醇各洗5 min;依次经95%、90%、80%、70%乙醇以及蒸馏水冲洗,各5 min;再用苏木精液染色10 min后自来水冲洗2 min;盐酸乙醇溶液(1%)短暂分化30 s,流水冲洗30 s;伊红液(1%)染色3 min,蒸馏水洗2 min,再依次用70%、80%、90%及95%乙醇脱水各2 min;无水乙醇各脱水3 min;二甲苯2次各透明3 min;使用中性树胶封固后在光学显微镜下观察。
1.4.2 Weigert弹力纤维染色肺组织包埋切片后常规脱蜡水洗;用酸性高锰酸钾水溶液(0.5%高锰酸钾水溶液50 mL,加0.5%硫酸水溶液2.5 mL)处理5 min,蒸馏水冲洗5次;1%草酸水溶液漂白3 min至无色,蒸馏水洗冲洗5次;70%乙醇浸洗,染色液浸染5 min;95%乙醇浸洗2次,无水乙醇脱水,二甲苯透明,中性树胶封固。
1.5 标本测定病理形态观察:光学显微镜下观察 HE染色标本,应用图文分析软件(IPP6.0)测量肺平均内衬间隔(MLI)、平均肺泡数(MAN)、肺泡腔面积与总面积比(PAA),同时对Weigert染色标本测量弹力纤维的相对面积。
观察方法:在同一放大倍数(10×10)及电压的条件下,每张切片均选取上、中、下3个视野,用OLYMPUS U-CMAD-2显微镜进行观察,用Nikon DS-Fi2进行图像采集,并用IMAGE-Pro plus 6.0图文分析软件对HE染色标本以及Weigert染色标本分别测量以下指标,在测量时避开支气管及大、中血管。
1.5.1 MLI在Image Pro plus 6.0图像分析系统上,以视野正中为中心划“十”字交叉线,计算通过该交叉线的肺泡间隔数(Ns),测出十字线的总长度(L)=0.768×10-3 m,以MLI=L/Ns得到平均内衬间隔,其数值反映肺泡的平均直径。
1.5.2 MAN计算每个视野内的肺泡数(Na),测出每个视野的面积(S)=0.144×10-6 m2,以MAN= Na/S计算各个视野的平均肺泡数,其数值反映肺泡的密度。
1.5.3 PAA测量每个视野内肺实质的灰度百分比,计算出每个视野内肺泡腔的面积在肺总面积中所占的比例。
1.5.4 弹力纤维相对面积Weigert染色的弹力纤维呈蓝紫色,随机选取3个视野测出蓝紫色视野所占面积,以及每个视野肺总面积,计算出弹力纤维的相对面积。
1.6 统计学方法采用 SPSS 20.0 软件统计。计量资料采用均数±标准差(x ± s)表示,正态分布计量资料组间比较采用单因素方差分析,组间两两比较采用LSD法,偏态分布计量资料组间比较采用Kruskal-Wallis秩和检验,组间两两比较采用Nemenyi法,P<0.05为差异具有统计学意义。
2 结果 2.1 一般情况HE染色显示,正常组气管内组织上皮结构完整,表面纤毛整齐、丰富,未见有脱落现象,气管壁结构清晰,肺组织结构正常,肺泡间隔完整,无气肿以及炎症,大小均匀一致。模型组肺泡间隔增厚,有炎性细胞浸润(中性粒细胞、淋巴细胞、嗜酸性粒细胞),近胸膜处肺泡明显扩张,肺泡间隔变窄断裂,扩张的肺泡融合形成较大的含气囊腔,呈肺大泡改变,肺泡壁毛细血管受压且数量减少,支气管内纤毛柱状上皮细胞部分剥脱,纤毛粘连、倒伏、变性和坏死,部分脱落,杯状细胞增多。其中以蒌芩止嗽煎组与氨溴索组组大鼠肺泡有部分扩张、少量炎性细胞浸润、纤毛粘连、倒伏、变性,较模型组明显破坏减轻,二陈汤组其次,以模型组破坏最重,见图 1。

|
| 图 1 各组病理形态观察(HE染色×100) |
应用图文分析软件(IPP6.0)测量MLI、MAN、PAA,见表 1。
| 组别 | n | MLI(mm) | MAN(/cm2) | PAA(%) |
| 注:与模型组比较,*P约0.05;**P约0.01。 | ||||
| 正常组 | 10 | 83.00±9.93 | 112.27±11.70** | 0.33±0.54* |
| 模型组 | 10 | 112.63±37.61 | 61.80±30.60 | 0.38±0.40 |
| 氨溴索组 | 10 | 86.23±28.45 | 90.03±29.82** | 0.36±0.24* |
| 二陈汤组 | 10 | 95.84±37.24 | 87.82±29.07** | 0.34±0.39* |
| 蒌芩止嗽煎组 | 10 | 89.12±32.58 | 92.53±26.75** | 0.34±0.41** |
结果显示,MLI:组间比较差异无统计学意义(P>0.05)。MAN:组间比较差异有统计学意义(P<0.05),进一步两两比较显示,与模型组相比,正常组、蒌芩止嗽煎组、氨溴索组与二陈汤组差异均有统计学意义(P<0.05),提示上述治疗对肺组织均有保护作用,正常组、蒌芩止嗽煎组、氨溴索组与二陈汤组之间差异无统计学意义,但均值比较显示正常>蒌芩>氨溴索>二陈。PAA:组间比较差异有统计学意义(P<0.05),进一步两两比较显示,与模型组相比,正常组、蒌芩止嗽煎组与二陈汤组差异均有统计学意义(P<0.05),正常组、蒌芩止嗽煎组与二陈汤组之间差异无统计学意义,但均值比较正常<蒌芩<氨溴索<模型。
2.3 观察Weigert染色标本下的弹力纤维相对面积情况见表 2。
| 组别 | n | 弹力纤维相对面积 |
| 注:组间比较差异无统计学意义,P>0.05。 | ||
| 正常组 | 10 | 0.069±0.012 |
| 模型组 | 19 | 0.065±0.018 |
| 氨溴索组 | 16 | 0.069±0.017 |
| 二陈汤组 | 19 | 0.068±0.012 |
| 蒌芩止嗽煎组 | 15 | 0.071±0.018 |
结果显示,组间比较差异无统计学意义(P>0.05)。正常组弹力纤维连续性好,结构清楚;蒌芩止嗽煎组弹力纤维连续性较好,结构相对清楚;氨溴索组、二陈汤组弹力纤维已有破坏;模型组弹力纤维明显破坏,失去原有连续性,见图 2。
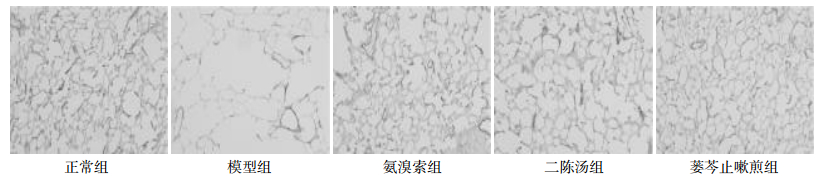
|
| 图 2 各组病理形态观察(Weigert染色×100) |
中医认为COPD是多种慢性肺系疾病长期反复发作,伤及肺、脾、肾,使痰瘀阻肺,肺气壅滞,肺体胀满,肺不敛降而成。武维屏等[6]通过对228例肺胀病例的回顾研究发现痰、瘀、虚病机主次及兼杂变化贯穿了肺胀病机的演变过程。无论是采用回顾性研究还是采用前瞻性研究方法[7, 8]均发现,实证方面痰证出现概率最高,其次为瘀证、热证。可见,痰邪贯穿了COPD的发病始终,既是病理产物又是致病因素。所以化痰法在COPD治疗中占有重要位置之一。
依清热化痰理气立法组成的蒌芩止嗽煎是武维屏教授多年临床经验的总结,由《统旨方》中清金化痰汤化裁而成,方中瓜蒌皮能清肺化痰,理气宽肠,黄芩长于清肺热,两者相合清热化痰,共为君药;漏芦、连翘均为清热解毒之品,清半夏为燥湿化痰代表药,浙贝母有化痰止咳、清热散结之功,4味药相合,共为臣药,助君药清热、化痰、止咳;杏仁、前胡苦降辛开,能宣能降,共奏宣降肺气之功,在方中共为佐使,使气降痰除。二陈汤源自《太平惠民和剂局方》,由法半夏、陈皮、茯苓、甘草组成,功能燥湿化痰、理气和中,主治湿浊痰邪内阻证,也是中药化痰方的基本方。近年研究[9, 10]发现清热化痰理气法指导下的蒌芩止嗽煎无论在临床还是基础研究中对COPD气道黏液高分泌均有一定影响。
本研究病理观察结果显示,1)一般情况:AECOPD模型组[5]镜下改变与正常组相比较有明显差别,肺泡间隔增厚,炎性细胞增多,扩张的肺泡融合形成肺大泡,支气管内纤毛柱状上皮细胞部分剥脱、变性和坏死,杯状细胞增多,说明模型复制成功。2)MLI组间比较无差异,MAN及PAA结果显示:蒌芩止嗽煎组、二陈汤组与氨溴索组在经过对 AECOPD痰热证大鼠模型的干预之后,MAN及PAA与模型组相比较有统计学差异。MLI反映的是平均肺泡直径,MAN反映的是平均肺泡个数,PAA反映的是肺泡进行气体交换的面积,所以三者的变化可代表肺组织结构的受损程度。本实验结果显示,模型组大鼠较正常组肺泡直径增宽,单位面积肺泡数明显减少,肺泡腔面积与总面积比亦明显减少,肺泡结构破坏明显,提示COPD病理状态下肺组织结构严重受损。蒌芩止嗽煎组、二陈汤组与氨溴索组MLI均较模型组没有显著差异,提示这3个治疗组不能明显减少COPD肺组织肺泡直径。蒌芩止嗽煎组、二陈汤组与氨溴索组MAN、PAA均较模型组有显著差异,提示这3组能明显增加单位面积上肺泡数及肺泡腔面积,对肺脏结构均有较好的保护作用。3)Weigert染色显示肺泡壁弹力纤维,其中以蒌芩止嗽煎组弹力纤维含量最高,以模型组受破坏最严重,其顺序从高到低依次为蒌芩止嗽煎组、氨溴索组、正常组、二陈汤组和模型组。
目前国内外文献报道氨溴索具有促进抗生素在肺内转运的作用[11, 12, 13],其作用机制可能是氨溴索是一种黏液溶解剂,能改变肺泡细胞膜的结构和功能,增加肺泡Ⅱ型细胞和表面活性物质的合成[14, 15, 16, 17]。本实验在对肺组织病理标本进行形态定量分析结果亦提示氨溴索增加单位面积上肺泡数及肺泡腔面积,增加肺泡壁弹力纤维。而清热化痰方和化痰方也可以增加单位面积上肺泡数及肺泡腔面积,增加肺泡壁弹力纤维,从对受损病理形态改善的角度证明中西医化痰法在COPD治疗中的重要位置。
此外,本研究采用传统、现代病证结合的方法,在大鼠体内模拟复制出人体疾病、证候和病理改变相近的模型,即AECOPD痰热证模型,在3种化痰法干预中,清热化痰方对受损肺组织的保护作用更为明显,体现中医辨证论治和法证合一的治疗特色。因此清热化痰法指导下的蒌芩止嗽煎提高抗生素的肺内转运作用的机制可能是通过不同程度增加单位面积上的肺泡个数、增加肺泡腔面积、保护弹力纤维等因素达到利于COPD病理改变中肺泡结构恢复,改善肺组织受损的形态结构,降低受损肺泡结构对抗生素的渗透限制来协助抗生素在肺组织中的正相扩散,从而影响抗生素在肺组织内的转运能力,协同抗生素发挥作用。
| [1] | 李 杰,武维屏,罗 慧,等.中药化痰法对青霉素在AECOPD大鼠肺组织转运能力的研究[J]. 北京中医药大学学报, 2013, 36(16):404-408. |
| [2] | 王林洋,王成祥,李 杰.蒌芩止嗽煎对急性加重慢性阻塞性肺疾病痰热证大鼠抗生素增效的作用[J]. 吉林中医药, 2014, 12(34):1266-1269. |
| [3] | 张 莉,李金田,刘永琦,等. 慢性阻塞性肺疾病大鼠模型病变特点的研究[J]. 四川动物, 2010,29(2): 285-287. |
| [4] | 李建生,周红艳,乔翠霞,等. 慢性阻塞性肺疾病急性加重期痰热证模型的建立与评价[J]. 中国中医基础医学杂志, 2010,16(7): 553-556. |
| [5] | 李 杰,邱泽计,吴 珺,等. 慢性阻塞性肺疾病急性加重期大鼠模型的建立[J]. 辽宁中医药大学学报, 2013,15(8): 106-109. |
| [6] | 武维屏,王 琦,田秀英,等.肺胀228例临床冶疗回顾[J].中国医药学报,1991,6(4):20-23. |
| [7] | 李 杰,王 琦,武维屏,等.结合GOLD分级浅析慢性阻塞性肺疾病的病机演变[J]. 北京中医药大学学报: 中医临床版, 2005,12(6):8-11. |
| [8] | 李 杰,冯淬灵,王 琦,等.COPD急性加重期中医证候要素与肺功能关系的研究[J]. 中国中西医结合杂志, 2011, 31(6):760-764. |
| [9] | 冯淬灵,于会勇,黄文通,等.清热化痰理气中药复方治疗65例急性加重期慢性阻塞性肺疾病疗效评价[J]. 北京中医药大学学报, 2011,34(11):786-790. |
| [10] | 李 杰,王 琦,冯淬灵,等. 清热化痰法对AECOPD大鼠血清中性粒细胞弹性蛋白酶水平的影响研究[J]. 中国药师, 2014,17(5):722-724. |
| [11] | Spatola J, Poderoso JJ,Wiemeyer JC, et al. Influence of ambroxol on lung tissue penetration of amoxicillin[J]. Arzneimittelf orsch,1987,37(8):965. |
| [12] | Peralta J,Poderoso JJ,Corazza C, et al. Ambroxol plus amoxicillin in the treatment of exacerbations of chronic bronchitis[J]. Arzneimittelf orsch,1987,37 (8):969 |
| [13] | 姚 坚,张建军,李凯述. 国产氨溴索治疗呼吸系统疾病疗效观察[J]. 临床肺科杂志, 2007, 12 (1): 17-18. |
| [14] | Peralta J,Poderoso JJ,Corazza C, et al. Ambroxol plus amoxicillin in the treatment of exacerbations of chronic bronchitis[J]. Arzneimittelf orsch,1987,37(8):969. |
| [15] | Curti PC,Renovanz HD. Influence of amphotericin B and ambroxol on pulmonary surfactant[J]. Mykosen,1981,24(9):541. |
| [16] | Mira E,Benazzo M, Manzoni M, et al. Effect of ambroxol on rabbit eustaxhian tube surfactant[J]. ORL J Otorhinolaryngol Relat Spec,1992, 54(3):130-132. |
| [17] | Uchida M, Noguchi Y, Araokawa R, et al. Effect of ambroxol on the guinea pig tracheal muccous secretion and the rat pulmonary surfactant secretion[J]. Nippon Yakurigaku Zasshi, 1992,100(4): 293-300. |
 2016, Vol. 35
2016, Vol. 35


