文章信息
- 石垚, 王琳琳, 余河水, 赖青海, 丁辉, 张丽娟, 宋新波
- SHI Yao, WANG Lin-lin, YU He-shui, LAI Qing-hai, DING Hui, ZHANG Li-juan, SONG Xin-bo
- 高速逆流色谱法分离纯化龙胆碱性乙醇提取物中的龙胆碱
- HSCCC separation and purification gentian alkaline ethanol extracts of gentian
- 天津中医药大学学报, 2016, 35(1): 44-47
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(1): 44-47
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.01.12
-
文章历史
- 收稿日期: 2015-09-26
龙胆为龙胆科植物龙胆(Gentiana scabra Bge)、条叶龙胆(G. manshurica Kitag)、三花龙胆(G. triflora Pal1)、或滇龙胆(G. rigescens Franch)的干燥根和根茎。前3种习称"龙胆",后一种习称"坚龙胆"。性寒、味苦、归肝、胆经;能清热燥湿、泻肝胆火,用于湿热黄疸、阴部湿痒、带下、肝火目赤、耳鸣耳聋、肋痛口苦、惊风抽搐等[1]。现代药理研究表明龙胆具有保肝、利胆、健胃、抗炎、抗病毒、抑菌等药理作用[2, 3, 4],近年来主要用于治疗急慢性肝炎、乙型脑炎和抗肿瘤等[5]。龙胆中主要的化学成分是环烯醚萜类化合物,其中龙胆苦苷是龙胆的主要有效成分[6],龙胆碱(又名秦艽甲素)是龙胆苦苷体内经代谢的重要活性产物[7]。文献报道,具有抗糖尿病活性的獐牙菜苦苷的体内代谢产物龙胆碱能上调胰岛素抵抗3T3-L1(PPAR 3T3-L1)脂肪细胞的基因表达[8]。药理研究表明,龙胆碱具有抗炎[9]、解热[10]、抗惊厥[11]和镇静催眠[12]等药理活性。龙胆碱(秦艽甲素)不是植物本身存在的化合物,而是龙胆苦苷与氨水反应的人工产物[13]。目前龙胆碱的制备主要有以龙胆苦苷为原料合成[14]和龙胆药材碱性提取后通过离子交换树脂柱和硅胶柱层析进一步纯化[15]。工艺相对繁琐,操作周期长,不利于大量制备。
高速逆流色谱(HSCCC)技术是一种无需任何固态载体或支撑的液-液分配色谱技术,具有众多优点,如:不需要固体做固定相;色谱柱无填料;容积极性可调范围大;可采用多种洗脱方式;对样品的吸附少,回收率高;容易实现放大生产等。被广泛地应用于天然产物中有效成分包括生物碱类、黄酮类、皂苷类、醌类、多酚类、苯丙素类、多肽,以及蛋白质、抗生素等的分离分析和制备[16, 17, 18, 19, 20, 21, 22]。本实验采用HSCCC技术对经过弱酸性阳离子交换树脂富集的龙胆碱性乙醇提取物进行分离纯化,制备得到高纯度的龙胆碱,方法稳定,回收率高,适应性强,为分离纯化龙胆碱提供了一种新技术路线。
1 仪器与材料ZDHW型调温电热套(北京中兴伟业仪器有限公司),DLSB型低温冷却循环泵(巩义市予华仪器有限公司),KQ-250E型超声清洗器(昆山市超声仪器有限公司),LC-2010 AHT高效液相色谱仪(Shimadzu日本岛津公司),AL204电子天平[梅特勒-托利多仪器(上海)有限公司],Kromasil C18(250 mm×4.6 mm,5 μm)(美瑞泰克科技有限公司),Agilent 1290 高效液相色谱仪(安捷伦科技有限公司),Accurate-Mass Q-TOF LC/MS 6520(安捷伦科技有限公司),TBE 300 B 高速逆流色谱仪(上海同田生物技术有限公司),D151弱酸性阳离子交换树脂(天津波鸿树脂科技有限公司),甲醇(分析纯)、乙醇(分析纯)、氨水(分析纯)(天津市赢达稀贵化学试剂厂),甲醇(色谱纯)、乙酸乙酯(色谱纯)、正己烷(色谱纯)(天津四友精细化学品有限公司),氯仿(天津江天化工技术有限公司)。
龙胆药材购自百善(唐山)药业有限公司,经天津中医药大学张丽娟教授鉴定为滇龙胆(G. rigescens Franch)。
2 实验方法 2.1 高效液相色谱(HPLC)分离条件LC-2010 AHT高效液相色谱仪,Kromasil C18色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水(30:70),等梯度洗脱,流速为1 mL/min,检测波长为275 nm,柱温为30 ℃。
2.2 HSCCC分离过程以20 mL/min的流速泵入固定相(上相),等检测器出口有溶剂流出,停泵,换上流动相(下相),选择正向旋转(FWD)缓慢调节主机转速至850 r/min,以流速1.5 mL/min泵入流动相,分离温度为25 ℃,检测器波长280 nm。
2.3 龙胆碱粗品的制备由于龙胆碱为龙胆中环烯醚萜苷类和氮原子的反应产物,其反应流程图见图 1。影响其合成的主要条件有溶液的pH值和浸泡时间,通过对龙胆碱的转化工艺进行优化确定提取溶液的最佳pH值为9.5,最佳浸泡时间为16 h。
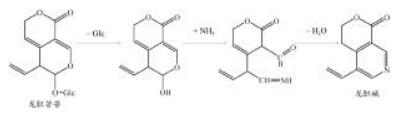
|
| 图 1 龙胆苦苷转化龙胆碱的流程图 |
龙胆药材1.2 kg,粉碎,用碱性乙醇溶液(pH 9.5)浸泡16 h,回流提取,提取2次,每次2 h,过滤,合并滤液,滤液减压浓缩至浸膏,加等量水混悬,等体积三氯甲烷萃取5次。合并三氯甲烷部分,回收三氯甲烷得到浸膏285.0 g。
3 实验结果 3.1 龙胆碱粗品的初步分离取D151弱酸性阳离子交换树脂,预处理后湿法装柱,用浓度为1%的盐酸(HCl)酸溶液平衡。取"2.3"项下的浸膏205.0 g,用1%的HCl-水溶液超声溶解,离心(6 000 r/min,10 min),上清液经过D151弱酸性阳离子交换树脂柱,依次用水、10%、15%、20%、25%、30%的乙醇梯度洗脱,HPLC、薄层层析技术(TLC)跟踪检测,其中20%乙醇部分检测到龙胆碱,收集20%乙醇洗脱部分,减压回收溶剂,浓缩,得到浸膏(龙胆碱粗品)12.0 g。
3.2 HSCCC分离纯化龙胆碱 3.2.1 HSCCC溶剂系统的优化溶剂体系的选择是HSCCC分离重要的一个环节[23]。选择逆流色谱的溶剂体系的方法多样,本实验采用HPLC测定分配系数K(0.5<K<2)法。
用HSCCC技术进行分离,其首要条件是保证样品在互不相溶的上下两相中有合适的分配系数。即K=溶质在固定相中的质量浓度(Cs)同溶质在流动相中的质量浓度(Cm)之比。用公式(1-1)表示:K=Cs /Cm(1-1),同时,HPLC的峰面积是与各组分的浓度是成正比的,即:Cs /Cm=As /Am(1-2),其中Am为样品在流动相中的峰面积,As为样品在固定相中的峰面积。通过调研文献和相关实验筛选,本实验选择了正己烷:乙酸乙酯:甲醇:水为溶剂系统。
称取"3.1"项下少量的粗龙胆碱,选择正己烷:乙酸乙酯:甲醇:水=5:5:5:5、正己烷:乙酸乙酯:甲醇:水=5:5:5:6:正己烷:乙酸乙酯:甲醇:水=5:5:6:5,正己烷:乙酸乙酯:甲醇:水=5:5:4:6和测定样品在上下相中的分配系数K。见表 1。
| 溶剂系统 | 比例(V/V) | 分配系数K值 |
| 正己烷-乙酸乙酯-甲醇-水 | 5:5:5:5 | 0.87 |
| 正己烷-乙酸乙酯-甲醇-水 | 5:5:5:6 | 1.26 |
| 正己烷-乙酸乙酯-甲醇-水 | 5:5:6:5 | 2.35 |
| 正己烷-乙酸乙酯-甲醇-水 | 5:5:4:5 | 1.45 |
结合分配系数K和不同的体积比的正己烷:乙酸乙酯:甲醇:水经过HSCCC后得到的龙胆碱的纯度,本实验选择了正己烷:乙酸乙酯:甲醇:水(5:5:4:5)为溶剂系统。
3.2.2 龙胆碱的纯化按照"3.2.1"项下正己烷:乙酸乙酯:甲醇:水=5:5:4:6的比例,配置溶剂体系2 000 mL于室温条件下静置过夜,取上相为固定相,下相为流动相,分别超声脱气20 min。称取龙胆碱粗品950.8 mg,用上下相溶解进行制备。根据HSCCC图收集目标化合物1流份。见图 2。
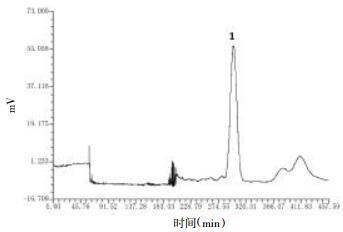
|
| 图 2 龙胆碱的HSCCC图 |
利用HPLC对HSCCC分离纯化到的目标化合物进行结构鉴定和纯度检测。得到的目标化合物与龙胆碱对照品进行HPLC分析,相同条件下,两者保留时间相同。采用外标法测定纯度为98.8%;样品与龙胆碱对照品进行电喷雾质谱法(ESI-MS)分析,[M+H]+ m/z 176.070 7,[M+Na]+ m/z 198.052 8。说明HSCCC分离纯化得到的目标化合物是龙胆碱。见图 3。
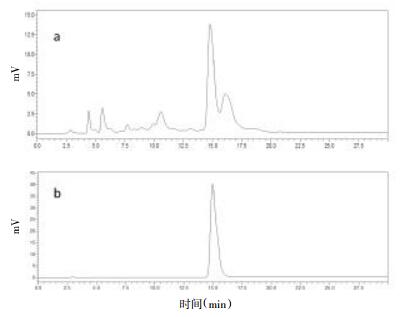
|
| a:粗龙胆碱;b:龙胆碱化合物 图 3 粗龙胆碱以及龙胆碱化合物的HPLC图 |
龙胆碱又名秦艽甲素,系裂环烯醚萜苷类在碱性环境下转化而来的人工产物[13]。文献报道的合成方法主要是利用龙胆苦苷经吡啶反应制得四乙酰龙胆苦苷,而后再以氨水反应后分离获得[14],还有利用龙胆药材碱性提取后通过离子交换树脂柱和硅胶柱层析进一步制备[15]。上述方法相对繁琐,产量低,不利于工业化制备。笔者在实验过程中发现,龙胆碱在温度过高时容易发生变化,因此在回流提取时保持微沸即可。通过硅胶柱层析分离龙胆碱时,不能直接完全将其解吸附,需要在流动相添加碱性溶液,回收处理较为繁琐。本实验采用阳离子交换树脂对龙胆碱粗品进行富集,再利用高速逆流色谱(HSCCC)技术,在分离的过程中不存在不可逆吸附,使用的样品可以全部回收再利用。该方法稳定,回收率高、适应性强,为高效分离纯化龙胆碱提供了一种新方法,实现了体内产物的体外制备。
| [1] | 国家药典委员会. 中国药典(一部)[S]. 北京:中国医药科技出版社,2010:89. |
| [2] | 李 鑫,李洪源,谢志平,等. 龙胆抗病毒有效部位RG2-1体外抗RSV作用的实验研究[J]. 疾病控制杂志,2007, 11(2):154-156. |
| [3] | 王理达,胡迎庆,屠鹏飞,等. 13种生药提取物及化学成分的抗真菌活性筛选[J].中草药,2001,32(3),241-244. |
| [4] | 刘占文,陈长勋,金 若,等. 龙胆苦苷的保肝作用研究[J]. 中草药,2002,31(1): 47. |
| [5] | 陈长勋,刘占文,孙 峥,等. 龙胆苦苷抗炎药理作用研究[J]. 中草药,2003,34(9): 814. |
| [6] | 陈 雷,王海波,孙晓丽,等. 龙胆苦苷镇痛抗炎药理作用研究[J]. 天然产物研究与开发,2008,20(5): 903-906. |
| [7] | 杨肖锋,宋纯清. 龙胆苦苷的肠内菌群代谢研究[J]. 中国中药杂志,2000, 25(11):673-675. |
| [8] | Vaidya H, Goyal RK, Cheema SK. Anti-diabetic Activity of Swertiamarin is due to an Active Metabolite, Gentianine, that Upregulates PPAR-Gene Expression in 3T3-L1 cells[J]. Phytotherapy Reserch, 2013, 27(4):624-627. |
| [9] | Kwak WJ, Kim JH, Ryu KH, et al. Effects of gentianine on the production of proinflammatory cytokines in male Sprague-Dawley rats treated with lipopolysaccharide (LPS)[J]. Biological Pharmaceutical Bulletin, 2005, 28(4):750-753. |
| [10] | 刘学伟,曹 敏,刘树民. 龙胆碱的解热作用及机制研究[J]. 中国实验方剂学杂志,2011,17(24):128-131. |
| [11] | 刘 刚. 龙胆碱对反复高热惊厥大鼠的解热抗惊厥作用机制探讨[J]. 中国实验方剂学杂志,2012,18(19):235-237. |
| [12] | 刘学伟,刘树民,柳长凤. 龙胆碱镇静催眠作用及对小鼠脑内5-HT、GABA含量的影响[J]. 时珍国医国药,2012, 23(2):394-396. |
| [13] | 杨肖锋,宋纯清. 天然产物研究中的人工产物[J]. 药学学报,1999,34(12):949-954. |
| [14] | 雷 军. 钩藤后下机制及龙胆苦苷结构修饰的研究[D]. 西安:西北大学,2004. |
| [15] | 刘学伟,刘天宇,刘树民,等. 正交试验优选龙胆中龙胆碱提取工艺[J]. 中国药房,2009,20(33):2582-2583. |
| [16] | 姚 舜,柳仁民,黄雪峰,等. 高速逆流色谱在天然产物分离中的方法学研究[J]. 中国天然药物,2008,6(1):13-19. |
| [17] | 字 敏,袁黎明,刘 频,等. 高速逆流色谱分离青叶胆中的生物碱[J]. 林产化学与工业,2002,22(1):74-76. |
| [18] | 洪 波,司云珊,赵宏峰.高速逆流色谱法分离附子中的l5-a-羟基新乌碱[J]. 吉林农业大学学报,2004,26(1):57-58. |
| [19] | Yang FQ, Yoichiro I. Preparative separation of lappaconitine,ranaconite,N-deacetyllappaconitine and N-deacetylranaconitine from crude alkaloids ofsample Aconitum sinomontanum Nakai by high speed countercurrent chromatography[J]. Chromatogr A, 2002,943(2):219. |
| [20] | Yang FQ, Yoichiro I. pH-Zone-refining counter-current chromatography of lappaconitine from Aconitum sinomontanum Nakai[J]. Chromatogr A, 2001, 923(1-2):281. |
| [21] | Liu RM, Chu X, Sun AL, et al. Preparative isolation andpurification of alkaloids from the Chinese medicinal herbEvodia rutaecarpa (Juss.) Benth by high-speed-counter-current chromatography[J]. J Chromatogr A, 2005, 1074(1-2):139-144. |
| [22] | Ouyang XK, Jin MC, He CH, et al. Preparative separation of four major alkaloids from medicinal plant of Tripterygium Wilfordii Hook. f. Using high-speed-counter-current chromatography[J]. Sep Purif Technol, 2007, 56(3):319-324. |
| [23] | 程 杰,符晓晖, 王维娜. 高速逆流色谱在中药分离中溶剂体系的筛选[J]. 中草药,2008,39(8):1272-1275. |
 2016, Vol. 35
2016, Vol. 35




