文章信息
- 杨岳, 李慧影, 张璐莎, 马亚珂, 赵步长, 贾力夫, 赵菁, 陈璐, 王虹
- YANG Yue, LI Hui-ying, ZHANG Lu-sha, MA Ya-ke, ZHAO Bu-chang, JIA Li-fu, ZHAO Jing, CHEN Lu, WANG Hong
- 脑心通胶囊提取物通过增强CXCR4表达促进心脏干细胞迁移
- Naoxintong extract promotes migration of cardiac stem cells through enhancing expression of CXCR4
- 天津中医药大学学报, 2016, 35(2): 99-103
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(2): 99-103
- DOI: 10.11656/j.issn.1673-9043.2016.02.08
-
文章历史
- 收稿日期: 2015-11-21
2. 陕西步长集团, 西安 710082
2. Shanxi Buchang Pharma, Xi'an 710082, China
缺血性心脏病及继发的心功能衰竭已成为当今世界威胁人类健康的重大疾病之一,目前药物治疗、内科介入治疗等仅仅只能恢复局部心肌组织的血液供应,不能从根本上修复已经发生坏死的心肌组织[1]。近年来细胞治疗技术为缺血性心脏病的治疗带来了新的前景。
心脏干细胞(CSCs)又称心脏祖细胞(CPCs),是一类存在于心脏组织中,具有自我更新、克隆形成、多种分化潜能,可分化为心肌细胞、内皮细胞及血管平滑肌细胞等多种细胞的干细胞。它的出现推翻了心脏是一个终末分化器官、缺乏自我更新潜能的这一传统观点。心脏干细胞可在心肌损伤后通过迁移来参与心脏损伤修复[2],对心脏维持自我稳定及损伤修复具有重要意义。当前,基于心脏干细胞移植治疗缺血性心脏病已成为心血管疾病研究中的热点,研究已发现多种具有不同表型特征的心脏干细胞,它们均具有参与心肌和血管再生的能力,可用于缺血性心脏病的治疗。
步长脑心通胶囊(以下简称脑心通,NXT)是根据中医理论研制而成的中药制剂,由黄芪、全蝎、地龙、水蛭、丹参、当归、川芍、赤芍、红花、乳香(制)、没药(制)、桑枝、桃仁、桂枝、牛膝16味中药加工制成,具有活血化瘀、行气止痛等心血管方面的药物作用。药理研究表明,脑心通胶囊中许多成分均对心血管有保护作用[3, 4]。很多临床实验表明脑心通胶囊能有效改善心肌缺血症状,治疗心血管疾病[5, 6, 7, 8]。
本研究观察了脑心通对小鼠心脏干细胞功能基因表达的影响,旨在探讨脑心通能否干预心脏干细胞治疗缺血性心脏病。
1 材料 1.1 细胞及试剂心脏干细胞:由美国西北大学覃刚建教授惠赠;脑心通超微粉(步长公司);DMEM/F12,Hyclone;L-Glutamine、β-mercaptoethanol、36%多聚甲醛(Sigma公司);MEM nonessential amino acids、Basic fibroblast grow factor(Gibco);胎牛血清、胰蛋白酶液(Biological Industries);High Pure RNA Isolation Kit(Roche);TaqMan® Reverse Transcription Rengents、TaqMan® Gene Expression Master Mix、基因芯片(Applied Biosystems);Anti-CXCR4 antibody,abcam;APC Rat IgG2b,κIsotype Control、APC Rat anti-Mouse CD184(CXCR4,BD公司);结晶紫染色液,碧云天;SDF-1、mTNF-α(RD公司);24孔板小室、chemiluminescent HRP substrate,Millipore;全蛋白提取试剂盒,生工;PageRuler Prest Protein Ladder,Thermo;β-Actin (13E5) Rabbit mAb、BCA Protein Assay Kit(cell signal);Anti-CXCR4 antibody,abcam。
1.2 仪器ABI PRISM 7500(Applied Biosystems),EXPRESS PCR仪、SEMI-DAY TRANSFER CELL(BIO-RAD公司),流式细胞仪(BD公司),凝胶成像分析仪(Syngene公司),STIK气套式二氧化碳培养箱[施都凯仪器设备(上海)有限公司],Ti-U倒置荧光显微镜(日本尼康公司),HR40-ⅡA2生物安全柜(Haier公司)。
2 方法 2.1 药物溶液配制 2.1.1 CCM完全培养液DMEM/F12,10% FBS, 2 mmol/L L-Glutamine,0.1mmol/L β-mercaptoethanol,1%(V/V) MEM nonessential amino acids,5 ng/mL Basic fibroblast grow factor,1%(V/V)抗生素。
2.1.2 脑心通混合物的提取脑心通超微粉172.36 g,以1∶8的料液比(kg/L)用1 378.88 mL 95% 乙醇回流提取2 h,然后用布氏漏斗抽滤。所得滤渣用1 378.88 mL 60%乙醇按上述方法回流提取2 h,然后用布氏漏斗过滤。两次滤液合并,以55 ℃水温旋转蒸发。旋蒸后置于蒸发皿中,在水浴锅上挥去残留有机溶剂,然后在真空干燥箱中烘干,最终得到脑心通超微粉提取物即脑心通混合物53.183 g。
2.2 心脏干细胞的培养与传代将心脏干细胞从液氮中迅速取出后,直接放入37~40 ℃的温水中,快速摇动使其融化。在无菌条件下,吸出细胞冻存液,转移至离心管并加入CCM完全培养基。1 000 r/min 25 ℃下离心5 min,去除上清液,再重复用培养液洗涤1次。加足够量培养液轻轻吹打使其成为细胞悬液,移入培养瓶(接种密度为5×105/mL),置于5% 二氧化碳(CO2)、95%空气、37 ℃、饱和湿度的培养箱内培养,24 h后更换培养液继续培养。
2.3 脑心通对心脏干细胞关键功能基因表达的影响心脏干细胞种板培养24 h后,分别向细胞中加入0.1%(V/V)二甲基亚砜(DMSO)和终浓度为12.5 mg/L的脑心通混合物。孵箱中孵育8 h后,采用High Pure RNA Isolation Kit 提取总RNA,采用TaqMan® Reverse Transcription Rengents试剂盒将总RNA反转录为cDNA(20 μL体系),取反转录产物cDNA模板2.5 μL,按照TaqMan® Gene Expression Master Mix试剂盒说明书进行实时定量PCR,测定心脏干细胞中基因相对表达量。采用2-ΔΔCt方法对实时定量PCR结果进行分析。功能基因的种类、符号及基因名见表1。
| 序号功能基因的种类 | 基因符号 | 基因名 |
| 1 Housekeeping gene | RN18S1 | RNA, 18S ribosomal 1 |
| 2 Stem cell marker | KIT | kit oncogene |
| 3 Stem cell marker | Ly6a | lymphocyte antigen 6complex, locusA |
| 4 Tissue EC | Pecam1 | platelet/endothelial cell adhesion molecule 1 |
| 5 Tissue EC | Vwf | VonWillebrand factor homolog |
| 6 Tissue EC | Tek | endothelial-specificreceptor tyrosine kinase |
| 7 myeloid | Itgam | integrinalphaM |
| 8 Cell cycle | Dmtf1 | cyclin Dbinding myb-like transcriptionfactor 1 |
| 9 Cell cycle | Ccne1 | cyclin E1 |
| 10 Cell cycle | Ccna2 | cyclin A2 |
| 11 Cell cycle | E2f3 | E2F transcriptionfactor 3 |
| 12 Cell cycle | Cdkn1a | cyclin-dependent kinase inhibitor 1A (P21) |
| 13 Cell cycle | Pcna | proliferating cell nuclear antigen |
| 14 Apoptosis | Faim | Fasapoptotic inhibitory molecule |
| 15 Apoptosis | Bcl2 | B-cell leukemia/lymphoma 2 |
| 16 Apoptosis | Bax | Bcl2-associatedX protein |
| 17 Smooth muscle cellmaker | Acta2 | actin, alpha 2, smoothmuscle, aorta |
| 18 Smooth muscle cellmaker | Tagln | transgelin |
| 19 Homing | Ccr2 | chemokine (C-C motif) receptor 2 |
| 20 Homing | Cxcl12 | chemokine (C-X-C motif) ligand12 |
| 21 Homing | Cxcr4 | chemokine (C-X-C motif) receptor 4 |
| 22 Adhesion molecules | Cul5 | cullin5 |
| 23 Adhesion molecules | Icam1 | intercellular adhesionmolecule1 |
| 24 Adhesion molecules | Itga4 | integrinalpha4 |
| 25 Adhesion molecules | Itgb2 | integrinbeta 2 |
| 26 Adhesion molecules | Itgb1 | integrinbeta 1(fibronectin receptor beta) |
| 27 Paracrine function | Ang | ngiogenin, ribonuclease, RNase A family,5 |
| 28 Paracrine function | Angpt1 | angiopoietin 1 |
| 29 Paracrine function | Hgf | hepatocyte growthfactor |
| 30 Paracrine function | Il18bp | interleukin18 binding protein |
| 31 Paracrine function | Tnfrsf1b | tumor necrosis factor receptor superfamily, member 1b |
| 32 Paracrine function | Il10 | interleukin10 |
| 33 Paracrine function | Fgf2 | fibroblast growthfactor 2 |
| 34 Paracrine function | IGF1 | insulin-like growthfactor 1 |
| 35 Paracrine function | VEGF | vascular endothelial growthfactor A |
| 36 Paracrine function | Inhba | inhibinbeta-A |
| 37 Paracrine function | eNOS | nitric oxide synthase 3, endothelial cell |
| 38 Survival | Hmox1 | heme oxygenase (decycling) 1 |
心脏干细胞种板培养24 h后,分别向细胞中加入0.1%(V/V)DMSO和终浓度为6.25、12.5、25 mg/L的脑心通混合物。孵箱中培养48 h后,胰蛋白酶液进行消化,300 g下离心10 min收集细胞,Buffer洗去胰蛋白酶液。100 μL Buffer重悬细胞,加入10 μL APC Isotype Control或APC-CXCR4抗体,2~8 ℃下避光孵育 45 min。加入适量Buffer洗去未结合的抗体,流式细胞仪检测APC-CXCR4的表达。
2.5 蛋白免疫印迹法(Western Blot)检测脑心通对心脏干细胞CXCR4蛋白表达的影响心脏干细胞种板培养24 h后,分别向细胞中加入0.1%(V/V)DMSO和终浓度为12.5 mg/L的脑心通混合物。孵箱中培养48h后,用全蛋白提取试剂盒提取总蛋白,用BCA Protein Assay Kit对总蛋白进行定量。取20 μg蛋白进行SDS-PAGE凝胶电泳后,转移到PVDF膜上,5%脱脂奶粉室温封闭2 h,Anti-CXCR4 Rantibody(1∶2000)、β-Actin(13E5)Rabbit mAb(1∶1000),4 ℃孵育过夜。加入按一定比例稀释的HRP标记的羊抗兔IgG(1∶15 000),室温孵育1 h后显影。采用凝胶成像分析仪进行电泳条带的拍照与分析。将目的条带与β-Actin灰度值的比值作为蛋白的相对表达水平。
2.6 脑心通对SDF-1诱导的心脏干细胞迁移的影响心脏干细胞种板培养24 h后,分别向细胞中加入DMSO和终浓度为12.5 mg/L的NXT混合物。孵箱中培养24 h后,胰蛋白酶液进行消化,分别用含药1%FBS CCM全培基悬浮细胞,将细胞密度调整至5×104/mL。将收集到的细胞分为4组(A~D组):A组为阴性对照组下室内加入含0.1%(V/V)DMSO的1%FBS CCM全培基,B组下室内加入含SDF-1α(125 μg/L)的1%FBS CCM全培基,C、D组下室内加入SDF-1α(125 μg/L)+NXT混合物(12.5 mg/L)的1%FBS CCM全培基。在FN包被的小室的上室中,A~C组上室内均加入200 μL细胞悬液,D组上室内加入与100 mg/L CXCR4受体阻断剂AMD3100共孵育30 min后的细胞悬液200 μL,将Transwell小室置孵箱中孵育。孵育4 h后,用棉签擦掉滤膜上侧没有迁移的细胞,多聚甲醛固定20 min,D-Hanks洗2次,结晶紫染色10 min,用显微镜观察染色的细胞,每个滤膜观察6个随机视野,进行拍照并计数染色阳性的细胞。
2.7 统计学分析实验数据均以均数±标准差($\bar x$±s)表示,采用SPSS 18.0统计软件对各组数据进行单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
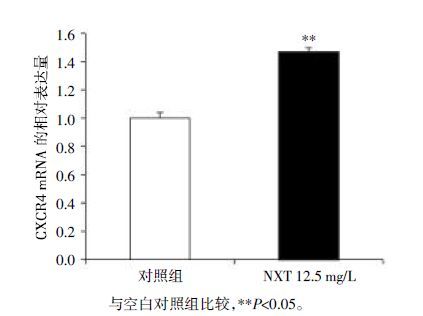
3 结果 3.1 脑心通上调心脏干细胞CXCR4基因的表达以芯片技术研究脑心通对心脏干细胞功能基因表达的影响。研究发现,心脏干细胞在孵箱中经12.5 mg/L的脑心通混合物孵育8 h后,与空白对照组相比,脑心通能够显著上调心脏干细胞CXCR4基因表达(P<0.05或P<0.01),见图1、图2。

|
| 图1 脑心通对心脏干细胞功能基因表达的影响 |
|
| 图2 脑心通对心脏干细胞CXCR4 基因表达的影响 ($\bar x$±s,n=3) |
以流式细胞术及蛋白免疫印迹法研究脑心通对心脏干细胞CXCR4蛋白表达的影响。研究发现,与空白对照组相比,脑心通促进心脏干细胞CXCR4蛋白的表达(P<0.05或P<0.01),见图3、图4。

|
| 图3 流式鉴定脑心通对心脏干细胞CXCR4 表达的影响($\bar x$±s,n=6) |

|
| 图4 NXT对CSCs细胞CXCR4蛋白表达的影响($\bar x$±s,n=3) |
Transwell 迁移实验研究发现,SDF-1能诱导心脏干细胞的迁移[(58.67±2.02vs(83.80±9.19),p<0.01,n=3],脑心通能够促进SDF-1诱导的心脏干细胞CXCR4的迁移[(83.80±9.19)vs(110.93±8.97),p<0.01,n=3],加入AMD3100后,可显著抑制脑心通对SDF-1诱导的心脏干细胞CXCR4迁移[(110.93±8.97)vs(65.12±9.43),P<0.01,n=3]。见图5。

|
| 图5 脑心通对SDF-1 诱导的心脏干细胞CXCR4 迁移的影响 |
心脏干细胞的发现不仅改变了心脏属于终末分化器官的传统的认识,且为心脏疾病的治疗提供了更为理想的种子细胞。现阶段对心脏干细胞的来源争议较大,Quaini等[9]认为心脏干细胞来源于骨髓。但是随着研究的进一步深入,大量的实验结果显示心脏干细胞来自心脏,心脏干细胞巢是心脏干细胞来自心脏有力的证据[10]。由于心脏干细胞能特异性分化为心系细胞,其在心脏病细胞治疗方面具有强大的优势。心脏干细胞修复心脏主要通过心脏干细胞分化潜能及其旁分泌作用[11, 12],但其具体作用机制尚不明确,还需进一步的研究。
趋化因子是指能使细胞发生趋化运动的小分子细胞因子。SDF-1属于CXC类趋化因子,又称为CXCL12或前B刺激因子,趋化活性高于其他趋化因子,最早由Nagasawa等[13]发现。CXCR4属于CXCR类趋化因子受体,是趋化因子SDF-1的特异性受体。CXCR4与SDF-1共同作用控制细胞的迁移、组织的靶向作用及归巢,但SDF-1/CXCR4轴调控CSCs迁移、归巢的作用及机制有待进一步研究。Tang等[14]研究发现CSCs细胞缺氧预处理后,能上调CXCR4的表达,并且招募至缺血心肌,减少心肌梗死面积,改善心肌梗死后的心脏功能。
本实验通过实时荧光定量PCR实验发现脑心通上调心脏干细胞CXCR4基因的表达,用流式细胞术及Western Blot法证实了脑心通促进心脏干细胞CXCR4蛋白的表达,然后用Transwell迁移实验证明脑心通能通过SDF-1/CXCR4轴促进心脏干细胞的迁移。SDF-1/CXCR4 轴介导的信号转导通路可分为G蛋白依赖的信号转导通路和非G蛋白依赖的信号转导通路两个方面,研究发现非G蛋白依赖的信号转导通路中p42/44MAPK信号通路和p38MAPK信号通路的活化与SDF-1诱导细胞的趋化、迁徙密切相关[15],为后续实验研究SDF-1/CXCR4轴调控CSCs细胞迁移的作用机制提供了思路。
近年来,研究发现CXCR7也可以与SDF-1相结合[16],脑心通是否能通过SDF-1/CXCR7轴促进心脏干细胞的迁移有待进一步的研究。
| [1] | Bolli R, Chugh AR, D'Amario D, et al. Effect of Cardiac Stem Cells in Patients with Ischemic Cardiomyopathy: Initial Results of the SCIPIO Trial[J]. Lancet, 2011,378(9806): 1847-1857. |
| [2] | Fukuda K, Yuasa S. Stem cells as a source of regenerative cardio-myocytes[J]. Circ Res, 2006,98(8): 1002-1013. |
| [3] | 承 燕,江时森.黄芪甲苷对心血管保护功能的研究进展[J].医学研究生学报,2011,24(6):637-640. |
| [4] | 叶世华,魏振华,黄洁莲,等.步长脑心通胶囊对冠心病合并高血脂患者的临床疗效[J].当代医学,2012,18(16):141-142. |
| [5] | 王东方,李雪英,赵树红.步长脑心通胶囊对冠心病患者血液流变学及血脂的影响[J].中外医学研究,2011,9(21):13. |
| [6] | 蒋 勇.步长脑心通胶囊与稳心颗粒联合应用对急性冠脉综合征患者复发的保护作用[J].实用心脑肺血管病杂志,2009,17(7):584-585. |
| [7] | 孔德梅.步长脑心通胶囊对冠心病心绞痛患者治疗的临床观察[J].中国实用医药,2009,4(33):128-129. |
| [8] | 哈尼帕·司马义,巴合达娜提·海沙尔.步长脑心通胶囊治疗冠心病心绞痛临床观察[J].中国误诊学杂志,2011, 30(22):65-67. |
| [9] | Quaini F, Urbanek K, Beltrami AP, et al. Chimerism of the transplanted heart[J]. N Engl J Med, 2002,346(1):5-15. |
| [10] | Urbanek K, Cesselli D, Rota M, et al. Stem cell niches in the adult mouse heart. PNAS, 2006,103(24): 9226-9231. |
| [11] | Johnston PV, Sasano T, Mills K, et al. Engraftment,differentiation, and functional benefits of autologous cardiosphere-derived cells in porcine ischemic cardiomyopathy[J]. Circulation, 2009, 120(12):1075-1083. |
| [12] | Maxeiner H,Krehbiehl N,Muller A, et al. New insights into paracrine mechanisms of human cardiac progenitor cells[J]. Eur J Heart Fail, 2010, 12(7):730-737. |
| [13] | Nagasawa TL, Kikutani H, Kishimoto T. Molecular cloning and structure of a pre-B-cell growth-stimulating factor[J]. Proc Natl Acad Sci USA,1994, 91(6):2305-2309. |
| [14] | Tang YL, Zhu WQ, Cheng M, et al. Hypoxic preconditioning enhances the benefit of cardiac progenitor cell therapy for treatment of myocardial infarction by inducing CXCR4 expression[J]. Circ Res,2009,104(10):1209-1216. |
| [15] | Raffaghello L, Cocco C, Corrias MV, et al. Chemokines in neuroectodermal tumour progression and metastasis[J]. Semin Cancer Biol, 2009, 19(2):97-102. |
| [16] | Balabanian K, Lagane B, Infantino S, et al. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes[J]. J Biol Chem, 2005,280(42): 35760-35766 |
 2016, Vol. 35
2016, Vol. 35