文章信息
- 黄竹娟, 苏宁, 吴绍锋, 林锐珊, 郭建超, 张小年
- HUANG Zhu-Juan, SU Ning, WU Shao-feng, LIN Rui-shan, GUO Jian-chao, ZHANG Xiao-nian
- 靶向端粒G-四链体手性钌配合物的抗肿瘤活性研究
- Anti-tumor activities research of chiral ruthenium to targeted telomeres G-quadruplex
- 天津中医药大学学报, 2016, 35(2): 109-113
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(2): 109-113
- DOI: 10.11656/j.issn.1673-9043.2016.02.10
-
文章历史
- 收稿日期: 2015-11-21
近年来肿瘤的发病率越来越高,中医药常以配合放化疗以增效减毒、提高机体免疫力以预防肿瘤复发与转移,或者用于治疗缺乏有效治疗手段的中晚期肿瘤等的辅助治疗方式出现,而中医药单用治疗肿瘤的规律还处在摸索与总结阶段。自从1969年顺铂被发现具有抗肿瘤活性以来,金属配合物研究引发了人们的广泛关注。目前国际上大多数研究报告认为非铂类配合物中的钌配合物具有低毒性、易吸收并可很快被排泄,且具有易于被肿瘤组织吸收的特点[1, 2, 3]。因此,钌配合物已被公认为是一类活性强的新型抗肿瘤药物,钌配合物的合成及其生物活性已经成了国内外的研究热点[4, 5, 6, 7]。手性钌配合物与DNA相互作用的研究始于美国科学家Barton和瑞典科学家Norden[8, 9]。Mei等[10]的研究进一步证实手性钌(Ⅱ)金属配合物与DNA的作用存在手性选择性,并且Λ-异构体与DNA的结合速率更快,在肿瘤的化学治疗、DNA的结构探针等领域具有潜在的应用前景[11]。而刘亚楠、Shi等[12, 13]研究证实手性钌(Ⅱ)金属配合物对端粒末端形成G-四链体具有高选择性。这种在端粒末端形成的G-四链体结构能够抑制端粒的复制,阻断端粒延伸,进而达到抑制肿瘤细胞增殖或促进其凋亡的目的。Sun等[14]在化学分子水平的研究表明,甲氧基的手性钌配合物Δ/Λ-[Ru(phen)2p-MOPIP]2+(Δ/Λ-OMe )能选择性诱导人体端粒形成G4-DNA结构并稳定该结构,说明了其在抗肿瘤活性中的潜在价值。且进一步研究表明其与G-四链体的作用存在明显的选择性,左旋异构体稳定G-四链体能力远远强于右旋异构体,但此项研究未进行体外实验。基于以上研究,本文从体外实验来验证Δ/Λ-OMe 及其消旋体dl-OMe的抗肿瘤活性以及凋亡诱导作用。
1 实验部分 1.1 肿瘤细胞、药物来源,实验菌株人胃癌细胞株(MGC-803),人结肠癌细胞株(Colo205),人乳腺癌细胞株(MCF-7),人肺腺癌上皮细胞株(A549),人肝癌细胞株(HepG2),人舌鳞状细胞癌株(SCC-9),人胃黏膜上皮细胞株(GES-1)均来源于暨南大学医学院实验中心,顺铂(CDDP)(美国Sigma公司),手性钌配合物(Λ-OMe、Δ-OMe)及其消旋体dl-OMe来源于暨南大学生命科学学院刘杰教授。

|
| 图1 手性钌配合物的结构图 |
RPMI-1640培养基(美国Gibco公司);DMEM培养液(美国Gibco公司);胎牛血清(杭州四季青公司);四甲基偶氮唑蓝(MTT,美国Sigma公司);二甲基基亚砜(DMSO,美国Sigma公司);Hoechst33342染色液(南京凯基生物技术有限公司);680型酶标仪(美国Bio-Rad公司);BNA-3210型二氧化碳(CO2)培养箱(日本Espec公司);IX71-F22FL/PH型荧光倒置显微镜及图像采集系统(日本Olympus公司)。
1.3 实验方法 1.3.1 细胞培养(人胃癌细胞株(MGC-803),人结肠癌细胞株(Colo205),人乳腺癌细胞株(MCF-7),人肺腺癌上皮细胞株(A549),人肝癌细胞株(HepG2),人舌鳞状细胞癌株(SCC-9))培养于含10%胎牛血清、1×105 U/L青霉素和100 mg/L链霉素的RPMI1640培养液中,人胃黏膜上皮细胞株(GES-1)培养于含10%胎牛血清、1×105 U/L青霉素和100 mg/L链霉素的DMEM培养液中,细胞在相对湿度为95%、37 ℃、5%CO2的环境中单层生长,取对数生长期细胞用于实验。
1.3.2 抗肿瘤活性实验 1.3.2.1 MTT筛选敏感细胞株及药物按MTT法[15],即取对数生长期的肿瘤细胞消化、计数,调整细胞密度,取每孔3 000~5 000铺于96 孔板中,每孔100 μL,在培养箱中培养24 h待贴壁后,再分别加入不同浓度Λ-OMe,Δ-OMe,dl-OMe 100 μL(使培养液的药物终浓度为2.5、5、10、20、40、80 mg/L),阴性对照为等体积培养液,阳性对照为顺铂,加样组和对照组均设3个复孔,置37 ℃,5% CO2培养。在药物处理48 h后每孔加入20 μL MTT(5 g/L),在37 ℃、5% CO2 的环境中继续培养4 h后,弃去上清液,加入DMSO每孔 150 μL,振荡10 min左右,于酶标仪570 nm波长处测吸光值A值,计算细胞存活率,通过软件计算其半数抑制浓度(IC50)。
1.3.2.2 MTT检测Λ-OMe对MGC-803细胞的抑制作用按四甲基偶氮唑蓝(MTT)法,即取对数生长期的细胞消化、计数,调整细胞密度,取3 000~5 000/孔铺于96孔板中,每孔100 μl,在培养箱中培养24 h待贴壁后,再分别加入不同浓度受试样品100 μL(使培养液的药物终浓度为5、10、20 μg/mL),阴性对照为等体积培养液,加样组和对照组均设3个复孔,置37 ℃,5%CO2培养。在药物处理24、48、72 h后收集细胞,每孔加入20 μL MTT(5 mg/mL),在37 ℃、5%CO2的环境中继续培养4 h后,弃去上清液,加入DMSO每孔150 μL,振荡10 min左右,于酶标仪570 nm波长处测吸光值,计算肿瘤生长抑制率。肿瘤细胞抑制率(%)=(1-加药组细胞A值/对照组细胞A值)×100%。
1.3.2.3 细胞凋亡实验取洁净盖玻片在70%乙醇中浸泡5 min或更长时间,用无菌的磷酸盐缓冲液(PBS)洗涤3遍,再用细胞培养液洗涤1遍。将盖玻片置于6孔板内,种入细胞培养过夜,使约为50%~80%。各浓度药物处理细胞48 h,吸尽培养液,加入0.5 mL含4%多聚甲醛或70%乙醇的固定液,固定10 min或更长时间(可4 ℃过夜)。去固定液,用PBS洗两遍,每次3 min,吸尽液体。洗涤时用摇床彻底清洗。加入1 mL 10 mg/L的Hoechst33342染色液,37 ℃染色15 min。去染色液,用PBS洗两遍,每次3 min,吸尽液体。滴一滴抗荧光淬灭封片液于载玻片上,将贴有细胞的盖玻片小心盖在载玻片上,让细胞接触封片液,尽量避免气泡。荧光显微镜下用紫外光激发,可检测到呈蓝色的细胞核,根据细胞核形态是否聚缩高亮度来判断细胞凋亡情况。
2 结 果 2.1 手性钌配合物的抗肿瘤活性 2.1.1 MTT筛选结果采用MTT法评价手性钌配合物Λ-OMe、Δ-OMe、dl-OMe及CDDP的体外抗肿瘤活性,配合物对肿瘤细胞及正常人胃黏膜上皮细胞的半数抑制浓度IC50(mg/L)见表1所示,如最高测试浓度下抑制率仍小于50%的,IC50以>100表示。从表1可以看出,两个异构体及外消旋体对所测试的肿瘤细胞株均表现出一定的细胞毒性,且两个异构体相比其外消旋体表现出了更为优异的抗肿瘤活性,其中配合物Λ-OMe对MGC-803细胞的抑制作用明显高于Δ-OMe、dl-OMe。这些结果显示钌配合物对肿瘤细胞具有一定的选择性,其中Λ-OMe对MGC-803胃癌细胞的化学预防作用最佳。
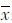 ±s)
±s)
| 化合物 | IC50(mg/L) | ||||||
| MGC-803 | Colo205 | MCF-7 | A549 | HepG2 | SCC-9 | GES-1 | |
| Λ-OMe(1) | 7.4± 1.8 | 35.3±4.3 | 21.8±3.1 | 33.4±3.6 | 42.3±3.9 | 33.2±2.7 | >100 |
| dl-OMe(2) | 47.1± 4.8 | 74.2± 8.3 | >100 | >100 | >100 | >100 | >100 |
| Δ -OMe | 21.3± 3.4 | 20.6± 3.7 | 32.2± 4.2 | 16.4± 2.3 | >100 | 22.7± 2.33.2 | 78.0± 9.1 |
| CDDP | 6.8± 1.5 | 18.6± 2.1 | 12.4± 2.11.7 | 13.6± 1.8 | 19.8± 3.6 | 15.9± 2.6 | 20.3± 1.9 |
进一步用MTT检测Λ-OMe对MGC-803细胞生长的抑制作用,发现其增殖抑制作用具有良好的时间和剂量依赖性。其结果见表2和图2,由实验数据可知,在相同时间内,随着药物浓度的增加,抑制率增加;而同一药物浓度,抑制率随作用时间的延长而增加。
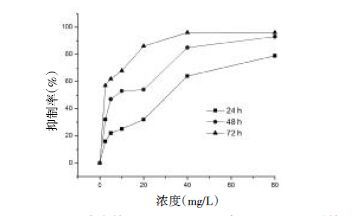
|
| 图2 不不同浓度的Λ-OMe处理细胞24、48、72 h后的 细胞抑制率 |
| Λ-OMe(mg/L) | 抑制率(%) | ||
| 24h | 48h | 72h | |
| 2.5 | 16 | 32 | 57 |
| 5.0 | 22 | 47 | 62 |
| 10.0 | 25 | 53 | 68 |
| 20.0 | 32 | 54 | 86 |
| 40.0 | 64 | 85 | 96 |
| 80.0 | 79 | 93 | 96 |
MGC803细胞经不同浓度的配合物Λ处理48 h后,用倒置显微镜拍得形态学特点如图3所示,其中A:0 μg/mL;B:5 μg/mL;C:10 μg/mL;D:20 μg/mL。根据药物的不同浓度变化,MGC-803细胞的数目和形态都发生了显著的变化。随着浓度增加,细胞数量减少,细胞间间隙增宽,漂浮细胞增多,形态从圆形变长梭形、三角形等不规则形状。
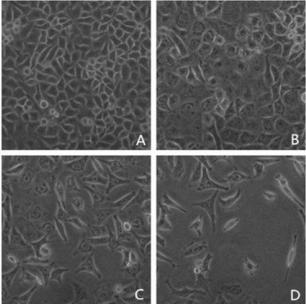
|
| 图3 光镜下观察Λ-OMe诱导 MGC-803细胞凋亡 |
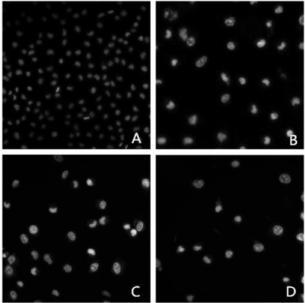
Hoec-hest33342对于细胞核染色质的形态学改变也是检测细胞凋亡的一个重要方法。为了验证配合物Λ对胃癌MGC-803的凋亡诱导作用,采用 Hoechest33342染色,在荧光显微镜下观察细胞核染色质的形态学改变,观察结果表明,对照组胃癌MGC-803其细胞核呈现弥散、均匀的荧光。加入配合物Λ后,胃癌MGC-803细胞的核染色质高度凝聚、边缘化,核内的荧光亮度增加,并且有不规则的核裂解现象,这种现象随着浓度的增加越来越明显,见图4。
|
| 图4 荧光显微镜下观察Λ-OMe诱导 MGC-803细胞凋亡 |
中医药对消化道肿瘤的治疗,主要以扶正固本、清热解毒、活血化瘀、消痰散结等方式,但现代临床治疗多配合以放化疗或介入,且均有相应的实验证明[16],这些治疗方法能提高机体免疫力,抑制肿瘤的生长和转移。在化疗药物的使用中,相对于其他金属配合物而言,手性钌配合物还具有丰富的光谱性质以及优异的抗菌、抗肿瘤等生物活性[17, 18, 19, 20]。在肿瘤的治疗过程中,使用化疗药物无可避免要关注其毒副作用,手性钌配合物Λ/Δ-OMe与端粒DNA的相互作用并诱导其形成G-四链体使得该类配合物在抗肿瘤方面具有了靶向性的潜在优势。笔者实验研究表明Λ-OMe具有良好的抗肿瘤活性,其对MGC-803细胞的增殖抑制能力在一定程度上强于顺铂,且对正常人胃黏膜上皮细胞的毒性很低,进一步研究表明其对胃癌MGC-803细胞的增殖抑制作用可能是通过诱导凋亡实现。鉴于手性钌配合物独特的结构和理化性质,为手性钌配合物结构优化和生物活性的作用机制以及临床开发应用提供了理论依据。但是其具体的抗肿瘤机制还待进一步研究。而且此类手性钌配合物是否能与中医药配合使用也待进一步研究。
| [1] | Cailleaux S, LoPes -Martins RA, Aimbire F,et al.Involvement of Platelet-activating factor in the modulationof vaseular tone in the isolated perfused rabbit kidney[J].Naunyn Schmiedebergs Arch Pharmacol, 1999,359(6):505-511 |
| [2] | Mendoza-Ferri MG,Hartinger CG,Mendoza MA,et al.Trans-ferring the concept of multinuclearity to rutheum complexesfor imProvement of anticancer activity [J].Med Chem,2009,52(4):916-925 |
| [3] | Heffeter P, JungwirthU, JakuPec M,et al.Resistance againstnovel anticancer metal compounds:differences andsimilarities[J]. Drug Resist UPdat, 2008,11(l-2):1-16 |
| [4] | 张小年,刘亚楠,杨晓新,等. 钌配合物诱导肿瘤细胞凋亡的信号通路及其作用机制[J].化学进展,2011,21(5):983-990 |
| [5] | Stevens SK, Strehle AP, Miller RL,et al. The anticancer ruthenium complex KP1019 induces DNA damage, leadingto cell cycle delay and cell death in Saccharomyces cerevisiae[J].Molecular Pharmacology,2013,83(1):225-234 |
| [6] | Chakree K,Ovatlarnporn C,Dyson PJ,et al. Altered DNABinding and Amplification of Human Breast Cancer Sup-pressor Gene BRCA1 Induced by a Novel Antitumor Com-pound, [Ru(η6-p-phenylethacrynate)Cl2(pta)][J].Interna-tional Journal of Molecular Sciences,2012,13(10): 13183-13202 |
| [7] | Heffeter P, Atil B, Kryeziu K, et al. The ruthenium compound KP1339 potentiates the anticancer activity ofsorafenib in vitro and in vivo[J]. European Journal of Cancer,2013,49(15): 3366-3375 |
| [8] | Rehmann JP, Barton JK. Proton NMR studies of tris(phenan-throline) metal complexes bound to oligonucleotides: char-acterization of binding modes[J]. Biochemistry, 1990, 29,1701-1709 |
| [9] | Eriksson MM, Leijon M, Hiort C,et al.Minor groove bindingof [Ru (phen)3]2 + to [d (CGCGATCGCG)]2 evidenced bytwo-dimensional NMR[J]. J.Am.Chem.Soc,1992,114: 493-494. |
| [10] | Mei WJ, Liu J, Zheng KC,et al.Experimental and theoretical study on DNA -binding andphotocleavage properties of chiral complexes Δ-and Δ-[Ru (bpy) 2 L](L=o-hpip,m-hpipand p-hpip)[J].Dalton Trans, 2003,32(7): 1352 -1359 |
| [11] | Kumar CV,Barton JK,Turro N J.Photophysics ofruthenium complexes bound to double helical DNA[J].J Am Chem Soc,1985,107: 5518-5520 |
| [12] | 刘亚楠,杨芳,梅文杰,等. 手性钌配合物的合成、抗肿瘤活性及其与血清蛋白的相互作用[J].高等学校化学学报,2010,31(3):435-441 |
| [13] | Shi S,Geng XT,Zhao J,et al.Interaction of[Ru( bpy)2( dppz)]2 +with human telomeric DNA: Preferential binding toG-quadruplexes over i-motif[J]. Biochimie, 2010,92:370-377 |
| [14] | Sun D,Liu Y,Liu D,et al.Stabilization of G -quadruplexDNA, inhibition of telomerase activity and live cell imagingstudies of chiral ruthenium(II)complexes[J].Chemistry,2012,18(14):4285-4295 |
| [15] | Mosmann T.Rapid colormetric assay for cellular growth andsurvial:applocation to proliferation and cytotoxicity assays[J].Immand Methods,1983,65:55-58 |
| [16] | 宋恩峰,张珏.消化道肿瘤的中医药治疗进展[C].中国中西医结合学会肿瘤专业委员会第三届国际中医、中西医结合肿瘤学术交流大会暨第十二届全国中西医结合肿瘤学术大会,2010:4. |
| [17] | Pahontu E,Julea F,Rosu T,et al.Antibacterial,antifungal andin vitro antileukaemia activity of metal complexes withthiosemicarbazones[J].Cell Mol Med, 2015,19(4);865-878. |
| [18] | Nitha LP, Aswathy R, Mathews NE, et al. Synthesis,spectroscopic characterisation, DNA cleavage, superoxidasedismutase activity and antibacterial properties of sometransition metal complexes of a novel bidentate Schiff basederived from isatin and 2-aminopyrimidine[J]. SpectrochimActa A Mol Biomol Spectrosc,2014,118:154-161. |
| [19] | Sun D, Zhang W, Lv M, et al. Antibacterial activity ofruthenium(II) polypyridyl complex manipulated by membranepermeability and cell morphology[J].Bioorg Med Chem Lett,2015,25 (10):2068-2073. |
| [20] | Malipeddi M, Lakhani C, Chhabra M, et al. An efficientsynthesis and in vitro antibacterial evaluation of rutheniumquinolinolcomplexes[J]. Bioorg Med Chem,2015,25(15):2892-2896. |
 2016, Vol. 35
2016, Vol. 35