文章信息
- 胡晓慧, 代向东, 李来来, 闫海峰, 王怡
- HU Xiao-hui, DAI Xiang-dong, LI Lai-lai, YAN Hai-feng, WANG Yi
- 生甘草与炙甘草的抗氧化能力比较研究
- Comparative study of antioxidant capacity between Shenggancao and Zhigancao
- 天津中医药大学学报, 2016, 35(2): 114-117
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(2): 114-117
- DOI: 10.11656/j.issn.1673-9043.2016.02.11
-
文章历史
- 收稿日期: 2015-11-10
甘草为多年生草本植物,主要栽培在内蒙古地区,来源于豆科(Leguminosae)甘草属(Glycyrrhizin)植物乌拉尔甘草(Glycyrrhizauralensis Fisch.)、胀果甘草(Glycyrrhiza inflate Bat.)或光果甘草(Glycyrrhiza glabra L.)的干燥根及根茎[1]。甘草的根和根茎主含三萜皂甙,其中60多种三萜类化合物,主要为甘草甜素,300多种黄酮素类化合物,多种香豆素类化合物,18种氨基酸,多种生物碱,多种有机酸和具网状内皮活性的甘草多糖等多种具免疫兴奋作用的多糖[2]。依据《全国中药饮片炮制规范》记载,先取原药材,除去杂质及芦头,大小条分开,浸泡至三四成熟,闷润至透,切厚片,干燥。蜜甘草:取炼蜜用适量开水稀释,加入甘草片拌匀,闷润,至锅内,用文火加热,炒至表面棕黄色,不黏手为度,取出放凉。在《中华人民共和国药典》(2010版)中记载,甘草按照干燥品计算,甘草苷不得少于0.5%,甘草酸不得少于2%。炙甘草中甘草苷不得少于0.5%,甘草酸不得少于1%。甘草炮制后其化学成分发生变化,药物的功效进而改变,生甘草清热解毒,炙甘草补脾益气,生甘草多用于解毒、抗菌,炙甘草抗疲劳和抗氧化作用更明显[3]。
自由基是指物质分子在光或热等外界条件影响下,共价键发生均裂,形成的含有不成对电子,它可以是原子、分子或者基团,生物体内自由基的产生和清除及氧化损伤与心血管疾病密切相关[4]。目前针对甘草抗氧化活性的报道较少,本实验通过1,1-二苯基-2三硝基苯肼(DPPH)清除自由基能力、铁子还原能力,总抗氧化能力和福林试剂法的测定,比较生甘草与炙甘草的抗氧化活性能力,为临床使用提供理论依据和物质基础。
1 仪器与试药 1.1 仪器多功能酶标仪(Enpire,美国Perkin Elmer 公司),XW-80A微型漩涡混合仪(上海沪西仪器厂有限公司),微量移液器(Eppendorf),Costar-3599 96孔细胞培养板(美国Costar公司)等。
1.2 试药 1.2.1 试剂抗坏血酸(天津市天新精细化工开发中心,分析纯20140910),DPPH(Sigma公司,101508320),三氯化铁(天津市赢达希贵化学试剂厂,分析纯20140929),铁氰化钾(天津市赢达希贵化学试剂厂,分析纯20130318),三氯乙酸(天津市福晨化学试剂厂,分析纯20150320),总抗氧化能力测试试剂盒(Solarbio公司,S0119),福林酚试剂(Solarbio公司),无水碳酸钠(天津市风船化学试剂科技有限公司),没食子酸标准品(中国药品制品检定所,纯度大于98%,20140909),磷酸盐缓冲液(PBS,0.01 mol/L,Solarbio,20131112),超纯水(Milli-Q)其余试剂均为色谱纯。
1.2.2 药材生甘草浸膏(中新药业),炙甘草浸膏(中新药业)。
实验使用的生甘草浸膏和炙甘草浸膏均为水提物,药厂提供生甘草与炙甘草浸膏,生甘草生药的浓度与炙甘草生药的浓度一致,生甘草出膏率为28.65%,炙甘草出膏率为30.03%,通过甘草浸膏和生药材的折换率计算得知,生甘草浸膏浓度为243.525 g/L,炙甘草浸膏浓度为255.255 g/L,通过实验性溶解最终确定生甘草和炙甘草浸膏的最大溶解度为250 g/L,由于浸膏折算生药后的浓度差异无统计学意义,为比较生甘草与炙甘草的体外抗氧化活性,实验选用生甘草浸膏和炙甘草浸膏的浓度为250 g/L。
2 方法 2.1 配制生甘草浸膏与炙甘草浸膏溶液精密称取生甘草和炙甘草浸膏750 mg,置于15 mg离心管中,加入超纯水3 mL,配制浓度为250 g/L的生甘草和炙甘草溶液,先经超声30 min,使用频率100 Hz,之后使用离心机以3 500 r/min离心5 min,取上清液用于实验。
2.2 生甘草与炙甘草对DPPH自由基清除能力的测定将样品溶液以每孔100 μL依次加到96孔板中,以每孔100 μL加入浓度为0.16 g/L的DPPH溶液;将100 μL甲醇与100 μL样品溶液混匀,作为空白对照组;最后将100 μL甲醇与100 μL的DPPH溶液均匀混合,以每孔200 μL依次加入,作为阴性对照组;使用浓度为0.2 g/L的维生素C作为母液,稀释8个梯度,按上文步骤测定。在37 ℃下充分反应50 min,在517 nm波长下测定A值,平行操作3次。清除率计算公式K=[1-(A1-A2)/A0]×100%,其中A1是测定样品组对应的A值,A2是测定空白对照组对应的A值,A0是阴性对照组对应的A值[5]。
2.3 生甘草与炙甘草对铁离子还原能力的测定 2.3.1 没食子酸标准曲线的制备精密称取没食子酸(GAE)标准品,分别配制10个浓度的样品溶液。分别取不同浓度的样品0.2 mL,分别加入1 mL PBS(pH 7.2)和1 mL铁氰化钾(1%,w/v),混合均匀后在50 ℃水浴锅中加热20 min。后加入1 mL三氯乙酸(10%,w/v)均匀混合后,取上清液1 mL加入1 mL超纯水,加入0.2 mL的氯化铁溶液(0.1%,w/v),室温静置30 min,在700 nm波长下测定吸光度,以甲醇-水代替没食子酸作为空白组,以没食子酸的浓度(X)为横坐标,吸光度(Y)为纵坐标,根据Y=0.005 5X+0.073 9(r2=0.998)绘制没食子酸的标准曲线。
2.3.2 没食子酸当量的计算分别取生炙甘草溶液20 μL,加入980 μL甲醇配制成1 mL溶液,分别取0.2 mL,实验步骤同没食子酸标准曲线制备,样品制备3份且3次平行实验。在700 nm下测定其吸光度,利用回归方程求出供试品溶液中折合没食子酸的浓度,即没食子酸当量。空白对照组:最后步骤不加0.2 mL的氯化铁溶液,用200 μL超纯水代替[6]。
2.4 生甘草与炙甘草总抗氧化能力的测试 2.4.1 ABTS工作液的配制用移液器精密取200 μL的ABTS溶液和200 μL氧化剂溶液,配制ABTS工作母液。室温避光存放12~16 h后使用,在3 d内稳定。在使用前,把ABTS母液用PBS稀释30倍即ABTS工作液。
2.4.2 绘制标准曲线使用PBS稀释标准品,把10 mmol/L Trolox溶液稀释成0.15、0.3、0.6、0.9、1.2、1.5 mmol/L。在96孔板的每个检测孔中加入200 μL的ABTS工作液。空白对照孔加10 μL的PBS溶液;标准曲线检测孔内加入10 μL的Trolox标准溶液;样品检测孔内加入10 μL各种样品,轻轻混匀[7]。室温孵育6 min后测定其A值,测定波长为734 nm。
2.5 生甘草与炙甘草的抗氧化能力 2.5.1 福利试剂实验中没食子酸标准曲线的制备分别取没食子酸溶液,用甲醇稀释到浓度为10个浓度,分别取100 μL没食子酸溶液加入500 μL福林显色试剂,均匀涡旋30 s,加入400 μL的碳酸钠溶液,在30 ℃下反应90 min,使用96孔板进行检测,每孔加入200 μL混合液体,每个浓度平行测试3组,波长765 nm,以待测液的溶剂为空白对照组[8]。
2.5.2 药物的含量测定精密取生甘草浸膏溶液和炙甘草浸膏溶液各100 μL加入500 μL福林试剂,均匀涡旋30 s,加入碳酸钠溶液400 μL,30 ℃条件下反应90 min,用移液器取200 μL于96孔板中,药物制备3份且平行实验3次。按照标准曲线方法的波长测定其吸光度。
2.6 统计学方法利用SPSS 17.0分析软件进行统计分析,组间比较采用单因素方差分析,实验结果以P<0.05为显著性差异,绘图软件使用Graphpad Prism Version5.0。
3 结果 3.1 生甘草与炙甘草清除DPPH自由基能力的比较实验采用体外清除DPPH自由基法[1],通过SPSS 17.0分析软件分析IC50作为指标,结果见表1。
| 样品 | n | IC50 |
| 生甘草浸膏溶液 | 9 | 0.6735±0.0639** |
| 炙甘草浸膏溶液 | 9 | 0.5389±0.0649**## |
| 维生素C溶液 | 9 | 0.0069±0.0002 |
| 注:与维生素C比较,**P<0.01,与生甘草比较,##P<0.01。 | ||
通过实验比较生甘草与炙甘草对铁离子的还原能力,结果见表2。
实验以Trolox的浓度(X)为横坐标,吸光度(Y)为纵坐标,绘制Trolox溶液的标准曲线。$\hat{Y}$=-0.685 8X+1.059 5(r2=0.999 1)。见图1。

|
| 图1 不同浓度标准品总抗氧化能力测试的标准曲线 |
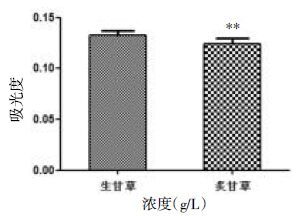
通过ABTS方法比较生甘草与炙甘草对自由基的清除能力,经过SPSS17.0分析软件分析,根据Trolox标准曲线,比较炙甘草与生甘草的体外抗氧化能力,炙甘草总抗氧化能力强于生甘草(P<0.01),实验结果见图2。
|
| 与生甘草比较,**P<0.01。 图2 总抗氧化能力测试结果 |
用没食子酸标准品的浓度(X)为横坐标,吸光度(Y)为纵坐标,绘制没食子酸的标准曲线,回归方程为$\hat{Y}$=0.004 3X+0.098 6(r2=0.992 3),在1~500 mg/L围内与吸光度呈良好的线性关系。没食子酸溶液标准曲线结果见图3。

|
| 没食子酸浓度(mg/L) 图3 没食子酸溶液的标准曲线 |
实验采用福林试剂法,对生甘草和炙甘草的总酚酸含量进行了测定,实验结果见图4,经SPSS 17.0分析软件统计数据,虽然生甘草与炙甘草没有显著性差异但炙甘草的总酚酸含量高于生甘草的含量。

|
| 图4 福林试剂法测试结果 |
研究表明外环境和内环境中某些化学物质进入机体后参与代谢过程,产生大量活性氧自由基、内源性抗氧化物质减少甚至耗竭,导致脂类、蛋白质等生物大分子的改变,进而引发疾病,抗氧化剂在体外实验中均有清除自由基的作用[9]。抗氧化剂可抑制活性氧自由基产生或清除体内有害的自由基,减少肿瘤、炎症和心血管疾病等退行性疾病。抗氧化能力的评价需要一定条件,如自由基近似于生物体体系,实验的重复性强,进行常规质量控制等[10]。有学者提出自由基反应是人体衰老的内在机制之一,通过抑制自由基的过氧化反应,可提升人体的抗氧化能力,对中药的抗氧化研究也将成为心血管领域的切入点[11]。甘草味甘,其主要化学成分为三萜皂苷类、黄酮类和多糖类化合物,作为补益的方药多体现在对气血阴阳的调节作用[12]。
DPPH是一种以氮为中心的稳定的自由基,加入抗氧化剂时DPPH的单电子被配对,溶液颜色与配对电子数呈剂量相关性[13],铁离子还原法中药物的还原能力与普鲁士蓝生成量成正比[14],ABTS+·是一种稳定的自由基,在抗氧化剂的作用下形成绿色的ABTS,最大吸收峰在734 nm,Trolox当量与药物的抗氧化能力成反比[15]。福林试剂在碱性条件下可被酚类化合物还原呈现蓝色,在765 nm波长处有最大吸收峰,实验以没食子酸为标准品折算总酚酸含量比较其抗氧化能力[16],本实验中炙甘草的抗氧化能力大于生甘草。结合以上实验说明炙甘草的抗氧化作用大于生甘草,甘草经过炮制其抗氧化作用有所增强,其他药理作用可进一步研究。
在国际市场中甘草的市场份额和出口需求将逐年增长[17],中药的抗氧化作用的开发利用在医疗卫生和护肤美容等方面均有应用,但其化学成分和物质基础的研究还需进一步深入[18]。
| [1] | 高学敏.中药学(新世纪第2版)[M].北京:中国中医药出版社,2007:96. |
| [2] | 李 薇,宋新波,张丽娟,等,甘草中化学成分研究进展[J].辽宁中医药大学学报,2012,14(7):40-44. |
| [3] | 孙付军,周 倩,王春芳,等,甘草炮制前后药效学比较[J].中国实验方剂学杂志,2010,16(14):115-118. |
| [4] | 李向荣.抗氧化剂和自由基与血清白蛋白相互作用的微量热和谱学研究[D].新乡:河南师范大学,2014:1-6. |
| [5] | 李 晋,胡 月,葛爱华,等.丹红、丹参和红花3种注射液抗氧化活性比较研究[J].天津中医药大学学报,2015,34(1): 37-41. |
| [6] | 李艳霞,贾华丽,谢建平,等.铁氰化钾分光光度法测定药物中维生素B1含量[J].分析科学学报,2014,30(2):294-296. |
| [7] | 张文彬,龚海英,张 丽,等.天然产物抗氧化活性体内外评价方法[J].武警后勤学院学报:医学版,2013,22(11):1035-1038. |
| [8] | 游见明,曹新志.福林酚法测定茶树中茶多酚的分布水平[J].湖北农业科学,2013,52(10):2417-2419. |
| [9] | Yen WJ, Chang LW, Lee CP, et al. Inhibition of lipid peroxidation and nonlipid oxidative damage by carnosine[J].Jaocs,2002,79(4):329-333. |
| [10] | Rossum TGU, Vulto AG, Man RAD, et al. Review article: glyeyrhizin as a potential treatment forehroniehe Patitis C[J]. Aliment Pharmaeol Ther, 1998,12(2):199-200. |
| [11] | 袁 蓉, 郭丽丽, 郜凤香.痰瘀与自由基的关系探讨[J].天津中医药大学学报, 2014, 33(4): 242-245. |
| [12] | Wang XT, Zhang H, Chen LL, et al. Liquorice, a unique guide drug of traditional Chinese medicine:A review of its role in drug interactions[J]. Journal of Ethnopharmacology,2013(150):781-790. |
| [13] | 邓 薏.近5年国内中药抗氧化作用研究进展(上)[J].中药药理与临床,2012,28(6):155-162. |
| [14] | 曾维才,石 碧.天然产物抗氧化活性的常见评价方法[J].化工进展,2013,32(6):1205-1213. |
| [15] | 丁亚芳,何 静,杨 静,等.总氧自由基清除能力法研究进展[J].中药材,2014,37(8):1495-1499. |
| [16] | 李培源,霍丽妮,苏 炜,等.总抗氧化能力检测试剂盒(ABTS)法测定江南星蕨的抗氧化活性[J].中国实验方剂学杂志,2011,17(1):162-164. |
| [17] | 卜彦花,周娜娜,王春悦,等.福林酚试剂法和紫外分光光度法测定冬枣多酚含量的比较研究[J].中国农学通报,2012,28(1):212-217. |
| [18] | 孙伟燕,韩明丽.中药抗氧化作用的研究进展[J].齐鲁药事,2010,29(3):161-163. |
 2016, Vol. 35
2016, Vol. 35