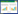文章信息
- 张谦, 刘志东, 秦璐, 顾星, 冯光维
- ZHANG Qian, LIU Zhi-dong, QIN Lu, GU Xing, FENG Guang-wei
- 丹参酮I固体脂质纳米粒的制备及评价
- Preparation and evaluation of Tanshinone I solid lipid nanoparticles
- 天津中医药大学学报, 2016, 35(2): 118-121
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(2): 118-121
- DOI: 10.11656/j.issn.1673-9043.2016.02.12
-
文章历史
- 收稿日期: 2015-11-18
2. 天津中医药大学, 天津市现代中药重点实验室一省部共建国家重点实验室培育基地, 天津 300193
2. Tianjin State Key Laboratory of Modern Chinese Medicine, Tianjin University of TCM, Tianjin 300193, China
据报道丹参酮具有极为广泛的药理作用,随着不断地研究深入,发现丹参酮具有较强的抗肿瘤作用[1],其中丹参酮Ⅰ、丹参酮ⅡA等成分能够抑制血液恶性肿瘤细胞的生长并且促进其凋亡 [2];此外丹参酮亦具有较强的抗心肌缺血缺氧,改善微循环,增加血流量的作用 [3],此作用在临床上得到广泛应用。丹参酮Ⅰ是丹参提取物中有效的脂溶性成分,不仅具有天然的抗氧化、抗菌消炎的作用,还具有较强的心血管作用[4]。由于丹参酮Ⅰ在水中难溶,不利于给药吸收。曾有人将其制成固体分散物以提高疗效,但事与愿违,实验结果并不理想[5, 6]。固体脂质纳米粒(SLN)作为一种新型的给药系统载体,具有物理稳定性好,药物包封率高,无毒以及生物可降解等特性[7]。本次实验将丹参酮Ⅰ制备成为SLN,并考察其粒径、电位,包封率等理化性质,以确保制剂的质量和安全性,保障下一步实验研究的顺利进行。
1 仪器与试剂 1.1 仪器SPD-10Avp岛津高效液相色谱仪(HPLC,日本Shimadzu);磁力搅拌(巩义市予华仪器有限责任公司),低速台式离心机(长沙湘仪离心机仪器有限公司),GM-0.33II型沸腾隔膜真空泵(天津Autoscience公司),C3860A超声清洗器(天津Autoscience公司),AX205电子天平(Mettler Toledo,瑞士),激光粒径测定仪(马尔文,英国),Jade DSC差示扫描量热仪(Perkin-Elmer,美国),冷冻干燥机(FDU-2100,日本),Milli-Q超纯水系统(Millipore,美国)。
1.2 试剂丹参酮Ⅰ对照品(天津中新药业,批号W13-0-1,含量≥98%),大豆卵磷脂(Lipoid S100,美国,批号79580-41/904),单硬脂酸甘油酯(天津光复精细化工研究所),ATO888(Gattefosse,法国),Myrj52(南京威尔化工有限公司,批号20130706),甲醇(天津康科德科技有限公司),无水乙醇(天津康科德科技有限公司),三氯甲烷(天津康科德科技有限公司)、三氯甲烷、乙醇均为分析纯,甲醇为色谱纯。
2 方法与结果 2.1 丹参酮Ⅰ-SLN的制备采用乳化固化法制备丹参酮Ⅰ-SLN。称取处方量的丹参酮Ⅰ、大豆卵磷脂和单硬酸甘油酯溶于适量的无水乙醇中,另称取ATO888适量,并加入少量的氯仿使之溶解,将无水乙醇和氯仿混合,搅拌加热使之完全混合构成油相。称取适量的Myrj52加入超纯水,74 ℃水浴搅拌加热至完全溶解,构成水相。将水相放入在74 ℃水浴中磁力搅拌,缓缓加入油相,继续搅拌直至体积浓缩至原来的1/3。放入4 ℃冰箱中冷藏2 h,过0.22 μm的微孔滤膜,得到丹参酮Ⅰ固体脂质纳米粒混悬液[8]。制剂呈红棕色,澄清半透明,并伴有乳样光泽。
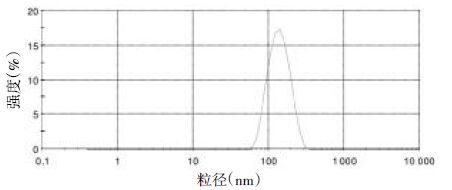
2.2 粒径、电位的测定取丹参酮Ⅰ-SLN 100 μL,并用超纯水稀释15倍。激光粒径测定仪测定其粒径、电位。得到丹参酮Ⅰ-SLN的平均粒径为(128±2.00) nm;电位为(-9.35±0.12) mV;PDI值为(0.16±0.07)。粒径、电位图如图1、图2所示。
|
| 图1 丹参酮Ⅰ-SLN粒径分布图 |
|
| 图2 丹参酮Ⅰ-SLN电位分布图 |
色谱柱:Diamond DIKMAODS C18(200 mm×4.6 mm,5 μm);流动相:甲醇-水(90∶10,V/V);紫外检测波长:244 nm;流速:1 mL/min;柱温:30 ℃;进样量:20 μL。
2.3.2 专属性考察分别取空白制剂、对照品溶液按照上述色谱条件进样,得到色谱图。根据色谱图可知,在丹参酮Ⅰ的出峰时间处空白制剂未出峰,说明在此色谱条件下,制剂中各种辅料对丹参酮Ⅰ无干扰,此分析方法专属性良好。
2.3.3 标准曲线的绘制精密称取丹参酮Ⅰ对照品适量,用甲醇溶解并稀释成浓度分别为0.532、2.660、6.384、10.640、15.960 mg/L的标准供试液。按照上述色谱条件,进样20 μL,记录峰面积,以样品色谱峰面积A对浓度c(mg/L)进行线性回归。得到标准曲线的回归方程为A=218 229c-11 222,r2=0.999,表明丹参酮Ⅰ在0.532~15.960 mg/L浓度范围内线性关系良好。
2.3.4 精密度考察选取低、中、高3个浓度的标准品溶液1 d内重复测定3次,计算日内相对标准偏差;连续测定3 d,求算日间相对标准偏差。结果见表1。结果表明,日内、日间相对标准偏差均小于2%,精密度符合方法学要求。
| 浓度(mg/L) | 日间 | 日内 | ||
| 平均值(mg/L) | RSD(%) | 平均值(mg/L) | RSD(%) | |
| 2.660 | 2.672 | 0.12 | 2.694 | 0.74 |
| 6.384 | 6.340 | 0.19 | 6.362 | 0.31 |
| 10.640 | 10.568 | 0.21 | 10.649 | 0.67 |
采用超滤离心法测量丹参酮Ⅰ-SLN的包封率。取制剂200 μL,加超纯水稀释15倍,涡旋混匀后置于超滤离心管内,5 000 r/min,离心20 min,游离药物存在于外管中。即取外管样品进样检测,即为W游;另取200 μL的纳米粒加入甲醇2.8 mL超声10 min破乳,5 000 r/min,离心20 min,离心后取上清液进样,HPLC测定,即为W总。根据公式EE(%)=(W总-W游)/W总×100计算制剂中丹参酮Ⅰ的包封率。测得丹参酮Ⅰ的包封率为(74.03±1.32)%。
2.5 重复性实验按照处方量制备3批丹参酮Ⅰ-SLN,并对其粒径、电位和包封率测定评价。结果见表2。
| 样品 | n | 1 | 2 | 3 | Aver |
| 粒径(nm) | 3 | 126.10 | 127.80 | 130.10 | 128±2.00 |
| 电位(mV) | 3 | -9.23 | -9.35 | -9.47 | -9.35±0.12 |
| 包封率(%) | 3 | 73.57 | 75.52 | 73.00 | 74.03±1.32 |
由上述数据可知,制得的3批样品粒径均一,电位和包封率稳定,说明该处方制剂重复性良好。
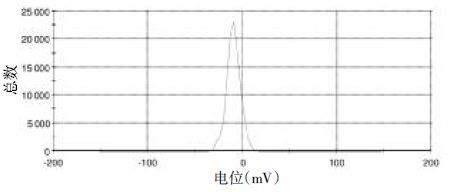
2.6 差式扫描量热法(DSC)分析分别取丹参酮Ⅰ标准品、丹参酮Ⅰ-SLN、空白固体脂质纳米粒以及物理混合物(空白纳米粒∶丹参酮Ⅰ=3∶2)的冻干品,采用差式扫描热量方法对其进行检测。以空铝坩埚为对照,另取坩埚放入5~10 mg的样品,设定升温速率为25 ℃/min,扫描范围为30~300 ℃。得到各个样品的DSC如图3。
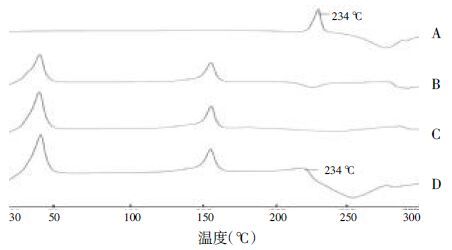
|
| A:丹参酮Ⅰ标准品;B:丹参酮Ⅰ-SLN;C:空白-SLN;D:物理混合物(空白纳米粒∶丹参酮Ⅰ=3∶2) 图3 丹参酮Ⅰ及丹参酮Ⅰ-SLN 的DSC图 |
从图3中可以看出,A中显示丹参酮Ⅰ标准品在234 ℃处出现熔融吸热峰;B、C中该峰消失,但在46 ℃和155 ℃时出现较强的熔融吸热峰,说明这俩个峰为制剂的特征峰;在丹参酮Ⅰ与空白SLN的物理混合物D中也明显见到234 ℃的吸热峰的出现,并具有制剂特征峰。物理混合物中可见制剂的特征吸热峰,并在234 ℃出现了丹参酮Ⅰ的特征峰。与文献中保持一致,由此可以说明丹参酮Ⅰ在制备成纳米粒后被包裹于其中,丹参酮Ⅰ在纳米粒中不是以晶体的形态存在,而是以分子分散状态存在[9]。
3 讨论固体脂质纳米粒的常用制备方法有高压乳匀法、微乳法、乳化固化法和超声分散法[10]。本次实验采用乳化固化法制备丹参酮Ⅰ固体脂质纳米粒,该制备方法具有操作简便,制备快速,对仪器的要求低等特点。在此方法下制备出的纳米粒,外观良好,粒径适中,重现性好。前期处方优化过程发现表面活性剂的性质和用量,脂质材料的性质及用量,投药量均能对制剂的粒径、电位和包封率产生显著影响。脂质材料的物理化学结构,可混合性以及药物在熔融脂质中的溶解度均为选择脂质材料时所需考虑的因素[11]。处方中选用的ATO888符合实验要求。实验中曾用无水乙醇溶解ATO888,但效果不佳,仅在加热时能够勉强溶解。在此状态下制备而成的纳米粒较为浑浊,粒径较大,且分布不均。山嵛酸甘油酯在氯仿中有较好的溶解性[12],故选用氯仿作为溶解剂。考虑到氯仿有毒性,因此氯仿用量较小,以能够充分溶解处方量的ATO888为宜。并且在制备过程中,氯仿会随之蒸发,使得纳米粒中的氯仿无残留。经实验证明,用氯仿溶解ATO888后制得的纳米粒澄清透明,并伴有乳样光泽。由于无水乙醇毒性较低,故选择无水乙醇溶解丹参酮Ⅰ和大豆卵磷脂。
固体脂质纳米粒是一种多相分散体系,在储存过程中存在药物降解或是粒径增大等问题。通过对Zeta 电位的测定评价胶体分散体系的稳定性。一般来说,较高的Zeta 电位可通过粒子间电荷斥力降低粒子之间的凝聚[13]。本次实验,测得丹参酮Ⅰ-SLN的电位为(-9.35±0.12) mV,由于电荷间相互影响,相同的负电荷存在较强的排斥作用,使得带电粒子存在较好的稳定性[14]。
丹参酮Ⅰ作为丹参脂溶性有效成分中的代表成分,具有众多的药理作用,能够预防肝细胞损伤及诱导多种癌细胞凋亡[15]。众多报道中丹参酮ⅡA的抗肿瘤作用已被证实,认可。但在治疗卵巢癌和前列腺癌上,丹参酮Ⅰ的抑制生长和诱导凋亡的作用要强于丹参酮ⅡA[16]。因而,对丹参酮Ⅰ的研究有待于提高,需开发其更多的药理作用,寻找更优剂型,推动新药发展。
| [1] | 李建恒, 乔亚君, 侯力峰,等. 丹参脂溶性有效成分丹参酮研究进展[J].河北大学学报:自然科学版,2015,35(2):217-224. |
| [2] | Li H, Zhang Q. Growth-inhibitory and apoptosis-inducing effects of transhinones on hematological malignancy cells and their structure-activity relationship[J]. Anti-Cancer Drug,2012,23(8):846. |
| [3] | 王 昕. 丹参酮药理研究及临床应用进展[J]. 光明中医,2011,26(7):1514-1517. |
| [4] | 郭丽丽,范丽丽,王爱潮,等. 丹参酮I脂质体的制备及表征[J].天津中医药,2015,32(5):308-311. |
| [5] | 钱名望,杨保津,顾文华,等.丹参有效成分的研究[J].化学学报,1978,36(3): 199-205. |
| [6] | 储茂泉,古宏晨,刘国杰.丹参酮固体分散物的研究[J].华东理工大学学报, 2001,27(2): 200-203. |
| [7] | 刘建平, 杜志永, 朱 丽. 丹参酮ⅡA固体脂质纳米粒的体外释药和大鼠肠吸收特性的研究[J]. 中国药理学通报,2005,21(2):186-190. |
| [8] | Li JW,Guo XJ,Liu ZD,et al. Preparation and evaluation of charged solid nanoparticles of tetrandrine for ocular drug deliver system: pharmacokinetics, cytotoxicity and cellular uptake studies[J]. Drug Development and Industrial Pharmacy, 2013,79(5):58. |
| [9] | 张继东,万江陵. 丹参酮ⅡA固体脂质纳米粒及体外释药[J].中国医院药学杂志,2014,32(6):431-436. |
| [10] | 孙远南. 新型纳米给药系统-纳米结构脂质载体的研究进展[J]. 海峡药学,2010,22(11):13-16. |
| [11] | Muller RH, Mader K, Gohla S.Soild lipid nanoparticles (SLN) for controlled drug delivery-a review of the state of the art[J]. European Journal of Pharmaceutics and Biopharmaceutics,2000,50(1):161-177. |
| [12] | 瞿继兰,刘志东,郭秀君,等.丹参酮ⅡA固体脂质纳米粒的制备及质量评价[J].天津中医药,2014,31(9):564-566. |
| [13] | Uner M, Yener G. Importance of solid lipid nanoparticles (SLN) in various administration routes and future perspectives[J]. International Journal of Nanomedicine, 2007,2(3):289-300. |
| [14] | 刘德育,罗德凤,叶建涛. 人参皂苷Rd固体脂质纳米粒的制备[J].中国医院药学杂志,2010,30(1):25-31. |
| [15] | 陈 坚,林庚金.丹参抗肿瘤的研究进展[J].复旦大学学报(医学版),2003, 30(6):626-628. |
| [16] | Wang L, Liu A, Zhang FL,et al. Evaluation and SAR analysis of the cytotoxicity of tanshinones in colon cancer cells[J]. Chinese Journal of Natural Medicines, 2014,12(3):167-171. |
 2016, Vol. 35
2016, Vol. 35