文章信息
- 金施施, 牛换云, 丁辉, 武婕, 余河水, 李薇, 曹满, 宋新波
- JIN Shi-shi, NIU Huan-yun, DING Hui, WU Jie, YU He-shui, LI Wei, CAO Man, SONG Xin-bo
- 正交实验法优化番泻叶的提取工艺
- The orthogonal experiment method to optimize the extraction process of senna
- 天津中医药大学学报, 2016, 35(2): 122-125
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(2): 122-125
- DOI: 10.11656/j.issn.1673-9043.2016.02.13
-
文章历史
- 收稿日期: 2015-11-14
2. 天津中一制药有限公司, 天津 300193
2. Tianjin Zhongyi Pharmaceutical Co.Ltd,Tianjin 300193, China
番泻叶是豆科植物狭叶番泻(Cassia angustifolia Vahl)或尖叶番泻(Cassia acutifolia Lelile)的干燥小叶。其性甘、苦、寒,归大肠经,具有泻热行滞、通便、利水之效。用于治疗热结积滞、便秘腹痛、水肿胀满[1]。近年来,其被广泛用于直肠检查、术前清洁肠道以及各种便秘,是全世界应用广泛的导泻剂。狭叶番泻叶含番泻苷A、B、C、D、芦荟大黄素双蒽醌苷、大黄酸葡萄糖苷、芦荟大黄素-8-葡萄糖苷、大黄酸、芦荟大黄素[2]。尖叶番泻叶含番泻苷A、B、C、芦荟大黄素-8-葡萄糖苷、大黄酸-1-葡萄糖苷、大黄酸-8-葡萄糖苷、芦荟大黄素、大黄酸[3]。此外,番泻叶中尚含有大黄酸-8-双葡萄糖苷、大黄酸蒽醌-8-葡萄糖苷、初级苷[4]。药理研究表明,番泻叶致泻的有效成分为蒽苷,其主要泻下成分为番泻苷A、B,番泻苷A、B在肠道多种细菌的作用下,通过不同的代谢途径,降解为大黄酸蒽酮,产生缓泻作用。此外番泻叶还具有止血、肌肉松驰与解痉以及抗胃黏膜损伤等作用[5]。番泻叶可刺激盆腔神经,并使盆腔器官充血,故月经期及妊娠妇女慎用或忌用。长期、大剂量服用番泻叶及其制剂能引起肠黏膜损伤及肠道神经组织的损伤,有一定成瘾性[6]及肝毒性[7]。传统对番泻叶的提取方法主要有:沸水煎煮、沸水浸泡、醇回流及超声提取等,在番泻叶提取过程中,温度对番泻苷有影响,可导致番泻苷降解。Lainonen等[8]和张阳等[9]研究发现,番泻苷在高温下长时间加热含量大量下降。陈丹丹等[10]研究番泻苷B的稳定性结果显示,温度对番泻苷B的含量亦有影响。本实验选取碳酸氢钠溶液作为提取溶剂,采用搅拌提取法,以番泻苷A、B的含量为指标,在单因素考察的基础上,进行正交实验优选最佳提取工艺,旨在筛选出简单、高效、稳定、可行的番泻苷提取方法。
1 仪器与材料LC-2010 AHT高效液相色谱仪(日本岛津公司),色谱柱 Megres C18(4.6 mm×250 mm,5 μm,江苏汉邦科技有限公司),磁力搅拌器(北京中西远大科技有限公司),分析天平(梅特勒-托利多国际贸易上海有限公司),,JD-A-10L超纯水仪(北京净道科技有限公司)。
番泻叶,购自安国药材市场,经天津中医药大学张丽娟教授鉴定为豆科植物狭叶番泻(Cassia angustifolia Vahl)的干燥小叶,番泻苷A标准品(天津一方科技有限公司,批号20121096,纯度大于98%)、番泻苷B标准品(天津一方科技有限公司,批号20121100,纯度大于98%),乙腈(色谱纯,美国Fisher Scientific公司),水为超纯水,其他试剂均为分析纯。
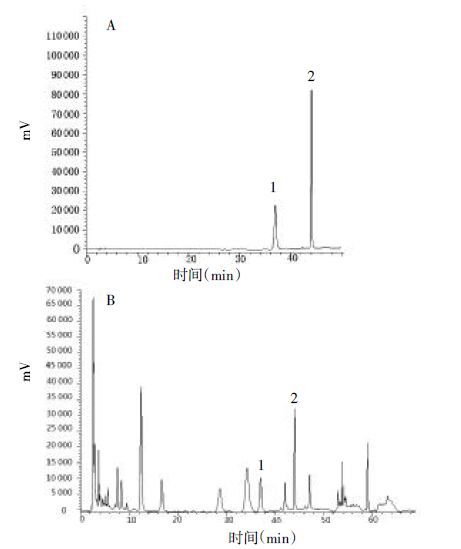
2 实验方法与结果 2.1 番泻苷A和番泻苷B分析方法的建立 2.1.1 色谱条件色谱柱:Megrace C18(4.6 mm×250 mm,5 μm)。流动相:乙腈(A)与0.7%磷酸-水(B)梯度洗脱,洗脱程序:0~30 min,A 15.5%。30~48 min,A 15.5%~30%;48~68 min,A 30%~58%。流速:1 mL/min。检测波长:254 nm。柱温:30 ℃。进样量:10 μL。在该色谱条件下,基线漂移较小,对照品番泻苷A和番泻苷B分离效果较好,色谱峰峰形好,供试样品色谱峰分布均匀,且保留时间稳定,见图1。
|
| A图:混合对照品;B图:供试品;1:番泻苷B;2:番泻苷A 图1 混合对照品和供试品色谱图 |
精密称取番泻苷A、番泻苷B对照品适量,分别置于5 mL容量瓶中,加0.1%碳酸氢钠溶液至溶解完全,定容至刻度,摇匀,分别配制成浓度为223、209 mg/L的对照品溶液,备用。
2.1.3 供试品溶液的制备精密称取番泻叶中粉2.00 g,置具塞锥形瓶中,精密加入0.1%碳酸氢钠200 mL,称定质量,超声处理30 min,放冷,补足减失的质量,摇匀,取上清液,过0.45 μm微孔滤膜,取续滤液,即得。
2.2 方法学考察 2.2.1 线性关系考察分别取番泻苷A 223 mg/L、番泻苷B 209 mg/L的对照品储备液适量,加0.1%碳酸氢钠稀释成番泻苷A:223~13.94 mg/L,番泻苷B:209~13.1 mg/L的一系列对照品溶液。按2.1色谱条件进行测定,以峰面积积分值为纵坐标(Y),以质量浓度为横坐标(X)绘制标准曲线,回归方程分别为:番泻苷A为$\hat{Y}$=1 186 373.32X-612.96(r=0.999 9),番泻苷B为$\hat{Y}$=1 148 336.11X-891.45(r=0.999 9)。表明番泻苷A和番泻苷B分别在13.9~223 mg/L、13.1~209 mg/L范围内线性良好。
2.2.2 精密度实验精密吸取番泻苷A和番泻苷B混合对照品溶液,进样10 μL,连续进样6次,按2.1色谱条件进行测定,计算得峰面积的RSD分别为0.199%、0.26%,表明仪器稳定性良好。
2.2.3 重复性实验取番泻叶提取物6份,精密称定,按供试品溶液制备方法制备样品,在2.1色谱条件下,测定6份样品中番泻苷A、B的含量,计算峰面积的RSD值分别为0.245%、0.267%。
2.2.4 稳定性实验取供试品溶液,分别于制备后2、4、6、8、10、12 h进样检测,按2.1色谱条件进行测定,计算峰面积的RSD分别为1.57%、1.66%,表明供试品溶液在12 h内稳定。
2.2.5 加样回收率实验精密称定同一批番泻叶样品6份,每份0.5 g,分别精密加入番泻苷A标准品36.3 μg,番泻苷B标品 41.5 μg,按供试品溶液制备方法制备样品,进行测定,计算回收率。所得平均回收率番泻苷A为97.9%,RSD=1.08%;番泻苷B为99.4%,RSD=1.73%,表明回收率符合要求。
2.3 工艺优化 2.3.1 提取溶剂的选择综合文献参考及适合生产应用,选取乙醇、水、碳酸氢钠3种溶剂进行筛选,取3份番泻叶中粉各1 g,精密称定,分别加入50%乙醇、水、碳酸氢钠各100 mL,称定质量,分别在相同条件用磁力搅器搅拌提取1 h,放冷,补加溶剂至原质量,取上清液,过0.45 μm滤膜,取续滤液,进样,检测。并计算番泻苷A 和番泻苷B的含量。结果表明碳酸氢钠提取效果最好,见表1。
精密称取5份番泻叶中粉各2 g ,放入锥形瓶内,分别加入浓度为0.05%、0.1%、0.5%、1%、3%的碳酸氢钠各200 mL,称定质量,锥形瓶加盖密封,相同条件下用磁力搅拌器搅拌提取1 h,放冷,补足质量,取上清液,过0.45 μm滤膜,取续滤液,进样。测定总番泻苷A、番泻苷B的含量。结果表明0.5%碳酸氢钠提取效果最好,见表2。
| 提取溶剂(%) | 番泻苷A+番泻苷B浓度(mg/L) |
| 0.05 | 92.8 |
| 0.10 | 96.5 |
| 0.50 | 105.7 |
| 1.00 | 104.8 |
| 3.00 | 104.1 |
在确定了提取溶剂、碳酸氢钠浓度的基础上,对影响提取的其他主要因素:提取温度(A)、提取时间(B)、提取溶剂用量(C)进行正交实验优选,每次实验用番泻叶中粉2 g,采用L9(34)进行正交实验[11, 12, 13, 14]。因素水平设计见表3,结果见表4、表5。
| 实验号 | 1 | 2 | 3 | 4 | 番泻苷A+番泻苷B含量(mg/g) |
| A | B | C | |||
| 1 | 1 | 1 | 1 | 1 | 9.87 |
| 2 | 1 | 2 | 2 | 2 | 9.92 |
| 3 | 1 | 3 | 3 | 3 | 10.64 |
| 4 | 2 | 1 | 2 | 3 | 9.96 |
| 5 | 2 | 2 | 3 | 1 | 10.98 |
| 6 | 2 | 3 | 1 | 2 | 9.67 |
| 7 | 3 | 1 | 3 | 2 | 10.13 |
| 8 | 3 | 2 | 1 | 3 | 13.02 |
| 9 | 3 | 3 | 2 | 1 | 9.98 |
| Ⅰ | 30.43 | 29.96 | 32.56 | 30.83 | |
| Ⅱ | 30.61 | 33.92 | 29.86 | 29.72 | |
| Ⅲ | 33.13 | 30.29 | 31.75 | 33.62 | |
| 极差R | 0.900 | 1.320 | 0.900 | 1.30 | |
| SSj | 1.519 | 3.219 | 1.280 | 2.692 |
| 方差来源 | 离均差平方和 | 自由度 | 方差 | F值 | 临界值 |
| 1 | 1.5192 | 2 | 0.760 | 0.564 | 19 |
| 2 | 3.2186 | 2 | 1.609 | 1.196 | 19 |
| 3 | 1.2798 | 2 | 0.640 | 0.475 | 19 |
| 4 | 2.6918 | 2 | 1.346 |
由直观分析表可以看出,各因素对番泻苷A+番泻苷B提取量的影响大小依次为:B>A=C,提取时间对提取量影响最明显,其次是提取温度和提取溶剂用量,由于番泻苷在高温条件下不稳定,所以提取温度选为60 ℃,最后优化提取工艺为10倍量0.5%的碳酸氢钠60 ℃搅拌提取1 h,该提取工艺与传统工艺相比,明显提高了番泻苷提取率。
2.3.5 验证实验按照上述确定的工艺,精密称取番泻叶中粉200 g,放入烧杯中,加入10倍量的浓度为0.5%的碳酸氢钠溶液,称质量,于60 ℃搅拌提取1 h,放冷,补足质量,过滤,续滤液稀释5倍,过0.45 μm滤膜,取续滤液,进样10 μL,计算番泻苷A、番泻苷B总含量为2.56 g。
3 讨论番泻叶的主要泻下成分为番泻苷A、B、C、D[15],番泻苷A、B互为同分异构体,番泻苷C、D也互为同分异构体。番泻苷C经口服后在肠内细菌的作用下,降解产物有芦荟大黄素蒽酮,芦荟大黄素蒽酮在多种细胞株的AMES试验中有遗传毒性作用[16]。因此本实验以番泻苷A、B来计有效成分的含量,较以番泻苷A或总番泻苷计有效成分更为合理。
本实验尝试了甲醇-水、乙腈-水、甲醇-三氟乙酸-水、乙腈-三氟乙酸-水、甲醇-磷酸-水、乙腈-磷酸-水系统[17, 18],最终确定了利用乙腈-0.7%磷酸-水作为流动相,此外,还尝试了不同流速和不同的线性梯度进行洗脱,结果显示,乙腈-0.7%磷酸-水作为流动相,进行线性梯度洗脱,基线漂移较小,分离效果较好,色谱峰峰形好,分布均匀,且保留时间稳定。
番泻苷类化合物具有酚羟基和羧基,具有一定酸性,在碱水中成盐而溶解,因此本实验选取碳酸氢钠作为一种提取溶剂,有利于充分提取番泻苷,且经济环保。文献报道显示,在室温条件下,pH 5.5~8.0 时,番泻苷较为稳定,在pH 6.5时,番泻苷最稳定。因此,本实验利用0.5%的碳酸氢钠60 ℃搅拌提取番泻苷后,将溶液调回中性,50 ℃减压浓缩,冰冻干燥成固体,有利于番泻苷的保存。
温度是影响番泻苷A和番泻苷B稳定性的主要因素,在高温受热过程中,特别是在高浓度乙醇作为溶剂的条件下,番泻苷A和番泻苷B易发生降解,且番泻苷B降解速率更大,番泻苷A和番泻苷B 60 ℃时在水中比较稳定,所以损失率较小[19],文献也多有提到番泻苷类成分不稳定[20]。因此本实验选取60 ℃作为提取的最高温度。随着中药的现代化发展,各种番泻叶制剂或者含其活性成分番泻苷的制剂越来越多[21]。在制剂制备过程中,提取、分离、浓缩、干燥等步骤均应注意稳定性问题。
本实验优选最佳提取工艺后,进行了3批放大提取,番泻苷A和番泻苷B的总提取率均达到预期,提取工艺稳定可靠,可为番泻苷相关研究和实际生产提供依据。
| [1] | 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2010:326. |
| [2] | Dequeker R.Some aspects of the chemical determination of the an-thracene constituents of senna leaf and tincture [J].Boll Chim Farm,1962, 10(1): 290. |
| [3] | 中国医学科学院药物研究所.中药志Ⅲ [M].北京:人民卫生出版社, 1960:620. |
| [4] | Lem LJ.Senna-an old drug in modern research[J].Pharmacology,1988, 36(1): 3. |
| [5] | 米 丽,李敬超,张夏华,等. 番泻叶的化学成分和药理作用研究进展[J].西南军医杂志,2009,11(4):727-728. |
| [6] | 刘永生.番泻叶的常见不良反应与防治[J].河南中医学院学报, 2003, 18(2): 71-72. |
| [7] | Vanderperrren B, Rizzo M, Angenot L. Acute liver failure with renal impairment related to the abuse of senna anthra-quinone glycosides[J]. Ann Pharmacother, 2005, 39(7-8):1353-1357. |
| [8] | Lainonen H, Marvola M, Hietala P, et al.The effect of different storage conditions on the chemical stability,laxative effect and acute toxicity of sennoside solutions[J].Pharm Toxicol,1988,63(1) : 37-41. |
| [9] | 张 阳, 曹 蔚,许松林, 等. 番泻叶中二蒽酮类化合物的提取工艺研究[J].西北药学杂志, 2007, 22(6):303-305. |
| [10] | 陈丹丹,徐建国, 薛桂蓬, 等. 番泻叶提取物中番泻苷 B 的热稳定性[J].中国实验方剂学杂志,2003,19(5):28-29. |
| [11] | 张 坚,马 琳,陈志娟, 等. 中药前胡炮制工艺优化的考察[J]. 天津中医药大学学报,2008,27(1):37-38. |
| [12] | 佟 杰, 李 进, 陈 涛, 等. 正交实验优选银屑灵涂膜剂的提取工艺[J]. 天津中医药大学学报,2007,26(1):34-35. |
| [13] | 王 磊,高 辉,谌爱富, 等. 清开灵口服液生产工艺优化研究[J]. 天津中医药大学学报,2012,31(2):98-100. |
| [14] | 雷 燕,刘砥威,邢建国, 等. 番泻叶提取工艺研究[J]. 新疆医学, 2008,38(10):132-133. |
| [15] | Tanaka H, Murata R, Yoshida A, et al. Analytical studies on the active constituents include drugs V. The structure of sen-noside G, a new glucoside from Senna [J] .Chem Pharm Bull, 1982, 30 (5): 1550-1556. |
| [16] | 潘 勤,肖 峰,孙 琳, 等. 一种番泻叶提取物及其制备方法:中国,CN101209278A[P]. 2008-07-02. |
| [17] | 何 伟, 张现涛, 严 军, 等. HPLC测定番泻总苷提取物中番泻苷A、番泻苷B的含量[J].中成药,2008,30(8):1182-1184. |
| [18] | 何结炜,何明珍,胡子帆,等.HPLC法测定番泻叶中番泻苷A和番泻苷B[J].中草药,2007,37(8):1263-1264. |
| [19] | 黄 娟,张 靖,徐 文, 等. 番泻叶提取液中番泻苷A、番泻苷B的稳定性考察[J].中国医院药学杂志,2014,34(10):797-801. |
| [20] | 曹 蔚,李教社,李小强,等.番泻叶提取工艺研究[J].中草药,2005,36(7):1019-1021. |
| [21] | 高 晔,朱艳华,贺 微,等.番泻叶的药用研究进展[J].中医药学刊,2006,24(11):2145-2146. |
 2016, Vol. 35
2016, Vol. 35