文章信息
- 王秀萍, 任小旦, 张莹雯
- WANG Xiu-ping, REN Xiao-dan, ZHANG Ying-wen
- 当归补血汤对糖尿病大鼠肾组织NF-κB、MCP-1表达的影响
- Effect of Astragals and Angelica Mixture on renal expression of NF-κB and MCP-1 in rats with diabetic
- 天津中药大学学报, 2016, 35(3): 167-172
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(3): 167-172
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.03.06
-
文章历史
收稿日期: 2016-02-21
糖尿病及其并发症已成为世界公共卫生领域的防治焦点,2010年中国国家疾病控制中心和中华医学会内分泌学分会调查结果显示,中国18岁以上人群糖尿病患病率为9.7%,其中20%~40%会发生糖尿病肾病(DN)[1]。随着对DN的研究不断深入,各种新的治疗手段也相继提出,但DN患病率仍持续增长,病情控制也远不如预期,每年大量的DN患者进展为终末期肾病,在生活质量降低的同时也带来沉重的经济负担,因此积极探索有效的防治措施具有重要的现实意义。近年来研究发现炎症在DN的发生和发展中具有重要意义[2-3],改善肾脏微炎症状态有望成为临床治疗DN的新靶点。当归补血汤是中医药经典方剂,在临床及实验研究中发现其可有效改善DN的肾脏损伤,但其对DN时肾脏炎症的作用尚未见报道,本研究拟通过动物实验探索其抗炎机制及其与肾脏保护的相关性。
1 材料与方法 1.1 实验动物与药材雄性SPF级SD大鼠60只,6~8周龄,体质量150~200 g,购自武汉大学动物实验中心[许可证号:SCXK(鄂)2014-0004]。当归补血汤由黄芪、当归按1:1配方(前期研究提示此为治疗DN最优配比),药材购自湖北省中药材公司,黄芪、当归生药浸水1 h,煮沸40 min,重煎2次,合并煎煮液,浓缩后置4 ℃冰箱备用;格列奇特缓释片(法国施维雅)。
1.2 仪器与试剂超净工作台(苏净安泰);全自动生化分析仪(Toshiba日本东芝公司),倒置光显微镜(Olympus日本),H-600透射电子显微镜(日立公司),LKB-V型超薄切片机(瑞典Bromma公司),台式高速冷冻离心机(TGL-16),基因扩增仪(TC-XP 杭州博日科技),实时荧光定量PCR仪(Life technologies: StepOneTM Real-Time PCR System)。生化检测试剂盒(南京建成生物工程研究所),酶联免疫吸附测定试剂盒(Elabscience Biotechnology);定量PCR试剂盒(Toyobo),链脲佐菌素(Sigma)。
1.3 实验分组及造模所有实验动物在武汉大学中南医院动物实验中心(SPF级)饲养实验,随机选取10只作为正常对照组(N),喂以普通饲料,其余大鼠以高脂饲料喂养。适应性喂养5 d后,禁食12 h,除N组外1次性腹腔注射链脲佐菌素(STZ)60 mg/kg(溶于1%柠檬酸钠缓冲液,pH 4.3)建立糖尿病模型,N组注射等量柠檬酸钠缓冲液。1周后大鼠尾静脉采血测血糖,以血糖浓度大于16.7 mmol/L为造模成功[4],随机选取40只纳入实验,按随机数字表法随机分为糖尿病肾病对照组(DN 组,生理盐水10 mL/kg)、格列奇特组[GT组,格列齐特缓释片2.68 mg/(kg·d)]、当归补血汤低剂量组[DL组,1.79 g/(kg·d)当归补血汤浓缩液]、当归补血汤高剂量组[DH组,7.14 g/(kg·d)当归补血汤浓缩液],每组10只,灌胃处理。正常对照组(N组)以生理盐水10 mL/(kg·d)灌胃。所有大鼠连续灌胃8周后取材。
1.4 指标检测及方法 1.4.1 一般状态及生化指标观察大鼠饮水量、进食量、精神、毛色、有无感染等。灌胃8周后以代谢笼收集24 h尿液,并记录尿量。称质量后无菌条件下给予1%戊巴比妥钠50 mg/kg麻醉,腹主动脉采血,分离血清备用。酶偶联比色法检测血糖(GUL)、甘油三酯(TG)、胆固醇(TC)、血肌酐(Scr)、尿肌酐(Ucr)、尿素氮(BUN),并计算内生肌酐清除率(Ccr):Ccr=[(尿肌酐浓度μmol/L×尿量mL/min)/血浆肌酐浓度μmol/L]×1 000。
1.4.2 大鼠肾脏组织作光镜、电镜及图象分析无菌条件下摘取双肾,除去包膜,预冷生理盐水洗净拭干后称质量,计算肾指数。切取约5 mm×5 mm大小皮质置于4%多聚甲醛固定,石蜡包埋、切片,常规行过碘酸雪夫氏(PAS)染色,光镜10×20倍视野下观察肾小球结构变化。另取小块肾皮质剪碎用1.25%戊二醛固定,待行透射电镜观察肾脏超微结构。
1.4.3 实时荧光定量PCR检测NF-κB p65、MCP-1 mRNA表达情况总RNA的提取按试剂盒说明操作,灭活RNA酶环境下进行,并用核酸测定仪检测RNA浓度及纯度。逆转录反应条件:65 ℃ 5 min,42 ℃ 30 min,80 ℃ 5 min,完成后-20 ℃保存。PCR扩增引物由Invitrogen Biotechnology Co,LTD中国公司合成,见表 1。预变性95 ℃,1 min;循环(40次):95 ℃ 15 s→58 ℃ 20 s→72 ℃ 20 s;末段延伸:72 ℃ 5 min;溶解曲线:72 ℃→95 ℃,每20 s升温1 ℃。分别取PCR产物和β-actin扩增产物各10 μL混均后行2%琼脂糖凝胶电泳,溴化乙锭(EB)做荧光指示剂,然后应用自动凝胶成像分析系统进行吸光度扫描,测得数据用2-ΔΔCt法分析基因表达。每组随机选取6个样本,各设置3个平行孔,结果取平均值。
| mRNA | 引物 名称 | 引物序列 (5'-3') | 片段长度 (bp) | 退火温度 (℃) |
| R-actin | 上游 | CGTTGACATCCGTAAAGACCTC | 110 | 58 |
| 下游 | TAGGAGCCAGGGCAGTAATCT | |||
| R-MCP-1 | 上游 | CCAATGAGTCGGCTGGAGAA | 280 | 58 |
| 下游 | TTGAGGTGGTTGTGGAAAAGAG | |||
| R-NF-资B p65 | 上游 | CACCAAAGACCCACCTCACC | 239 | 58 |
| 下游 | CCGCATTCAAGTCATAGTCCC |
实验设立空白孔、标准孔、样品孔,在各孔中加入标准品或样品各100 μL,37 ℃孵育90 min,倒去孔内液体,加入100 μL 生物素化抗体工作液,37 ℃孵育60 min,洗涤3次,加入100 μL酶结合物工作液,37 ℃孵育30 min,洗涤5次,加入90 μL底物溶液,37 ℃孵育15 min左右,加入50 μL终止液,立即在450 nm波长处测量A值。
1.5 统计学处理采用SPSS19.0软件进行分析,计量数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果 2.1 一般情况实验过程中DN组大鼠死亡2只(分别死于极度消瘦和感染),DH组死亡1只(灌胃事件),GT组死亡3只(1只原因未明,2只死于感染)。造模3 d即可见大鼠饮水量、尿量明显增多。N组大鼠皮毛光泽,动作自如,反应灵敏;DN组大鼠毛色湿黄、无光泽,精神萎靡、反应迟钝,这一情况在药物干预组得到改善,DH组改善较明显。
2.2 体质量及肾指数改变N组大鼠体质量随月龄增加不断增长,DN组大鼠体质量明显低于正常大鼠,差异有统计学意义(P<0.01),GT组大鼠体质量较之造模前无明显改变,与DN组之间无差异,DH、DL组大鼠体质量稍增加,较之DN组差异有统计学意义(P<0.01或0.05)。造模组大鼠肾指数显著高于N组,差异有统计学意义(P<0.01),但各造模组间差异无统计学意义,见表 2。
| 组别 | n | 体质量(g) | 肾指数(×100) | GLU(mmol/L) | TG(mmol/L) | TC(mmol/L) |
| N组 | 10 | 518.80±4.21 | 11.12±0.27 | 5.07±0.61 | 1.13±0.10 | 0.83±0.10 |
| DN组 | 8 | 217.00±3.74* | 21.59±0.21* | 27.41±0.96* | 4.14±0.12* | 2.14±0.10* |
| GT组 | 7 | 218.71±2.50* | 21.41±0.18* | 9.92±0.52*# | 2.26±0.11*# | 1.27±0.10* |
| DL组 | 10 | 221.70±5.01*## | 21.51±0.20* | 15.71±0.60*#△ | 3.91±0.18*#△ | 2.05±0.07*##△ |
| DH组 | 9 | 234.11±6.37*#△ | 20.44±0.10* | 11.72±0.69*#△ | 2.40±0.15*# | 1.35±0.08*# |
| 注:与N组比较,*P<0.01;与DN组比较,#P<0.01,##P<0.05;与GT组比较,△P<0.01。 | ||||||
DN组大鼠GLU、TG、TC、BUN、Scr、MAU较N组均有显著增高,而Ccr降低,差异有统计学意义(P<0.01),干预后各组大鼠GLU、TG、TC、BUN、Scr、MAU降低,Ccr增高(P<0.01或0.05)。GT组GLU明显降低,较之DH、DL组差异有统计学意义(P<0.01),TG、TC、BUN、Scr低于DL组,而Ccr升高,差异有统计学意义(P<0.01或0.05)。DH组Scr较之N组无明显差异,Ccr升高较之N组差异有统计学意义(P<0.05),BUN低于GT、DL组(P<0.01)。MAU在GT组明显高于DH、DL组,差异有统计学意义(P<0.01),见表 2、表 3。
| 组别 | n | MAU(mg/L) | BUN(mmol/L) | Scr(μmol/L) | Ccr(×1 000) |
| N组 | 10 | 0.76±0.05 | 11.48±0.60 | 5.12±0.60 | 102.91±2.14 |
| DN组 | 8 | 1.50±0.03* | 27.81±0.49* | 13.98±0.77* | 56.20±3.63* |
| GT组 | 7 | 1.31±0.03*# | 18.77±0.45*# | 6.41±0.64*# | 97.57±1.86* |
| DL组 | 10 | 1.26±0.03*#△△ | 19.45±0.78*#△△ | 8.27±0.57*#△ | 86.76±1.92*#△ |
| DH组 | 9 | 1.02±0.04*#△ | 16.09±0.62*#△ | 5.56±0.48#△ | 105.90±3.20**#△ |
| 注:与N组比较,*P<0.01,**P<0.05;与DN组比较,#P<0.01;与GT组比较,△P<0.01,△△P<0.05。 | |||||
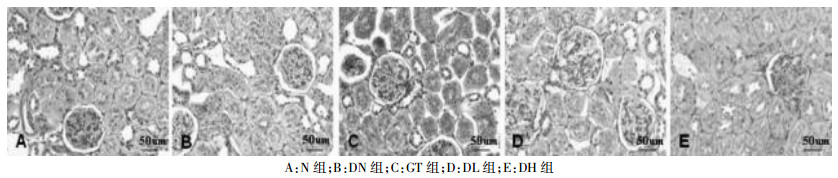
N组大鼠光镜下肾组织结构完整(图 1A)。DN组肾脏结构损伤严重,光镜下可见肾小球基底膜(GBM)增厚,系膜基质增生明显,苏木精-伊红(HE)染色呈强阳性,部分可见肾小球结节性硬化,肾小管上皮细胞肿胀变性,官腔变窄,肾间质部分小血管玻璃样变性(图 1B)。GT、DL组大鼠可见肾小球基底膜弥漫性增厚,系膜基质轻度增生(图 1C、图 1D);DH组明显改善,仅见肾小球轻度水肿,无明显增生性病变(图 1E);3组肾小管光镜下均未见异常改变。电镜下N组可见系膜细胞足突相互交错排列成栅栏状,基底膜厚度适中,结构完整,排列整齐(图 2 A)。DN组大鼠 GBM 均质性增厚,足细胞排列紊乱且发生融合,足突间隙变大,系膜基质增多,肾小管上皮细胞肿胀变性,部分可见细胞脱落,小管基底膜明显增厚,线粒体增大变圆,线粒体嵴脱落(图 2 B)。GT、DL组病变减轻,GBM轻度增厚基质增多(图 2 C、图 2D),DH组明显改善(图 2 E)。
|
| 图 1 光镜下肾脏结构改变PAS染色(×200) |

|
| 图 2 电镜下肾脏结构改变枸橼酸铅染色(×2 000) |
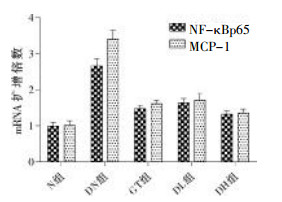
PCR扩增结果显示,DN组大鼠肾组织中NF-κBp65、MCP-1转录活性明显增强,分别为正常大鼠的(2.66±0.20、3.4±0.25)倍,药物治疗组较DN组明显减低,差异均有统计学意义(P<0.01),DH组NF-κBp65 mRNA为(1.32±0.10),较之GT组(1.47±0.10)差异无统计学意义(P=0.58),DL组(1.64±0.12)高于GT组,差异有统计学意义(P<0.05);DH组MCP-1 mRNA表达为N组的(1.35±0.11)倍,较之GT、DL组(1.61±0.12、1.71±0.19)差异有统计学意义(P<0.05和0.01),GT、DL组之间差异无统计学意义。见图 3。
|
| 图 3 大鼠肾组织NF-资B p65、MCP-1mRNA表达变化 |
在N组肾组织中存在一定量的NF-κB、MCP-1蛋白表达,DN组大鼠肾组织中NF-κB、MCP-1蛋白含量显著增加,较之N组差异有统计学意义(P<0.01)。DH组NF-κB、MCP-1含量明显降低,较之GT、DL组差异均有统计学意义(P<0.01),GT、DL组NF-κB含量差异无统计学意义(P > 0.05),GT组MCP-1低于DL组,差异有统计学意义(P<0.01)。见表 4。
| 组别 | n | 50.41±1.87 | 0.41±0.010 |
| N组 | 10 | 50.41±1.87 | 0.41±0.010 |
| DN组 | 8 | 70.57±2.55* | 0.65±0.010* |
| GT组 | 7 | 62.71±1.64*# | 0.56±0.007*# |
| DL组 | 10 | 60.98±2.31*# | 0.59±0.010*#△ |
| DH组 | 9 | 53.12±1.47*#△ | 0.49±0.007*#△ |
| 注:与N组比较,*P<0.01;与DN组比较,#P<0.01;与GT组比 较,△P<0.01。 | |||
DN是糖尿病最常见的微血管并发症,也是糖尿病患者最主要的死亡原因之一,其病理机制复杂,糖尿病时各种内环境改变如糖脂代谢紊乱、高血压、血流动力学异常、氧自由基、糖基化终末产物等均参与了DN的发生发展。近年来针对DN发生的分子机制的研究不断深入,炎症在DN发展中的作用受到重视,许多学者提出炎症反应可能是这些致病因素作用的关键环节。已证明在DN患者肾组织中存在多种炎症细胞浸润和血清C反应蛋白(CRP)、炎症因子增加[3],而在有DN病史的化疗患者中,微炎症更是普遍存在[5]。DN的主要病理改变为肾小球硬化和间质纤维化,研究表明肾脏纤维化与炎症时巨噬细胞浸润及炎症因子增加密切相关,炎症因子可激活损伤部位的成纤维细胞并诱导肾脏固有细胞如系膜细胞、肾小球和肾小管上皮细胞等向肌成纤维细胞转化,导致大量细胞外基质成分产生和沉积[6-7],从而推动纤维化进程。炎症还可造成肾小球内皮损伤及功能障碍[8],诱导足细胞等肾脏固有细胞凋亡,促进蛋白尿的发生[9]。
核因子κB(NF-κB)是一种重要的核转录因子,广泛存在于各种细胞中,参与细胞内的信号传递,调控多种基因的表达,NF-κB信号转导通路被认为是炎症时内皮细胞激活的关键[2]。在正常情况下,NF-κB与其抑制蛋白IkB结合以无活性的形式存在于细胞质中,细胞受到刺激时可通过多种途径激活NF-κB,活化的NF-κB转位到核内与其相关的DNA序列结合诱导靶基因的转录[10]。NF-κB是一种二聚体复合物,p65是组成NF-κB二聚体的主要家族成员之一,NF-κB活化时,IkB与p65亚单位解离,此时p65可被检测到,因此本实验以NF-κBp65作为NF-κB的活性标志。单核细胞趋化蛋白-1(MCP-1)是受NF-κB调节的炎性趋化因子之一[11],是诱导血液中单核-巨噬细胞在炎症部位聚集和活化的关键,而巨噬细胞是肾脏重构的主要参与者[12]。研究发现在高糖培养下的系膜细胞和内皮细胞,NF-κB、MCP-1的活性及表达明显增加,而通过抑制肾脏NF-κB活性及表达,减少MCP-1的产生及巨噬细胞浸润,可有效改善肾脏炎症状态,缓解DN肾脏损伤[11,13]。
本实验研究发现,在造模8周后,DN组大鼠出现肾功能下降、蛋白尿等异常,肾脏镜下可见肾小球基底膜(GBM)增厚,系膜基质增生,肾小球结节性硬化等明显的DN改变。同时肾组织NF-κB、MCP含量显著增加,mRNA活性增强,再次验证了在DN中存在炎症反应。格列齐特为T2DM的一线治疗药物,可有效降低糖尿病患者血糖、血脂,改善代谢紊乱,有研究证明其可减少糖尿病患者血清急性时相反应蛋白、白介素、肿瘤坏死因子-α等炎症因子水平,具有抗炎效应[14-15]。本实验中经过格列齐特处理后大鼠血糖、血脂显著降低,肾脏病理损伤减轻,肾功能得到一定改善,肾组织炎症因子NF-κB、MCP-1也明显低于DN组,提示格列齐特抗炎作用可能与其抑制NF-κB/MCP-1信号通路有关。值得提出的是GT组MAU高于DL、DH组,且其改变与肾功能无明显相关性,提示MAU的发生可能存在其他机制的参与,有研究认为蛋白尿为DN发生及进展的独立危险因素[16-17],本研究结果在一定程度上支持此观点,其具体机制尚有待进一步探讨。
糖尿病在中医属于“消渴病”的范畴,其病机在于阴津亏损,燥热偏盛,DN多发生在糖尿病的后期阶段,此时多见气阴两伤或气血阴阳俱虚。当归补血汤由黄芪和当归两味药组成,具有补气生血的功效,与DN的病机相一致。课题组前期研究证明,当归补血汤可抑制肾脏系膜细胞增生及细胞外基质积聚,减轻肾小管-间质损伤,减少尿白蛋白,起到抗纤维化作用[18-19]。本实验发现经当归补血汤治疗后,大鼠血糖、血脂显著降低,肾功能改善,蛋白尿减轻,肾脏镜下病理改变亦明显减轻,且DH组明显优于DL组,提示当归补血汤具有较好的肾脏保护作用并具有一定的剂量依耐性,而肾组织中NF-κB、MCP-1含量明显下降,NF-κBp65、MCP-1 mRNA活性也显著受抑,并与肾功能改变具有一致性,证实当归补血汤可降低NF-κB、MCP-1炎症因子的表达,抑制肾脏炎症反应,减轻DN肾脏损伤。
| [1] | 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中国糖尿病杂志, 2014, 22 (8) : 2–42. |
| [2] | Denk A, Goebeler M, Schmid S, et al. Activation of NF-kappa B via the Ikappa B kinase complex is both essential and sufficient for proinflammatory gene expression in primary endothelial cells[J]. J Biol Chem, 2001, 276 (30) : 28451–28458. |
| [3] | Mima A. Inflammation and oxidative stress in diabetic nephropathy:new insights on its inhibition as new therapeutic targets[J]. J Diabetes Res, 2013 (2013) : 248563. |
| [4] | 李伟, 张红, 殷松楼, 等. 不同剂量链脲佐菌素诱导SD大鼠糖尿病肾病模型的研究[J]. 徐州医学院学报, 2006, 26 (1) : 52–55. |
| [5] | Nath I, Nath CK, Baruah M, et al. A Study of Inflammatory Status in Nephropathy Patients with History of Type-Ⅱ Diabetes Mellitus Undergoing Haemodialysis[J]. J Clin Diagn Res, 2013, 7 (10) : 2143–2145. |
| [6] | Kanasaki K, Taduri G, Koya D. Diabetic nephropathy:the role of inflammation in fibroblast activation and kidney fibrosis[J]. Front Endocrinol (Lausanne), 2013, 4 : 7. |
| [7] | Maeshima A, Mishima K, Yamashita S, et al. Follistatin, an activin antagonist, ameliorates renal interstitial fibrosis in a rat model of unilateral ureteral obstruction[J]. Biomed Res Int, 2014, 2014 : 376191. |
| [8] | Mudaliar H, Pollock C, Ma J, et al. The role of TLR2 and 4-mediated inflammatory pathways in endothelial cells exposed to high glucose[J]. Plos One, 2014, 9 (10) : e108844. |
| [9] | Marques C, Mega C. Sitagliptin prevents inflammation and apoptotic cell death in the kidney of type 2 diabetic animals[J]. Mediators Inflamm, 2014 (2014) : 538737. |
| [10] | Benedetti F, Davinelli S, Krishnan S, et al. Sulfur compounds block MCP-1 production by Mycoplasma fermentans-infected macrophages through NF-κappaB inhibition[J]. J Transl Med, 2014, 12 : 145. |
| [11] | Ha H, Yu MR, Choi YJ, et al. Role of high glucose-induced nuclear factor-kappaB activation in monocyte chemoattractant protein-1 expression by mesangial cells[J]. J Am Soc Nephrol, 2002, 13 (4) : 894–902. |
| [12] | Duran-Salgado MB, Rubio-Guerra AF. Diabetic nephropathy and inflammation[J]. World J Diabetes, 2014, 5 (3) : 393–398. |
| [13] | Matsushita Y, Ogawa D, Wada J, et al. Activation of peroxisome proliferator-activated receptor delta inhibits streptozotocin-induced diabetic nephropathy through anti-inflammatory mechanisms in mice[J]. Diabetes, 2011, 60 (3) : 960–968. |
| [14] | 李婷芝, 阳建伶. 格列齐特对2型糖尿病患者血清急性时相蛋白的影响[J]. 中国临床研究, 2010, 23 (7) : 587–588. |
| [15] | 王翠捷, 何汝帮. 二种降糖药对2型糖尿病患者血清hs-CRP、TNF-α、IL-6水平的影响[J]. 中国民族民间医药, 2009, 17 (18) : 20. |
| [16] | Retnakaran R, Cull CA, Thorne KI, et al. Risk factors for renal dysfunction in type 2 diabetes:U.K. Prospective Diabetes Study 74[J]. Diabetes, 2006, 55 (6) : 1832–1839. |
| [17] | Svensson MK, Cederholm J, Eliasson B, et al. Albuminuria and renal function as predictors of cardiovascular events and mortality in a general population of patients with type 2 diabetes:a nationwide observational study from the Swedish National Diabetes Register[J]. Diab Vasc Dis Res, 2013, 10 (6) : 520–529. |
| [18] | 龚宇, 张莹雯. 当归补血汤含药血清对高糖条件下肾小球系膜细胞增殖的影响[J]. 中西医结合研究, 2011, 3 (4) : 175–178. |
| [19] | 周必发, 陆备军, 陈明军, 等. 当归补血汤对糖尿病肾病患者肾脏保护的研究[J]. 中华中医药学刊, 2011, 19 (9) : 2114–2116. |
 2016, Vol. 35
2016, Vol. 35




