文章信息
- 刘艳庭, 应树松, 武艺静, 董鹏志, 吴红华, 徐砚通
- LIU Yan-ting, YING Shu-song, WU Yi-jing, DONG Peng-zhi, WU Hong-hua, XU Yan-tong
- 一种改良的5-羟色胺转运体活性化合物高内涵筛选方法
- An improved high content screening method for compounds on activity of serotonin transporters
- 天津中药大学学报, 2016, 35(3): 180-186
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(3): 180-186
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.03.09
-
文章历史
收稿日期: 2016-01-28
2. 天津国际生物医药联合研究院 中药新药研发中心, 天津 300457
2. Research and Development Center of Chinese Materia Medica, Tianjin International Joint Academy of Biotechnology and Medicine, Tianjin 300457, China
5-羟色胺(5-HT)是一种高度保守的信号传导分子,化学性质属于吲哚胺,主要存在于大脑和消化道中,在运动、睡眠、摄食、生殖、认知以及情感等生理功能调节中发挥重要作用[1]。在生理条件下,5-HT发挥作用后需要及时清除或灭活,以免产生中毒反应及5-HT受体脱敏现象,其中5-HT转运体(SERT)在5-HT清除过程中发挥重要作用[2]。SERT是一种对5-HT具有高度亲和力的Na+-Cl-依赖性神经递质转运蛋白,含有12个跨膜结构域,属于有机阳离子转运体,广泛分布在大脑边缘系统、胃肠道嗜铬细胞膜、肥大细胞和五羟色胺能神经突触前膜上,SERT将细胞间的5-HT重摄取入细胞内,通过控制5-HT量及其与5-HT受体作用时间实现对信息传递精细调控[3]。研究表明,SERT在维持神经、精神和心理功能正常中发挥重要作用,脑内5-HT系统功能失调可导致强迫、抑郁、焦虑、惊恐等精神疾患,而且SERT功能异常与药物成瘾性密切相关[4-6]。在消化道中,SERT功能异常可导致胃肠道动力及分泌功能异常,内脏敏感性提高,与慢性便秘、腹泻、肠道易激综合征(IBS)及功能性消化不良等胃肠道功能性疾病密切相关[7-12]。因此,研发SERT活性新药对治疗神经精神疾病和胃肠道功能性疾病具有重要意义。
传统SERT活性药物筛选方法采用了放射性同位素标记技术[13-17]。为了考察化合物对SERT亲和力,放射性配体竞争结合实验采用3H标记选择性SERT抑制剂(SSRI)如Fluoxetine、Citalopram等,应用液体闪烁技术考察待测化合物与3H标记SSRI竞争结合SERT能力;为了考察化合物对SERT摄取功能影响,采用3H标记5-HT作为SERT摄取底物,检测待测化合物对细胞/神经突触体SERT摄取3H标记5-HT能力影响。放射性同位素标记方法有其优越性,如3H标记对化合物自身结构和生物活性影响小,利于准确测定待测化合物对SERT蛋白亲和力和对SERT摄取5-HT功能影响,但使用放射性元素具有很多不足,包括生物危害、环境污染、实验条件要求苛刻、放射性废料处理费用高昂等,导致在高通量药物筛选应用方面受到很多限制,因此有必要发展安全可靠的SERT活性药物筛选方法。
荧光检测是放射性同位素标记的常见替代方法,目前已报道了应用荧光检测SERT摄取功能的方法。荧光检测方法虽然灵敏度比放射性同位素低,但是它不仅可以观察SERT对荧光底物转运的实时动态过程,而且适用于高通量化合物筛选,属于SERT活性化合物发现的重要方法。现有SERT摄取功能荧光检测方法包括:一是采用MDS Analytical Technologies公司神经递质转运体摄取试剂盒在酶标仪FLIPRTETRA上检测胞内荧光强度,此方法通用于SERT、多巴胺转运体(DAT)和去甲肾上腺素转运体(NET),由于酶标仪检测不能区分胞内、外荧光染料,试剂盒采用了细胞膜不通透染料来遮盖胞外荧光染料以降低背景干扰信号;二是采用荧光分子4-[4-(dimethylamino)-styrl]-N-methylpyridinium (ASP+)作为底物在高内涵系统上进行检测,发展了NET和DAT高内涵检测方法[18-19],高内涵方法基于细胞影像信息考察细胞功能改变,能够直观便捷地确定细胞内荧光强度并且可以观察SERT对APP+转运的实时动态过程。
由于SERT对ASP+转运效率低,导致SERT高内涵检测方法应用受到限制。近年新合成了荧光染料4-[4-(dimethylamino)phenyl]-1-methylpyridinium(APP+),实验证实SERT对APP+转运效力比ASP+强数倍,电生理研究发现APP+属于SERT底物,但ASP+属于SERT抑制剂,且APP+对细胞膜不着色,进一步提高了细胞内荧光特异性,可见APP+在SERT活性检测方面明显优于ASP+[16],但至今尚未见应用APP+荧光染料优化高内涵系统筛选SERT活性化合物的报道,本研究从构建hSERT-HEK293细胞株入手,在此基础上优化APP+在高内涵系统检测条件,为发现SERT活性化合物提供工具。
1 材料与方法 1.1 材料HEK293细胞系(中国科学院典型培养物保藏委员会细胞库)、hSERT-pcDNA3(Addgene公司,15483)见图 1。LB培养基(生物生工公司,SD7002)、大提质粒试剂盒(Transgene公司,H10105)、PEI(Polysciences,23966-2)、G418(Merck Millipore公司,D00117999)、Anti-SERT antibody和 Anti-Tubulin antibody(Abcam公司)、Super Signal West Pico化学发光底物(Thermo公司)、RT-PCR试剂盒和Faststart Universal SYBR Green Master为Roche公司产品、MEM培养基(41500034)和胎牛血清(10099-141)为Gibco公司产品,Trizol、RIPA裂解液和BCA蛋白浓度测定试剂盒均为碧云天公司产品,Ampicillin、APP+、Fluoxetine、D-多聚赖氨酸、Tianeptine均为Sigma公司产品。96孔细胞培养板(Costar 3925)美国Corning公司。
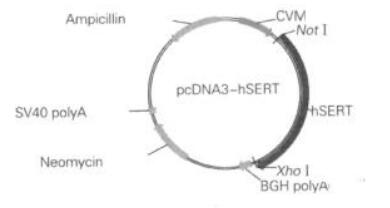
|
| 图 1 hSERT-pcDNA质粒图谱 |
选取含有质粒的感受态细菌接种到含有Ampicillin的液体LB培养基中,在37 ℃、220 rpm条件下过夜培养。吸取100 μL菌液,涂布到含有Ampicillin的固体LB培养上,在37 ℃过夜培养,挑取单克隆接种到含有Ampicillin的液体LB培养基中扩大培养,采用大提质粒试剂盒提取质粒。
1.3 质粒的测序将含有目的基因的DH5α菌液送由生物生工公司以T7和BGH为引物测序,根据其序列设计扩增引物,上游引物:CTGGGGCAAGA-AGGTGGATT,下游引物:CCAGTGCGAGCTCCATG-TAA,引物由上海生物生工公司合成。
1.4 建立稳定转染hSERT-HEK293细胞系 1.4.1 HEK293细胞转染实验为了确定G418最佳筛选浓度,将HEK293细胞与浓度在0~1 200 mg/L间 G418共培养,每3~4 d更换培养基,14~15 d后导致HEK293完全死亡的最低G418浓度为筛选用最佳浓度[20-21]。
HEK293细胞转染实验按照PEI试剂转染法操作,在HEK293细胞转染(PEI体积:DNA质量=3:1)4~6 h后,将转染试剂换成MEM完全培养基,在37 ℃、5% CO2、饱和湿度培养24 h后,换用含800 mg/L G418的MEM完全培养基进行筛选,每3 d更换培养基,经14~15 d筛选后换成含400 mg/L G418 的MEM完全培养基扩大培养[22-23]。
1.4.2 转染细胞系hSERT mRNA表达的鉴定采用实时荧光定量聚合酶链式反应(Real-time PCR)方法验证hSERT mRNA表达,应用Trizol法提取细胞总RNA,分光光度法测定RNA浓度,RNA纯度判断依据A260/280比值在1.8~2.0,琼脂糖凝胶电泳显示28S和18S条带明亮清晰且28S条带亮度在18S条带的两倍以上,电泳无拖尾现象。按照逆转录试剂盒说明书操作获取cDNA,然后进行Real-time PCR 检测,反应体系包括: cDNA模板1μL,上下游引物各1.25 μL(hSERT fwd: CTGGGGCAAGA-AGGTGGATT,hSERT rev:CCAGTGCGAGCTCCAT-GTAA;GAPDH fwd:CTCTCTGCTCCTCCTGTTCGAC,GAPDH rev: TGAGCGATGTGGCTCGGCT)Supermix 12.5 μL,RNase-free water 9.0 μL。反应程序设定:95 ℃ 3 min预变性,95 ℃ 30 s变性,60 ℃ 40 s退火,72 ℃ 40 s延伸,共42个循环。溶解曲线条件设定:95 ℃ 10 s,65℃ 5 s,95℃。采ΔΔCt法分析Real-time实验结果。
1.4.3 转染细胞系hSERT蛋白表达的鉴定采用蛋白免疫印迹(Western blotting)方法验证hSERT蛋白表达,将稳定转染hSERT-HEK293细胞提取总蛋白,采用BCA法测定蛋白浓度。Western blotting遵循常规程序操作,其中抗体稀释倍数分别为:SERT抗体(1:2 500),Tubulin抗体(1:4 000),二抗均采用羊抗兔IgG-HRP(1:5 000),使用ECL检测试剂盒显色,在暗室曝光显影,采用Image J软件对扫描后显影条带进行光密度值分析,计算SERT/Tubulin蛋白光密度值的比值,并对HEK293细胞组值进行均一化后表示。
1.4.4 稳定转染细胞系hSERT功能的验证为了验证hSERT-HEK293细胞SERT摄取功能并优化APP+摄取高内涵检测条件,将转染细胞和对照HEK293细胞接种至96孔板培养24 h,细胞同步化培养12~16 h,弃除培养基后加入0、1、2、5、10、20、30、40 μmol/L荧光染料APP+,避光孵育20 min,洗去APP+加入1 μg/L Hoechst 33342 染色细胞核,在37 ℃避光孵育20 min,采用Krebs Ringers HEPES(KRH)缓冲液(130 mmol/L NaCl,1.3 mmol/L KCl,2.2 mmol/L CaCl2,1.2 mmol/L MgSO4,1.2 mmol/L KH2PO4,10 mmol/L HEPES,1.8 g/L葡萄糖pH 7.3)洗去染料进行高内涵检测,荧光染料的激发光和发射光波长。见表 1。
为了验证SERT高内涵筛选(HCS)方法的可靠性,分别采用选择性SERT抑制剂(SSRI)Fluoxetine和SERT增强剂(SSRE)Tianeptine进行验证。hSERT-HEK293细胞培养24 h后同步化12~16 h,弃除培养基加入Fluoxetine 10.0、2.0、1.0、0.1 、0.01、0.001 μmol/L或Tianeptine 20.0,10.0,1.0,0.1,0.01,0.001 μmol/L在37 ℃孵育2 h,加入终浓度为2 μmol/L APP+轻轻混匀,避光孵育20 min,弃除反应液,加入终浓度为1 μg/L Hoechst 33342 在37 ℃避光孵育20 min,KRH洗去染料进行高内涵检测。
1.6 数据分析采用SPSS 18.0软件进行统计分析,其中Western blotting实验hSERT蛋白表达量结果采用两独立样本T-tert检验,hSERT功能实验结果采用单因素方差分析(ANOVA),组间两两比较采用Dunnett’s Multiple Comparison Test进行组间比较,实验结果采用Mean±S.E.M 表示。
2 结果 2.1 稳定转染hSERT-HEK293细胞系的获得质粒测序结果与GeneBank比对表明,目的基因SERT序列与Human Na+/Cl- dependent serotonin transporter mRNA,complete cds,L05568.1一致,说明该质粒可以用于细胞转染。G418浓度筛选结果显示在800~1 200 mg/L条件下HEK293细胞全部死亡,表明HEK293细胞的G418最佳筛选浓度为800 mg/L,用于培养转染细胞的G418维持浓度为400 mg/L。经PEI转染和G418筛选获得了稳定转染的hSERT-HEK293细胞系。
2.2 稳定转染细胞系hSERT mRNA和蛋白表达水平的验证Real-time PCR结果经ΔΔCt法分析显示hSERT-HEK293细胞(Ct=27.12±0.16)比HEK293细胞(Ct=38.38±0.87) hSERT表达量提高了约5 422倍(n=3)。Western blotting结果证实hSERT蛋白表达量在hSERT-HEK293细胞系比未转染HEK293显著增加,见图 2。
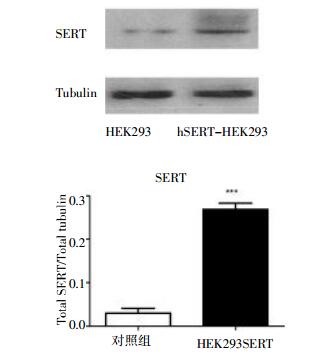
|
| 图 2 hSERT蛋白在转染/未转染细胞中的表达(n=3 hSERT蛋白表达量在hSERT-HEK293细胞与对照组HEK293相比显著性增加(***P < 0.001)。 |
APP+摄取实验证实hSERT-HEK293细胞具有SERT转运功能,且随APP+浓度增高呈饱和趋势;在相同条件下,转染细胞荧光强度比HEK293细胞显著增高,见图 3。Fluoxetine 2.0 μmol/L显著降低了hSERT-HEK293胞内APP+荧光强度,见图 4,证实hSERT摄取APP+具有特异性,以上结果从功能学角度验证了稳定转染hSERT-HEK293细胞系的质量。
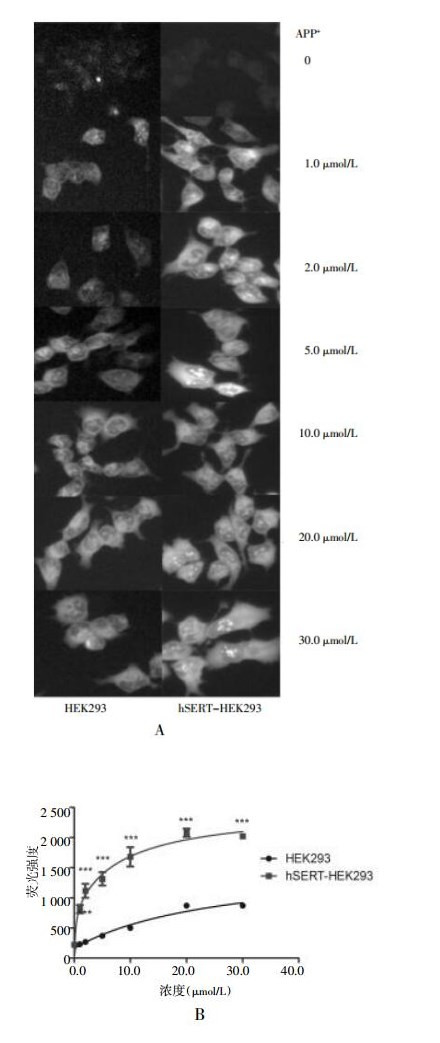
|
| 图 3 hSERT-HEK293和HEK293对APP+摄取效率 A:不同浓度APP+染色HCS检测效果图;B:不同浓度APP+摄取效果的量-效关系图。APP+孵育时间为20 min,***P < 0.001(n=6)。 |
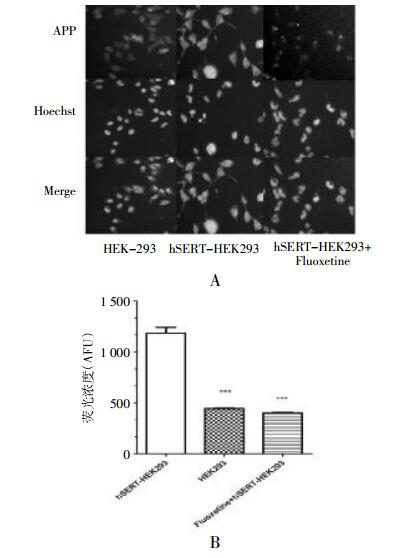
|
| 图 4 hSERT摄取APP+功能特异性验证 A:APP+染色高内涵检测效果图,HEK293代表未转染细胞,hSERT-HEK293代表稳定转染细胞,Fluoxetine+hSERT-HEK293代表加用Fluoxetine,其中APP+浓度为2.0 μmol/L,Fluoxetine浓度为2.0 μmol/L;B:hSERT-HEK293、HEK293和Fluoxetine +hSERT-HEK293胞内荧光强度量化结果(n=6);Fluoxetine浓度为2.0 μmol/L,***P < 0.001。 |
为了优化hSERT-HEK293细胞摄取APP+活性HCS条件,首先考察了APP+浓度对hSERT-HEK293细胞染色效果的影响,结果显示APP+为1.0 μmol/L时,hSERT-HEK293细胞荧光强度已经比HEK293细胞显著增高,在APP+为2.0 μmol/L时,两者间差异最大,随着APP+增高至10 μmol/L,两种细胞的荧光强度均趋向饱和,见图 3。为了尽量降低干扰荧光同时获得较高特异荧光信号,本实验结果提示APP+ 2.0 μmol/L可作为HCS优化浓度。
根据文献报道,APP+荧光强度对温度具有明显依赖性,在37 ℃孵育后胞内荧光强度最高,因此HCS优化条件选择在37 ℃孵育。为了优化APP+孵育时间,在37 ℃条件下比较了2.0 μmol/L APP+在10~40 min内hSERT-HEK293胞内荧光强度,结果显示20 min孵育时间能够达到胞内荧光强度相对稳态,为了实验节省时间,因此HCS优化条件选择20 min作为APP+孵育时间。
2.4 应用阳性药物验证SERT HCS方法的可靠性为了考察SERT HCS方法可靠性,应用SSRI Fluoxetine和SSRE Tianeptine作为工具药进行验证,实验结果显示Fluoxetine和Tianeptine均显示良好量效关系,见图 5。其中Fluoxetine IC50=11.1 nmol/L,与文献中采用同位素3H标记5-HT测得值IC50=7.3 nmol/L接近,比ASP+方法测得值IC50=24.7 nmol/L灵敏度明显提高[8]。Tianeptine在0.1~20.0 μmol/L范围内显著促进了hSERT对APP+摄取,验证了Tianeptine对SERT促进作用,但当浓度达到50~100 μmol/L,细胞出现破裂现象,胞内荧光强度反而降低。由此可见,该高内涵方法不仅可以用于筛选hSERT抑制剂还可以筛选hSERT促进剂,为发现hSERT活性化合物提供了便捷实用的方法。
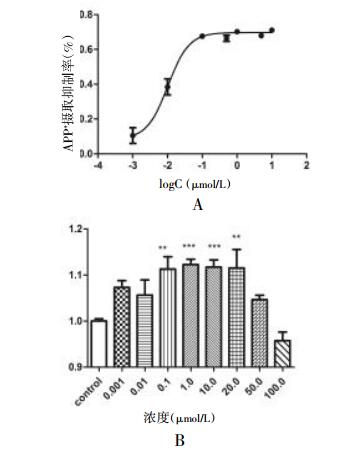
|
| 图 5 Fluoxetine和Tianeptine对SERT摄取APP+活性的影响 A:Fluoxetine抑制SERT活性量效关系;B:Tianeptine促进SERT活性量效关系,**P < 0.01,***P < 0.001,(n=6)。 |
本研究目标是建立一种改良的hSERT活性化合物HCS方法。鉴于放射性同位素标记方法的诸多不便,选择了荧光检测技术。现已报道的hSERT活性HCS方法采用了ASP+为荧光底物,由于灵敏度低限制了其应用;近年新合成的荧光底物APP+克服了ASP+在SERT活性检测方面的不足,但至今未见应用APP+为荧光底物优化hSERT活性化合物HCS条件的报道。本研究首先建立了稳定转染hSERT-HEK293细胞系,并在转录和翻译水平验证了hSERT表达,在高内涵系统验证了hSERT对APP+摄取功能;为了优化SERT活性化合物高内涵筛选条件,考察了APP+浓度、孵育时间和公认工具药物Fluoxetine和Tianeptine在此系统上的药效,验证了此筛选系统的可靠性。
本研究确立的hSERT活性化合物HCS方法包括以下特征:1)优化了以APP+为荧光底物的hSERT活性化合物HCS条件,比ASP+方法灵敏度有明显提高。2)首次验证了SSRE Tianeptine在HCS检测效果,证实此方法不仅可用于筛选hSERT抑制剂,而且可用于筛选hSERT促进剂。3)采用稳定转染hSERT-HEK293细胞株进行实验,存在随细胞传代次数增加hSERT活性会随之降低问题,本研究采用了两种方法来克服这种不足,一是限制细胞使用传代次数,实验证实hSERT-HEK293细胞在15代内荧光强度相对稳定,可以用于高内涵筛选,防止由于细胞传代次数过高导致hSERT活性降低,从而影响HCS实验结果可靠性; 二是采用计算相对荧光强度方法(公式1)分析实验结果,无论是不同转染批次细胞或者是同批相隔代数较多细胞间APP+绝对荧光强度会存在较大差别,采用对照组荧光强度作为参照来消除这种细胞批次/代数本底的影响,能够更客观地反映化合物活性。4)APP+荧光强度会随着时间增长而淬灭,本实验证实APP+绝对荧光强度在30 min内能够维持稳定,因此在实验操作过程中需要注意以下两方面,一是同一张多孔板内的样品数量不宜过多,样品数量多会导致高内涵系统扫描时间过长而影响APP+荧光强度;二是在同一张多孔板内设立多个对照组,在高内涵系统扫描过程中随着时间推移都有相应对照组用于相对荧光强度计算,从而减少误差。5)总体而言,该方法快速高效,实验成本低,安全性高,适用于高通量药物筛选。
公式1:Flu(相对)=Flu(药物组)/Flu(对照组)
本方法适用于考察化合物对hSERT摄取功能的影响,但不能确定化合物与hSERT蛋白间是否存在直接相互作用,因为影响hSERT活性的途径既可能通过直接相互作用也可能通过间接步骤实现,如果需要进一步确定化合物对hSERT蛋白直接相互作用,可采用传统放射性配体竞争结合实验方法考察进行验证。
| [1] | Serretti A, Calati R, Mandelli L, et al. Serotonin transporter gene variants and behavior:a comprehensive review[J]. Curr Drug Targets, 2006, 7 (12) : 1659–1669. |
| [2] | 李陕区, 杨博, 许昌泰. 神经递质5-羟色胺研究现状[J]. 临床医学工程, 2010, 17 (5) : 145–147. |
| [3] | Christopher P, Duman RS. Stress, depression, and neuroplasticity:a convergence of mechanisms[J]. Neuropsychopharmacology Official Publication of the American College of Neuropsychopharmacology, 2008, 33 (1) : 88–109. |
| [4] | 李慈珍, 杨智昉, 王艺颖, 等. 5-羟色胺重摄取过程的机制[J]. 细胞生物学杂志, 2006, 28 (6) : 917–922. |
| [5] | Zhou FC. Serotonin transporters are located on the axons beyond the synaptic junctions:anatomical and functional evidence[J]. Brain Res, 1998, 805 : 241–254. |
| [6] | Feng CZ, Sari Y, Jing KZ. Expression of serotonin transporter protein in developing rat brain[J]. Developmental Brain Research, 2000, 119 (119) : 33–45. |
| [7] | 陆敏, 张伟, 姚青, 等. 肠康方对肠易激综合征内脏高敏感模型大鼠脑肠轴中5-羟色胺转运体的作用[J]. 世界华人消化杂志, 2015, 23 (8) : 1231–1237. |
| [8] | 黎可京, 邱小蕾, 袁耀宗. 5-羟色胺转运体与肠易激综合征患者躯体心理症状的相关性分析[J]. 中国医药导报, 2014, 11 (6) : 18–20,25. |
| [9] | 常媛媛. 5-羟色胺转运体基因启动子区多态性与肠易激综合征[C]. 中华医学会第十三次全国内科学学术会议, 2011. |
| [10] | Chen JJ, Li Z, Pan H, et al. Maintenance of serotonin in the intestinal mucosa and ganglia of mice that lack the high-affi nity serotonin transporter:Abnormal intestinal motility and the expression of cation transporters[J]. J Neurosci, 2001, 21 : 6348–6361. |
| [11] | Pata C, Erdal ME, Derici E, et al. Serotonin transporter gene polymorphism in irritable bowel syndrome[J]. Am J Gastroenterol, 2002, 97 : 1780–1784. |
| [12] | Areeshi MY, Haque S, Panda AK, et al. A serotonin transporter gene (SLC6A4) polymorphism is associated with reduced risk of irritable bowel syndrome in American and Asian population:a meta-analysis[J]. Plos One, 2013, 8 (9) : 454–454. |
| [13] | Fowler A, Seifert N, Acker V, et al. A nonradioactive high-throughput/high-content assay for measurement of the human serotonin reuptake transporter function in vitro[J]. Journal of Biomolecular Screening, 2006, 11 (8) : 1027–1034. |
| [14] | Jørgensen S, Nielsen EØ, Peters D, et al. Validation of a fluorescence-based high-throughput assay for the measurement of neurotransmitter transporter uptake activity[J]. Journal of Neuroscience Methods, 2008, 169 (1) : 168–176. |
| [15] | 王艺颖, 金珠, 李慈珍, 等. 5-羟色胺转运体基因异体表达模型的建立[J]. 中国应用生理学杂志, 2005 (4) : 444–448. |
| [16] | Solis EJ, Zdravkovic I, Tomlinson ID, et al. 4-(4-(dimethylamino)phenyl)-1-methylpyridinium (APP+) is a fluorescent substrate for the human serotonin transporter[J]. The Journal of biological chemistry, 2012, 287 (12) : 8852–8863. |
| [17] | Karpowicz RJ, Matthew D, David S, et al. APP+, a fluorescent analogue of the neurotoxin MPP+, is a marker of catecholamine neurons in brain tissue, but not a fluorescent false neurotransmitter[J]. Acs Chemical Neuroscience, 2013, 4 (5) : 858–869. |
| [18] | Haunsø A, Buchanan D. Pharmacological characterization of a fluorescent uptake assay for the noradrenaline transporter[J]. Journal of Biomolecular Screening, 2007, 12 (3) : 378–384. |
| [19] | 吕茂民, 贾莉玮, 王建国, 等. G418抗性HEK293细胞的培育[J]. 中国实验动物学报, 2003, 11 (1) : 7–8. |
| [20] | 赵欣, 杨向军, 白霞, 等. 稳定表达hHCN2基因HEK293细胞系的建立[J]. 中国应用生理学杂志, 2006, 22 (2) : 254–256. |
| [21] | Fortune JA, Novobrantseva TI, Klibanov AM. Highly effective gene transfection in vivo by alkylated polyethylenimine[J]. Journal of drug delivery, 2011 (2011) : 2040–2058. |
| [22] | 鲁悦, 杨航, 袁林, 等. 多聚乙烯亚胺介导肿瘤细胞基因转染[J]. 南京医科大学学报:自然科学版, 2012, 32 (12) : 1684–1689. |
| [23] | Wiseman JW, Goddard CA, Mclelland D, et al. A comparison of linear and branched polyethylenimine (PEI) with DCChol/DOPE liposomes for gene delivery to epithelial cells in vitro and in vivo[J]. Gene Therapy, 2003, 10 (19) : 1654–1662. |
 2016, Vol. 35
2016, Vol. 35




