文章信息
- 杨茜, 宫美玲, 李晋, 金华, 马琳, 常艳旭
- YANG Xi, GONG Mei-ling, LI Jin, JIN Hua, MA Lin, CHANG Yan-xu
- HPLC-UV法同时测定羌活酚酸和香豆素类成分含量
- Simultaneous determination of phenolic acids and coumarins for quality control of Rhizoma et Radix Notopterygii.by HPLC-UV
- 天津中药大学学报, 2016, 35(3): 192-195
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(3): 192-195
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.03.11
-
文章历史
收稿日期: 2016-02-05
羌活,是伞形科植物羌活(裂叶羌活,Ntopterygium incisum Ting ex H. T. Chang)或宽叶羌活(Notopterygium forbesii Boiss.)的干燥根茎及根[1]。味辛、苦,性温。有散寒、祛风、除湿和止痛功能。在临床上有较广泛的应用,常用于治疗风寒感冒[2]、头痛[3]、风湿痹痛[4]、肩背酸痛[5]等症。羌活的化学成分主要为挥发油类、酚酸和香豆素类成分[6]。现代研究表明羌活具有抗炎[7]、镇痛解热[7]、抗心律失常[8]、抗心肌缺血[9]和抗菌[10]等作用。研究发现绿原酸具有一定的抗内毒素作用[11],新绿原酸对补体激活具有显著的抑制作用[12],阿魏酸具有抗辐射、抗氧化和抗炎等作用[13-15],羌活醇和异欧前胡素具有抗肿瘤作用[16-17]、舒张血管作用[18-19]和抗病毒活性[20]。因此,选择上述5种成分为指标,进行质量控制研究比选择单一指标羌活醇进行质量控制研究更符合羌活多成分协同发挥药效作用特点,更能全面地、合理地评价羌活药材质量。
目前,尽管已有相关文献报道测定羌活中阿魏酸、羌活醇、异欧前胡素和苯乙基阿魏酸酯4种成分的含量测定的方法[21],但未见羌活中新绿原酸、绿原酸、阿魏酸、羌活醇和异欧前胡素同时定量的分析方法。本研究拟建立测定羌活中两类5种成分(新绿原酸、绿原酸、阿魏酸、羌活醇和异欧前胡素)同时定量的高效液相色谱-紫外分析法(HPLC-UV),并对不同产地裂叶羌活中含量进行测定,比较不同产地裂叶羌活5种指标性成分含量差异,为裂叶羌活羌活药材的质量提供技术支撑。
1 仪器与试剂Waters 2695高效液相色谱仪,Waters 2487双波长UV检测器,Agilent Zorbax SB-C18反相色谱柱(4.6 mm×250 mm,5 μm)。乙腈和甲醇均为色谱级,水为超纯水(Milli-Q超纯水系统),其余试剂均为分析级。实验所用其余仪器为超声提取器,低温离心机,十万分之一天平,万分之一天平,中药粉碎机。新绿原酸、绿原酸、阿魏酸、羌活醇、异欧前胡素等标准品购于中国药品食品检定所,纯度均大于98%。16批次不同产地(四川、青海、甘肃、内蒙古、安徽和山西)羌活样品于秋季采收,经天津中医药大学马琳教授鉴定为裂叶羌活(Ntopterygium incisumTing ex H. T. Chang)干燥根茎及根。
2 实验方法 2.1 色谱条件色谱柱:Agilent Zorbax SB-C18反相色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈(A),0.2%磷酸水(B);梯度洗脱程序:0~2 min,12%~17% A;2~10 min,17%~17.5% A;10~12 min,17.5%~17.5% A;12~20 min,17.5%~18% A;20~22 min,18%~21% A;22~26 min,21%~24% A;26~28 min,24%~28% A;28~30 min,28%~30% A;30~33 min,30%~38% A;33~80 min,38%~38% A;80~82 min,38%~60% A;82~100 min,60%~60% A;检测波长:330 nm;流速1 mL/min;进样量:5 μL;柱温:30 ℃。
2.2 标准品溶液的制备精密称定5.00 mg新绿原酸、绿原酸、阿魏酸、羌活醇、异欧前胡素标准品,分别置于5 mL容量瓶中,甲醇定容,摇匀,即得1.00 g/L的标准品母液。
2.3 样品溶液的制备精密称取不同产地羌活粉末(60目)0.200 g,分别置于锥形瓶内,加10 mL 80%甲醇,称质量,超声提取30 min,放冷至室温后补足损失的质量,摇匀,将样品溶液置于离心管中在14 000 r/min下离心10 min,取上清液,用0.45 μm微孔滤膜过滤,进样分析。
2.4 方法学验证 2.4.1 线性范围将5个标准品母液配成适宜浓度的混标溶液,然后将此混标溶液稀释至一系列浓度,分别进样5 μL分析,计算峰面积,以浓度为横坐标,峰面积为纵坐标建立标准曲线。
2.4.2 精密度精密称取同一羌活(青海)样品0.200 g,用2.3项下的样品制备方法制备样品,在同一色谱条件下连续进样6次,进样体积均为5 μL,计算新绿原酸、绿原酸、阿魏酸、羌活醇、异欧前胡素的峰面积,分别计算5成分峰面积的RSD。
2.4.3 重复性精密称取6份同一羌活(青海)样品0.200 g,用2.3项下的样品制备方法制备6份样品,在同一色谱条件下分别进样,进样体积为5 μL,计算新绿原酸、绿原酸、阿魏酸、羌活醇、异欧前胡素的峰面积,分别计算5成分峰面积的RSD。
2.4.4 稳定性精密称取同一羌活(青海)样品0.200 g,用2.3项下的样品制备方法制备1份样品,在同一色谱条件下,分别在0、2、4、8、16、24 h进样,分别计算5成分峰面积的RSD。
2.4.5 加样回收率精密称定0.100 g羌活(青海)药材粉末于10 mL内,加入各成分含量与药材中含量相近的已知量的标准品,连续称取3份,分别加80%甲醇定容、称质量,超声30 min后取出放至室温,补足质量,摇匀,将样品溶液置于离心管中14 000 r/min离心10 min,上清液用0.45 μm微孔滤膜过滤,进样分析,记录各指标成分的峰面积,计算含量,求出各成分的加样回收率。
3 结果 3.1 羌活提取条件的优化为充分提取出羌活中5种成分,本研究采用正交实验对羌活的提取条件进行了优化,以化合物含量为指标,选用L9(34)设计实验,采用三因素三水平考察了物料比、溶剂的比例、超声时间对提取率的影响,实验设计的因素-水平表见表 1。
以新绿原酸、绿原酸、阿魏酸、羌活醇、异欧前胡素的质量百分含量之和为指标,对实验结果进行直观分析。直观分析结果见表 2。
| 实验号 | 时间 | 序号 | 实验结果 (%) |
|||
| 溶剂 | 物料比 | |||||
| 1 | 1 | 1 | 1 | 1 | 1.601 3 | |
| 2 | 1 | 2 | 2 | 2 | 2.471 2 | |
| 3 | 1 | 3 | 3 | 3 | 1.835 8 | |
| 4 | 2 | 1 | 2 | 3 | 2.398 4 | |
| 5 | 2 | 2 | 3 | 1 | 3.028 8 | |
| 6 | 2 | 3 | 1 | 2 | 3.570 7 | |
| 7 | 3 | 1 | 3 | 2 | 2.472 2 | |
| 8 | 3 | 2 | 1 | 3 | 3.813 7 | |
| 9 | 3 | 3 | 2 | 1 | 2.813 3 | |
| 均值1 | 1.969 | 2.157 | 2.995 | 2.481 | ||
| 均值2 | 2.999 | 3.105 | 2.561 | 2.838 | ||
| 均值 3 | 3.033 | 2.740 | 2.446 | 2.683 | ||
| 极差 | 1.064 | 0.948 | 0.549 | 0.357 | ||
通过直观分析,发现影响羌活提取率的因素顺序为:提取时间>溶剂比例>物料比;确定最佳的提取条件为提取时间45 min,溶剂比例80%甲醇,物料比1:50。
3.2 方法学验证5个成分的标准曲线方程及相关系数见表 3,结果表明5个化合物线性关系良好。
| 标准品 | 回归方程 | 相关系数(r) | 线性范围(mg/L) |
| 新绿原酸 | Ŷ =12 426.0X- 87.472 | 0.999 3 | 0.14~ 9.2 |
| 绿原酸 | Ŷ=17 187.0X+4 065.900 | 0.996 7 | 1.56~600.0 |
| 阿魏酸 | Ŷ=26 489.0X+1 813.000 | 0.999 9 | 0.31~120.0 |
| 羌活醇 | Ŷ= 5 671.9X+ 368.240 | 0.999 8 | 0.05~320.0 |
| 异欧前胡素 | Ŷ= 9 820.6X+5 786.000 | 0.999 9 | 1.56~600.0 |
精密度实验结果中各化合物峰面积的RSD均小于2%,表明仪器的精密度良好。重复性实验结果中各化合物峰面积的RSD均小于5%,说明方法的重复性良好。稳定性实验结果中各化合物峰面积的RSD均小于4%,表明羌活样品在24 h内稳定,实验结果见表 4。加样回收率实验结果表明,各成分的平均回收率均在95%~105%范围内,见表 5。
| % | |||
| 成分 | 精密度实验 | 重复性实验 | 稳定性实验 |
| 新绿原酸 | 1.60 | 3.64 | 0.75 |
| 绿原酸 | 0.89 | 4.79 | 0.82 |
| 阿魏酸 | 1.48 | 3.50 | 3.72 |
| 羌活醇 | 0.76 | 1.67 | 0.42 |
| 异欧前胡素 | 0.61 | 1.81 | 0.57 |
| 成分 | 样品中含量 (μg) |
加入量 (μg) |
测得量 (μg) |
回收率 (%) |
平均回收率 (%) |
RSD (%) |
| 新绿原酸 | 2.06 | 2.10 | 4.18 | 101.0 | 103 | 1.5 |
| 2.10 | 4.22 | 103.0 | ||||
| 2.10 | 04.24 | 104.0 | ||||
| 绿原酸 | 13.50 | 13.50 | 26.70 | 097.8 | 100 | 2.4 |
| 13.50 | 27.07 | 101.0 | ||||
| 13.50 | 27.35 | 103.0 | ||||
| 阿魏酸 | 7.26 | 7.30 | 14.54 | 099.8 | 105 | 4.4 |
| 7.30 | 14.95 | 105.0 | ||||
| 7.30 | 15.21 | 109.0 | ||||
| 羌活醇 | 38.42 | 38.40 | 76.81 | 099.9 | 99.9 | 0.2 |
| 38.40 | 76.76 | 099.8 | ||||
| 38.40 | 76.86 | 100.0 | ||||
| 异欧前胡素 | 37.17 | 37.20 | 74.98 | 102.0 | 104 | 4.6 |
| 37.20 | 78.07 | 110.0 | ||||
| 37.20 | 74.93 | 102.0 |
将2.2和2.3项制备的样品溶液与混合对照品溶液进行高效液相色谱法(HPLC)分析,得到混合对照品溶液和羌活药材(青海)的HPLC色谱图,见图 1。
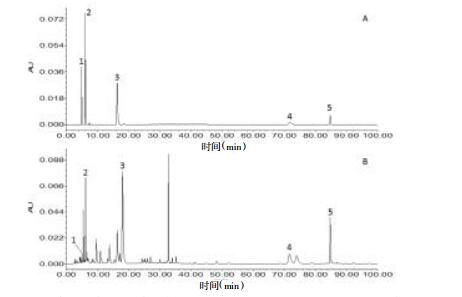
|
| 图 1 羌活药材(1号)及混合对照品溶液的HPLC色谱图 A:羌活混标;B:羌活样品。1:新绿原酸;2:绿原酸;3:阿魏酸;4:羌活醇;5:异欧前胡素 |
利用所建立分析方法对16批不同产地的羌活样品溶液进行HPLC分析,记录色谱图,计算峰面积,按标准曲线计算出含量,结果见表 6。
| mg/g | ||||||
| 批次 | 产地 | 新绿 原酸 | 绿原酸 | 阿魏酸 | 羌活醇 | 异欧前胡素 |
| 1 | 青海 | 0.19 | 1.16 | 0.91 | 3.79 | 3.94 |
| 2 | 四川 | 0.13 | 0.92 | 0.73 | 0.62 | 4.33 |
| 3 | 四川 | 0.09 | 0.29 | 0.58 | 1.92 | 02.05 |
| 4 | 四川 | 0.02 | 0.15 | 0.10 | 0.00 | 07.49 |
| 5 | 四川 | 0.13 | 2.98 | 0.46 | 0.43 | 01.25 |
| 6 | 四川 | 0.14 | 0.94 | 0.69 | 0.23 | 04.57 |
| 7 | 四川 | 0.10 | 0.25 | 0.49 | 0.00 | 16.80 |
| 8 | 甘肃 | 0.14 | 0.59 | 0.66 | 0.89 | 03.56 |
| 9 | 甘肃 | 0.26 | 1.26 | 1.19 | 3.02 | 06.13 |
| 10 | 甘肃 | 0.08 | 0.19 | 0.44 | 0.64 | 06.37 |
| 11 | 甘肃 | 0.29 | 0.61 | 2.14 | 7.86 | 06.40 |
| 12 | 内蒙古 | 0.09 | 0.37 | 0.76 | 2.08 | 00.58 |
| 13 | 安徽 | 0.05 | 0.13 | 0.27 | 1.11 | 00.55 |
| 14 | 山西 | 0.04 | 0.40 | 0.89 | 2.88 | 00.97 |
| 15 | 山西 | 0.09 | 1.94 | 0.80 | 4.99 | 01.72 |
| 16 | 山西 | 0.03 | 0.90 | 1.03 | 6.32 | 02.03 |
结果显示,不同产地的羌活中,各指标化合物的含量变化范围较大,新绿原酸的含量范围是0.03~0.29 mg/g,绿原酸的含量范围是0.13~2.98 mg/g,阿魏酸的含量范围是0.10~2.14 mg/g,羌活醇的含量范围是0~6.32 mg/g,异欧前胡素的大致含量范围是0.55~16.8 mg/g。
4 结论不同产地的羌活药材中酚酸和黄酮两类成分的含量有显著差异。表明中药市场中羌活药材的质量差异较大,原因众多,可能是由植物基源、生长环境、采收加工等,储存运输等因素造成的。因此,对羌活药材中的指标成分的含量进行控制必不可少。本研究以新绿原酸、绿原酸、阿魏酸、羌活醇、异欧前胡素等成分为指标,建立对这两类化合物同时定量的HPLC-UV分析方法,为羌活质量控制提供技术支撑。
| [1] | 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京:中国医药出版社,2010:205. |
| [2] | 朱艺. 九味羌活软胶囊治疗感冒(风寒挟湿证)的临床研究[D]. 南京:南京中医药大学,2007. |
| [3] | 李锐, 王芸, 刘大宾. 九味羌活汤治疗药物性头痛39例[J]. 实用中医药杂志, 2002, 18 (8) : 12. |
| [4] | 李万. 不同体位牵引结合羌活胜湿汤治疗神经根型颈椎病(风寒湿痹型)的临床研究[D]. 长沙:湖南中医药大学,2013. |
| [5] | 吴惠明. 加味芍药甘草汤与羌活胜汤治疗颈椎病的疗效观察[J]. 中国中医骨伤科杂志, 2008, 16 (1) : 23–24. |
| [6] | 张鹏, 杨秀伟. 羌活化学成分进一步研究[J]. 中国中药杂志, 2008, 33 (24) : 2918–2921. |
| [7] | 陈智煌, 廖华军, 刘晨, 等. 羌活挥发油的GC-MS分析及其抗炎镇痛的药理作用初探[J]. 海峡药学, 2015, 27 (8) : 20–23. |
| [8] | 路新强, 胡燕, 肖文彬. 羌活提取物对实验性心律失常的保护作用[J]. 军事医学科学院院刊, 1992 (4) : 272–274. |
| [9] | 武新华, 王北香. 自拟芎归羌活人参汤治疗冠心病心绞痛65例[J]. 中医药研究, 2002, 18 (2) : 19. |
| [10] | 李娆娆. 羌活中的2个抗菌活性成分[J]. 国外医学:中医中药分册, 2003, 25 (5) : 304. |
| [11] | 宋建华. 金银花解热抗炎作用的实验研究[J]. 重庆医学, 2011, 40 (25) : 2552–2553. |
| [12] | 宋亚玲, 王红梅, 倪付勇, 等. 金银花中酚酸类成分及其抗炎活性研究[J]. 中草药, 2015, 46 (4) : 490–495. |
| [13] | 赵文红, 邓泽元, 范亚苇, 等. 阿魏酸体外抗氧化作用研究[J]. 食品科学, 2010, 29 (1) : 219–223. |
| [14] | 洪倩. 阿魏酸抗辐射活性及其作用机制研究[D]. 北京:中国人民解放军军事医学科学院,2012. |
| [15] | 吴建良, 沈敏敏, 杨水新, 等. 阿魏酸对小胶质细胞炎性反应的抑制作用[J]. 中国药理学通报, 2015, 31 (1) : 97–102. |
| [16] | Kleiner HE, Reed MJ, DiGiovanni J. Naturally occurring coumarins inhibit human cytochromes P450 and block benzo[a] pyrene and 7, 12-dimethylbenz[a] anthracene DNA adduct formation in MCF-7 cells[J]. Chemical research in toxicology, 2003, 16 (3) : 415–422. |
| [17] | 张雪霞. 羌活的抗肿瘤活性成分研究[D]. 石家庄:河北医科大学药学院,2009. |
| [18] | 李振坤, 刘玫琦, 杨洪军. 伞形科辛味中药主要化学成分对离体血管作用研究[J]. 中药药理与临床, 2009, 25 (1) : 38–40. |
| [19] | Nie H, Meng L, Zhou J, et al. Imperatorin is responsible for the vasodilatation activity of Angelica dahurica var. formosana regulated by nitric oxide in an endothelium dependent manner[J]. Chinese journal of integrative medicine, 2009, 15 : 442–447. |
| [20] | Tsassi VB, Hussain H, Meffo BY, et al. Antimicrobial coumarins from the stem bark of Afraegle paniculata[J]. Natural product communications, 2010, 5 (4) : 559–561. |
| [21] | 古丽娜·沙比尔, 郭洪祝, 郭慧, 等. HPLC法测定羌活中阿魏酸、羌活醇、苯乙基阿魏酸酯和异欧前胡素[J]. 中草药, 2006, 37 (6) : 937–940. |
 2016, Vol. 35
2016, Vol. 35




