文章信息
- 陆宁, 刘晓东, 谢晓娟, 汪旭
- LU Ning, LIU Xiao-dong, XIE Xiao-juan, WANG Xu
- ⅠA期乳腺癌临床病理特征、中医证型及预后相关因素分析
- Analysis of clinicopathological characteristics and syndromes of traditional Chinese medicine and prognostic factors in breast cancer patients of stageⅠA
- 天津中医药大学学报, 2016, 35(4): 225-229
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(4): 225-229
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.04.03
-
文章历史
收稿日期: 2016-05-23
近几十年来,乳腺癌发病率呈上升趋势,已成为女性最常见的恶性肿瘤。中医认为乳腺癌相当于中医的“乳岩”、“乳石痈”、“乳痞”、“乳发”、“乳核”、“妒乳”等范畴。伴随着健康意识的提高,影像学诊断技术发展,更多的患者在早期即得到明确诊断。针对这些淋巴结阴性且体积小的早期乳腺癌(T1N0M0,ⅠA期)治疗方案的选择也是个体化治疗中重要的组成部分。本研究通过回顾性分析156例早期乳腺癌患者的临床病理特征、中医证型、治疗及预后,为临床个体化治疗提供有效的理论±据。
1 资料与方法 1.1 临床资料 1.1.1 病例选择收集2004年1月—2009年12月天津医科大学肿瘤医院收治的156例早期乳腺癌(T1N0M0,ⅠA期)的临床病理资料,患者全部为女性,早期乳腺癌诊断均经病理学(手术标本或穿刺标本)证实,且具备完整病历和随访资料。排除标准为临床资料不完整及合并其他恶性肿瘤病史者。
中医证型诊断,患者见乳房结块,皮色如常,质地坚硬,多伴有情志不调、心胸憋闷或两胁胀痛,舌苔薄白者辨为情志郁结证;症见乳房结块坚硬且伴月经不调或婚后未育或生育过多,舌见淡红者辨为冲任失调证;症见胸部囊肿破溃,血水淋漓,或臭秽不堪,剧痛色紫,身体羸瘦者,辨为燥毒蕴结证。若患者胸部不断渗流血水,剧痛难忍,兼见面色苍白,不思饮食及动辄气短喘甚者,辨证为气血双亏兼邪毒内陷证。
1.1.2 观察指标雌激素受体(ER)、孕激素受体(PR)采用免疫组织化学方法检测,阳性细胞≥10%为阳性。人表皮生长因子受体-2(HER-2)按照美国临床肿瘤学会(ASCO)/美国病理学家协会(CAP)指南推荐的评分系统判定结果。HER-2免疫组织化学染色0或(+)被判定为阴性,(+++)被判定为阳性,(++)者采用荧光原位杂交(FISH)进行验证,未进一步进行FISH验证的HER-2染色(++)被归入表达不详组。Ki-67的表达水平以免疫组化染色阳性细胞的百分率来计算,阳性细胞数<14%为低表达,阳性细胞数≥14%为高表达。按2012年WHO肿瘤组织学分级:根据腺管形成程度、细胞核多形性以及核分裂计数,每项评分从1~3分,然后将3类分数相加,评出3个等级:3~5分为Ⅰ级,6~7分为Ⅱ级,8~9分为Ⅲ级。
1.2 方法 1.2.1 治疗部分患者术后(保乳术或改良根治术)接受CMF(环磷酰胺+甲氨蝶呤+氟尿嘧啶)方案、AC(蒽环类+环磷酰胺)方案、TC(多西他赛+环磷酰胺)方案或其他方案化疗,HER-2患者接受曲妥珠单抗治疗;其他患者未接受化疗及抗HER-2靶向治疗;部分患者接受术后放疗。
1.2.2 随访采用住院检查、门诊复查或电话询问方式对所有患者进行随访。随访开始时间为确诊为乳腺癌的时间,随访截止日为 2015年12月31日。无进展生存(PFS)时间是从确诊为乳腺癌的时间至出现疾病进展的时间,总生存(OS)时间是从确诊为乳腺癌的时间至任何原因所致死亡的时间或随访截止日。
1.3 统计学分析采用SPSS 22.0统计软件进行统计学分析。计数资料比较采用χ2检验,应用Kaplan-Meier法进行生存分析,单因素分析采用Log-rank检验,多因素分析采用Cox比例风险回归模型。P<0.05为差异具有统计学意义。
2 结果 2.1 临床病理特征患者初诊为ⅠA期(T1N0M0)乳腺癌时的中位年龄为55岁(32~76岁),见表 1。
| 临床病理特征 | 例数(%) |
| 年龄(岁) | |
| ≤35 | 29(18.6) |
| >35 | 127(81.4) |
| 病理类型 | |
| 浸润性导管癌 | 115(73.7) |
| 浸润性小叶癌 | 12( 7.7) |
| 其他 | 29(18.6) |
| 临床分期 | |
| T1mic~T1a(≤5 mm) | 34(21.8) |
| T1b(>5 mm,≤10 mm) | 45(28.8) |
| T1c(>10 mm,≤20 mm) | 77(49.4) |
| 组织学分级 | |
| Ⅰ级 | 19(12.2) |
| Ⅱ级 | 79(50.6) |
| Ⅲ级 | 58(37.2) |
| 受体类型 | |
| ER/PR(+), HER-2(-) | 70(44.9) |
| ER/PR(+), HER-2-(+) | 28(17.9) |
| ER/PR(-), HER-2(+) | 16(10.3) |
| ER/PR(-), HER-2(-) | 42(26.9) |
| Ki-67 | |
| <14% | 50(32.0) |
| ≥14% | 106(68.0) |
| 淋巴脉管癌栓 | |
| 有 | 76(48.7) |
| 无 | 80(51.3) |
| 术式 | |
| 保乳术 | 68(43.6) |
| 改良根治术 | 83(53.2) |
| 未手术 | 5( 3.2) |
| 新辅助化疗 | |
| 有 | 141(90.4) |
| CMF | 17(10.9) |
| AC | 54(34.6) |
| CAF | 33(21.2) |
| TA | 28(17.9) |
| AC→T | 9( 5.8) |
| 无 | 15( 9.6) |
| 应用曲妥珠单抗 | |
| 有 | 32(20.5) |
| 无 | 124(79.5) |
| 放疗 | |
| 有 | 40(25.6) |
| 无 | 116(74.4) |
中医辨证分为肝气郁结证、冲任失调证、燥毒蕴结证、气血双亏及邪毒内陷证4型,见表 2。
| 中医证候分型 | 例数(%) |
| 肝气郁结证 | 61(39.1) |
| 冲任失调证 | 52(33.3) |
| 燥毒蕴结证 | 27(17.3) |
| 气血双亏、邪毒内陷证 | 16(10.3) |
行保乳手术68例(43.6%),行改良根治术83例(53.2%),其余5例(3.2%)未接受手术;术后行辅助化疗141例(90.4%),其中以AC方案为多,为54例(34.6%),其他方案包括:CAF方案33例(21.2%),TA方案28例(17.9%),CMF方案17例(10.9%),AC→T方案9例(5.8%),15例(9.6%)未行辅助化疗;术后应用曲妥珠单抗32例(20.5%);术后放疗40例(25.6%)。
2.4 生存分析 2.4.1 单因素分析所有ⅠA期(T1N0M0)乳腺癌患者的中位随访期为43个月,5 a PFS为93.3%,5 a OS为99.1%。复发和转移共有10例,胸壁复发3例,同侧锁骨上淋巴结转移2例,肺转移2例和肝转移3例,其中1例肺转移在确诊后51个月死亡,2例肝转移患者分别在确诊后37个月及42个月死亡。3例复发转移患者为T1b期,7例为T1c期;组织学Ⅱ级2例,组织学Ⅲ级8例。全部3例死亡患者均为浸润性导管癌、组织学Ⅱ~Ⅲ级、Ki-67≥14%及淋巴脉管侵犯。单因素分析结果显示,组织学分级、Ki-67表达及淋巴脉管侵犯与患者的PFS相关(P<0.05),而年龄、病理学类型、分期、分子亚型、手术方式、化疗、曲妥珠单抗及放疗对PFS无明显影响,见表 3。
| 变量 | n | 复发/转移(例) | PFS(5-year/%) | P | 死亡(例) | OS(5-year/%) | P |
| 年龄(岁) | 0.307 | 0.711 | |||||
| ≤35 | 29 | 3 | 96.1 | 1 | 99.9 | ||
| >35 | 127 | 7 | 98.1 | 2 | 99.0 | ||
| 病理类型 | 0.612 | 0.945 | |||||
| 浸润性导管癌 | 115 | 8 | 92.1 | 3 | 98.6 | ||
| 浸润性小叶癌 | 12 | 0 | 95.4 | 0 | 99.1 | ||
| 其他 | 29 | 2 | 97.2 | 0 | 98.9 | ||
| 临床分期 | 0.891 | 0.758 | |||||
| T1mic~T1a(≤5 mm) | 34 | 0 | 97.9 | 0 | 99.9 | ||
| T1b(>5 mm,≤10 mm) | 45 | 3 | 97.1 | 0 | 99.4 | ||
| T1c(>10 mm,≤20 mm) | 77 | 7 | 96.3 | 3 | 98.3 | ||
| 组织学分级 | 0.039 | 0.069 | |||||
| Ⅰ级 | 19 | 0 | 100.0 | 0 | 100.0 | ||
| Ⅱ级 | 79 | 2 | 94.8 | 0 | 98.6 | ||
| Ⅲ级 | 58 | 8 | 89.1 | 3 | 97.3 | ||
| 受体类型 | 0.062 | 0.477 | |||||
| ER/PR(+), HER-2(-) | 70 | 0 | 99.2 | 0 | 99.8 | ||
| ER/PR(+), HER-2-(+) | 28 | 1 | 98.7 | 0 | 99.3 | ||
| ER/PR(-), HER-2(+) | 16 | 3 | 96.4 | 1 | 98.1 | ||
| ER/PR(-), HER-2(-) | 42 | 6 | 90.1 | 2 | 91.6 | ||
| Ki-67 | 0.046 | 0.070 | |||||
| <14% | 50 | 2 | 97.4 | 0 | 98.9 | ||
| ≥14% | 106 | 8 | 92.8 | 3 | 97.1 | ||
| 淋巴脉管癌栓 | 0.041 | 0.082 | |||||
| 有 | 76 | 9 | 94.0 | ||||
| 无 | 80 | 1 | 99.1 | ||||
| 术式 | 0.0501 | 0.722 | |||||
| 保乳术 | 68 | 4 | 95.9 | 1 | 97.8 | ||
| 改良根治术 | 83 | 3 | 96.5 | 0 | 99.1 | ||
| 未手术 | 5 | 3 | 93.8 | 2 | 96.0 | ||
| 新辅助化疗 | 0.521 | 0.679 | |||||
| 有 | 141 | 7 | 96.6 | 0 | 99.8 | ||
| CMF | 17 | 2 | 96.5 | 1 | 99.7 | ||
| AC | 54 | 1 | 97.1 | 0 | 99.9 | ||
| CAF | 33 | 2 | 96.9 | 0 | 99.8 | ||
| TA | 28 | 1 | 96.8 | 0 | 99.4 | ||
| AC→T | 9 | 1 | 97.0 | 1 | 99.7 | ||
| 无 | 15 | 3 | 95.1 | 1 | 99.3 | ||
| 应用曲妥珠单抗 | 0.650 | 0.891 | |||||
| 有 | 32 | 2 | 98.4 | 1 | 99.1 | ||
| 无 | 124 | 8 | 97.8 | 2 | 98.8 | ||
| 放疗 | 0.873 | 0.853 | |||||
| 有 | 40 | 4 | 97.6 | 2 | 99.9 | ||
| 无 | 116 | 6 | 97.5 | 1 | 99.2 |
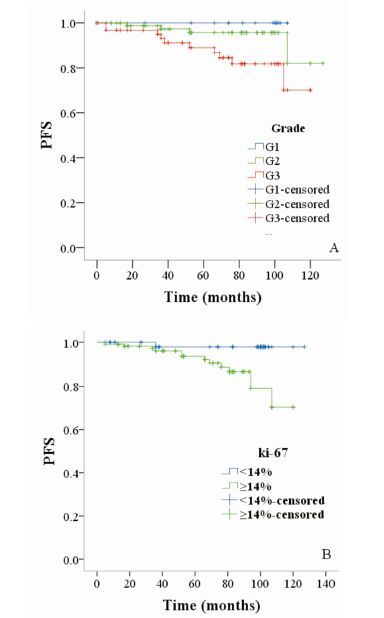
组织学分级及Ki-67表达情况是影响患者PFS的独立预后因素(P<0.05),见表 4,即组织学分级低及Ki-67<14%患者的PFS优于组织学分级高及Ki-67≥14%者,见图 1。
| 变量 | B | SE | Exp(B) | 95%CI for Exp(B) | P value |
| 年龄 | 0.783 | 0.523 | 1.912 | 0.605~3.237 | 0.783 |
| 病理学类型 | 2.340 | 1.569 | 5.897 | 1.492~10.934 | 0.601 |
| 临床分期 | 1.856 | 1.005 | 2.574 | 1.089~5.630 | 0.680 |
| 组织学类型 | 0.256 | 0.673 | 2.266 | 1.457~4.639 | 0.027 |
| 受体类型 | 1.088 | 0.721 | 3.001 | 1.562~5.782 | 0.196 |
| Ki-67 | 1.539 | 0.874 | 2.501 | 0.349~6.443 | 0.018 |
| 淋巴脉管癌栓 | 0.783 | 0.502 | 0.831 | 0.129~2.403 | 0.391 |
| 术式 | 0.187 | 0.598 | 1.171 | 0.842~1.735 | 0.802 |
| 新辅助化疗 | 0.096 | 0.178 | 0.743 | 0.495~1.620 | 0.058 |
| 应用曲妥珠单抗 | 1.896 | 1.220 | 3.097 | 2.013~6.320 | 0.344 |
| 放疗 | 2.903 | 3.465 | 2.995 | 1.990~6.485 | 0.532 |
|
| 图 1 ⅠA期(T1N0M0)乳腺癌患者不同组织学分级及Ki-67表达情况与PFS比较 |
M.D. Anderson研究显示淋巴结阴性、体积小的乳腺癌总体预后可[2-4]。虽然ⅠA期(T1N0M0)乳腺癌预后好,但某些亚组的患者预后差,复发转移风险较高。肿瘤组织学分级Ⅲ级的5a无病生存(DFS)风险明显高于Ⅰ~Ⅱ级(83.9% vs. 90.3%,P=0.000 9),Ki-67高表达者复发转移风险高于低表达者(≤15% vs.>15% :92.3% vs. 84.8%,P=0.05)[5-6]。本研究发现组织学分级、Ki-67表达以及淋巴脉管侵犯与患者的PFS相关,组织学分级及Ki-67表达情况是影响患者PFS的独立预后因素。
Vaz-Luis等[7]对NCCN数据库中4 113例淋巴结阴性、小肿瘤的治疗及转归分析,提示早期复发风险较低的患者即使不化疗预后同样好。本研究发现ⅠA期(T1N0M0)乳腺癌患者5 a PFS为96.3%,5 a OS为99.1%。正因为该部分患者对化疗绝对获益较小,针对此类低危乳腺癌治疗方案的研究相对缺乏。故如何选出ⅠA期(T1N0M0)中的那些预后差并能从全身辅助治疗中获益的患者是目前面临的课题之一。
Colleoni等[8]对2 257例接受经典CMF方案或内分泌治疗的淋巴结阴性乳腺癌患者进行分析,提示该经典方案仍为淋巴结阴性乳腺癌的治疗选择之一。MA5试验进一步比较了CEF方案与传统CMF方案在早期乳腺癌中的疗效,Meta分析显示HER-2阳性肿瘤从蒽环类化疗中获益最大[9],另外,也有研究[9]证明了4周期TC方案在早期乳腺癌中优于传统的AC方案(DFS:TC 81% vs. AC 75%,P=0.003,OS:87% vs. 82%,P=0.032)。
2015 St. Gallen会议上,Winner教授认为对于此类低风险乳腺癌应根据肿瘤大小、亚型、分级及患者年龄等因素确认需要化疗以降低复发风险的患者,T1a、T1b期肿瘤可给予简单方案化疗(AC、TC、CMF),T1c期肿瘤可采用三阴性乳腺癌(TNBC)标准治疗方案如蒽环类联合或序贯紫杉类药物[11-12]。本研究中的ⅠA期(T1N0M0)乳腺癌患者接受了较高比率(90.4%)的辅助化疗,但单因素分析显示包括AC、CMF、CAF、TA 及AC→T方案对PFS无明显影响,可见出于风险效益比的考虑,此类乳腺癌化疗对于化疗药物的选择需尤为慎重。
一项Meta分析结果显示,无论是激素受体阳性还是阴性的患者,曲妥珠单抗治疗HER-2阳性小肿瘤患者的预后很好[13-14]。本研究中HER-2阳性患者占25%,但曲妥珠单抗的使用对PFS无明显影响,其不是影响该类乳腺癌患者PFS的独立危险因素。目前指南及专家共识强力推荐在T1bN0及以上分期的HER-2阳性乳腺癌患者接受抗HER-2治疗;T1aN0的HER-2阳性乳腺癌患者,抗HER-2治疗带来的风险及不良反应可能超过其治疗获益。
中医理论认为乳腺癌的发病机制主要是正气不足、风寒内侵、七情内伤、所愿不遂、郁结伤肝、引起体内脏腑功能紊乱、冲任失调,降低了机体对肿瘤细胞的监视抵抗力,在癌基因作用和机体免疫功能低下时终致气滞血瘀、邪毒蕴内,痰浊交凝,结滞乳部而成乳腺癌[15]。“毒邪”是贯穿乳腺癌发生、发展和转移始终的病因和病理产物,“六淫伏毒”和“七情郁毒”是乳腺癌发生的两大主要病因,“癌毒内生”是乳腺癌发生的核心变化,“痰毒瘀结”是乳腺癌发展的核心病机,“余毒未清”是术后的主要病机,“余毒旁窜”是术后复发转移的关键病机,“散结解毒”是术后抗复发转移治疗的重要治则[16]。
综上,ⅠA期(T1N0M0)乳腺癌患者虽然预后较好,但某些亚组患者预后较差,存在明显的复发转移风险。本研究发现,组织学分级及Ki-67表达情况是影响患者PFS的独立预后因素,肿瘤组织学分级越高及Ki-67表达越高则预后越差,在结合患者淋巴脉管侵犯情况及分子亚型等进行综合评估的基础上,可为ⅠA期(T1N0M0)乳腺癌的辅助化疗提供参考±据。但本研究的是回顾性研究且入组病例较少,随访时间较短,患者仍需要更多循证医学证据为临床治疗的选择提供±据。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics[J]. CA Cancer J Clin, 2014, 64 (1) : 9–29. DOI:10.3322/caac.21208 |
| [2] | Gonzalez-Angulo AM, Litton JK, Broglio KR, et al. High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor 2-positive, node-negative tumors 1 cm or smaller[J]. J Clin Oncol, 2009, 27 (34) : 5700–5706. DOI:10.1200/JCO.2009.23.2025 |
| [3] | Parinyanitikul N, Lei X, Chavez-MacGregor M, et al. Receptor status change from primary to residual breast cancer after neoadjuvant chemotherapy and analysis of survival outcomes[J]. Clin Breast Cancer, 2015, 15 (2) : 153–160. DOI:10.1016/j.clbc.2014.09.006 |
| [4] | Le Du F, Eckhardt BL, Lim B, et al. Is the future of personalized therapy in triple-negative breast cancer based on molecular subtype[J]. Oncotarget, 2015, 6 (15) : 12890–12908. DOI:10.18632/oncotarget |
| [5] | Gamucci T, Vaccaro A, Ciancola F, et al. Recurrence risk in small, node-negative, early breast cancer: a multicenter retrospective analysis[J]. J Cancer Res Clin Oncol, 2013, 139 (5) : 853–860. DOI:10.1007/s00432-013-1388-2 |
| [6] | Gonzalez-Angulo AM, Akcakanat A, Liu S, et al. Open-label randomized clinical trial of standard neoadjuvant chemotherapy with paclitaxel followed by FEC versus the combination of paclitaxel and everolimus followed by FEC in women with triple receptor-negative breast cancer[J]. Ann Oncol, 2014, 25 (6) : 1122–1127. DOI:10.1093/annonc/mdu124 |
| [7] | Vaz-Luis I, Ottesen RA, Hughes ME, et al. Outcomes by tumor subtype and treatment pattern in women with small, node-negative breast cancer: a multi-institutional study[J]. J Clin Oncol, 2014, 32 (20) : 2142–2150. DOI:10.1200/JCO.2013.53.1608 |
| [8] | Colleoni M, Cole BF, Viale G, et al. Classical cyclophosphamide, methotrexate, and fluorouracil chemotherapy is more effective in triple-negative, node-negative breast cancer: results from two randomized trials of adjuvant chemoendocrine therapy for node-negative breast cancer[J]. J Clin Oncol, 2010, 28 (18) : 2966–2973. DOI:10.1200/JCO.2009.25.9549 |
| [9] | Cheang MC, Voduc KD, Tu D, et al. Responsiveness of intrinsic subtypes to adjuvant anthracycline substitution in the NCIC. CTG MA.5 randomized trial[J]. Clin Cancer Res, 2012, 18 (8) : 2402–2412. DOI:10.1158/1078-0432.CCR-11-2956 |
| [10] | Jones S, Holmes FA, O'Shaughnessy J, et al. Docetaxel With Cyclophosphamide Is Associated With an Overall Survival Benefit Compared With Doxorubicin and Cyclophosphamide: 7-Year Follow-Up of US Oncology Research Trial 9735[J]. J Clin Oncol, 2009, 27 (8) : 1177–1183. DOI:10.1200/JCO.2008.18.4028 |
| [11] | Coates AS, Winer EP, Goldhirsch A, et al. Tailoring therapies--improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015[J]. Ann Oncol, 2015, 26 (8) : 1533–1546. DOI:10.1093/annonc/mdv221 |
| [12] | Goldhirsch A, Winer EP, Coates AS, et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J]. Ann Oncol, 2013, 24 (9) : 2206–2223. DOI:10.1093/annonc/mdt303 |
| [13] | Early Breast Cancer Trialists' Collaborative Group (EBCTCG), Peto R, Davies C, et al. Comparisons between different polychemotherapy regimens for early breast cancer: meta-analyses of long-term outcome among 100, 000 women in 123 randomised trials[J]. Lancet, 2012, 379 (9814) : 432–444. DOI:10.1016/S0140-6736(11)61625-5 |
| [14] | Early Breast Cancer Trialists' Collaborative Group (EBCTCG), Coleman R, Powles T, et al. Adjuvant bisphosphonate treatment in early breast cancer: meta-analyses of individual patient data from randomised trials[J]. Lancet, 2015, 386 (10001) : 1353–1361. DOI:10.1016/S0140-6736(15)60908-4 |
| [15] | 曾青青, 王鹏, 潘桂湘, 等. 中药逆转MCF-7/ADM细胞多药耐药机制的研究进展[J]. 天津中医药, 2015, 32 (4) : 253–256. |
| [16] | 章迅, 吴艾平, 章永红. 石榴皮多酚对人乳腺癌细胞MDA-MB-231增殖及凋亡的影响[J]. 天津中医药大学学报, 2012, 31 (4) : 214–217. |
 2016, Vol. 35
2016, Vol. 35


