文章信息
- 梅莎莎, 宋恩峰, 项琼
- MEI Sha-sha, SONG En-feng, XIANG Qiong
- 黄芪注射液对高糖介导的肾小管上皮细胞NF-κB表达的影响
- Influence of Astragalus on expression of nuclear factor-κB induced by high glucose in human proximal renal tubular epithelial cells
- 天津中医药大学学报, 2016, 35(4): 253-257
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(4): 253-257
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.04.09
-
文章历史
收稿日期: 2016-04-15
近年来糖尿病肾病(DN)严重威胁着人们的健康。肾小管病变在糖尿病肾病的发病机制中有重要作用,而高血糖可作为独立的危险因子损伤肾小管。体外高糖培养肾小管上皮细胞(HK-2),可激活核转录因子-κB(NF-κB)的表达,调节炎性介质,是DN炎性反应的中心环节,也是炎症细胞积聚的重要特征,其表达量的增加可能诱导肾小管上皮细胞的凋亡,致使肾小管损伤。中医学认为糖尿病肾病发病机制为本虚标实之症,治疗以扶正祛邪,攻补兼施为主[1-3]。研究表明黄芪对NF-κB具有抑制作用,能够降低肾炎大鼠肾皮质NF-κB的表达,改善肾脏组织病理学损伤[4],但黄芪注射液能否降低HK-2细胞NF-κB的表达尚不清楚。本文用黄芪注射液对高糖环境下HK-2细胞进行干预,探讨其是否降低NF-κB蛋白表达,保护HK-2细胞,从而起到治疗糖尿病肾病的作用。
1 材料与方法 1.1 材料人近端肾小管上皮细胞株(HK-2),武汉大学人民医院肾内科实验室惠赠;DMEM高糖、低糖培养液,吉诺生物医药技术有限公司;胎牛血清,赛默飞世尔生物化学制品有限公司;0.25%胰酶溶液、青-链霉素溶液、磷酸盐缓冲液(PBS),吉诺生物医药技术有限公司;苯甲基碛酰氟(PMSF)、RIPA裂解液、BCA蛋白浓度测定试剂盒,碧云天;GAPDH抗体,杭州贤至生物有限公司;HRP标记羊抗兔二抗,武汉博士德生物工程有限公司;NF-ΚBp65,Bioworlde;黄芪注射液,哈尔滨圣泰制药股份有限公司,国药准字Z23020820。
1.2 方法 1.2.1 细胞培养HK-2细胞用含10%胎牛血清及1%双抗的DMEM低糖培养基,在37 ℃、5%CO2培养箱中培养。倒置显微镜观察细胞铺满瓶底约80%~90%时可进行细胞传代。
1.2.2 细胞分组将细胞移至六孔板中培养至细胞融合至80%,将培养基换成无血清DMEM低糖培养基培养24 h后,弃去无血清培养基。将细胞分为5组:1)低糖对照组(A组):低糖培养基含D-葡萄糖5.5 mmol/L;2)高糖组(B组):高糖培养基含D-葡萄糖25 mmol/L;3)高糖+黄芪注射液小剂量组(C组):高糖培养基+2 mg/L黄芪注射液;4)高糖+黄芪注射液中剂量组(D组):高糖培养基+20 mg/L黄芪注射液;5)高糖+黄芪注射液大剂量组(E组):高糖培养基+200 mg/L黄芪注射液,每组设3个复孔。于37 ℃培养箱中培养24、48、72 h,收集细胞及细胞上清液用于后续实验。
1.2.3 细胞形态观察倒置相差显微镜观察HK-2细胞形态变化。
1.2.4 Western Blot检测NF-κB蛋白表达 收集细胞,配制裂解液提取蛋白,测定蛋白浓度,将蛋白上样进行电泳。电泳结束后将凝胶移入转膜缓冲液固定,按转膜电极板阴极至阳极方向,±次叠放滤纸、电泳凝胶、膜及滤纸。转膜完毕后将膜置人含5%(W/V)脱脂奶粉的磷酸盐吐温缓冲液(PBST)中,室温下封闭1 h。封闭液稀释一抗,室温下反应2 h,或4 ℃反应过夜,用PBST洗涤3次,每次5 min用封闭液稀释荧光二抗,室温下反应30 min,用PBST洗涤3次,每次5 min。每张膜滴加适量的ECL底物液,孵育数分钟。等荧光条带显示清楚后,将多余的底物液用滤纸吸出,并将保鲜膜覆盖其上,待X胶片压片好后,±次放入显影液、定影进行显影和定影。
1.3 统计学方法采用SPSS 18.0软件处理。所有的数据均以均数±标准差(x±s)表示,采用单因素方差分析,组间比较用LSD检验,P<0.05认为差异有统计学意义。
2 结果 2.1 HK-2细胞形态变化A组细胞呈多边形生长,贴壁紧密,呈铺路石样排列,细胞间紧密连接,有较强折光性,分裂相明显。B组细胞呈梭形生长,贴壁性差,排列不规则,细胞连接松散,折光性差,分裂相及数量明显减少。C组细胞形态较B组变化不大,贴壁性较差,折光性较差。D组细胞成梭形,呈小片散在分布,折光性较弱,细胞数量较B组多,细胞连接较松散。E组细胞成梭形,贴壁较B组好,折光性减弱,细胞数量较多,连接较紧密。见图 1。

|
| 图 1 48 h各组HK-2细胞形态学改变 |
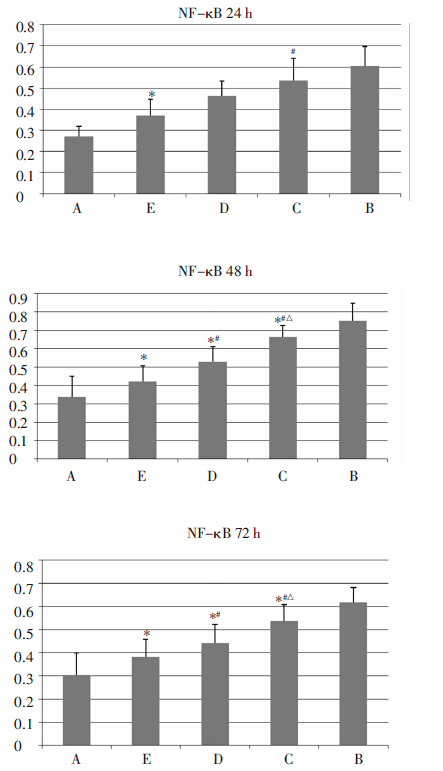
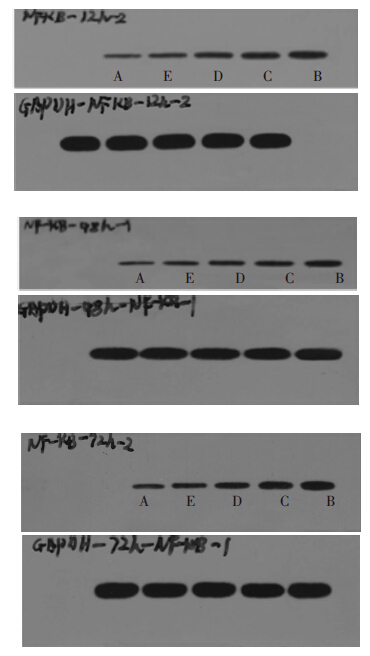
HK-2细胞在24、48、72 h 3个时间段A组中NF-κB蛋白表达量低,与B组有显著差异(P<0.05),表明高糖环境能诱导HK-2细胞NF-κB蛋白表达量的增加。24 h时间段E组与B组比较有显著性差异(P<0.05)。48 h和72 h两时间段C、D、E组与B组比较均有显著性差异(P<0.05),C、D、E组之间比较均有显著性差异(P<0.05)。以上结果表明,E组24 h能够明显抑制NF-κB蛋白表达。E、D、C组48、72 h均能够明显抑制NF-κB蛋白表达,且E、D、C 3组之间也有明显差异。见表 1。24、48、72 h NF-κB蛋白表达以A、E、D、C、B±次增加,柱状图中可见柱高±次增加,Western条带颜色±次加深,宽度增加。见图 2、图 3。
| 组别 | 24 h | 48 h | 72 h |
| A 组 | 0.271 3±0.048 8 | 0.297 0±0.061 5 | 0.303 7±0.096 8 |
| B 组 | 0.606 3±0.091 9 | 0.854 0±0.030 6 | 0.921 7±0.057 1 |
| C 组 | 0.537 7±0.103 3# | 0.617 7±0.009 1*#Δ | 0.578 7±0.031 3*#Δ |
| D 组 | 0.462 3±0.071 2 | 0.514 0±0.022 3*# | 0.469 7±0.022 7*# |
| E 组 | 0.371 0±0.075 0* | 0.408 3±0.068 3* | 0.345 3±0.031 9* |
| 注:与B 组比较,*P<0.05;与E 组比较,#P<0.05;与D 组比较, | |||
|
| 图 2 依次为24、48、72 h 不同浓度黄芪注射液对HK-2细胞NF-κB 蛋白表达的影响 与B 组比较,*P<0.05;与E 组比较,#P<0.05;与D 组比较,ΔP<0.05 |
|
| 图 3 依次为24、48、72h 不同浓度黄芪注射液对HK-2细胞NF-κB 表达的影响 |
近年来随着糖尿病发病率的不断升高,其常见并发症糖尿病肾病发病人数也不断上升,并引起了人们的关注。肾小球、肾小管、肾间质的损伤是糖尿病肾病的发病机制,其中肾小球损伤是DN的主要发病机制,近年研究发现肾小管损伤可能早于肾小球损伤,在DN患者蛋白尿排泄率正常时可能就已经发生了肾小管的损伤。肾间质纤维化和肾功能与肾小管病变联系密切,其密切程度优于肾小球硬化与肾功能的关系。
在糖尿病肾病发病过程中肾小管损伤的发生主要见于以下几方面:1)肾小管上皮细胞的凋亡。有研究表明对DN患者取肾脏组织进行病理检查发现肾小管及肾小球细胞都有明显凋亡,肾小管的凋亡程度与糖尿病病程及低密度脂蛋白胆固醇有相关性[5]。2)糖尿病肾病发病过程中会产生大量细胞因子及细胞产物,可导致肾小管上皮细胞肥大,肾小管基底膜受损及细胞外基质堆积,这些细胞产物及因子主要包括血管紧张素Ⅱ、活性氧簇(ROS)、晚期糖基化终末产物、转化生长因子β等。3)炎症反应。炎症反应对肾小管及肾间质的损伤有重要作用。4)肾小管间质纤维化。各种促进肾小管纤维化因子对糖尿病肾病发生发展有重要作用,如结缔组织生长因子(CTGF)、NF-κB、单核细胞趋化蛋白(MCP-1)等。
肾小管上皮细胞的损伤在多种肾脏病的进展中发挥着重要作用[6],该细胞被各种因素激活后可产生大量细胞因子及炎症介质,如白介素、肿瘤坏死因子、趋化因子、黏附分子等[7]。NF-κB在肾小管损伤中表达明显增加,可调控免疫因子及转录因子的表达,参与炎症、纤维化及细胞凋亡的过程。在肾脏组织中NF-κB主要表达于肾小管上皮细胞及间质细胞[8]。NF-κB在细胞中为无活性状态,当细胞受到刺激后,即以激活状态存在,并发挥其调控作用[9]。糖尿病肾病发病过程中NF-κB为炎症信号的主要传导通路[10]。有研究发现抑制NF-κB信号传导通路,可减轻糖尿病小鼠肾脏病变[11],而激活NF-κB信号传导通路,则可诱导炎症因子的释放及巨噬细胞浸润,促进糖尿病肾病的发病进程,其中高糖环境是常见的激活该通路的因素之一[12]。
在糖尿病肾病发病过程中高血糖是一个重要的独立危险因子,有研究证明长期高血糖诱发糖尿病肾病,从20世纪80年代开始的两个研究—糖尿病前瞻性研究和糖尿病控制与并发症实验都得出结论:控制高血糖可以减少DN的发生[13-14]。常规体外培养近端肾小管上皮细胞发现NF-κB 蛋白主要表达于肾小管上皮细胞的胞浆中,且为无活性状态,而在培养基中加入高浓度葡萄糖后发现NF-κB 蛋白表达活性增强,并与培养的时间成正相关,表明高糖能够诱导NF-κB 蛋白及基因的表达[15]。NF-κB表达的增加可能诱导肾小管上皮细胞的凋亡,致使肾小管损伤。本实验中高糖组NF-κB蛋白表达及细胞凋亡率明显较正常对照组高,与文献报道一致。
黄芪是是补气的传统中药。黄芪归脾、肺经,性味甘温,有益气固表,托毒生肌,利水消肿等作用。黄芪主要用于治疗气虚乏力,中气下陷,久泻脱肛,便血崩漏,表虚自汗,气虚水肿,痈疽难溃,久溃不敛,血虚萎黄,内热消渴。在现代医学领域主要治疗糖尿病、慢性肾炎、冠心病、心力衰竭、脑梗死等。药理实验表明黄芪能增加机体免疫力,还具有清除体内自由基抗衰老作用,对肝脏也有一定的保护作用,对人体多个系统都有影响,如泌尿系统、内分泌系统、心血管系统、血液系统及中枢神经系统。
黄芪注射液的有效成分是黄芪甲甙,从黄芪草本植物中提取出来。黄芪的主要有效成分是黄酮类、氨基酸类、多糖类、皂苷类等,但黄芪注射液的具体组成成分还不明确,现在大多数研究认为皂苷类、黄芪多糖及大量微量元素是黄芪注射液的有效治疗成分,其中多糖成分是重要的免疫活性物质,微量元素可以调节机体的元素失调。黄芪注射液的治疗作用与黄芪基本相似,有益气养元、扶正祛邪、养心通脉、健脾利湿等作用。可用于治疗病毒性心肌炎、心力衰竭、免疫力低下导致的慢性活动性肝炎、慢性肝炎、白细胞减少症、血小板减少性紫癜、慢性肾炎、肾病综合征、糖尿病肾病等。
研究发现黄芪注射液能够明显降低肾炎大鼠肾皮质NF-κB的表达[16]。新生儿窒息血清诱导人近曲小管上皮细胞损伤后,NF-κB核转位增加显著,用黄芪注射液干预后能够明显抑制NF-κB的激活,降低其表达[17]。黄芪注射液不仅对肾脏组织有抑制NF-κB的作用,对其他组织细胞也有抑制作用。黄芪注射液可通过提高肺组织热休克蛋白70的表达,抑制NF-κB活性,并下调一系列炎症因子TNF-α、IL-6,以减轻炎症反应,起到对肺脏的保护作用[18]。黄芪注射液能够明显抑制大鼠胰腺炎胰腺组织中NF-κB蛋白表达,抑制急性胰腺炎的发展及损伤[19]。黄芪注射液还能够抑制脓毒血症大鼠肾脏组织中NF-κB 蛋白的表达,对大鼠肾脏有保护作用[20]。
本实验用高糖培养基培养HK-2细胞,不同时间点测定细胞内NF-κB蛋白含量,以此证明高糖环境能诱导HK-2细胞中NF-κB蛋白表达,高糖环境下HK-2细胞形态也发生明显变化,A组与B组比较发现细胞在高糖环境下生长状态较低糖组差,生长缓慢,贴壁性差,细胞密度减小,分裂相减少,折光性减弱,形态由正常铺路石样变为长梭形。表 1可见在24、48、72 h 3个时间点,B组NF-κB蛋白表达较A组明显增加,表明高糖环境能够诱导NF-κB蛋白表达。黄芪注射液干预组则表现为对NF-κB蛋白表达的抑制作用。
黄芪注射液可通过抑制NF-κB表达,对HK-2细胞起到保护作用,但黄芪注射液作为中药提取物,其成分复杂,对HK-2细胞有保护作用的成分并不十分清楚,所以还有待进一步研究,以明确黄芪注射液的具体作用机制,为临床治疗糖尿病肾病提供依据。
| [1] | 金政男. 糖尿病肾病中医病因病机初探[J]. 实用中医内科杂志, 2011, 25 (9) : 6–8. |
| [2] | 梁晓平. 糖尿病肾病中医诊治思路[J]. 中医药临床杂志, 2014, 24 (2) : 168–170. |
| [3] | 梁海洋, 张传方. 消渴肾病的中医病因病机研究进展[J]. 中国中西医结合肾病杂志, 2012, 13 (1) : 84–85. |
| [4] | 陈应强, 曾家顺, 李龙. 黄芪对糖尿病大鼠肾组织 NF-κb和MCP-1 表达的影响[J]. 贵州医药, 2009, 33 (2) : 102–106. |
| [5] | Verzola D, Gandolfo MT, Ferrario F, et al. Apoptosis in the kidneys of patients with type Ⅱ diabetic nephyopathy[J]. Kidney Int, 2007, 72 : 1262–1272. DOI:10.1038/sj.ki.5002531 |
| [6] | 赵宗江, 谷海瑛, 邵悦. 复方鳖甲软肝方对 LPS刺激肾小管上皮细胞NF-κB?IκBα表达的影响[J]. 北京中医药大学学报, 2006, 29 (3) : 172–176. |
| [7] | Seg ES, Nelson PJ, Schlondo RD. Chem okines, chemokine receptors, and renal disea se: From basic science to pathophysiologic and the rapeutic studies[J]. JAm Socephrol, 2000, 11 (1) : 152–176. |
| [8] | Guijarro C, Egido J. Transcription facto r-κB(N F-κB) and rena l disease[J]. K idney In t, 2001, 59 : 415–424. |
| [9] | 杨丽, 张小敏, 胡顺金. 核因子 -κb 信号转导通路与糖尿病肾脏疾病的中医药干预[J]. 中医药临床杂志, 2015, 27 (1) : 14–16. |
| [10] | Navarro-Gonzalez JF, Mora-Fernandez C, Muros de Fuentes M, et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J]. Nat Rev Nephrol, 2011, 7 (6) : 327–340. DOI:10.1038/nrneph.2011.51 |
| [11] | Yong P, Zhang XH, Wang Y, et al. Targeting JNK by a new curcumin analog to inhibit NF-κb-Mediated expression of cell adhesion molecules attenuates renal macrophage infiltration and injury in diabetic mice[J]. Plos One, 2013, 8 (11) : 79–84. |
| [12] | Gruden G, Setti G, Hayward A, et al. Mechanical stretch induces monocyte chemosttractant activity via an NF-κb-dependent monecyte chemoattractant Protein-1-Mediated pathway in human mesangial cells:inhibition by rosiglitazone[J]. J Am Soc Nephrol, 2005, 16 (3) : 688–696. DOI:10.1681/ASN.2004030251 |
| [13] | The control and complication trial research group. The effect of intensive treatment of diabrtes on the development and progression of long-term complication in insulin-depentment diabetes mellitus[J]. N Engj Med, 1993 : 329–342. |
| [14] | Prospective Diabetes Study (UPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes[J]. Lancet, 1998, 352 : 837–845. DOI:10.1016/S0140-6736(98)07019-6 |
| [15] | 刘淑霞, 张玉军, 刘汝俊, 等. NF-κB?COX-2在高糖培养的肾小管上皮细胞中的表达及意义[J]. 河北医科大学学报, 2008, 29 (3) : 321–323. |
| [16] | 王文花, 戴恩来, 崔笑梅. 黄芪注射液对肾炎大鼠肾皮质细胞NF-κB表达影响的实验研究[J]. 中国中西医结合肾病杂志, 2001, 2 (8) : 450–452. |
| [17] | 熊涛, 董文斌, 王明勇, 等. 黄芪注射液对新生儿窒息后血清诱导人肾小管细胞损伤信号机制的影响[J]. 中国中西医结合杂志, 2010, 30 (4) : 398–402. |
| [18] | 淘伍元, 张文武. 黄芪注射液对急性肺损伤大鼠热休克蛋白70核转录因子-κB表达的影响[J]. 中国急救医学, 2012, 32 (3) : 227–223. |
| [19] | 张超贤, 郭晓凤, 秦永梅. 黄芪注射液对急性胰腺炎大鼠NF-κB活性、 NF-κB及TNF-α mRNA表达的影响[J]. 世界华人消化杂志, 2010, 18 (10) : 10511055. |
| [20] | 沈建明, 沈蕾, 天少江, 等. 黄芪注射液对脓毒症大鼠急性肾损伤的保护作用[J]. 重庆医学, 2011, 40 (16) : 1619–1621. |
 2016, Vol. 35
2016, Vol. 35




