文章信息
- 丁苗苗, 杨凯伦, 王东亮, 汝文文, 黄瑞, 刘志东, 李楠, 张兵
- DING Miao-miao, YANG Kai-lun, WANG Dong-liang, RU Weng-weng, HUANG Rui, LIU Zhi-dong, LI Nan, ZHANG Bing
- 超微粉碎对西洋参中人参皂苷体外溶出的影响研究
- Effect of ultrafine comminution on ginsenoside dissolution rate in Panax quinquefolium L.
- 天津中医药大学学报, 2016, 35(5): 327-331
- Journal of Tianjin University of Traditional Chinese Medidine, 2016, 35(5): 327-331
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.05.11
-
文章历史
收稿日期: 2016-05-05
2. 东阿阿胶股份有限公司, 国家胶类中药工程技术研究中心, 聊城 252200
2. Dong-E-E-Jiao Co., Ltd., National Engineering Technology Research Center of Glue of Traditional Medicine, Liaocheng 252200, China
超微粉碎技术是应用于中药领域中的一项新技术,超微粉碎后的中药,细胞破壁率增加,有效成分充分暴露,有利于药物的释放和吸收,提高生物利用度[1],与传统粉碎技术相比,具有广阔的市场前景和社会经济价值。超微粉碎是在粉体学基础上,利用机械或流体力学将直径大于3 mm以上的中药粉碎至75 μm以下的操作技术[2]。其主要作用原理是通过强烈的冲击力或气流使物料与磨体或物料间相互碰撞、摩擦和剪切,以达到粉碎目的,从而使物质表面发生特定变化。常见的粉碎机主要有机械冲击式、气流式以及搅拌磨和振动磨等。由于其具有提高有效成分溶出速率、生物利用度高、节约中药资源、药物均匀度高等优势, 超微粉碎技术逐渐应用于一些贵重药材或者稀少的中药材品种上[3]。西洋参(Panax quinquefolium L.)是五加科人参属多年生草本植物,药用为根,别名西洋人参、洋参、花旗参,主产于美国、加拿大及法国。是一种具有特殊医疗价值的贵重补益药物。西洋参具有补气养阴,清热生津等功效,广泛应用于医疗保健品和食品中[4]。现代药理研究表明,西洋参具有增强免疫、抗疲劳、保护心肌细胞,抑制血管痉挛、抗高血压等作用[5]。
人参皂苷是西洋参中主要有效成分,含量也最为丰富,《中国药典》以人参皂苷Rg1、Re、Rb1的含量作为西洋参质量衡量标准,其中人参皂苷Rb1和Re的含量占西洋参总皂苷含量的50%以上[6-7]。人参皂苷具有多种生物活性,人参皂苷Re有较强的抗缺血性心率失常[8],抗氧化,抗衰老作用[9],此外还具有镇静、抗利尿[10],增强药物的透皮吸收[11]等功能。人参皂苷Rg1具有保护心肌细胞[12],降血糖[13],抗纤维化[14]等作用。人参皂苷Rb1具有双向调节血压,改善心功能[15],提高超氧化物歧化酶(SOD)含量,对脑组织损伤有较好的保护作用[16],能够减慢心率、降低血压,对心肌损伤起到缓解和保护的作用[17],这3种有效成分的药理活性通常可以表达西洋参的多效性。通过参照《中国药典》(2010版)、文献[7-20]及活性成分的药理作用确定西洋参测定指标为人参皂苷Rg1、Re、Rb1。本实验主要考察将西洋参超微粉碎后的超微粉和一般粉碎方式所得粗粉中人参皂苷Rg1、Re、Rb1体外溶出的差异,分析超微粉碎对西洋参中人参皂苷体外溶出的影响,为西洋参等滋补药材超微粉体的临床应用提供实验依据。
1 仪器与材料超高效液相色谱仪(UPLC,Waters, 美国),Mastersizer 2000 激光粒度仪(英国马尔文仪器有限公司),AX205电子天平(METTLER TOLEDO, 瑞士),DELTTA320 PH计(METTLER TOLEDO, 瑞士),Milli-Q超纯水系统(Millipore,美国),C3860A超声清洗器(天津奥特赛恩斯仪器有限公司),透皮扩散试验仪(TK-6H, 上海锴凯科技贸易有限公司)。
西洋参超微粉、西洋参粗粉(山东东阿阿胶保健品有限公司,批号20151029),人参皂苷Rg1标准品:纯度95% (中国食品药品检定研究院,批号110703-102228),人参皂苷Re标准品:纯度92.7%(中国食品药品检定研究院,批号110754-201324),人参皂苷Rb1标准品:纯度93.7%(中国食品药品检定研究院,批号110704-201424),乙腈:色谱纯(默克公司),甲醇:色谱纯(默克公司),磷酸二氢钾、氢氧化钠均为分析纯(天津市光复化学试剂厂)。
2 方法与结果 2.1 西洋参粉末粒径测定参考2010版药典粒径测定方法(附录IX E),以水为分散介质,采用马尔文2000粒径测定仪测定西洋参超微粉和粗粉的粒径,结果见表 1。
| μm | ||||
| 药品 | 粉碎粒度 | d0.1 | d0.5 | d0.9 |
| 西洋参 | 超微粉 | 4.626 | 32.524 | 111.992 |
| 粗粉 | 27.092 | 365.741 | 560.356 | |
| 注:d0.1、d0.5、d0.9分别表示小于该粒径的粒子在全粒子群中的含量比为10%、50%、90%。 | ||||
ACQUITY® UPLC HSS T3色谱柱(2.1 mm×50 mm,1.8 μm),UPLC HSS T3预柱(2.1 mm×5 mm,1.8 μm),柱温30 ℃,检测波长为203 nm,流速为0.3 mL/min,,进样量为1 μL(进样体积范围:0.1~10.0 μL标配),梯度洗脱见表 2[20]。
| 时间(min) | 流量(mL/min) | 水(%) | 乙腈(%) |
| 0 | 0.3 | 81 | 19 |
| 2 | 0.3 | 81 | 19 |
| 9 | 0.3 | 77 | 23 |
| 10 | 0.3 | 70 | 30 |
| 13 | 0.3 | 60 | 40 |
| 17 | 0.3 | 10 | 90 |
| 18 | 0.3 | 81 | 19 |
| 21 | 0.3 | 81 | 19 |
精密称定人参皂苷Rg1、人参皂苷Re和人参皂苷Rb1对照品适量,加甲醇适量溶解,得到含人参皂苷Rg1为202.8 mg/L、人参皂苷Re为200.8 mg/L、人参皂苷Rb1为202.4 mg/L的混合对照品溶液。
2.2.3 供试品溶液制备取不同时间溶出的介质溶液,样品经14 000 r/min,25 min离心,0.22 μm微孔滤膜过滤,取续滤液,作为供试品溶液。
2.2.4 专属性考察空白溶出介质溶液对西洋参中人参皂苷Rg1、Re、Rb1的测定无干扰,结果见图 1。
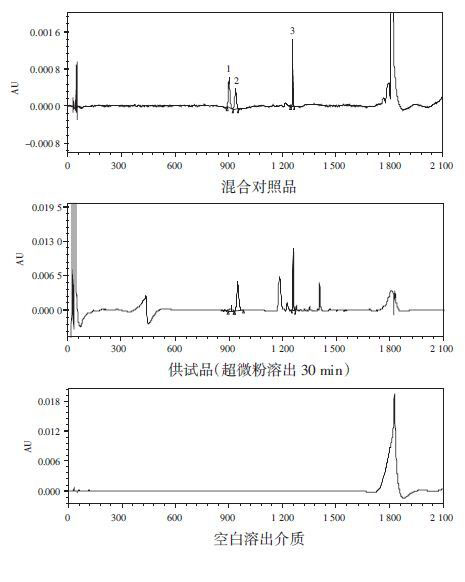
|
| 图 1 人参皂苷Rg1、Re、Rb1 UPLC色谱图 1.人参皂苷Rg1;2.人参皂苷Re;3.人参皂苷Rb1 |
人参皂苷Rg1在1.872~29.954 mg/L(r=0.999 8)范围内线性关系良好;人参皂苷Re在 1.860~29.753 mg/L(r=0.999 7)范围内线性关系良好;人参皂苷Rb1在1.868~29.888 mg/L(r=0.999 8)范围内线性关系良好。
2.2.6 精密度实验人参皂苷Rg1、Re、Rb1峰面积的RSD均小于1.5%,表明仪器精密度良好。见表 3。
| 浓度(mg/L) | 成分 | A1 | A2 | A3 | 均值 | RSD(%) |
| 低浓度 | Rg1 | 4 538 | 4 526 | 4 638 | 4 567 | 1.3 |
| Re | 2 635 | 2 604 | 2 685 | 2 641 | 1.5 | |
| Rb1 | 3 069 | 3 048 | 2 974 | 3 030 | 1.6 | |
| 中浓度 | Rg1 | 9 043 | 9 155 | 9 093 | 9 097 | 1.3 |
| Re | 5 765 | 5 799 | 5 967 | 5 844 | 1.5 | |
| Rb1 | 6 698 | 6 780 | 6 758 | 6 745 | 0.6 | |
| 高浓度 | Rg1 | 37 489 | 37 246 | 37 311 | 37 349 | 1.3 |
| Re | 24 179 | 24 175 | 24 580 | 24 311 | 1.5 | |
| Rb1 | 27 966 | 27 926 | 27 995 | 27 962 | 0.1 |
取人参皂苷Rg1、Re、Rb1混标储备液,分别用水、pH 1.2盐酸溶液以及pH6.8、pH7.2、pH7.4的磷酸盐缓冲液(PBS)溶液稀释得到样品溶液,置于37 ℃恒温浴中振荡,于0、1、2、4、6、8 h取样,UPLC分析。实验结果表明,人参皂苷在pH1.2的中不稳定,在水以及pH6.8、pH7.2、pH7.4的PBS溶液中可以保持8 h稳定。见表 4。
| 人参皂苷 | T(h) | Water | pH1.2 | pH 6.8 | pH 7.2 | pH 7.4 |
| Rg1 | 0 | 11 489 | 8 526 | 11 821 | 11 926 | 11 866 |
| 1 | 11 479 | 5 299 | 12 076 | 11 908 | 12 022 | |
| 2 | 11 522 | 1 625 | 12 187 | 11 858 | 11 911 | |
| 4 | 11 229 | ND | 11 462 | 12 236 | 11 493 | |
| 6 | 11 339 | ND | 11 607 | 12 122 | 11 279 | |
| 8 | 11 446 | ND | 12 056 | 11 458 | 11 833 | |
| x | 11 417 | 11 868 | 11 918 | 11 734 | ||
| RSD(%) | 0.069 | 0.024 | 0.022 | 0.024 | ||
| Re | 0 | 9 295 | 6 904 | 9 995 | 9 977 | 10 026 |
| 1 | 9 190 | 3 890 | 10 050 | 9 971 | 10 064 | |
| 2 | 9 317 | 1 962 | 10 035 | 9 853 | 9 817 | |
| 4 | 9 242 | ND | 10 671 | 9 969 | 10710 | |
| 6 | 9 188 | ND | 10 867 | 10 038 | 10 595 | |
| 8 | 9 357 | ND | 9 964 | 10 702 | 9 681 | |
| x | 9 265 | 10 264 | 10 085 | 10 149 | ||
| RSD(%) | 0.065 | 0.038 | 0.031 | 0.041 | ||
| Rb1 | 0 | 6 492 | ND | 3 013 | 2 609 | 2 871 |
| 1 | 6 867 | ND | 2 612 | 2 951 | 2 583 | |
| 2 | 6 797 | ND | 2 704 | 2 897 | 2 909 | |
| 4 | 6 545 | ND | 3 252 | 2 644 | 3 104 | |
| 6 | 6 710 | ND | 2 732 | 3 456 | 3 060 | |
| 8 | 6 932 | ND | 3 132 | 3 216 | 3 565 | |
| X | 6 724 | 2 908 | 2 962 | 3 015 | ||
| RSD(%) | 0.076 | 0.089 | 0.111 | 0.108 |
精密称取同一样品6份,每份样品液加入混合对照品溶液适量,按照“2.2.3”项下方法制备供试品溶液,并按照“2.2.1”项下色谱条件进行UPLC分析。根据测得量和加入量计算其回收率。实验结果见表 5。结果表明测定结果准确,方法可行。
| 成分 | 样品含量 | 对照品加入量 | 测得量 | 回收率 | 平均回收率 | RSD |
| (mg) | ( mg) | ( mg) | (%) | ( %) | ( %) | |
| Re | 0.015 4 | 0.0162 | 0.032 3 | 104.12 | 102.06 | 2.05 |
| 0.032 0 | 102.27 | |||||
| 0.031 8 | 101.03 | |||||
| 0.032 4 | 104.74 | |||||
| 0.031 5 | 99.18 | |||||
| 0.031 8 | 101.03 | |||||
| Rb1 | 0.018 0 | 0.0185 | 0.037 3 | 104.44 | 104.17 | 1.42 |
| 0.037 5 | 105.52 | |||||
| 0.036 9 | 102.27 | |||||
| 0.037 6 | 106.06 | |||||
| 0.037 2 | 103.90 | |||||
| 0.037 0 | 102.81 |
分别称取西洋参超微粉和粗粉约20 mg,平行3份,置于烧杯中,溶于25 mL,pH7.2PBS,将小杯置于(37±0.5) ℃恒温水浴槽中,设定转速600 r/min,开启电磁搅拌,分别于 2、5、10、15、30 min取样1 mL,同时补充同温度同体积的空白溶出介质1 mL,样品经14 000 r/min,25 min高速离心取上清液,过0.22 μm微孔滤膜,照“2.2.1”色谱条件,UPLC分析,计算累积溶出率,绘制溶出曲线,结果见图 2、图 3和表 6。
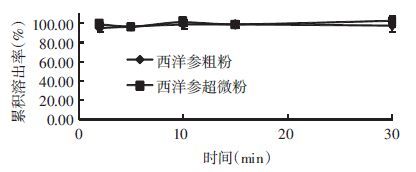
|
| 图 2 人参皂苷Re体外溶出曲线 |
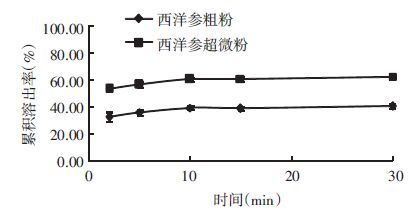
|
| 图 3 人参皂苷Rb1 体外溶出曲线 |
| 成分 | 取样时间(min) | n | 超微粉累积溶出率(%) | 粗粉累积溶出率(%) |
| Re | 2 | 6 | 97.7±1.8 | 94.3±2.7 |
| 5 | 6 | 96.2±2.3 | 96.4±3.3 | |
| 10 | 6 | 100.9±4.0 | 97.7±3.4 | |
| 15 | 6 | 98.6±5.5 | 98.5±3.9 | |
| 30 | 6 | 102.3±5.4 | 96.6±1.3 | |
| Rbl | 2 | 6 | 53.5±1.2 | 33.0±3.3 |
| 5 | 6 | 56.9±1.8 | 36.3±2.1 | |
| 10 | 6 | 60.7±1.8 | 39.5±1.4 | |
| 15 | 6 | 61.1±2.0 | 39.1±1.6 | |
| 30 | 6 | 62.9±2.1 | 40.6±1.9 |
西洋参超微粉和粗粉中人参皂苷Rb1、Re的溶出速率经两独立样本t检验比较分析,西洋参超微粉中人参皂苷Rb1的溶出速率高于粗粉,两者比较具有极显著性差异(P<0.01);人参皂苷Re的累积溶出率,西洋参超微粉与粗粉比较无显著性差异(P>0.05)。实验结果表明,超微粉碎可以促进西洋参中人参皂苷Rb1的溶出,而对于西洋参中人参皂苷Re的体外溶出度无影响。
3 讨论在实验中按照中国药典(2010年版2部附录X C)溶出度测定方法,采用桨法进行西洋参超微粉和粗粉体外溶出实验,实验过程中观察到西洋参超微粉相互吸引而发生团聚,形成超微粉的团聚体;而西洋参粗粉分散状态较均匀,未出现团聚现象。由于超微粉形成团聚体使其分散性变差,流动性差,降低了人参皂苷从超微粉中的溶出速率。为排除超微粉形成团聚体对超微粉中人参皂苷溶出速率的影响,改进了溶出实验方法,采用恒温水浴磁力搅拌体外溶出实验,考察超微粉碎对西洋参中人参皂苷体外溶出速率的影响。
恒温水浴磁力搅拌体外溶出实验过程中,笔者考察了200、300、600 r/min的转速对西洋参超微粉和粗粉中人参皂苷体外溶出速率的影响。结果显示,在转速为200、300 r/min时,5~10 min的取样点,超微粉中人参皂苷Rb1、Re都有上升的趋势,分析超微粉在低转速时仍需数分钟破除团聚现象,当转速升高为600 r/min时,基本解决了团聚的影响,且600 r/min为本实验室所能达到的最大转速,因此本实验最终确定转速为600 r/min。
本实验初始以人参皂苷Rg1、Rb1、Re为溶出速率指标性成分,由于人参皂苷Rg1在西洋参中含量过低,实验条件下未达到仪器定量限,所以本实验最终以人参皂苷Rb1、Re为溶出速率指标性成分。实验结果表明,西洋参超微粉可以显著提高人参皂苷Rb1的溶出速率,说明药材经过超微粉碎后,有利于药物有效成分的溶出。这与文献报道具有一致性[21-22]。
西洋参超微粉和粗粉中人参皂苷Re的溶出速率无差异,说明超微粉碎对人参皂苷Re的溶出无影响,这可能是由于人参皂苷Re为四环三萜类人参三醇型皂苷,较四环三萜类人参二醇型人参皂苷Rb1的分子量更小一些,空间位阻相对减小,溶出速度会快一些,然而超微粉表面积大,表面能高,体系内不稳定有较强的吸引力,为达到稳定的状态,粒子产生团聚,使其分散性、流动性变差,掩盖了超微粉的溶出优势。另一方面可能是粉末在溶出过程中存在溶出与吸附平衡,微粉溶出虽然稍多,但药材超微粉碎粒度过小,药材表面积急剧增大而使其表面能增加,药物粉体吸附力增大,从而不易溶出[23]。也有文献[24]报道由于超微粉的团聚不稳定的缺点,将超微粉制粒成型后能够有效地解决该缺陷,且成型产品质量较超微粉更稳定。
实验结果表明,不同粒径对人参皂苷不同单体影响并不是完全相同,超微粉碎技术可以显著提高西洋参中人参皂苷Rb1的溶出速率,而对于人参皂苷Re的溶出无影响。因此在西洋参应用过程中,应该根据入药的具体情况,结合药理活性,综合制造成本,多选几种评价指标,确定其合理粉碎粒径范围。
| [1] | 刘佳, 金思岑, 张颖, 等. 微粉化技术在名贵中药中的应用[J]. 中国药房, 2014, 25 (23) : 2192–2193. |
| [2] | 王艳萍, 刘宇灵, 杨立新, 等. 超微粉碎技术对三七药材粉碎效果及有效成分含量的影响[J]. 中国中药杂志, 2014, 39 (8) : 1430–1434. |
| [3] | 陈斌, 赵伯涛, 钱骅, 等. 人参花超微粉碎扫描电镜观察及人参皂苷测定[J]. 中成药, 2012, 34 (10) : 1974–1978. |
| [4] | 赵树清, 载新荣. 西洋参研究进展[J]. 广东药学, 2005, 15 (6) : 63–65. |
| [5] | 王丽君. 西洋参皂苷和多糖的活性研究[D]. 北京:中国农业科学院, 2013. |
| [6] | 国家药典委员会. 中国药典(一部)[S]. 北京:化学工业出版社, 2000. |
| [7] | 马宝兰, 秦绪花, 史载祥, 等. 西洋参临床药理研究进展[J]. 江西中医学院学报, 2011, 23 (5) : 88–92. |
| [8] | 彭缨, 王淑君, 潘卫三, 等. 人参皂苷Re大鼠体内药物动力学研究[J]. 沈阳药科大学学报, 2006, 23 (4) : 97–200. |
| [9] | 雷秀娟, 冯凯, 孙立伟, 等. 人参皂苷抗衰老机制的研究进展[J]. 氨基酸和生物资源, 2010, 32 (1) : 44–47. |
| [10] | Yamaguchi Y, Higashi M, Kobayashi H. Effects of ginseno-sides on impaired performance caused by scopolamine in rats[J]. European journal of pharmacology, 1996, 312 (2) : 149–151. DOI:10.1016/0014-2999(96)00597-3 |
| [11] | Sekiya K, Kadota S, Katayama K, et al. Study on baths with crude drug. Ⅲ. The effect of ligustici chuanxiong rhizoma extract on the percutaneous absorption of some natural compounds[J]. Biological & pharmaceutical bulletin, 1997, 20 (9) : 983–987. |
| [12] | 杨敏, 陈广玲, 陈畅, 等. 人参皂甙Rg1对大鼠急性心肌梗死的治疗作用[J]. 中西医结合心脑血管病杂志, 2007, 5 (11) : 1075–1077. |
| [13] | 李艳娇. 西洋参果中皂苷成分及其生物活性的研究[D]. 长春:吉林大学, 2010. |
| [14] | 马岚青, 梁兵, 柳波, 等. 人参皂苷Rg1抗肝纤维化的实验研究[J]. 中国中西医结合消化杂志, 2007, 15 (3) : 165–168. |
| [15] | 李朋, 刘正湘. 人参皂苷Rb1对急性心肌梗死大鼠心室重构的影响[J]. 实用心脑肺血管病杂志, 2006, 14 (2) : 118–121. |
| [16] | 史以菊, 夏作理, 李娟, 等. Rb1对MCAO脑组织SOD、NO含量的影响[J]. 泰山医学院学报, 1999, 20 (2) : 30–32. |
| [17] | 魏志泉. 人参皂苷单体Rb1对抗高血压发展过程研究[D]. 长春:东北师范大学, 2006. |
| [18] | 姜婷, 刘婷婷. 长芦人参、西洋参中总皂苷及单体皂苷Re, Rg1, Rb1的含量测定[J]. 人参研究, 2014 (1) : 17–22. |
| [19] | 杨丽玲, 吴铁. 不同粉碎度对人参皂苷3种不同单体提取率影响[J]. 长春中医药大学学报, 2009 (5) : 669–671. |
| [20] | 林苏娜, 余楚钦, 林华庆, 等. UPLC测定参麦注射液中人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1的含量[J]. 中国实验方剂学杂志, 2014, 20 (8) : 48–50. |
| [21] | 卓丹如, 阙慧卿, 章宁, 等. 不同粉碎度野生西洋参人参皂苷Rb1的体外溶出度研究[J]. 药物评价研究, 2013, 36 (5) : 374–376. |
| [22] | 翟旭峰, 张晨, 郭晓蕾. 西洋参超微粉与细粉中人参皂苷Rb1的溶出度比较研究[J]. 中药材, 2009, 32 (2) : 290–292. |
| [23] | 李春华. 中药超微细化及有效成分溶出特性研究[D]. 云南:昆明理工大学, 2002. http://cdmd.cnki.com.cn/article/cdmd-10674-2002101957.htm |
| [24] | 邓雯. 三七、西洋参两味中药材超微粉的制备工艺与质量评价研究[D]. 广州:广州中医药大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10572-2008100629.htm |
 2016, Vol. 35
2016, Vol. 35




