文章信息
- 王丹, 黄琦
- WANG Dan, HUANG Qi
- 人参皂苷对波动性高血糖大鼠肾脏Nrf2/ARE信号通路的影响
- Effect of ginsenoside on Nrf2/ARE signaling pathway in the kidney of rats exposed to intermittent high glucose
- 天津中医药大学学报, 2016, 35(6): 385-389
- Journal of fianjin university of traditional chinese medicine, 2016, 35(6): 385-389
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.06.07
-
文章历史
收稿日期: 2016-08-12
2. 浙江省中医院, 杭州 310000
2. Zhejiang Provincial Hospital of Traditional Chinese Medicine, Hangzhou 310000, China
糖尿病肾病是糖尿病患者常见的微血管并发症,同时也是致死的主要原因,高血糖导致的肾脏细胞凋亡参与了糖尿病肾病的发生发展[1]。近年来研究发现波动性高血糖较稳定性高血糖对糖尿病患者肾脏的危害性更大[2]。长期暴露于高糖环境中使肾脏组织发生各种代谢变化,负反馈调节上游的调控因子,抵消部分糖毒性,而波动性高糖可能削弱这种适应能力,使糖毒性更加明显。研究认为,转录因子NF-E2相关因子2(Nrf2) /应答元件(ARE)信号通路可减少高糖环境下活性氧的产生,发挥其抗氧化应激损伤作用[3],在糖尿病并发血管病变的防治中发挥重要作用。随着研究的不断深入,中药在抗氧化应激中具有独特优势[4]。现代药理学研究认为,人参皂苷作为人参的提取物,具有抗氧化及清除自由基的作用。血红素加氧酶-1(HO-1) 、γ-谷氨酰半胱氨酸合成酶(γ-GCS)是Nrf2/ARE信号通路调节的抗氧化蛋白,建立波动性高血糖大鼠模型并用传统中药人参皂苷进行干预,研究Nrf2/ARE下游基因HO-1,γ-GCS的表达,以探讨在防治糖尿病肾脏病变中的作用。
1 材料与方法 1.1 主要药品和试剂人参皂苷粉末(浙江省中医院自制,制剂批准号:201308190) ,超短效胰岛素诺和锐(丹麦诺和锐),链尿佐菌素(STZ),(Sigma公司),自制高脂饲料:蔗糖10%、蛋黄10%、猪油10%、胆固醇0.5%、基础饲料69.5%;HO-1、γ-GCS、Nrf2引物(Takara公司),兔抗HO-1多克隆抗体、兔抗γ-GCS多克隆抗体和兔抗Nrf2多克隆抗体(CST公司),RT-PCR反应试剂盒(TaKaRa公司),Trizol裂解液(Invitrogen公司)。
1.2 主要仪器血糖试纸及血糖仪(德国罗氏),Step one plus PCR仪(美国生物应用系统公司)。
1.3 动物6~8周龄SD雄性大鼠32只,体质量160~180 g,由上海西普尔必凯实验动物有限公司提供[SCXK(沪)2008-0016]。温度(20±2) ℃,相对湿度50%~60%,光照12 h明暗交替,饲养于浙江中医药大学动物实验研究中心[SYXK(浙)2008-0115]。
1.4 糖尿病模型制备正常对照组(NC组n=8) 予普通饲料喂养;糖尿病模型组(n=24) 予高脂饲料喂养2周,所有大鼠禁食不禁水16 h,糖尿病模型组用小剂量STZ 35 mg/kg腹腔注射诱导建立糖尿病大鼠模型,造模1周后,禁食不禁水16 h,测空腹血糖15~20 mmol/L为模型制作成功。
1.5 血糖波动模型制备将糖尿病模型组定时给予腹腔注射250 g/L葡萄糖溶液0.375 g/(kg·d),错时30 min后给予腹腔注射超短效胰岛素类似物诺和锐,造成1 d中血糖值大幅度波动模型,使其血糖值在高血糖和低血糖间反复漂移,注射后30 min测血糖,2周后,将波动性高糖模型组按随机数字表法随机分为3组,分别为波动性高血糖组(FHG组,n=8) ,人参皂苷低剂量组(LG组,n=8) 、人参皂苷高剂量组(HG组,n=8) 。治疗组分别予人参皂苷[14、56 mg/(kg·d)]灌胃,正常对照组及波动性高糖组予等量生理盐水灌胃8周作对照,每日2次。
1.6 标本采集每周用血糖仪测尾尖血血糖,称其体质量,并计算水和食物的摄入量。至实验结束,大鼠禁食12 h,切取肾脏组织,放入液氮罐中保存,用于蛋白免疫切迹方法(Western blot)及实时荧光定量聚合酶链式反应(RT-PCR)检测。
1.7 Western blot检测HO-1、Nrf2、γ-GCS蛋白表达水平从液氮罐中取出肾脏组织,放入液氮预冷过的研钵中,加入蛋白酶抑制剂+裂解液(1:100) 适量,研磨至液体澄清;吸取全部液体放入离心管中,12 000 r/min,4℃,离心15 min,提取细胞总蛋白;采用考马斯亮蓝法测定蛋白浓度;吸取蛋白样品,以60 V电压电泳,当条带跑至分离胶和浓缩胶分界面时改为90 V电泳,时间2~4 h;聚偏二氟乙烯(PVDF)转膜(250 MA,2.5 h);将PVDE膜浸于封闭液中,4℃封闭过夜;取出膜,与一抗接触,室温旋转孵育2~3 h,用洗膜缓冲液(TBST)冲洗3次,同样的方法二抗室温孵育1~2 h后,TBST洗3次;加入增强化学发光法(ECL)试剂,将PVDF膜放在Chemi Doc XRS上采集图像。
1.8 RT-PCR检测HO-1、NRF2、γ-GCSmRNA表达由基因库查的所需mRNA的核苷酸序列,PrimerPremier计算机软件辅助引物设计,引物由TakaRa公司设计并合成。HO-1上下游引物分别为:5'-GGAACTTTCAGAAGGGCCAGGT -3'和5'-TGCAGCTCTTCTGGGAAGTAGACA -3',γ-GCS上下游引物分别为:5'-TGTAGTGCGAGGAAGAGGT-ATGA -3'和5'-GGAGGGAAAGGAGAGGAAGG -3',NRF2上下游引物分别为:5'-ATTGTGCTTGTG-AGGGTGTTTC -3'和5'-CCCTTCCTGTCTTTTCTT-CTCTCT -3'。从液氮中取出肾脏组织冰上迅速研碎后,用Trizol法提取总RNA;吸取1μL抽提的RNA在Nanodropl000上进行RNA浓度测定,用1%琼脂糖凝胶进行电泳,检测RNA的完整性;取RNA按照逆转录体系逆转录为cDNA;取cDNA 2μL及HO-1、γ-GCS上下游引物各0.4 μL,SYBRPremix Ex TaqTM(2×)10 μL,Rox Reference Dye II(50×)0.4 μL,灭菌双蒸水6.8 μL(扩增条件为:95℃、5 min,94℃、1 min,1 min,72℃、1 min,32个循环后,72℃、8 min。2%琼脂糖凝胶中进行电泳,然后置于Bio-Rad Gel凝胶图像分析系统进行吸光度扫描分析,以GAPDH作为内参照,用目的基因的吸光度与GAPDH吸光度的比值分析目的基因的相对表达水平。)
1.9 统计学分析采用SPSS 18.0统计软件,数据均采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较如果方差齐采用LSD,方差不齐采用Tamhane'sT2。P<0.05为差异有统计学意义。
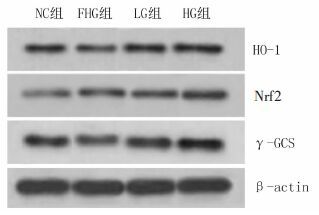
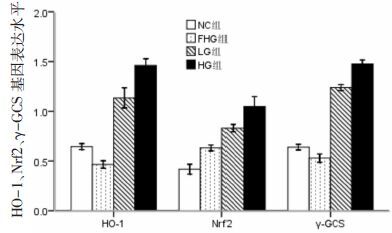
2 结果 2.1 人参皂苷对HO-1、Nrf2和γ-GCS蛋白的表达Western blot结果显示,与NC组相比,FHG组Nrf2蛋白表达增高(P<0.05) ,HO-1、γ-GCS蛋白表达下降(P<0.05) ;与FHG组相比,LG组及HG组HO-1、γ-GCS和Nrf2蛋白表达均明显增高(P<0.05) 。见图 1、图 2。
|
| 图 1 各组大鼠肾脏HO-1、Nrf2及γ-GCS蛋白的表达 |
|
| 图 2 各组大鼠肾脏HO-1、Nrf2及γ-GCS蛋白表达的相对含量 |
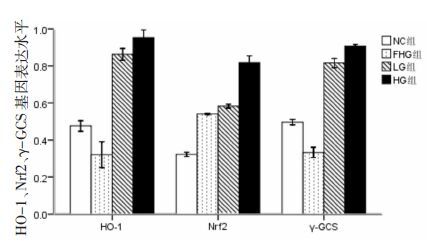
RT-PCR结果显示,与NC组相比,FHG组Nrf2 mRNA表达增高(P<0.05) ,HO-1、γ-GCS mRNA表达下降(P<0.05) ;与FHG组相比,LG组及HG组HO-1、Nrf2和γ-GCS mRNA表达均明显增高(P<0.05) ,见表 1、图 3。
| 组别 | n | HO-1 | Nrf2 | y-GCS |
| NC 组 | 8 | 0.65±0.04 | 0.42±0.06 | 0.64±0.03 |
| FHG 组 | 8 | 0.47±0.04* | 0.63±0.03* | 0.53±0.05* |
| LH组 | 8 | 1.13±0.12# | 0.83±0.04# | 1.24±0.03# |
| HG 组 | 8 | 1.46±0.08# | 1.04±0.12# | 1.48±0.07# |
| 注:与NC组相比,*P<0.05;与FHG组相比,#P<0.05。 | ||||
|
| 图 3 HO-1、Nrf2、γ-GCS mRNA表达水平 |
氧化应激是指机体组织或细胞内氧自由基生成增加和(或)消除能力降低,活性氧簇(ROS)的产生与抗氧化防御系统的清除失衡,导致机体组织细胞及蛋白的损伤。ROS在糖尿病发展过程中起关键作用[5],在高糖状态下,蛋白激酶C活性增强,多元醇途径、己糖胺通路、晚期糖基化终末产物途径等旁路代谢过度激活,这些不同代谢途径引起细胞内烟酰胺嘌呤二核甘磷酸(NADPH)氧化产生的ROS,可致体内氧自由基大幅增加并产生过氧化反应,同时使机体的抗氧化防御能力出现下降趋势,因此在机体内表现为氧化能力大大超过了抗氧化能力,从而诱导细胞内发生氧化应激反应[6]。研究表明,氧化应激是糖尿病发展的重要机制[7],Forbes Josephine等[8]研究认为氧化应激是糖尿病肾病发生的主要原因。其通过线粒体电子传递链、葡萄糖自氧化和多元醇等途径,使ROS含量增加。Chang等[9]研究发现,急性和慢性血糖波动均可增加2型糖尿病患者氧化应激和慢性炎症反应。波动性高血糖较稳定性高血糖刺激机体产生较多ROS,抗氧化能力下降,导致内皮细胞功能紊乱。氧化应激参与波动性高糖诱导的肾小管上皮细胞的凋亡[10],Nrf2/ARE信号通路可通过调控下游基因的表达,提高机体的抗氧化应激能力,延缓糖尿病并发症的发生。
应答元件(ARE)是一个特异的DNA启动子结合序列,是II相解毒酶和细胞保护蛋白基因表达的上游调节区,Nrf2是这一序列的激活因子。活化的Nrf2从Keap1(Kelchlike Echassociated protein-1) 解离后进入细胞核,与细胞核内小Maf蛋白(small Maf proteins)结合成异二聚体后与ARE序列结合,进而启动受ARE调控的基因的转录,称为Keap1-Nrf2-ARE通路。Nrf2/ARE是一种重要的抗氧化应激通路[11]。研究表明,该信号通路可延缓糖尿病的发展,预防糖尿病并发症的发生,在维持血糖平衡和抑制糖尿病发生的过程中发挥了重要的作用[12-13]。氧化与抗氧化系统相互拮抗平衡,人体才能正常发挥其有效的生理功能,如果ROS产生过多,各种抗氧化物质如HO-1,谷胱甘肽(GSH)等的含量下降,抗氧化能力降低,不能有效的清除自由基,就会发生氧化应激损伤。Nrf2/ARE信号通路可降低高糖环境下活性氧的产生,机体细胞受到ROS信号作用,Nrf2从Keap-1中解离,通过与ARE结合,并参与下游II相代谢酶基因和抗氧化基因的转录,包括HO-1、γ-GCS[14]。γ-GCS、HO-1能够启动氧化应激系统,清除体内自由基,从而起到保护细胞的作用。Yap等[15]研究发现,山楂酸通过激活Nrf2/ARE通路,上调HO-1和醌氧化还原酶(NQO1) 的表达,其机制可能是增强了Nrf2蛋白的稳定性,减少Keap-1的表达,引起Nrf2在核内的累积,进而与下游靶基因ARE结合有关。实验研究发现,FHG组Nrf2蛋白及mRNA表达明显高于NC组,说明在生理状态下,其表达量较低,但在引起氧化应激的因素诱导下如波动性高血糖、缺氧、血红素等,均可诱导其显著表达。波动性糖尿病大鼠肾脏中出现了氧化应激,激活了Nrf2蛋白及mRNA表达,但FHG组HO-1、γ-GCS蛋白及mRNA的表达明显低于NC组,这可能是由于波动性高血糖氧化应激过强消耗了通过机体自身的Nrf2/ARE信号通路激活而增加的抗氧化蛋白HO-1、γ-GCS,致使机体内抗氧化蛋白含量降低,氧化与抗氧化系统拮抗失衡,因而氧化应激对波动性高血糖大鼠肾脏的损伤显著增加。氧化应激损伤的发生,与机体的抗氧化能力下降有关,因此,通过提高机体内抗氧化蛋白的水平,减缓波动性高糖所致的肾脏损伤,对预防糖尿病并发症的发生有着重要的作用。
随着社会的不断发展,传统中医中药在防治糖尿病方面发挥了重要的作用[16-17]。中医认为,糖尿病属"消渴"范畴,其病机主要在于阴精亏虚,燥热偏胜,故以清热润燥、养阴生津为治疗大法。人参具有"大补元气、补脾益肺、生津、安神益智"的功效。现代医学研究表明,人参皂苷是其主要活性成分,具有抗氧化、清除自由基、抗炎、解毒、抑制肿瘤细胞增殖、提高免疫力、降血糖等作用[18-19]。前期研究结果表明[20],人参皂苷使细胞中超氧化物歧化酶(SOD)活性增加,丙二醛(MDA)含量降低,有效清除机体内过多的自由基,阻止脂质过氧化物的过度产生,在波动性高血糖环境中增强血管内皮细胞抗氧化和抗凋亡能力。人参皂苷通过改善肾组织中基质金属蛋白酶-2(2MMP-2) 的表达,减少细胞外基质的形成,起到对肾脏的保护性作用[21]。实验研究发现,人参皂苷治疗后,HO-1、γ-GCS、和Nrf2蛋白及mRNA表达明显高于正常对照组及波动性高血糖组,提示人参皂苷通过促进Nrf2与Keap1解离,使其转位进入细胞核内,结合抗氧化反应元件ARE,上调HO-1、γ-GCS的表达,抗氧化蛋白含量增加,提高了机体的抗氧化反应能力,这与既往研究结果相一致[22]。人参皂苷具有较强的抗氧化和自由基清除能力,通过调控Nrf2/ARE信号通路,抑制波动性高糖所致的肾脏损伤,在防治糖尿病及其并发症方面具有确切的临床疗效。
综上所述,人参皂苷可以减轻波动性高血糖大鼠肾脏的氧化应激损伤,波动性高血糖大鼠的肾脏保护机制其机制可能是通过激动Nrf2/ARE信号通路启动抗氧化蛋白HO-1、γ-GCS的转录和表达。在临床上,现有的治疗及研究很难从根源上彻底逆转胰岛β细胞功能的障碍和凋亡,因而控制波动性高糖所致氧化应激对肾脏功能的损害,阻滞糖尿病并发症的发生尤为重要。西医对此无有效方法及药物,而传统中药可以发挥自身优势。因此,应该强调平稳降糖,尽量减少血糖的波动,重视波动性高血糖对肾脏组织的损害,及传统的中药对延缓糖尿病并发症的作用。
| [1] | Kumar D, Zimpelmann J, Robertson S, et al. Tubular and interstitial cell apoptosis in the streptozotocin-diabetic rat kidney[J]. Nephron Exp Nephrol, 2004, 96 (3) : 77–88. DOI:10.1159/000076749 |
| [2] | Ge QM, Dong Y, Zhang M, et al. Effects of intermittent high glucose on oxidative stress in endothelial cells[J]. Acta Diabetologica, 2010, 47 (1) : 97–103. |
| [3] | 崔俣, 马海英, 孔力. Nrf2/ARE通路与机体抗氧化机制的研究进展[J]. 吉林大学学报:医学版, 2011, 37 (1) : 187–190. |
| [4] | 王和强, 张太坤, 符莹, 等. 中药糖通饮方治疗早期糖尿病肾病患者临床观察[J]. 天津中医药大学学报, 2014, 33 (5) : 267–269. |
| [5] | Abdul-Ghani MA, Jani R, Chavez A, et al. Mitochondrial reactive oxygen species generation in obese non-diabetic and type 2 diabetic participants[J]. Diabetologia, 2009, 52 (4) : 574–582. DOI:10.1007/s00125-009-1264-4 |
| [6] | Quagliaro L, Piconi L, Assa R, et al. Intermittent high glucose enhances apoptosis related to oxidative stress inhuman umbilical vein endothelial cells:the role of protein kinase c and NAD (P) H-oxidase activation[J]. Diabetes, 2003, 52 (11) : 2795–2804. DOI:10.2337/diabetes.52.11.2795 |
| [7] | Evans JL, Goldfine ID, Maddu BA, et al. Oxidative stress and stress-activated signaling pathways:a unifying hypothesis of type 2 diabetes[J]. diabetes Endocrine, 2002, 23 (5) : 599–622. |
| [8] | Forbes JM, Coughlan MT, Cooper ME. Oxidative stress as a major culprit in kidney disease in diabetes[J]. Diabetes, 2008, 57 (6) : 1446–1454. DOI:10.2337/db08-0057 |
| [9] | Chang CM, Hsieh CJ, Huang JC, et al. Acute and chronic fluctuations in blood glucose levels can increase oxidative stress in type 2 diabetes mellitus[J]. Acta Diabetol, 2012, 49 (1) : 171–177. |
| [10] | 李素娟, 李剑敏, 汪洋, 等. 氧化应激和P53参与波动高糖诱导的肾小管上皮细胞凋亡[J]. 中国病理生理杂志, 2011, 27 (12) : 2302–2306. |
| [11] | Menshikova EB, Tkachev VO, Zenkov NK. Redox-dependent signaling system Nrf2/ARE in inflammation[J]. Molecular Biology, 2010, 44 (3) : 343–357. DOI:10.1134/S0026893310030015 |
| [12] | Uruno A, Yagishita Y, Yamamoto M. The Keap1-Nrf2 system and diabetes mellitus[J]. Archives of Biochemistry and Biophysics, 2015 (566) : 76–84. |
| [13] | Elango B, Dornadula S, Palanisamy R, et al. The emerging role of redox-sensitive Nrf2-Keap1 pathway in diabetes[J]. Pharmacological Research, 2015 (91) : 104–114. |
| [14] | Thimmulappa RK, Mai KH, Srisuma S, et al. Identification of Nrf2-regulated genes induced by the chemopreventive agent sulforaphane by oligonucleotide microarray[J]. Cancer Research, 2002, 62 (18) : 5196–203. |
| [15] | Yap WH, Khoo KS, Lim YH, et al. Maslinic acid induces HO-1 and NOQ1 expression via activation of Nrf2 transcription factor[J]. Biomedicine Preventive Nutrition, 2012, 2 (1) : 51–58. DOI:10.1016/j.bionut.2011.12.005 |
| [16] | 吕树泉, 张淑芳, 王猛, 等. 中西医结合治疗糖尿病周围血管病变临床疗效观察[J]. 天津中医药大学学报, 2016, 35 (2) : 92–94. |
| [17] | 谭俊珍, 李庆雯, 范英昌, 等. 六味地黄丸对糖尿病大鼠血糖和血脂的影响[J]. 天津中医药大学学报, 2007, 26 (4) : 196–198. |
| [18] | 孟凡丽, 苏晓田, 郑毅男. 人参皂苷Rb3对糖尿病模型小鼠的降血糖和抗氧化作用[J]. 华南农业大学学报, 2013, 34 (4) : 553–557. |
| [19] | 何道同, 王兵, 陈珺明. 人参皂苷药理作用研究进展[J]. 辽宁中医药大学学报, 2012, 14 (7) : 118–121. |
| [20] | 黄琦, 邓雯雯, 许家鸾, 等. 人参总皂苷对波动性高糖诱导的人脐静脉内皮细胞凋亡的影响[J]. 中药新药与临床药理, 2012, 23 (5) : 500–504. |
| [21] | 倪海祥, 杨雪辉, 朱峰, 等. 人参皂苷对糖尿病大鼠肾组织基质金属蛋白酶2表达的影响[J]. 中国中西医结合肾病杂志, 2009, 10 (3) : 211–213. |
| [22] | Kundu JK, Surh YJ. Nrf2-Keap1 Signaling as a potential target for chemoprevention of inflammation-associated carcinogenesis[J]. Pharm Res, 2010 (27) : 999–1013. |
 2016, Vol. 35
2016, Vol. 35