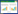文章信息
- 李春华, 刘志东, 丁伶伶, 黄瑞, 王舒雅
- LI Chun-hua, LIU Zhi-dong, DING Ling-ling, HUANG Rui, WANG Shu-ya
- 姜黄素固体脂质纳米粒制备及体外释放的研究
- Preparation and in vitro release of curcumin solid lipid nanoparticle
- 天津中医药大学学报, 2016, 35(6): 400-403
- Journal of fianjin university of traditional chinese medicine, 2016, 35(6): 400-403
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.06.10
-
文章历史
收稿日期: 2016-08-30
2. 天津中医药大学, 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 300193
2. Tianjin Modern Chinese Medicine Key Laboratory, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
姜黄素(Cur)是从姜黄属植物姜黄、郁金等根茎中提取的一种多酚类化合物。近年来国内外对Cur的研究表明,Cur具有多种生物学活性,如抗肿瘤,抗炎,抗氧化,降血脂,保护心肌等广泛的药理活性,并且对啮齿类动物和人的毒副作用小[1-4]。但是由于姜黄素的活性低,水溶性差,生物利用度低和稳定性差等特点,限制了其在临床上的应用[5-6]。因此,如何提高Cur生物利用度,研制生物利用度高,用量低且高效,稳定性好的制剂成为亟待解决的课题。
固体脂质纳米粒(SLN)是近年来正在发展的一种新型毫微粒类给药系统,作为一种新型给药载体综合了纳米乳和脂质体的优点,不仅可以改善药物稳定性,亲水性和生物利用度,还具有缓控释的作用[7-11]。
本实验采用乳化蒸发-低温固化法制备姜黄素固体脂质纳米粒(Cur-SLN),并对其粒径、电位、包封率进行测定,用差示扫描量热法(DSC)表征其性质,同时考察了其体外释放。
1 仪器与材料 1.1 仪器Nano ZS型激光散射粒径分析仪(Malvern,英国);TK-20A 型透皮散试验仪(上海锴凯科技贸易有限公司);Milli-Q超纯水系统(Millipore,美国);XS20S型电子天平(十万分之一,Mettler-Toledo,瑞士);CP70ME超高速离心机(日立公司,美国)。
1.2 材料姜黄素对照品(天津中新药业,≥ 98%);姜黄素原料药(西安赛扬物科技有限公司,≥ 95%);卵磷脂(Lipoid,上海东尚实业有限公司);单硬脂酸甘油酯(天津市北方天医化学试剂厂);聚氧乙烯(40)硬脂酸酯(Myrj52,南京威尔化工有限公司);透析袋(上海源叶生物科技有限公司);乙醇(分析纯,天津康科德科技有限公司);乙腈,甲醇(色谱纯,Sigma)。
2 方法与结果 2.1 姜黄素固体脂质纳米粒的制备称取处方量Myrj52加入超纯水10 mL,75℃水浴使溶解作为水相。另称取处方量的Cur,大豆卵磷脂,单硬脂酸甘油酯溶于4 mL无水乙醇,加热至溶解作为有机相,将有机相缓慢注入600 r/min搅拌的水相中,继续搅拌至有机溶剂挥发至8 mL[12-15]。
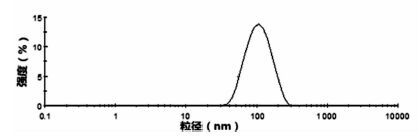
2.2 粒径及Zeta电位测定取最优处方制备的Cur-SLN混悬液适量,用水稀释20倍,分别测定粒径和Zeta电位[16]。粒径为(89.24±2.06) nm,见图 1,Zeta电位为(-18.77±1.27) mV,见图 2。
|
| 图 1 Cur-SLN粒径图 |
|
| 图 2 Cur-SLN Zeta电位图 |
色谱柱为ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流动相:乙腈-0.2%甲酸水(42:58),等度洗脱;流速:0.2 mL/min;检测波长:427 nm;柱温:35℃;进样量:5 μL。
2.3.2 线性关系的考察精密称取姜黄素标品适量,用甲醇依次稀释到14.7、19.6、29.4、39.2、58.8 mg/L的系列对照品溶液。分别取5 μL注入液相色谱仪,记录峰面积,以浓度C(mg/L)为横坐标,峰面积A为纵坐标进行回归,得到标准曲线方程为A=2.520×105C-2.858×105、相关系数r2=0.999 1,结果表明姜黄素在14.7~58.8 mg/L范围内线性关系良好。
2.3.3 精密度实验取质量浓度为 14.7、29.4、58.8 mg/L的Cur甲醇溶液,分别于1 d内测定5次,计算日内精密度;每日测定1次,连续测定3 d,计算日间精密度。结果日内RSD分别为0.13%、0.52%和0.19%,日间RSD分别为0.29%、0.26%和0.65%。
2.3.4 Cur-SLN包封率的测定取0.2 mL Cur-SLN加入甲醇稀释至2 mL,超声30 min使之破乳,4 000 r/min离心30 min,采用UPLC测定其总药物质量浓度(C总)。取0.2 mL Cur-SLN加入超纯水稀释至2 mL,60 000 r/min离心1 h,取上清液进样,UPLC测定其游离药物的质量浓度(C游离)。计算Cur-SLN包封率。包封率=(1-C游离/C总)×100%,其中 C游离为Cur-SLN混悬液中游离药物的浓度,C总为Cur-SLN混悬液中药物总的质量浓度。经测定,Cur-SLN的包封率为(89.55±1.84)%。
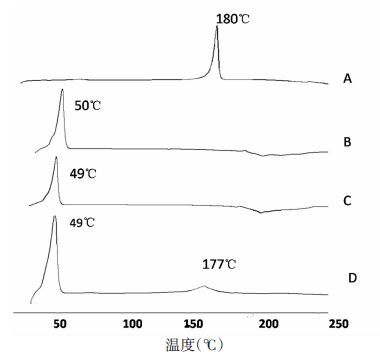
2.3.5 DSC检测取Cur原料药,Cur-SLN冻干粉,空白SLN冻干粉和Cur原料药与空白SLN冻干粉物理混合物(1:1)适量分别置于坩埚中,在氮气流20 mL/min、加热速率10℃/min的条件下,从 30℃升温到300℃,见图 3。
|
| 图 3 差示扫描量热仪(DSC)图谱 A:Cur;B:空白-SLN;C:Cur-SLN;D:Cur与空白-SLN物理混合物(1:1) |
结果显示,姜黄素在180℃有相变峰,空白SLN在50℃出现相变峰。比较姜黄素与物理混合物DSC曲线,物理混合物在49℃和177℃出现两个相变峰,分别对应空白SLN和姜黄素的相变温度。而Cur-SLN的DSC曲线中,姜黄素单体的相变峰消失,表明姜黄素被包裹于纳米粒中。
2.3.6 Cur-SLN体外释放以0.2%吐温80的磷酸盐缓冲溶液(PBS)(pH 7.4)为溶出介质,采用透析袋法进行测定[17-19]。精密吸取1 mL Cur-SLN和姜黄素溶液,分别置于透析袋中,两端封口固定于溶出杯内。取释放介质50 mL加热至37℃,在0.5、1、1.5、2、4、6、8、10、12 h取样1 mL,同时补充同温度同体积的介质。取出液体12 000 r/min离心15 min,取上清液进样UPLC测定含量并计算其累计释放度。结果见图 4。结果显示,姜黄素溶液组在8 h释放完全,达到平台期,释放率达96.34%。而Cur-SLN在10 h时释放达到平台期,释放率为39.04%.
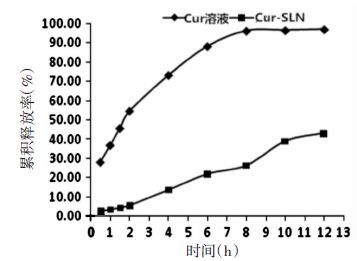
|
| 图 4 Cur累计释放曲线 |
固体脂质体纳米粒的制备方法主要有高压乳均法,高速搅拌超声法,微乳法,乳化-固化法等[8, 20]。高压乳均法适用于工业的生产[8],高速搅拌超声法需要高浓度的乳化剂来降低粒径,过高的乳化剂含量可能产生毒性[8],微乳法制备的SLN的包封率和载药量较低[3],本实验采用乳化-固化法制备了Cur-SLN,简单易行,通过对各项理化性质及物理稳定性考察,结果表明乳化-固化法制备的制剂物理稳定性好。
在筛选处方的过程中,选用了单硬脂酸甘油酯、山嵛酸甘油酯(ATO888)作为脂质材料,分别单独使用一种脂质材料和两者联合使用,最终确定以单硬脂酸甘油酯单独为载体材料制备的固体脂质纳米粒稳定性以及粒径、电位、包封率均较好,故选用单硬脂酸甘油酯为脂质载体。单因素考察Myrj52 和卵磷脂的量,选择Myrj52的用量为400、500、600、700 mg和卵磷脂的用量为200、250、300 mg分别进行单一变量分析,最终确定Myrj52为700 mg,卵磷脂为250 mg时,纳米粒的粒径和包封率较适宜。
姜黄素是脂溶性的药物,难溶于水,所以在体外释放实验中,释放介质中加入0.2%吐温80增加姜黄素的溶解度。从体外释放的结果可以看出,Cur-SLN中药物从脂质体释放时没有突释效应,说明此固体脂质纳米粒的载药机制主要为包裹镶嵌[14];Cur-SLN组体外释放前10 h释放较快,累计释放率为39.04%,10 h以后缓慢释放,12 h累计释放率为43.12%,表明Cur-SLN具有良好的缓释作用,而在动物甚至人体内的相应特征尚待进一步研究证实。
| [1] | 余美荣, 蒋福升, 丁志山. 姜黄素的研究进展[J]. 中草药, 2009, 40 (5) : 828–831. |
| [2] | Bengmark S, 刘 青. 植物源保护剂姜黄素的研究进展[J]. 现代药物与临床, 2009, 24 (1) : 22–31. |
| [3] | 琚辉, 郝存江, 尹飞, 等. 姜黄素固体脂质纳米粒的制备及表征[J]. 药物评价的研究, 2010, 33 (60) : 420–423. |
| [4] | 许东晖, 王胜, 金晶, 等. 姜黄素的药理作用研究进展[J]. 中草药, 2005, 36 (11) : 1737–1740. |
| [5] | Hossain DM, Bhattacharyya S, Das T, et al. Curcumin:the multi-targeted therapy for cancer regression[J]. Front Biosci (Schol Ed), 2012, 7 (4) : 335–355. |
| [6] | Gao CX, Ding ZS, Liang BB, et al. Study on the effects of curcumin on angiogenesis[J]. J Chin Med Mater, 2003, 26 (7) : 499–502. |
| [7] | 李欣玮, 孙立新, 林晓宏, 等. 固体脂质纳米粒作为药物载体[J]. 化学进展, 2007, 19 (1) : 87–92. |
| [8] | 王影, 李京京, 陆兵. 固体脂质纳米粒的制备及应用研究进展[J]. 生物技术通讯, 2006, 17 (3) : 471–475. |
| [9] | 王建新, 张志荣. 固体脂质纳米粒的研究进展[J]. 中国药学杂志, 2001, 36 (2) : 73–76. |
| [10] | 陈毅文, 张玲. 姜黄素纳米制剂的研究进展[J]. 医学综述, 2014, 20 (2) : 237–241. |
| [11] | Ghadiri M, Fatemi S, Vatanara A, et al. Loading hydrophilic drug in solid lipid media as nanoparticles:Statistical modeling of entrapment efficiency and particle size[J]. Int J Pharm, 2012, 424 (1-2) : 128–137. DOI:10.1016/j.ijpharm.2011.12.037 |
| [12] | 瞿继兰, 刘志东, 郭秀君, 等. 丹参酮ⅡA固体脂质纳米粒的制备及质量评价[J]. 天津中医药, 2014, 36 (9) : 564–566. |
| [13] | 张卿, 张良珂, 袁佩, 等. 和厚朴酚固体脂质纳米粒的制备及性质研究[J]. 中草药, 2010, 42 (4) : 691–693. |
| [14] | 李厚丽, 翟光喜, 祝伟伟, 等. 槲皮素固体脂质纳米粒的制备及小鼠口服吸收研究[J]. 中国药学杂志, 2008, 43 (6) : 435–438. |
| [15] | 张先洲, 陈晓清, 潘细贵, 等. 青藤碱固体脂质纳米粒制备[J]. 中国医院药学杂志, 2008, 28 (24) : 2081–2084. |
| [16] | 佟玲, 李志宝, 陈静, 等. 麦角甾苷固体脂质纳米粒制备及其体外释药的研究[J]. 天津中医药, 2015, 32 (6) : 368–370. |
| [17] | 张晓娟, 刘科攀, 王丽峰, 等. 淫羊藿苷隐形固体脂质纳米粒的制备及体外释放研究[J]. 中成药, 2010, 33 (11) : 1905–1907. |
| [18] | 黄义, 李新中, 雷鹏, 等. 黄芩苷固体脂质纳米粒体外释放研究[J]. 中国药房, 2009, 20 (9) : 646–647. |
| [19] | 肖琴, 陈芳, 常明泉, 等. 槲皮素固体脂质纳米粒体外释放度考察[J]. 药品检验, 2012, 9 (25) : 135–142. |
| [20] | 夏爱晓, 宋倩倩, 孙渊. 固体脂质纳米粒制备及应用研究进展[J]. 药学实践杂志, 2012, 30 (5) : 2081–2084. |
 2016, Vol. 35
2016, Vol. 35