文章信息
- 董勇喆, 史文中, 杨圣财, 李晓霞, 张祎, 王涛
- DONG Yong-zhe, SHI Wen-zhong, YANG Sheng-cai, LI Xiao-xia, ZHANG Yi, WANG Tao
- 沙葱化学成分的分离与结构鉴定Ⅱ
- Isolation and structural identification of constituents from Allium mongolicm Regel II
- 天津中医药大学学报, 2016, 35(6): 404-408
- Journal of fianjin university of traditional chinese medicine, 2016, 35(6): 404-408
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.06.11
-
文章历史
收稿日期: 2016-08-07
沙葱(Allium mongolicm Regel), 为百合科葱属植物, 又名蒙古韭, 因具有挥发性的硫醚类化合物, 使得与其他葱属植物同样具有特殊刺激性气味[1]。其富含粗蛋白质、粗脂肪、粗纤维和人体所需的常量、微量元素以及必需氨基酸。沙葱以其地上部分入药, 可用于降血脂、降压, 治疗胸闷胸痛以及秃疮、青腿病等[2]。中医理论认为食用沙葱有利于增强胃肠蠕动, 从而提高食欲, 常用来治疗消化不良, 便秘、瘴气、腹泻、白痢、肠炎等疾病[3]。此外, 长期食用还能强肾补阳, 强志益目, 更有通宣理表, 防流感之效。在中国境内, 主要分布于内蒙古自治区、甘肃、新疆、青海、宁夏、陕西等地, 境外于俄罗斯、蒙古有少量分布, 具有抗旱抗寒, 适应性强的特点[4~6]。
沙葱主要含有黄酮、生物碱、挥发油和多糖等化学成分。现代药理学研究表明, 沙葱具有多种药理学活性, 如包美艳等[7]和蔺婷娟等[8]在研究沙葱多糖的过程中发现, 其能够促进羊外周血淋巴细胞的增殖和影响肠道免疫球蛋白数量和活性, 从而发挥免疫调节作用。萨茹丽等[9]通过对沙葱叶、花和秆的总提取物中总黄酮进行抗氧化能力和抗菌性的研究, 发现三者均有一定作用, 且叶提取物活性较高。此外, 扈瑞平等[10]研究发现沙葱多糖也有较强的体外抑菌作用, 还有研究表明, 在细胞分子水平上, 沙葱多糖在促进淋巴因子的表达中有显著作用, 进而发挥抗肿瘤作用[11]。
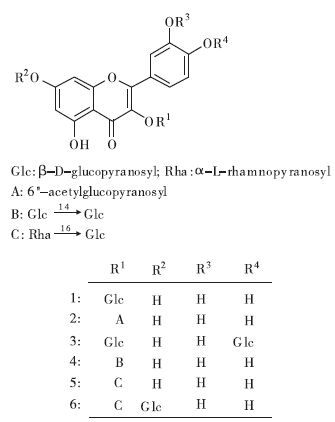
笔者在对沙葱化学成分研究的过程中, 利用与文献[12~17]类似的方法, 分离鉴定出6个单体化合物。其中, 2、6为从葱属植物中首次分离得到, 1、3~5为从该植物中首次分离得到, 结构见图 1。
|
| 图 1 沙葱中得到的黄酮类化合物(1~6) |
Bruker 500MR 超导核磁共振波谱仪(瑞士Bruker公司, Avance Ⅲ 500MR), 安捷伦6520 Q-TOF LC/MS, D101大孔吸附树脂(天津海光化工有限公司), Sephadex LH-20(瑞典Ge Healthcare Bio-Sciences AB公司), Cosmosil 5C18-MS-II 制备柱和分析柱(250 mm×4.6 mm和250 mm×20 mm, 均为5 μm, Japan, Nacalai Tesque 公司), TLC Silica gel 60 F254 (Aluminium sheets 20 cm×20 cm, 德国 Merck 公司)。
色谱/分析纯氯仿、甲醇、乙腈、丙酮、冰醋酸等试剂购自天津康科德科技有限公司。
沙葱采自内蒙古阿拉善盟, 由天津中医药大学李天祥教授鉴定为百合科葱属植物沙葱(Allium mongolicm Regel)。
2 提取与分离取新鲜沙葱17.8 kg, 依次用2倍量95%乙醇溶液和2倍量50%乙醇加热回流提取(2 h/1 h), 减压回收溶剂得乙醇提取物浸膏约515 g。取浸膏约470 g, 加水溶解后, 用乙酸乙酯-水(1:1, V/V)萃取, 得到乙酸乙酯层萃取物65 g和水层萃取物381 g。取萃取后水层342 g 经D101大孔吸附树脂柱层析, 分别用水和95%乙醇依次洗脱, 得到水洗脱物(289 g)及95%乙醇洗脱物(30 g)。
上述95%乙醇洗脱物, 经制备型高效液相色谱(PHPLC)分离制备[MeOH-H2O(20:80 → 30:70 → 55:45 → 100:0) , 得到22个组分(Fr. 1~22) 。
Fr. 13(426.2 mg)经Sephadex LH-20 柱层析[MeOH-H2O(1:1, V/V)], 得到6个组分(Fr. 13-1~13-6) 。Fr. 13-2 先后经2次PHPLC分离制备[CH3CN-H2O(9:91, V/V)+1% HAc, CH3CN-H2O(11:89, V/V)+ 1% HAc], 得到化合物quercetin-3-O-(6''-O-α-L-rhamnopyransoyl)-β-D-glucopyranoside-7-O-β-D-glucopyranoside(6, 10.0 mg)。
Fr. 16(3.2 g)经Sephadex LH-20柱层析[MeOH-H2O(1:1, V/V)], 得到5个组分(Fr. 16-1~16-5) 。Fr. 16-4 经PHPLC分离制备[CH3CN-H2O(19:81, V/V)+ 1% HAc], 得到槲皮素-3, 4'-二-O-β-D-吡喃葡萄糖苷(3, 38.7 mg)。
Fr. 18(1.4 g)经Sephadex LH-20柱层析[MeOH-H2O(1:1, V/V), 得到4个组分(Fr. 18-1~18-4) 。Fr. 18-4 经PHPLC再次分离制备[CH3CN-H2O(20:90, V/V)+ 1% HAc], 得到异槲皮苷(1, 131.0 mg)、quercetin-3-O-β-D-glucopyranosyl-(1→4) -β-D-glucopyranoside(4, 61.3 mg)和芦丁(5, 340.3 mg), 同时得到的组分Fr. 18-4-6继续经PHPLC分离制备[CH3CN-H2O(20:90, V/V)+ 1% HAc], 得到槲皮素-3-O-(6″-O-乙酰基)-β-D-吡喃葡萄糖苷(2, 7.1 mg)。
3 结构鉴定化合物1:黄色结晶。高分辨Q-TOF-ESI-MS给出其准分子离子峰m/z 463.088 4[M-H]-, 确定其分子式为C21H20O12(Calcd for C21H19O12, 463.088 2) 。1H-NMR(500 MHz, DMSO-δ6) :δ 6.21(1H, br. s, H-6) , 6.41(1H, br. s, H-8) , 7.59(1H, d, J=2.0 Hz, H-2'), 6.86(1H, d, J=8.0 Hz, H-5'), 7.60(1H, dd, J=2.0、8.0 Hz, H-6'), 12.65(1H, br. s, 5-OH), 5.48(1H, d, J=7.0 Hz, H-1″), 3.11~3.62(6H, m, H-2″~6″)。其1H-、13C-NMR(125 MHz, DMSO-d6, 见表 1)谱数据与文献[18]相对照, 鉴定该化合物为异槲皮苷(isoquercetin)。
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 序号 | 3 | 4 | 5 | 6 |
| 2 | 156.3 | 156.3 | 155.2 | 156.3 | 156.4 | 157.1 | 1´´´ | 101.4 | 103.1 | 100.7 | 100.6 |
| 3 | 133.2 | 133.0 | 133.7 | 133.1 | 133.1 | 133.4 | 2´´´ | 73.2 | 73.2 | 70.3 | 70.2 |
| 4 | 177.3 | 177.2 | 177.3 | 177.2 | 177.1 | 177.4 | 3´´´ | 75.8 | 76.4 | 70.5 | 70.4 |
| 5 | 161.2 | 161.1 | 161.1 | 161.1 | 161.1 | 160.8 | 4´´´ | 69.6 | 69.9 | 71.8 | 71.7 |
| 6 | 98.7 | 98.8 | 99.0 | 98.8 | 98.2 | 99.2 | 5´´´ | 77.1 | 76.7 | 68.1 | 68.1 |
| 7 | 164.6 | 164.8 | 165.4 | 164.6 | 164.9 | 162.7 | 6´´´ | 60.6 | 61.0 | 17.6 | 17.6 |
| 8 | 93.5 | 93.5 | 93.8 | 93.5 | 93.6 | 94.4 | 1´´´´ | 99.8 | |||
| 9 | 156.0 | 156.3 | 156.4 | 156.1 | 156.4 | 155.9 | 2´´´´ | 73.0 | |||
| 10 | 103.8 | 103.7 | 103.6 | 103.7 | 103.5 | 105.5 | 3´´´´ | 76.3 | |||
| 1´ | 121.1 | 120.9 | 124.4 | 121.0 | 121.0 | 120.9 | 4´´´´ | 69.5 | |||
| 2´ | 116.1 | 116.0 | 116.4 | 116.1 | 116.1 | 116.3 | 5´´´´ | 77.0 | |||
| 3´ | 144.8 | 144.8 | 146.1 | 144.8 | 144.7 | 144.7 | 6´´´´ | 60.5 | |||
| 3´ | 148.5 | 148.5 | 147.3 | 148.5 | 148.5 | 148.6 | |||||
| 5´ | 115.1 | 115.0 | 115.3 | 115.2 | 115.1 | 115.1 | |||||
| 6´ | 121.5 | 121.4 | 120.8 | 121.5 | 121.4 | 121.6 | |||||
| 1" | 100.9 | 100.9 | 100.7 | 100.6 | 101.2 | 100.9 | |||||
| 2" | 74.0 | 73.9 | 74.1 | 73.7 | 74.0 | 73.9 | |||||
| 3" | 76.4 | 76.1 | 76.4 | 74.7 | 76.4 | 76.3 | |||||
| 4" | 69.9 | 69.7 | 69.9 | 80.2 | 69.9 | 69.9 | |||||
| 5" | 77.5 | 73.9 | 77.5 | 75.3 | 75.8 | 75.9 | |||||
| 6" | 60.9 | 62.7 | 60.9 | 60.3 | 66.9 | 66.9 | |||||
| 6"_COCH3 | _ | 169.8 | |||||||||
| 6"_COCH3 | 20.0 |
化合物2:黄色粉末。高分辨Q-TOF-ESI-MS给出其准分子离子峰m/z 505.096 6[M-H]-, 确定其分子式为C23H22O13(Calcd for C23H21O13, 505.098 8) 。1H-NMR(500 MHz, DMSO-d6) :d 6.19(1H, br. s, H-6) , 6.39(1H, br. s, H-8) , 7.52(1H, br. s, H-2'), 6.83(1H, d, J=8.0 Hz, H-5'), 7.53(1H, br. d, ca. J=8 Hz, H-6')、12.62(1H, br. s, 5-OH), 5.37(1H, d, J=7.0 Hz, H-1″), 3.03~4.14(6H, m, H-2″~6″), 1.73(3H, s, 6″-COCH3) 。其1H-、13C-NMR(125 MHz, DMSO-d6, 见表 1)谱数据与文献[19]相对照, 鉴定该化合物为槲皮素-3-O-(6″-O-乙酰基)-β-D-吡喃葡萄糖苷(quercetin-3-O-(6″-O-acetyl)-β-D-glucopyranoside)。
化合物3:黄色粉末。高分辨Q-TOF-ESI-MS给出其准分子离子峰m/z 661.115 0[M+Cl]-, 确定其分子式为C27H30O17(Calcd for C27H30O17Cl, 661.117 7) 。1H-NMR(500 MHz, DMSO-d6) :δ 6.19(1H, br. s, H-6) , 6.41(1H, br. s, H-8) , 7.65(1H, d, J=2.0 Hz, H-2'), 7.22(1H, d, J=8.5 Hz, H-5'), 7.62(1H, dd, J=2.0、8.5 Hz, H-6'), 12.56(1H, s, 5-OH), 5.50(1H, d, J=7.0 Hz, H-1″), 3.23(1H, dd, J=7.0、9.0 Hz, H-2″), 3.24(1H, J=9.0、9.0 Hz, H-3″), 3.12(2H, m, H-4″ and 5″), [3.36(1H, dd, J=4.5、11.0 Hz), 3.61(1H, br. d, ca. J=11 Hz), H2-6″], 4.88(1H, d, J=7.0 Hz, H-1″'), 3.36(1H, dd, J=7.0、8.5 Hz, H-2″'), 3.35(1H, dd, J=8.5、9.0 Hz, H-3″'), 3.22(1H, dd, J=9.0、9.0 Hz, H-4″'), 3.41(1H, m, H-5″'), [3.52(1H, dd, J=5.5、11.5 Hz), 3.74(1H, br. d, ca. J=12 Hz), H2-6″']。其1H-、13C-NMR(125 MHz, DMSO-d6, 见表 1)谱数据与文献[20]相对照, 鉴定该化合物为槲皮素-3, 4'-二-O-β-D-吡喃葡萄糖苷(quercetin-3, 4'-di-O-β-D-glucopyranoside)。
化合物4:黄色粉末。高分辨Q-TOF-ESI-MS给出其准分子离子峰m/z 625.142 1[M-H]-, 确定其分子式为C27H30O17(Calcd for C27H29O17, 625.141 0) 。1H-NMR(500 MHz, DMSO-d6) :δ 6.20(1H, br. s, H-6) , 6.41(1H, br. s, H-8) , 7.59(1H, d, J=2.0 Hz, H-2'), 6.87(1H, d, J=7.5 Hz, H-5')、7.57(1H, dd, J=2.0, 7.5 Hz, H-6'), 12.63(1H, s, 5-OH), 5.52(1H, d, J=7.5 Hz, H-1″), 3.37(1H, dd, J=7.5、8.0 Hz, H-2″), 3.43(1H, J=7.5、8.0 Hz, H-3″), 3.42(1H, J=8.0、8.0 Hz, H-4″), 3.29(1H, m, H-5″), [3.52(1H, dd, J=4.5、11.5 Hz), 3.66(1H, br. d, ca. J=12 Hz), H2-6″], 4.29(1H, d, J=7.5 Hz, H-1″'), 3.02(1H, dd, J=7.5、8.0 Hz, H-2″'), 3.18(1H, dd, J=8.0、8.5 Hz, H-3″'), 3.09(1H, J=8.5、8.5 Hz, H-4″'), 3.23(1H, m, H-5″'), [3.44(1H, dd, J=5.5、12.0 Hz), 3.73(1H, br. d, ca. J=12 Hz), H2-6″']。其1H-、13C-NMR(125 MHz, DMSO-d6, 见表 1)谱数据结合1H-1H COSY、HSQC、HMBC等2D-NMR谱的解析, 鉴定该化合物为文献[21]所报道的quercetin-3-O-β-D-glucopyranosyl-(1→4) -β-D-glucopyranoside。
化合物5:黄色粉末。高分辨Q-TOF-ESI-MS给出其准分子离子峰m/z 609.144 4[M-H]-, 确定其分子式为C27H30O16(Calcd for C27H29O16, 609.146 1) 。1H-NMR(500 MHz, DMSO-d6) :δ 6.17(1H, br. s, H-6) , 6.36(1H, br. s, H-8) , 7.53(1H, d, J=2.0 Hz, H-2'), 6.84(1H, d, J=8.5 Hz, H-5'), 7.55(1H, dd, J=2.0, 8.5 Hz, H-6'), 12.57(1H, s, 5-OH), 5.33(1H, d, J=7.0 Hz, H-1″), 3.22(2H, J=7.0、9.5 Hz, H-2″ and 3″), 3.07(1H, dd, J=9.5、9.5 Hz, H-4″), 3.23(1H, m, H-5″), [3.28(1H, dd, J=6.0、12.0 Hz), 3.71(1H, br. d, ca. J=12 Hz), H2-6″], 4.39(1H, br. s, H-1″'), 3.40(1H, br. d, ca. J=3 Hz, H-2″'), 3.29(1H, dd, J=3.0, 9.5 Hz, H-3″'), 3.08(1H, dd, J=9.5、9.5 Hz, H-4″'), 3.27(1H, m, H-5″'), 1.00(3H, d, J=6.0 Hz, 6″'-CH3) 。其1H-、13C-NMR(125 MHz, DMSO-d6, 见表 1)谱数据与文献[22]相对照, 鉴定该化合物为芦丁(rutin)。
化合物6:黄色粉末。高分辨Q-TOF-ESI-MS给出其准分子离子峰m/z 771.200 2[M-H]-, 确定其分子式为C33H40O21(Calcd for C33H39O21, 771.198 9) 。1H-NMR(500 MHz, DMSO-d6) :δ 6.45(1H, br. s, H-6) , 6.73(1H, br. s, H-8) , 7.57(1H, br. s, H-2'), 6.86(1H, d, J=8.5 Hz, H-5'), 7.55(1H, br. d, ca. J=9 Hz, H-6'), 12.60(1H, s, 5-OH), 5.39(1H, d, J=7.0 Hz, H-1″), 3.23(1H, J=7.0、9.5 Hz, H-2″), 3.24(1H, J=9.0、9.5 Hz, H-3″), 3.06(1H, J=9.0、9.0 Hz, H-4″), 3.25(1H, m, H-5″), [3.47(1H, dd, J=4.5, 12.0 Hz), 3.71(1H, br. d, ca. J=12 Hz), H2-6″], 4.40(1H, br. s, H-1″'), 3.38(1H, br. d, ca. J=3 Hz, H-2″'), 3.27(1H, dd, J=3.0、9.5 Hz, H-3″'), 3.08(1H, J=9.5、9.5 Hz, H-4″'), 3.28(1H, m, H-5″'), 1.00(3H, d, J=6.5 Hz, 6″'-CH3) , 5.08(1H, d, J=7.5 Hz, H-1″″), 3.26(1H, J=7.5、9.5 Hz, H-2″″), 3.24(1H, J=9.5、9.5 Hz, H-3″″), 3.18(1H, J=9.5、9.5 Hz, H-4″″), 3.44(1H, m, H-5″″), [3.30(1H, m, overlapped), 3.72(1H, br. d, ca. J=12 Hz), H2-6″″]。其1H-、13C-NMR(125 MHz, DMSO-d6, 见表 1)谱数据与文献[23]相对照, 鉴定该化合物为quercetin 3-O-(6″-O-α-L-rhamnopyranosyl)-β-D-glucopyranoside-7-O-β-D-glucopyranoside。
4 结果为了进一步扩大对大漠植物沙葱的开发与利用, 笔者运用色谱和波谱学方法, 对沙葱的化学成分进行了研究, 分离并鉴定了以下6个单体成分, 分别是异槲皮苷(1) 、槲皮素-3-O-(6″-O-乙酰基)-β-D-吡喃葡萄糖苷(2) 、槲皮素-3, 4'-二-O-β-D-吡喃葡萄糖苷(3) 、quercetin-3-O-β-D-glucopyranosyl-(1→4) -β-D-glucopyranoside(4) 、芦丁(5) 、quercetin 3-O-(6″-O-α-L-rhamnopyranosyl)-β-D-glucopyranoside-7-O-β-D-glucopyranoside(6) 。其中, 化合物2、6为首次从葱属中分离得到, 1、3~5为首次从该植物中分离得到。
5 讨论沙葱营养成分丰富[24], 作为一种可食用绿色植物, 已逐渐被人们所熟知。同时, 作为一种优等饲料, 绵羊饲用后, 能够明显改善羊肉的口感和味道[25]。
目前, 有关沙葱药理作用的研究多集中沙葱多糖上, 也有学者曾对沙葱总提取物进行了研究[26~28], 但仍需进一步深入。通常, 黄酮类化合物因B环中含有C-2、C-3位双键, C-4位羰基和C-3、C-5位的羟基取代, 使得黄酮类化合物具有一定的抗氧化作用, 且在防治心血管疾病[29]方面也有潜在的药用价值, 但对于沙葱中所含的黄酮类化合物仅有少数药理学方面的研究, 对其药效物质基础和相应的构效关系以及其他的药理活性, 尚需进行更深层次的研究和探索。
| [1] | 王俊魁. 顶空固相微萃取结合气质联用分析沙葱中挥发性成分[J]. 食品工业科技, 2012, 33 (24) : 171–173. |
| [2] | 斯琴巴特尔, 刘新民. 蒙古韭的营养成分及民族植物学[J]. 中国草地, 2002, 24 (3) : 52–54. |
| [3] | 王丽思, 敖长金, 张兴夫. 沙葱多糖对小鼠腹腔巨噬细胞的激活作用[J]. 中国畜牧兽医, 2010, 37 (4) : 50–52. |
| [4] | 马筑泉.内蒙古植物志(第5卷)[M].第2版.呼和浩特:内蒙古人民出版社,1994. |
| [5] | 刘英心, 杨喜林, 姚育英. 中国沙漠植物志(第1卷)[M]. 北京: 科学出版社, 1987 |
| [6] | 陈山. 中国草地饲用植物资源[M]. 沈阳: 辽宁民族出版社, 1994 |
| [7] | 包美艳, 敖长金, 赵飞艳, 等. 沙葱多糖对绵羊外周血淋巴细胞的调节作用研究[J]. 饲料工业, 2013, 34 (12) : 9–12. |
| [8] | 蔺婷娟.沙葱多糖对肉羊血液生化指标和肠道粘膜免疫影响的研究[D].呼和浩特:内蒙古农业大学,2011. |
| [9] | 萨茹丽, 木其尔, 王翠芳, 等. 沙葱不同部位提取物总黄酮含量及其体外抗氧化、抗菌活性研究[J]. 食品工业科技, 2014, 35 (22) : 124–127. |
| [10] | 扈瑞平, 敖长金, 杜玲, 等. 沙葱多糖的体外抑菌试验研究[J]. 内蒙古大学学报:自然版, 2011, 42 (3) : 299–303. |
| [11] | 赵飞艳, 敖长金, 包美艳, 等. 沙葱多糖对绵羊外周血淋巴细胞IFN-γ与STAT1 mRNA表达的影响[J]. 畜牧兽医学报, 2013, 44 (12) : 1932–1938. |
| [12] | 吴帅, 刘二伟, 张祎, 等. 川续断中化学成分的研究[J]. 天津中医药大学学报, 2010, 29 (3) : 147–150. |
| [13] | 刘丽丽, 李晓霞, 陈玥, 等. 槐米中酚酸类化学成分的研究[J]. 天津中医药大学学报, 2014, 33 (1) : 39–41. |
| [14] | 刘丽丽, 李晓霞, 陈玥, 等. 槐米化学成分研究Ⅰ[J]. 天津中医药大学学报, 2014, 33 (4) : 230–233. |
| [15] | 王强, 张祎, 韩立峰, 等. 中药川续断化学成分的研究Ⅲ[J]. 天津中医药大学学报, 2014, 33 (2) : 108–111. |
| [16] | 邓屾, 刘丽丽, 陈玥, 等. 益母草化学成分研究Ⅲ[J]. 天津中医药大学学报, 2014, 33 (6) : 362–365. |
| [17] | 吴克磊, 康利平, 熊呈琦, 等. 蒺藜全草中甾体皂苷类化学成分研究[J]. 天津中医药大学学报, 2012, 31 (4) : 225–228. |
| [18] | 陈江弢, 冯峰. 四川寄生的化学成分研究[J]. 中药材, 2007, 30 (11) : 1393–1395. |
| [19] | 许芳, 赵军, 徐芳, 等. 新疆圆柏枝叶化学成分研究[J]. 中药材, 2013, 36 (12) : 1957–1959. |
| [20] | 杨晓虹, 刘银燕, 刘丽娟, 等. 分蘖葱头中新黄酮苷的结构鉴定[J]. 药学学报, 2000, 35 (10) : 752–755. |
| [21] | Yamauchi K, Mitsunaga T, Batubara I, et al. Synthesis of quercetin glycosides and their melanogenesis stimulatory activity in B16 melanoma cells[J]. Bioorganic&Medicinal Chemistry, 2014, 22 (3) : 937–944. |
| [22] | 刘荣华, 余伯阳. 山里红叶化学成分研究[J]. 中药材, 2006, 29 (11) : 1169–1173. |
| [23] | Lu Y, Sun Y, Foo LY, et al. Phenolic glycosides of forage legume Onobrychis viciifolia[J]. Phytochemistry, 2000, 55 (1) : 67–75. DOI:10.1016/S0031-9422(00)00143-6 |
| [24] | 张巧娥, 敖长金. 沙葱提取物中营养成分分析[J]. 畜牧与兽医, 2008, 40 (5) : 53–54. |
| [25] | 卢媛.沙葱、地椒风味活性成分及其对绵羊瘤胃发酵和羊肉风味的影响[D].呼和浩特:内蒙古农业大学,2002. |
| [26] | 哈斯额尔敦, 敖长金, 张巧娥, 等. 沙葱水溶性提取物对绵羊瘤胃发酵功能(体外)的影响[J]. 畜牧与兽医, 2008, 40 (1) : 26–31. |
| [27] | 张巧娥, 敖长金, 缪亚娟. 沙葱提取物对绵羊消化道乳酸菌产共轭亚油酸(CLA)含量的影响[J]. 畜牧与兽医, 2008, 40 (12) : 35–39. |
| [28] | 李亚蕾, 罗瑞明. 沙葱提取物抗菌效果的研究[J]. 安徽农业科学, 2008, 36 (33) : 14596–14597. |
| [29] | Obdulio BG, Julian C, Francisco RM, et al. Uses and properties of citrus flavonoids[J]. J Agric Food Chem, 1997, 45 (12) : 4505–4515. DOI:10.1021/jf970373s |
 2016, Vol. 35
2016, Vol. 35