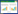文章信息
- 张晓雪, 武婕, 余河水, 张丽娟, 李薇, 宋新波
- ZHANG Xiao-xue, WU Jie, YU He-shui, ZHANG Li-juan, LI Wei, SONG Xin-bo
- 加味香连丸的质量控制研究
- The research of quality contral of Jiawei Xianglian pill
- 天津中医药大学学报, 2016, 35(6): 413-417
- Journal of fianjin university of traditional chinese medicine, 2016, 35(6): 413-417
- http://dx.doi.org/10.11656/j.issn.1673-9043.2016.06.13
-
文章历史
收稿日期: 2016-07-11
2. 天津中一制药有限公司, 天津 300193
2. Tianjin Zhongyi pharmaceutical Co. Ltd, Tianjin 300193, China
痢疾是痢疾杆菌引起的肠道传染病。临床主要表现为发热、腹痛、腹泻、里急后重、排黏液脓血样大便。痢疾夏季发病率高,中医学认为多由湿热之邪所致[1-8]。其中加味香连丸就是常用于治疗大肠湿热所致痢疾的中成药之一。具有清热祛湿,化滞止痛的功效,现代应用多用于治疗泄泻、慢性结肠炎[9-10]。收载于2015版《中国药典》[11]。本品由木香、黄芩、白芍、姜厚朴、槟榔、制吴茱萸、炙甘草、姜黄连、黄柏、当归、麸炒枳壳、醋延胡索等12味药物组成。其中白芍、当归、枳壳、黄芩、厚朴均为主要药味,但现行标准仅有木香、厚朴、枳壳和延胡索的薄层色谱定性鉴别项及盐酸小檗碱的含量测定项[12-13],所以本实验对加味香连丸中的白芍、黄芩、当归进行定性鉴别,并采用高效液相色谱法(HPLC)同时测定加味香连丸中芍药苷、柚皮苷、黄芩苷、厚朴酚的含量。为进一步提高加味香连丸用药安全和质量控制研究提供科学依据。
1 仪器和试药 1.1 仪器LC-2010AHT型液相色谱仪(日本岛津公司),岛津LC-2010色谱工作站;AB135-S电子分析天平(上海跃进医疗器械有限公司);HH.S21-6数显式电热恒温水浴锅(上海跃进医疗器械有限公司);1AB恒温干燥箱(天津市天宇实验仪器有限公司);SHB-Ⅲ循环水式真空泵(天津科诺仪器设备有限公司)。薄层层析硅胶GF254板、G板(青岛鼎康硅胶有限公司)。
1.2 试药加味香连丸(批号3082226、3082225、2083019) ,购自北京同仁堂制药有限公司;阴性样品均为实验室自制。芍药苷(批号AB017P)、阿魏酸(批号AB156F)、藁本内酯(批号AB177W),均购自天津一方科技有限公司;黄芩苷(批号110715-201312) 、黄芩素(批号111595-20130905) 、汉黄芩素(批号111514-20130403) 、柚皮苷(批号110722-2013012) 、厚朴酚(批号110729-201309) 、当归对照药材(批号120927-201516) ,均购自中国药品生物制品检定所。芍药对照药材(批号2013-006) 、黄芩对照药材(批号2013-010) ,均购自天津中医药大学。
1.3 试剂甲醇(色谱级、美国Fisher Scientific公司);甲苯、三氯甲烷、二氯甲烷、环己烷、乙醚、乙酸乙酯、乙醇、磷酸、盐酸、甲酸(分析级、天津百世化工有限公司);超纯水。
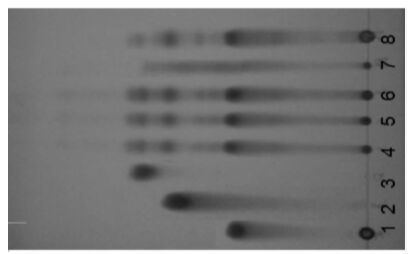
2 方法与结果 2.1 定性鉴别 2.1.1 白芍的薄层鉴别取3种批号的加味香连丸研匀,取粉末1 g,加无水乙醇20 mL,振荡10 min,滤过,滤液挥干,残渣加无水乙醇2 mL溶解,作为供试品溶液。取按加味香连丸处方及制备工艺制备缺白芍的阴性样品1 g,同法制成阴性对照品溶液。取白芍对照药材0.5 g,同法制成对照药材溶液。另取芍药苷对照品,加乙醇制成每1 mL含1 mg的溶液,作为对照品溶液。吸取上述6种溶液各5 μL,分别点于同一硅胶G板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(40:5:15:0.2) 为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,于105℃烘至斑点显色清晰。供试品色谱中,在对照品及对照药材色谱相应的位置上显相同颜色的斑点,在与白芍阴性对照色谱中,无此斑点。色谱图见图 1。

|
| 图 1 白芍薄层色谱 1:对照品;2~4:3个批号供试品;5:阴性对照;6:对照药材 |
取3种批号的加味香连丸研匀,取粉末0.5 g,加甲醇20 mL,超声30 min,滤过,滤液挥干,残渣加少量水溶解,用稀盐酸调pH2~3左右,用30、20、20 mL乙醚分别萃取3次,合并萃取液,挥干,残渣用2 mL甲醇溶解,作为供试品溶液。取按加味香连丸处方及制备工艺制备缺当归的阴性样品1 g,同法制成阴性对照品溶液。取当归对照药材0.5 g,加乙醚超声20 min,滤过,滤液挥干,残渣加1 mL无水乙醇溶解,作为当归对照药材溶液。另取阿魏酸和藁本内酯对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。吸取上述7种溶液各10 μL,分别点于同一硅胶G板上,以环乙烷-二氯甲烷-乙酸乙酯-甲酸(40:25:10:1) 为展开剂,展开,取出,晾干,置紫外光灯(254、365 nm)下检视。供试品色谱中,在与对照品及对照药材色谱相应的位置上显相同颜色的斑点,在与当归阴性对照色谱中,无此斑点。色谱图见图 2。
|
| 图 2 当归薄层色谱 1:阿魏酸;2:藁本内酯;3~5:3个批号供试品;6:阴性对照;7:对照药材 |
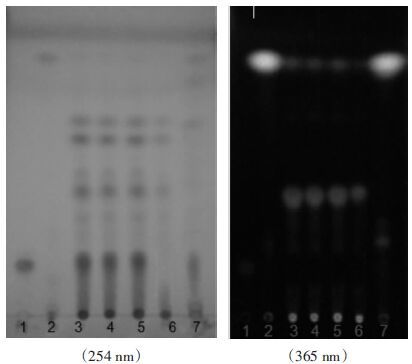
取3种批号的加味香连丸研匀,取粉末1 g,加乙酸乙酯-甲醇(3:1) 的混合溶液30 mL,加热回流30 min,放冷,滤过,蒸干,残渣加甲醇5 mL使溶解,取上清液为供试品溶液。取按加味香连丸处方及制备工艺制备缺黄芩的阴性样品1 g,另取黄芩对照药材1 g,同法制成阴性对照品溶液及黄芩对照药材溶液。另取黄芩苷、黄芩素、汉黄芩素对照品加甲醇制成每1 mL含1、0.5、0.5 mg的溶液,作为对照品溶液。吸取上述8种溶液各10 μL,分别点于同一硅胶GF254板上,以甲苯-乙酸乙酯-甲醇-甲酸(10:3:2:1) 为展开剂,饱和30 min,展开,取出,晾干,置紫外灯(254 nm)下检视。供试品色谱中,在与对照品及对照药材色谱相应的位置上显相同颜色的斑点,在与黄芩阴性对照色谱中,无此斑点。色谱图见图 3。
|
| 图 3 黄芩薄层色谱图 1:黄芩苷:2:黄芩素;3:汉黄芩素;4~6:3个批号供试品;7:对照药材:8:阴性对照 |
色谱柱:SHIMADZU VP-ODS(250 mm×4.6 mm,5 μm);以甲醇(A):0.1%磷酸水(B)为流动相,梯度洗脱(0~15 min,20%~30%A;15~50 min,30%~75%A;50~65 min,75%~100%A);检测波长为230 nm;流速:1.0 mL/min;柱温:30℃;进样量10 μL,理论塔板数按黄芩苷峰计算应不低于6 000。
2.2.2 混合对照品溶液的制备取芍药苷、柚皮苷、黄芩苷、厚朴酚对照品适量,精密称定,加入甲醇制成每1 mL含0.116 8 mg芍药苷、0.22 mg柚皮苷、0.255 mg黄芩苷、0.041 mg厚朴酚的混合对照品溶液。
2.2.3 供试品溶液的制备取加味香连丸,研成细末,精密称定0.5 g,置25 mL容量瓶中,加入适量甲醇,浸渍2 h,在45℃下,超声提取(功率250 W,频率40 kHz)30 min,放至室温,再用甲醇定容至刻度线,过滤,滤液用微孔滤膜(0.45 μm)滤过,取续滤液作为供试品溶液。按照加味香连丸处方量和制备工艺制备缺白芍、枳壳、黄芩、厚朴的阴性样品,按照供试品溶液的制备方法制备阴性对照溶液。
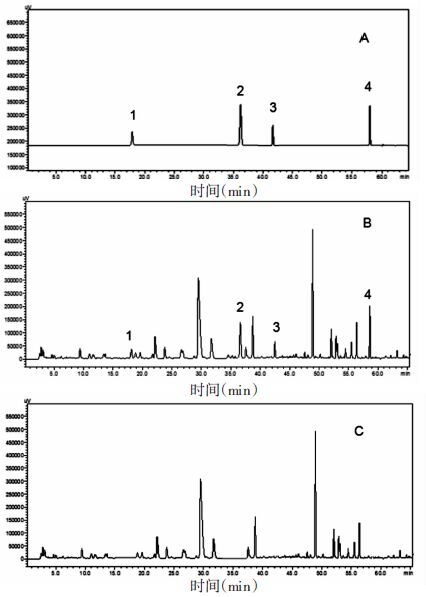
2.2.4 专属性实验精密吸取混合对照品溶液、供试品溶液和阴性对照溶液进样,结果阴性样品无干扰,证明此色谱条件可行。见图 4。
|
| 图 4 加味香连丸供试品、阴性样品吸混合对照品的色谱图 1:芍药苷;2:柚皮苷;3:黄芩苷;4:厚朴酚 A 混合对照品,B 供试品,C 阴性样品 |
精密吸取1、2、4、6、8、10 mL"2.2.2"项下的混合对照品贮备液,分别置于不同的10 mL容量瓶中,加入甲醇定容,在"2.2.1"项下色谱条件进样分析,以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),计算线性回归方程,得到芍药苷、柚皮苷、黄芩苷、厚朴酚的回归方程分别$\hat{Y}$=1 000 000X-6 658.6(r2=0.999 7) ,线性范围为0.011 68~0.116 8 g/L;$\hat{Y}$=20 000 000X-24 276(r2=0.999 8) ,线性范围为0.022~0.22 g/L;$\hat{Y}$=9 957.4X-12 889(r2=0.999 8) ,线性范围为0.025 5~0.255 g/L;厚朴酚$\hat{Y}$=30 000 000X+677.54(r2=0.999 7) ,线性范围为0.004 1~0.041 g/L。
2.2.5.2 精密度实验精密吸取混合对照品溶液,即"2.2.2"制备的对照品溶液,按"2.2.1"项下方法测定峰面积,连续进样6次。测得芍药苷、柚皮苷、黄芩苷、厚朴酚峰面积值得RSD为0.34%、0,86%、0.54%、0.27%,精密度符合要求。
2.2.5.3 稳定性实验取同一供试品溶液分别在0、2、4、6、8、12、24 h进样1次,依法进行含量测定,测定芍药苷、柚皮苷、黄芩苷、厚朴酚峰面积RSD分别为0.43%、0.72%、1.24%、0.48%,表明供试品溶液在24 h内稳定。
2.2.5.4 重复性实验取同一批号(3082226) 样品6份,按"2.2.3"项下制备方法制备供试品溶液,按"2.2.1"项下方法测定分析,结果6份样品中芍药苷的平均含量1.98 mg/g,RSD=0.85%,柚皮苷的平均含量4.42 mg/g,RSD=1.24%,黄芩苷的平均含量3.02 mg/g,RSD=0.69%,厚朴酚的平均含量0.28 mg/g,RSD=0.74%,结果表明重复性符合要求。
2.2.5.5 加样回收率实验取同一批号(3082226) 的样品6份,各0.5 g,精密称定,置25 mL容量瓶中,分别精密加入芍药苷0.001 05 g、柚皮苷0.002 45 g、黄芩苷0.001 40 g、厚朴酚0.000 13 g,按"2.2.3"项下的方法制备供试品溶液,依法测定样品中的芍药苷、柚皮苷、黄芩苷、厚朴苷的含量,计算回收率。结果芍药苷、柚皮苷、黄芩苷、厚朴苷平均回收率为98.75%、99.79%、99.22%、99.36%;RSD分别为1.63%、1.30%、1.57%、1.60%。结果见表 1。
| 成分 | 取样量 (g) | 原有量 (mg) | 加人量 ( mg) | 测得量 ( mg) | 回收率(%) | 平均回收率(%) | RSD(%) |
| 芍药苷 | 0.510 4 | 1.020 3 | 1.050 0 | 2.058 4 | 98.87 | 98.75 | 1.63 |
| 0.480 7 | 1.0189 | 1.050 0 | 2.0404 | 97.29 | |||
| 0.495 4 | 1.024 2 | 1.050 0 | 2.0426 | 96.99 | |||
| 0.501 8 | 1.019 6 | 1.050 0 | 2.0727 | 100.29 | |||
| 0.495 7 | 1.0184 | 1.050 0 | 2.048 4 | 98.10 | |||
| 0.504 4 | 1.022 7 | 1.050 0 | 2.0826 | 100.94 | |||
| 柚皮苷 | 0.5104 | 2.464 5 | 2.450 0 | 4.9307 | 100.66 | 99.79 | 1.30 |
| 0.480 7 | 2.430 4 | 2.450 0 | 4.9003 | 100.81 | |||
| 0.495 4 | 2.460 9 | 2.450 0 | 4.8902 | 99.16 | |||
| 0.501 8 | 2.458 8 | 2.450 0 | 4.9001 | 99.64 | |||
| 0.495 7 | 2.440 7 | 2.450 0 | 4.9125 | 100.89 | |||
| 0.504 4 | 2.450 3 | 2.450 0 | 4.8404 | 97.56 | |||
| 黄芩苷 | 0.5104 | 1.4991 | 1.400 0 | 2.8947 | 99.69 | 99.22 | 1.57 |
| 0.480 7 | 1.4877 | 1.400 0 | 2.876 3 | 99.19 | |||
| 0.495 4 | 1.4903 | 1.400 0 | 2.9044 | 101.01 | |||
| 0.501 8 | 1.5109 | 1.400 0 | 2.9209 | 97.11 | |||
| 0.495 7 | 1.500 7 | 1.400 0 | 2.859 7 | 100.61 | |||
| 0.504 4 | 1.4704 | 1.400 0 | 2.797 9 | 97.14 | |||
| 厚朴酚 | 0.5104 | 0.1398 | 0.1300 | 0.2703 | 100.64 | 99.36 | 1.60 |
| 0.480 7 | 0.129 9 | 0.1300 | 0.259 8 | 97.68 | |||
| 0.495 4 | 0.1407 | 0.1300 | 0.2723 | 101.23 | |||
| 0.501 8 | 0.1376 | 0.1300 | 0.263 6 | 96.92 | |||
| 0.495 7 | 0.144 7 | 0.1300 | 0.2742 | 99.62 | |||
| 0.504 4 | 0.1323 | 0.1300 | 0.259 8 | 98.08 |
取3批样品(批号3082226、3082225、2083019) ,按"2.2.3"项下方法制备供试品溶液,分别测定芍药苷、柚皮苷、黄芩苷、厚朴酚的峰面积,结果芍药苷的含量分别为2.040 0、2.039 4、2.035 3 mg/g,柚皮苷的含量分别为4.909 1、5.010 9、4.904 8 mg/g,黄芩苷的含量分别为3.018 2、3.034 2、3.012 6 mg/g,厚朴酚含量分别为0.279 6、0.283 0、0.276 7 mg/g。
3 结论与讨论 3.1 薄层色谱的选择因为加味香连丸处方中白芍、当归、黄芩均为主要药味,但查阅《中国药典》及参考文献均未对处方中白芍、当归、黄芩进行薄层色谱鉴别。所以本实验选择三者进行定性鉴别,对加味香连丸中定性鉴别进行补充。在展开剂的选择上,分别参考了《中国药典》中单味药材的薄层鉴别方法,但发现芍药苷、阿魏酸、黄芩苷等的比移(Rf)值太小,所以适当的调整了展开剂的极性比例,发现分离成分的Rf值和分离度较好。
3.2 色谱条件的选择参考文献[14-16]芍药苷、柚皮苷、黄芩苷及厚朴酚最佳吸收波长分别为230、274、284、294 nm,通过比较4个波长下4种成分的含量变化,最终选择230 nm为最佳检测波长,此时4种成分含量均较高,且与杂峰分离较好。
在流动相的选择上,考察了甲醇-0.1%冰醋酸水溶液、甲醇-0.1%磷酸水溶液、乙腈-0.2%磷酸水溶液[17-20],结果表明甲醇-0.1%磷酸水溶液的峰形较好,又考察了此条件下流动相的洗脱程序,发现梯度程序比等度程序能更好将四种成分与杂质峰分离,峰形较好,且阴性样品无干扰。
| [1] | 杨梅英. 小儿细菌性痢疾的中西医并治[J]. 中华临床医学杂志, 2005, 6 (11) : 65–66. |
| [2] | 迟丹. 芍药汤加减治疗细菌性痢疾临床分析[J]. 中国中医药现代远程教育, 2009, 7 (5) : 23. |
| [3] | 黎佩珍. 阿莫西林与头孢派酮治疗细菌性痢疾疗效的临床对照研究[J]. 齐齐哈尔医学院学报, 2015, 36 (32) : 4887–4888. |
| [4] | 张巧云, 拓占斌. 左氧氟沙星联合复方黄连素片治疗急性细菌性痢疾的临床疗效[J]. 临床合理用药, 2015, 8 (10) : 48–49. |
| [5] | 田敬步. 利福平注射液治疗顽固性细菌性痢疾62例疗效观察[J]. 药物与临床, 2006, 3 (14) : 238–239. |
| [6] | 范燕. 磷霉素治疗细菌性痢疾的疗效及不良反应的文献分析[J]. 中国药物警戒, 2013, 10 (11) : 673–675. |
| [7] | 陈光武. 急性细菌性痢疾菌药敏分布与临床治疗调查探讨[J]. 中国实用医药, 2015, 10 (36) : 187. |
| [8] | 段淑红, 范晓冬, 刘梅生. 依替米星治疗急性细菌性痢疾临床观察与分析[J]. 中华医院感染学杂志, 2011, 21 (13) : 2801–2803. |
| [9] | 金奎坤. 加味香黄连治疗慢性结肠炎30例体会[J]. 安徽中医临床杂志, 2009, 11 (5) : 316. |
| [10] | 黄云春. 加味香连丸治疗泄泻25例[J]. 湖北中医杂志, 2003, 25 (9) : 43. |
| [11] | 国家药典委员会.中国药典(一部)[S].北京:中国医药出版社,2015:905. |
| [12] | 何洋, 孙悦, 黄娟萍. HPLC法同时测定加味香连丸中木香烃内酯和去氢木香内酯的含量[J]. 药物分析杂志, 2011, 31 (2) : 223–224. |
| [13] | 陶胜源, 刘玉波, 车慧. 高效液相色谱法测定加味香连丸中盐酸小檗碱的含量[J]. 解放军药学学报, 2009, 25 (3) : 257–259. |
| [14] | 徐力. HPLC测定加味香连丸中芍药苷的含量[J]. 中国中医指南, 2011, 9 (3) : 13–14. |
| [15] | 范丽丽, 李楠, 顾星. UPLC法测定痤疮凝胶中黄芩苷和蒙花苷的含量[J]. 天津中医药大学学报, 2015, 34 (1) : 42–44. |
| [16] | 梁远园, 冯彪, 倪晨. HPLC法测定枳实药材中橙皮苷和柚皮苷的含量[J]. 中药新药与临床药理, 2006, 17 (5) : 359–361. |
| [17] | 师永清, 康淑荷, 王爱军. HPLC同时测定黄连双清丸中栀子苷、芍药苷、黄芩苷、盐酸小檗碱和大黄素的含量[J]. 药物分析杂志, 2013, 33 (9) : 1613–1616. |
| [18] | 李想, 卢静华. HPLC法同时测定加味香黄连中芍药苷、柚皮苷、陈皮苷和黄芩苷[J]. 中成药, 2015, 37 (9) : 1955–1958. |
| [19] | 何洋, 黄娟萍, 孙悦, 等. HPLC同时测定加味香连丸中和厚朴酚与厚朴酚和[J]. 华西药学杂志, 2011, 26 (6) : 585–587. |
| [20] | 苏超, 刘君仪, 张盛. RP-HPLC法测定妇科分清丸中栀子苷和芍药苷的含量[J]. 光明中医, 2015, 30 (5) : 956–957. |
 2016, Vol. 35
2016, Vol. 35