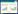文章信息
- 谭晓文, 董鹏志, 宁召臣, 朱彦
- TAN Xiao-wen, DONG Peng-zhi, NING Zhao-cheng, ZHU Yan
- 以ADP受体P2Y12为靶标的中药抗栓活性无标记细胞表型筛选
- ADP receptor P2Y12-targeted screening of TCM anti-thrombotic activities by Lable-free cell phenotype profiling
- 天津中医药大学学报, 2017, 36(1): 6-10
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(1): 6-10
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.01.02
-
文章历史
收稿日期: 2016-10-20
2. 天津国际生物医药联合研究院中药新药研发中心, 天津 300457。
二磷酸腺苷(ADP) 受体P2Y12是Gi偶联型的G蛋白偶联受体(GPCR),是血小板聚集的关键受体,也是抗血小板药物研究的主要靶点。同时血小板膜受体P2Y12与糖尿病患者的抗血小板药物抵抗、高血压,冠心病、缺血性卒中等一系列病症均有一定相关性[1-2]。ADP与P2Y12受体结合后,P2Y12受体通过与Gi蛋白偶联,使血小板颗粒分泌血栓素A2 (TXA2), 激活纤维蛋白原受体,从而实现血小板的聚集。活化后的P2Y12受体,既可以引起血小板自身的活化,也可以通过与Gi蛋白偶联激活其信号的传导通路, 抑制血小板腺苷酸环化酶的活化, 降低环磷酸腺苷(cAMP) 在细胞内水平,引发血小板的聚集[3]。目前,针对P2Y12受体的拮抗药物主要有普拉格雷、坎格雷洛、替格雷洛、依诺格雷等,但都伴随起效慢,并发出血症,需药物联用等不足。针对P2Y12受体拮抗药物的开发,仍有很大的空间[4]。而无标记高通量筛选,作为一种新型高通量药物筛选模式,是一种利用生物传感器,针对细胞的动态物质重分配原理(DMR) 而开发的检测,对于其应用于GPCR受体药物开发,具有影响低,可提供广泛的、无创的细胞信号动力学高通量扫描,不局限于某一特定的细胞信号通路反应等优势[5-6]。本项研究旨在通过获得pCMV-hP2Y12-C-His稳定转染HEK293细胞系,以建立ADP受体P2Y12为靶标的无标记细胞表型筛选方法。
1 材料与方法 1.1 材料HEK293细胞系(中国科学院典型培养物保藏委员会细胞库),pCMV-C-His质粒(碧云天公司,D2650),LB培养基(生物生工公司,SD7002),大提质粒试剂盒(Transgen,H10105),PE (I Polysciences, 23966-2),G418 (Merck Millipore,D00117999),Tks GflexTM DNA Polymerase (TaKaRa,R060A),胶回收试剂盒(Axygen ap-gx-250),限制性内切酶(NEB,Hind Ⅲ R0104s、BamHI R0136S,buffer2.1 B7202s),T4连接酶(NEB,M0202T),HEPES缓冲液(invitrogen,15630-080),平衡盐(HBSS),缓冲液(Invitrogen,14025-126),EnSpire-LFC,384孔板(PerkinElmer,5740-14212),ADP (SIGMA,F3879),替卡格雷(selleck,S4079),Anti-His tag antibody (碧云天,AH367),β-Actin antibody (中杉金桥,TA-09),DMEM培养基(Gibco,12800-017),胎牛血清(Gibco,10099-141),qRT-PCR试剂盒和Fast start Universal SYBR Green Master (Roche),Trizol、RIPA裂解液和BCA蛋白浓度测定试剂盒(碧云天公司)。
1.2 pCMV-P2Y12-C-His表达载体构建P2Y12模板DNA以Tks GflexTM DNA Polymerase扩增,5’端引入酶切位点Hind Ⅲ,3’端引入酶切位点BamHI。引物信息如下:pCMV-hP2Y12-C-His-sense,CGCggatccATGCAAGCCGTCGACAATCT,pCMV-hP2Y12-C-His-anti,AGCaagctt CATTGGAGTCTCTT CATTTG,P2Y12 PCR产物进行凝胶回收产物、pCMV-C-His载体进行BamHI Hind Ⅲ双酶切(37 ℃ 1 h),酶切产物进行凝胶回收,凝胶回收产物T4连接酶连接(16 ℃,过夜) [7-8]。
1.3 建立pCMV-hP2Y12-C-His稳定转染的细胞系参考文献[9]标准。
1.3.1 pCMV-hP2Y12-C-His的转染实验HEK293细胞以每孔105个接种到6孔板中,细胞融合度达80%后,按照PEI:DNA=3 μL:1 μg的比例将PEI试剂、DNA溶液分别与250 μL不含血清DMEM的基础培养基涡旋混匀,静置20 min后,两种混合液加到一起,再次涡旋混匀,静置20 min。弃去6孔板中细胞培养液,磷酸盐缓冲溶液(PBS) 小心清洗2次后,将转染液加到细胞中,DMEM基础培养基补齐至2.5 mL。6 h后弃去转染液,换成DMEM完全培养基在37 ℃、5%二氧化碳(CO2) 饱和湿度培养24 h后,换为含有500 mg/L的DMEM完全培养基培养,每3 d左右换液1次,直至6孔板内的细胞生长起来,约15~20 d左右,然后进行扩大培养。
1.3.2 转染细胞系pCMV-hP2Y12-C-His的qRT-q PCR鉴定以Trizol提取细胞总RNA,分光光度法测定RNA浓度,A 260/280比值在1.8~2.0间,琼脂糖凝胶电泳显示28S亮度在18S条带的两倍以上,条带清晰无拖尾现象。按照逆转录试剂盒说明书操作获取cDNA,然后进行qRT-PCR检测,反应体系:cDNA模板1 μL,引物sense,anti各1.25 μL (pCMV-hP2Y12-C-His-sense CGCggatccATGC-AA GCCGTCGACAATCT,pCMV-hP2Y12-C-His-anti AGCaagcttCATTGGAGTCTCTTCATTTG) Supermix 12.5 μL,RNase-free water 9.0 μL。反应条件:95 ℃ 3 min预变性,95 ℃ 30 s变性,60 ℃ 40 s退火,72 ℃ 40 s延伸,共42个循环。溶解曲线条件设定:95 ℃ 10 s,65 ℃ 5 s,95 ℃。采用△△Ct法分析qRT-PCR实验结果。
1.3.3 转染细胞系P2Y12-His Western Blot鉴定pCMV-hP2Y12-C-His稳转细胞系提取总蛋白, BCA法测定蛋白浓度,上样量40 μg。分离胶选用10%SDS聚丙烯酰胺凝胶,浓缩胶浓度为5%。完成蛋白分离后,转至PVDF膜,5%脱脂奶粉室温封闭过夜,孵育一抗Anti-His-tag antibody (1:1 000倍稀释)4 ℃过夜,洗去一抗后孵育二抗羊抗鼠IgGHRP (1:5 000),室温孵育1 h,洗去二抗,试剂盒显色,暗室显影。使用一抗、二抗去除液洗去His-tag的一抗和二抗,5%脱脂奶粉重新封闭,同样条件孵育Anti-βactin antibody (1:4 000) 及二抗羊抗鼠IgG-HRP (1:5 000),再次显影。
1.4 稳转细胞系Lable-free功能检验 1.4.1 P2Y12受体激动剂ADP对该体系作用第1天:试剂准备检测缓冲液[1LHBSS+20 mL 1 mol/L羟乙基哌嗪乙硫磺酸(HEPES) 储备液],pCMVhP2Y12-C-His稳转细胞以每孔104个种板培养12 h。第2天:将培养液移除,换至检测缓冲液,放置机器中,温度平衡90 min,同时开始准备化合物待用,温度平衡好后进行基线读取30 min。快速加入激动剂ADP,终浓度分别是200、20、2、0.2、0.02、0(对照组)μmol/L,轻轻混匀1次,立即放入机器中,进行最终值读取1 h。
1.4.2 P2Y12受体抑制剂替卡格雷对该体系作用第1天:试剂准备检测缓冲液(1 L HBSS+20 mL 1 mol/L HEPES储备液),pCmv-hP2Y12-C-His稳转细胞以每孔104个种板,培养12 h。第2天:将培养液移除,换至检测缓冲液,放置机器中, 温度平衡90 min,同时开始准备化合物待用,温度平衡好后进行基线读取30 min。加入抑制剂替卡格雷,终浓度分别是2、0.2、0.02、0.002、0.000 2、0 (对照组)μmol/L,轻轻混匀1次,孵育30 min后,加入终浓度为20 μmol/L的ADP,轻轻混匀1次,立即放入机器中,进行最终值读取,时间为1 h。
1.5 数据分析采用Graphpad Prism5.0作图,SPSS 18.0软件进行统计分析。采用Image J软件对X线片进行数据处理:首先将压好的X线片经扫描形成电子版后用Image J软件分析条带光密度值,计算每个目的蛋白条带光密度值与内参光密度值的比值,并以对照组的值均一化后表示,采用T-test方法分析, 结果用均数±标准差(x±s) 表示。P2Y12受体激动剂ADP对该体系作用实验结果采用单因素方差分析,实验结果采用均数±标准差(x±s) 表示。
2 实验结果 2.1 pCMV-hP2Y12-C-His稳定转染细胞系qRTPCR及Western Blot验证 2.1.1 qRT-PCR结果见图 1、表 1。实验组、对照组各设2个复孔,由图 1可见,稳转P2Y12细胞组先于HEK293细胞组起峰。
|
| 图 1 qRT-PCR实验P2Y12-C-His扩增图 |
| 名称 | n | P2Y12-HEK293 | HEK293 |
| P2Y12(Ct) | 3 | 34.20 | 39.65 |
| GAPDH (Ct) | 3 | 26.87 | 25.88 |
| △Ct | 7.33 | 13.77 | |
| △△Ct | -6.44 | ||
| 2-△△Ct | 86.82 | ||
量化分析结果,P2Y12-His在P2Y12-HEK293细胞系表达比未转染HEK293细胞mRNA量表达量提高了86.82倍。
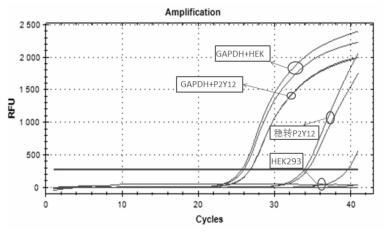
2.1.2 Western Blot结果见图 2。上样量均为40 μg,由胶图结果可见,P2Y12-His稳转细胞有清晰蛋白条带,而HEK293细胞则没有。量化分析结果表明,与对照组相比,P2Y12-HEK293细胞蛋白表达量显著性增加,P<0.01 (n=3)。
|
| 图 2 P2Y12-His蛋白在转染/未转染细胞中蛋白的表达(n=3) 与对照组比较,**P<0.01。 |
见图 3、图 4、图 5。Enspire多功能读板机检测激动剂ADP对于pCMV-hP2Y12-C-His稳定转染细胞作用影响,ADP终浓度分别是200、20、2、0.2、0.02、0(对照组)μmol/L,当ADP浓度为2 μmol/L至200 μmol/L时,与对照组有显著性差异,P < 0.01(n=3),求得EC50为3.38 μmol/L,与文献报道一致[3, 13]。

|
| 图 3 激动剂ADP对pCMV-hP2Y12-C-His稳定转染AD293细胞系作用 与对照组比较,**P<0.01。 |
|
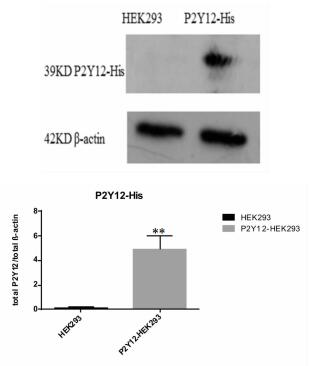
| 图 4 抑制剂替卡格雷对pCMV-hP2Y12-C-His稳定转染AD293细胞系作用 与对照组比较,*P<0.05,**P<0.01。 |
|
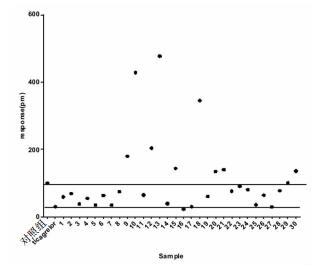
| 图 5 P2Y12的无标记高通量筛选应用于中药活性成分筛选 |
Enspire多功能读板机检测抑制剂替卡格雷对于pCMV-hP2Y12-C-His稳定转染细胞系作用影响, 替卡格雷终浓度为2、0.2、0.02、0.002、0.000 2、0 (对照组)μmol/L,ADP浓度为20 μmol/L。当替卡格雷浓度在0.002 μmol/L以上时,与对照组相比有显著性差异,P < 0.01(n=4),P<0.05(n=4),求得IC50为0.002 1 μmol/L,与文献报道一致[3, 13]。
Lable-free Enspire实验表明P2Y12受体激动剂ADP,抑制剂替卡格雷,均有显著的激动及抑制作用,具有明确的量效关系,由于HEK293细胞本身并无其他ADP受体表达,因此可以认为ADP,替卡格雷的信号反应均是针对受体P2Y12[14]。由此,本实验可以认为是成功建立了ADP受体P2Y12的Lable-free Enspire多功能读板机的无标记高通量筛选方法。
Enspire多功能读板机检测30种中药单体及组分针对受体P2Y12的作用效果,中药单体及阳性药Ticagrelor终浓度均为1 μmol/L,组分终浓度为20 mg/L,激动剂ADP终浓度为20 μmol/L,筛选结果为样品3、5、7、16、17、25、27抑制P2Y12活性显著,为进一步筛选、机制研究等提供基础数据支持。
3 讨论目前用于基于配体受体结合的GPCR高通量筛选实验方法主要有放射性同位素受体配体结合、时间分辨荧光共振能量转移(TR-FRET) 等方法,由于并不是基于功能的分析,尽管能够判断受体与配体的结合,但得到的信息很有限,而且操作复杂,对细胞干扰因素较多[15-16]。而Lable-free针对GPCR的检测,是基于受体偶联Gi、Gq、Gs3种不同的G蛋白,会呈现3种不同的动力学扫描图谱,由于这3种G蛋白分别对应着不同的下游信号反应:Gi与GS作用类似,通过GTP-GDP交换来调节信号传导,受体与GS偶联后,cAMP减少,与Gi偶联后,cAMP释放增加,Gq通过IP3-Ca2+信号途径,调节Ca2+释放。所以,Lable-free Enspire检测系统具有一定的预测下游信号通路的功能,是更优于目前已有的方法的检测手段[17]。本研究意在建立一种方便快捷的GPCR高通量筛选方案,实验具有以下需注意的事项:1) Lable-free Enspire系统对于温度较为敏感,应注意实验环境的温度控制,25 ℃最为适宜。2) 考虑到实验的稳定性及平行性,应保证所用的稳转细胞代数,平行实验之间要使用相临近代数的细胞。3) 实验前,细胞要提前放置仪器周围平衡1~2 h,使细胞充分适应缓冲液环境及温度。
| [1] | 龙厚元, 代伟, 宋玉强, 等. 血小板膜蛋白P2Y12受体的临床研究进展[J]. 中国医药指南, 2012, 25(388): 74–76. |
| [2] | Suryadevara S, Ueno M, Tello-Montoliu A, et al. Effects of pioglitazone on platelet P2Y12-mediated signalling in clopidogrel-treated patients with type 2 diabetes mellitus[J]. Thromb Haemost, 2012, 108(5): 930–936. DOI:10.1160/TH12-06-0397 |
| [3] | Guidetti GF, Lova P, Bernardi B, et al. The Gi-coupled P2Y12 receptor regulates diacylglycerol-mediated signaling in human platelets[J]. Biol Chem, 2008, 283(43): 28795–28805. DOI:10.1074/jbc.M801588200 |
| [4] | 王思铭, 张丽华, 张海波, 等. 血小板P2Y (12) 受体拮抗剂的研究进展[J]. 中华临床医师杂志, 2014, 11(822): 4124–4129. |
| [5] | Fang Y. Label-free drug discovery[J]. Front Pharmacol, 2014, 27(5): 52–53. |
| [6] | Fang Y. Label-Free Receptor Assays[J]. Drug Discov Today Technol, 2011, 7(1): 5–11. |
| [7] | 曹慧青. 多基因共表达载体的构建策略[J]. 国外医学:分子生物学分册, 2002, 1(1): 1–4. |
| [8] | 饶贤才, 胡福泉. 基因串联体的构建策略及其表达模式[J]. 医学研究生学报, 2006, 1(6): 557–560. |
| [9] | Fortune JA, Novobrantseva TI, Klibanov AM, et al. Highly Effective Gene Transfection In Vivo by Alkylated Polyethylenimine[J]. J Drug Deliv, 2011, 20(40): 58–64. |
| [10] | Schmidt P, Ritscher L, Dong E, et al. Identification of Determinants Required for Agonistic and Inverse Agonistic Ligand Properties at the ADP Receptor P2Y12[J]. Mol Pharmacol, 2013, 83(1): 256–266. DOI:10.1124/mol.112.082198 |
| [11] | Deng H, Sun H, Fang Y, et al. Label-free cell phenotypic assessment of the biased agonism and efficacy of agonists at the endogenous muscarinic M3 receptors[J]. J Pharmacol Toxicol Methods, 2013, 68(3): 323–333. DOI:10.1016/j.vascn.2013.07.005 |
| [12] | Fleming MR, Shamah SM, Kaczmarek LK, et al. Use of Label-free Optical Biosensors to Detect Modulation of Potassium Channels by G-protein Coupled Receptors[J]. J Vis Exp, 2014(84): 513–520. |
| [13] | Giezen VAN, Nilsson L, Berntsson P, et al. Ticagrelor binds to human P2Y (12) independently from ADP but antagonizes ADP-induced receptor signaling and platelet aggregation[J]. Thromb Haemost, 2009, 7(9): 1556–1565. DOI:10.1111/jth.2009.7.issue-9 |
| [14] | Atwood BK, Lopez J, Wager-Miller J, et al. Expression of G protein-coupled receptors and related proteins in HEK293, AtT20, BV2, and N18 cell lines as revealed by microarray analysis[J]. BMC Genomics, 2011, 7(12): 12–14. |
| [15] | Leyris JP, Roux T, Trinquet E, et al. Homogeneous time-resolved fluorescence-based assay to screen for ligands targeting the growth hormone secretagogue receptor type 1a[J]. Anal Biochem, 2011, 408(2): 253–262. DOI:10.1016/j.ab.2010.09.030 |
| [16] | Odagaki Y, Toyoshima R. Muscarinic acetylcholine receptor-mediated activation of G (q) in rat brain membranes determined by guanosine-5'-O-(3-[J]. J Neural Transm, 2012, 119(5): 525–532. DOI:10.1007/s00702-011-0742-2 |
| [17] | Heym RG, Hornberger WB, Lakics V, et al. Label-free detection of small-molecule binding to a GPCR in the membrane environment[J]. Biochim Biophys Acta, 2015, 1854(8): 979–986. DOI:10.1016/j.bbapap.2015.04.003 |
 2017, Vol. 36
2017, Vol. 36